芸香科(Rutaceae)植物黄皮(Clausena lansium)是两广地区极常栽培的水果作物,其果实饱满、酸甜适中,是岭南特有的季节性佳果[1-2]。但黄皮果季节时效强,保鲜周期短,每年因天气、储藏或采摘不当而废弃的鲜果数以千吨计[3-4]。
果胶是一种以α-1,4糖苷键连接半乳糖醛酸组成的高分子多糖,存在于植物的果实、根、茎和叶等部位[5-6]。因其具有良好的增稠、胶凝化、乳化稳定等的特性,被广泛应用于食品、药品及化妆品等多个领域,具有较高的经济价值[7-11]。此外,果胶还具有良好的生理和药理活性,如降糖、降脂、抑癌和调节机体免疫等作用[12-13]。目前全球对果胶的年需求量以每年10%的速度递增,且国内食用级果胶的产能受制于原料问题,大部分需要靠进口解决[14-15]。黄皮中富含机酸、果胶、生物碱、黄酮等多种活性成分,具有重要的营养价值和药用价值[16-17]。目前,黄皮的深加工产品仅为果干、果脯、果汁及果酒等,但这些产品所需黄皮果为优等果才有较好的经济价值,无形中也占用了黄皮果的优质资源,不利于增加黄皮果产品附加值[18]。有研究报道[19],采用微波辅助酸提取法制备黄皮果果胶,在不考虑果胶纯度的情况下,粗果胶的产率仅为3.59%,不利于黄皮果果胶的商业化开发。
目前工业化生产果胶的方法主要有酸提取法、离子交换树脂法、酶法、微波辅助提取法和超声辅助提取法等,在制备工艺和果胶质量上互有优劣[20-22]。为了有效对黄皮果废果进行二次开发,前期研究发现黄皮果干基,其粗果胶含量约为20%~28%,总糖含量>70%,是制备高品质果胶的理想原料,若利用黄皮果废果生产果胶,将会极大增加黄皮果产业的附加值。本研究充分结合当地的实际情况和黄皮果的原料特征,在超声波预处理的基础上,采用传统酸提取法提取果胶,通过单因素试验及正交试验优选提取黄皮果胶的最佳工艺参数,为开发利用黄皮果果胶资源提供实验依据。
1 材料与方法
1.1 材料与试剂
黄皮粉末:将购自广东茂名的黄皮,除核,洗净,蒸馏水中浸泡2 h(脱除小分子糖类和部分色素),沥干,置于沸水浴中灭酶3 min,置于烘箱中进行干燥后,粉碎,过20 目筛,密封贮藏,备用;D-半乳糖醛酸标品(纯度≥97%):美国Sigma公司;柠檬酸、盐酸、硫酸、无水乙醇(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
HX-200高速中药粉碎机:浙江省永康市溪岸五金药具厂;DK-98-Ⅱ电热恒温水浴箱:天津市泰斯特仪器有限公司;DZF-6090真空干燥箱:上海精宏实验设备有限公司;AUW120D型电子分析天平:日本Shimadau公司;KQ-250DE型超声波清洗器:昆山超声仪器有限公司;LD-UPW-VF超纯水机:上海砾鼎水处理设备有限公司;Epoch酶标仪:美国Bio-Tek公司。
1.3 方法
1.3.1 黄皮果胶的提取工艺流程
称取干燥黄皮粉末5.0 g,放入500 mL 烧杯中,加入一定量的蒸馏水,搅拌,用盐酸溶液将pH调至2.0,在超声波功率250 W、超声频率40 kHz的条件下预处理30 min,采用热回流方式进行提取,热抽滤,收集滤液,冷却至室温后,加入0.5%提取液质量的活性炭,80 ℃脱色20 min,过滤。滤液蒸发浓缩至原体积的50%,静置冷却,在不断搅拌下加入1.5倍体积的无水乙醇。将果胶醇沉溶液置于25 ℃中静置90 min,离心分离,收集沉淀,依次用无水乙醇、体积分数为90%、80%、70%、60%的乙醇溶液洗涤,离心收集沉淀,冷冻干燥,即得黄皮果胶。
1.3.2 果胶含量的测定
采用咔唑-硫酸法测定果胶含量。半乳糖醛酸标准曲线的绘制:取6支离心管,分别加入质量浓度为0.6 mg/mL半乳糖醛酸标准品溶液0、5 μL、10 μL、15 μL、20 μL、25 μL,并分别加蒸馏水稀释到50 μL,于冰水浴中沿壁缓缓加入300 μL浓硫酸,混匀后沸水浴中加热25 min,迅速冷却至室温,再分别向离心管中加入10 μL 0.15%咔唑-乙醇溶液,混匀,放置120 min后,在波长530 nm条件下,测定其吸光度值,以半乳糖醛酸质量浓度(x)为横坐标,吸光度值(y)为纵坐标绘制标准曲线。按照标准曲线回归方程y=0.002 9x+0.059 9(R2为0.995)计算样品中半乳糖醛酸含量,其计算公式如下:
式中:X1为果胶样品中半乳糖醛酸含量,%;C为按标准曲线回归方程计算半乳糖醛酸质量浓度,μg/mL;D为稀释因数;W为样品质量,mg。
纯果胶含量计算公式如下:
式中:X2为黄皮果中纯果胶含量,g;X1为果胶样品中的半乳糖醛酸含量,%;W1为冷冻干燥后粗果胶的质量,g。纯果胶得率计算公式如下:
式中:p为纯果胶得率,%;X2为黄皮果中的纯果胶含量,g;W2为样品黄皮的质量,g。粗果胶得率计算公式如下:
式中:X3为粗果胶得率,%;W1为冷冻干燥后粗果胶的质量,g;W2为样品黄皮的质量,g。
1.3.3 果胶胶凝度的测定[23-24]
准确称取3.00 g果胶置于250 mL烧杯中,加31 mL蒸馏水,搅拌溶解果胶,加入35.7 g白砂糖使之溶化,浓缩至总质量54.7 g。烧杯中加入12.5%柠檬酸溶液1 mL,然后倒入上述果胶糖液,用玻棒迅速搅拌均匀后罩上一只稍大烧杯,室温静置24 h,取出果冻,调向装入另一烧杯中(注意勿使果冻破裂),采用破碎压力计算法测定黄皮果胶的胶凝度,其计算公式如下:
式中:G为果胶胶凝度,g/cm2;S为制作果冻时所用的白砂糖
量,g;m为制作果冻时所用的果胶量,g;A为滴定水量,g。
1.3.4 提取条件优化单因素试验
分别在不同的提取溶剂(0.01 mol/L盐酸、0.05 mol/L硫酸、0.135 mol/L柠檬酸),液料比(10∶1、20∶1、30∶1、40∶1、50∶1(mL∶g)),提取温度(60 ℃、70 ℃、80 ℃、90 ℃、100 ℃),提取时间(60 min、90 min、120 min、150 min、180 min),初始pH值(1.0、2.0、3.0、4.0、5.0)条件下提取黄皮果胶,提取液经过浓缩、沉淀、离心、干燥后称取粗果胶质量,测其半乳糖醛酸含量,考察不同的单因素对纯果胶得率的影响。
1.3.5 提取条件优化正交试验
在单因素试验的基础上,以黄皮纯果胶得率为考察指标,选取提取温度(A)、初始pH值(B)、提取时间(C)、料液比(D)进行4因素3水平L(934)正交试验,其因素与水平见表1。
表1 提取工艺优化正交试验因素与水平
Table 1 Factors and levels of orthogonal tests for extractio n technology optimization
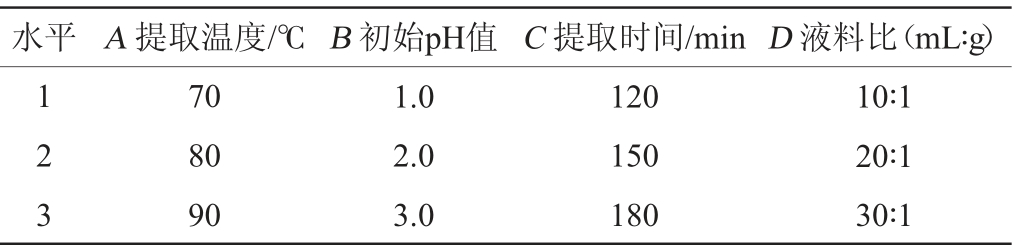
水平 A 提取温度/℃ B 初始pH值 C 提取时间/min D 液料比(mL∶g)1 2 3 70 80 90 1.0 2.0 3.0 120 150 180 10∶1 20∶1 30∶1
1.3.6 黄皮果胶品质分析
水分含量:参照GB 5009.3—2010《食品中水分的测定》[25]中的直接干燥法;总半乳糖醛酸、酰胺化度、酸不溶灰分参照国标GB 25533—2010《食品添加剂果胶》[26];二氧化硫:参照国标GB/T 5009.34—2016《食品中二氧化硫的测定》[27]滴定法;铅:参照国标GB 5009.12—2017《食品中铅的测定》石墨炉原子吸收光谱法[28]。
2 结果与分析
2.1 提取工艺优化单因素试验
2.1.1 提取溶剂对纯果胶得率的影响
本试验选用了0.01 mol/L盐酸、0.05 mol/L硫酸和0.135 mol/L柠檬酸作为提取剂[29-30],考察其对黄皮纯果胶得率及胶凝度的影响,结果分别见图1和图2。
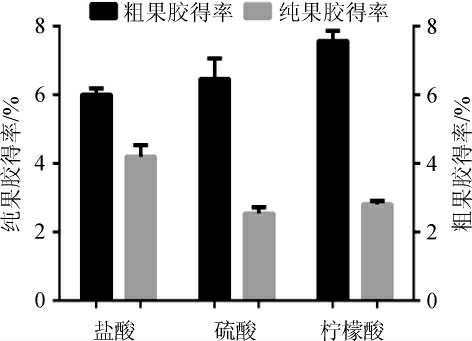
图1 不同提取剂对纯果胶得率和粗果胶得率的影响
Fig. 1 Effect of different extraction solvents on the yield of pure pectin and crude pectin
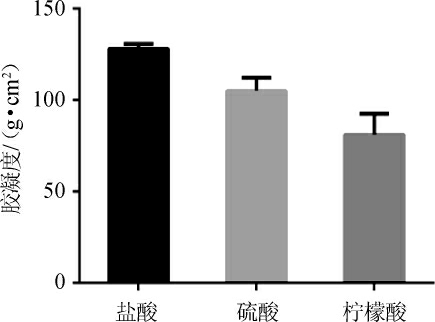
图2 不同提取剂对果胶胶凝度的影响
Fig. 2 Effect of different extraction solvents on the gelatinization of pectin
由图1可知,不同的提取剂对纯果胶得率有一定的影响,柠檬酸提取黄皮果胶,其粗果胶得率最高为7.82%,但以半乳糖醛酸含量计,纯果胶得率仅为2.89%;而盐酸提取黄皮果胶,尽管其粗果胶得率最低仅为6.52%,纯果胶的得率最高为4.96%。由图2可知,柠檬酸提取的果胶胶凝度最低仅为81.12 g/cm2,而盐酸提取的果胶胶凝度最高,达128.03 g/cm2。因此,综合考虑,选择0.01 mol/L盐酸作为最适黄皮纯果胶提取剂。
2.1.2 液料比对纯果胶得率的影响

图3 不同液料比对纯果胶得率的影响
Fig. 3 Effect of different liquid and material ratio on extraction yield of pure pectin
由图3可知,当液料比为10∶1~20∶1(mL∶g)时,黄皮纯果胶得率随之增加;当液料比为20∶1(mL∶g)时,黄皮纯果胶提取效率达到峰值,得率为5.56%;继续增大液料比,纯果胶得率有所降低,但变化趋势不明显,后趋于平稳。原因是当提取效率达到峰值后,继续增大提取液用量,可降低溶液中的果胶浓度,使得醇沉时无法充分析出,也会增加过滤和浓缩时间,反而使纯果胶的得率下降。因此,液料比选择20∶1(mL∶g)为宜。
2.1.3 提取温度对纯果胶得率的影响
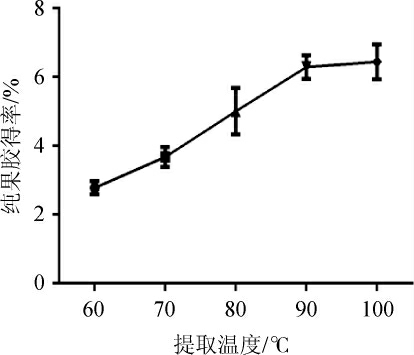
图4 不同提取温度对纯果胶得率的影响
Fig. 4 Effect of different extraction temperatures on extraction yield of pure pectin
由图4可知,随着提取温度在60~90 ℃范围内的升高,黄皮果纯果胶的得率呈明显上升趋势,在提取温度达到100 ℃后,纯果胶得率最高为6.44%,而90 ℃时的纯果胶得率为6.29%,两者相比差异不明显。因此,提取温度选择90 ℃为宜。
2.1.4 提取时间对纯果胶得率的影响
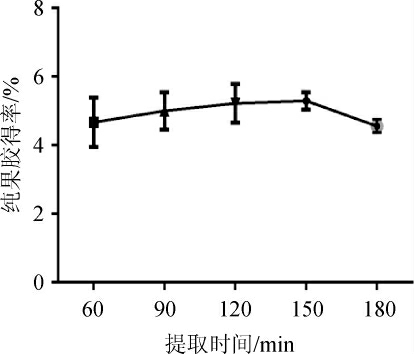
图5 不同提取时间对纯果胶得率的影响
Fig. 5 Effect of different extraction time on extraction yield of pure pectin
由图5可知,提取时间在60~150 min内,黄皮纯果胶得率随提取时间的延长缓缓增加,但增幅不大;在提取时间150 min时,纯果胶得率达到最大为5.29%,而180 min后,纯果胶得率有所下降。可能是因提取时间的延长,果胶在热水和酸的作用下,发生水解所致。因此,提取时间选择150 min为宜。
2.1.5 初始pH值对纯果胶得率的影响
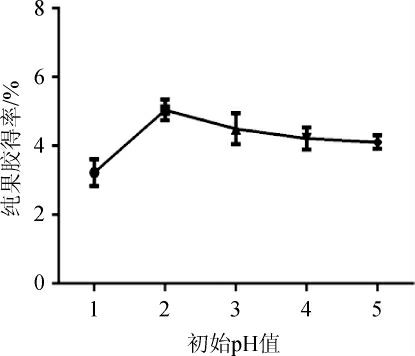
图7 不同初始pH值对纯果胶得率的影响
Fig. 7 Effects of different initial pH values on extraction yield of pure pectin
由图6可知,初始pH值为1.0~2.0时,纯果胶得率随之增加,并在初始pH值为2.0时达到峰值,为5.05%,其后随着初始pH值的增高而逐渐下降,这说明选择合适的H+浓度是提高纯果胶得率的关键因素。初始pH值过低可使果胶分子内的甙键和酯键发生断裂,水解成小分子;而在酸性条件下,初始pH过高则易使果胶转化为果胶酸,溶解性增加,使收率降低密切相关。因此,选择初始pH 2.0为宜。
2.2 提取工艺优化正交试验
在单因素试验的基础上,以黄皮纯果胶得率为考察指标,选取提取温度(A)、初始pH值(B)、提取时间(C)、料液比(D)进行4因素3水平L9(34)正交试验,正交试验结果与分析见表2,方差分析见表3。
表2 提取工艺优化正交试验结果与分析
Table 2 Results and analysis of orthogonal tests for extraction technology optimization

试验号 A B C D 纯果胶得率/%123456789k1 111222333 123123123 123231312 123312231 4.66 5.33 4.04 5.12 5.69 5.95 6.48 6.76 6.23 k2 k3R 4.677 5.587 6.490 1.813 5.420 5.927 5.407 0.520 5.790 5.560 5.403 0.387 5.527 5.920 5.307 0.613
由表2可知,各因素影响纯果胶得率的主要顺序为提取温度(A)>液料比(D)>初始pH(B)>提取时间(C)。最佳组合为A3B2C1D2,即提取温度为90 ℃、液料比为20∶1(mL∶g)、初始pH值为2.0,提取时间为120 min。在此最佳工艺条件进行3次平行试验,纯果胶的平均提取率为6.84%。
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal tests results

注:“*”表示对结果影响差异显著(P<0.05)。
方差来源 平方和 自由度 均方 F 值 Fa临界值 显著性ABCD误差4.932 0.527 0.227 0.579 0.230 2 2 2 2 2 2.466 0.264 0.114 0.290 21.63 2.316 1.000 2.544 F0.05(2,2)=19.0 F0.01(2,2)=99.0*
由表3可知,因素A的F值为21.63>F0.05临界值19.0,对结果影响差异显著(P<0.05),说明因素A(提取温度)是影响黄皮纯果胶得率的关键性因素,而其他3个因素的影响无显著差异(P>0.05)。
2.3 黄皮果果胶制品质量分析
参照果胶强制标准GB 25533—2010《食品添加剂果胶》中涉及的方法对提取的果胶进行检测。
由表4可知,黄皮果胶的各项指标都达到了国标GB 25533—2010《食品添加剂果胶》的相关要求,结果表明黄皮果胶品质较好。
表4 黄皮果胶质量分析结果
Table 4 Results of quality analysis of pectin from wampee fruit
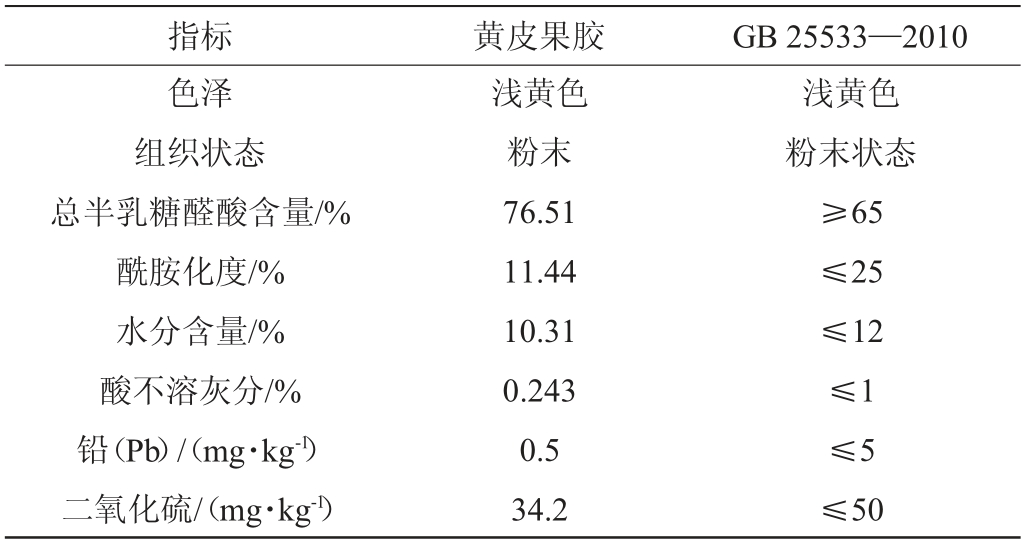
指标 黄皮果胶 GB 25533—2010色泽组织状态总半乳糖醛酸含量/%酰胺化度/%水分含量/%酸不溶灰分/%铅(Pb)/(mg·kg-1)二氧化硫/(mg·kg-1)浅黄色粉末76.51 11.44 10.31 0.243 0.5 34.2浅黄色粉末状态≥65≤25≤12≤1≤5≤50
3 结论
以黄皮果为原料,利用超声波进行破壁预处理后,采用盐酸热回流提取法制备黄皮果果胶,通过单因素试验和L(93)4正交试验优化提取工艺。结果发现,以0.01 mol/L盐酸为提取黄皮果果胶的最佳提取溶剂,优化提取工艺条件为提取温度90 ℃、液料比20∶1(mL∶g)、初始pH值为2.0,提取时间120 min。在此最优工艺条件下,黄皮果纯果胶得率可达6.84%,半乳糖醛酸含量为76.51%。该工艺条件下所得的黄皮果果胶各项指标均达到GB 25333—2010《食品添加剂果胶》要求,说明提取工艺参数可行,果胶质量可靠。
[1]彭文文,宋卫武,刘欣媛,等.黄皮属植物中咔唑生物碱的研究进展[J].中草药,2017,48(13):2761-2770.
[2]陆育生,林志雄,邱继水,等.黄皮种质资源果实性状多样性分析及其数量分类研究[J].园艺学报,2016,43(10):1903-1915.
[3]马超,刘杰凤,周天,等.黄皮果多糖提取工艺优化及抗氧化性研究[J].江苏农业科学,2013,41(8):290-292.
[4]李学文,萧洪东,喻敏.无核黄皮和有核黄皮果胶含量与甲基酯化度的差异[J].中国南方果树,2013,42(4):81-83.
[5]MULLER-MAATSCH J,BENCIVENNI M,CALIGIANI A,et al.Pectin content and composition from different food waste streams[J]. Food Chem,2016,201(1):37-45.
[6] PASANDIDE B, KHODAIYAN F, MOUSAVI Z E, et al. Optimization of aqueous pectin extraction from Citrus medica peel[J]. Carbohydr Polym,2017,178:27-33.
[7] BABBAR N, DEJONGHE W, GATTI M, et al. Pectic oligosaccharides from agricultural by-products: production, characterization and health benefits[J].Crit Rev Biotechnol,2016,36(4):594-606.
[8]TENCI M,RASSI S,BONFERONI M C,et al.Particulate systems based on pectin/chitosan association for the delivery of manuka honey components and platelet lysate in chronic skin ulcers[J].Int J Pharmaceut,2016,509(1-2):59-70.
[9] OLIVEIRA A N,PAULA D A,DE OLIVERIA E B, et al. Optimization of pectin extraction from Ubá mango peel through surface response methodology[J].Int J Biol Macromol,2018,113:395-402.
[10]DE SOUZA C G,RODRIGUES T H,LM E S,et al.Sequential extraction of flavonoids and pectin from yellow passion fruit rind using pressurized solvent or ultrasound[J].J Sci Food Agric,2018,98(4):1362-1368.
[11] BAYAR N, FRIJI M, KAMMOUN R. Optimization of enzymatic extraction of pectin from Opuntia ficus indica cladodes after mucilage removal[J].Food Chem,2017,241:127-134.
[12]SANTOS J D,ESPELETA A F,BRANCO A,et al.Aqueous extraction of pectin from sisal waste[J].Carbohydr Polym,2013,92(2):1997-2001.
[13]FERREIRA-LAZARTE A,KACHRIMANIDOU V,VILLAMIEL M,et al. In vitro fermentation properties of pectins and enzymatic-modified pectins obtained from different renewable bioresources[J]. Carbohydr Polym,2018,199:482-491.
[14]高健,马路山,胡建军,等.果胶提取技术研究进展[J].食品工业科技,2014,35(6):368-372.
[15]沈锐,赵壮志,李磊,等.火龙果皮中果胶的提取工艺优化及理化性质分析[J].食品研究与开发,2018,39(12):71-78.
[16]KONG F,SU Z,GUO X,et al.Antidiabetic and lipid-lowering effects of the polyphenol extracts from the leaves of Clausena lansium(Lour)skeels on streptozocin-induced type 2 diabetic rats[J]. J Food Sci,2017,83(1):212-220.
[17]张帅,董基,黄志明,等.微波辅助提取黄皮果肉果胶工艺参数优化[J].农业工程学报,2012,28(15):264-269.
[18]闵甜.黄皮核水溶性多糖的分离纯化、结构与抗氧化活性研究[D].广州:华南理工大学,2013.
[19]王娟,贺莹莹,韦寿莲,等.黄皮果胶对力竭游泳小鼠的抗疲劳功效[J].中国科技论文,2015,10(24):2884-2887.
[20]余小娜,杨晓露,成明.超声波辅助提取柑橘皮中果胶的研究[J].许昌学院学报,2017,36(2):87-90.
[21]李英,郭宗明,李立红,等.草酸铵法提取冬瓜皮果胶及其理化性质研究[J].食品研究与开发,2017,38(20):47-50.
[22]李萍,汪青青,闫静坤,等.超声波辅助酸法提取陈皮中果胶的工艺优化[J].天津农学院学报,2017,24(3):79-84.
[23]周应浩.从柑桔皮中提取果胶的工艺的研究[J].广州食品工业科技,2004,20(3):77-79.
[24]万建华.马铃薯渣果胶的提取及其性质的研究[D].无锡:江南大学,2008.
[25]中华人民共和国卫生部.GB 5009.3—2010 食品中水分的测定[S].北京:中国标准出版社,2010.
[26]中华人民共和国卫生部.GB 25533—2010 食品添加剂果胶[S].北京:中国标准出版社,2011.
[27]中华人民共和国卫生部.GB/T 5009.34—2016 食品中二氧化硫的测定[S].北京:中国标准出版社,2016.
[28]中华人民共和国卫生部.GB 5009.12—2017 食品中铅的测定[S].北京:中国标准出版社,2017.
[29] PEREIRA P H, OLIVEIRA T Í, ROSA M F, et al. Pectin extraction from pomegranate peels with citric acid[J].Int J Biol Macromol,2016,8:373-379.
[30]白家玮,苏党,应铁进.碱性条件下几种添加剂对不同体系非酶褐变的影响[J].食品科技,2018,43(4):283-292.