灰树花(Grifola frondosa)在日本称之“舞茸”(maitake),美国称之为“林鸡”,是一种食用药用型真菌,隶属担子菌纲,多孔菌目,多孔菌科。灰树花中蛋白质、活性多糖、维生素、微量元素等生物活性物质具有丰富的营养价值,尤其是灰树花多糖具有抗肿瘤[1-2]、增强免疫[3]、抗氧化[4-6]、抗艾滋病毒[7]、清除自由基[8]等生物活性。而天麻作为传统名贵中药,兰科寄生植物,以蜜环菌的菌丝或菌丝分泌物为营养来源,一直受国内外医学研究者青睐[9]。大量研究表明,天麻的主要成分包括天麻素、对羟基苯甲醇(p-hydroxybenzyl alcohol,HA)、香草醇、香兰素等[10-11],其中对羟基苯甲醇具有抗炎及抗脑血栓[12]、保护脑缺血引起的脑内炎症损伤[13]、抗血小板凝聚等作用[14]。
近年来,很多研究者在真菌液体发酵体系中添加一定的诱导物,结果可以促进菌丝体生长和代谢产物合成。GAO Q L等[15]向灵芝发酵液中添加乙酸乙酯提取的鳖虫、蜣螂,实验证明,灵芝多糖含量增加36%左右。HSIEH C Y等[16]向灰树花发酵液中添加1%的橄榄油,研究发现其菌丝体生物量显著提高,并且胞外多糖(exopolysaccharides,EPS)由0.70 g/L升至2.24 g/L,同时也减缓了灰树花细胞的老化。此外,中药经过真菌发酵,其药效增强,毒性减弱,同时还会利用生物转化,合成新的活性物质。POSTEMSKY P 等[17]利用猪苓固态发酵小麦籽粒,研究证明发酵后的小麦籽粒抗氧化活性明显增强。李国红等[18]用枯草芽孢杆菌(Bacillus subtilis)对三七须根进行发酵,在发酵液中发现化合物人参皂苷Rh4,此化合物在三七原料药材中并未检测到,证明产生了新的活性物质人参皂苷。
本课题组的前期研究结果表明,天麻醇提物的添加可以促进灰树花生物量和胞外多糖的产生[19-21]。但天麻中的有效单一成分对灰树花发酵产物的影响机理尚不明确,本实验向灰树花深层发酵体系中添加天麻单一成分对羟基苯甲醇(HA),并分析了生物量、胞外多糖及发酵产物的1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、羟基、超氧阴离子自由基及过氧化氢清除率、还原力的变化,利用高效液相色谱(high performance liquid chromatography,HPLC)分析HA在灰树花发酵体系中的利用情况。通过本研究可以阐明天麻部分有效成分在灰树花深层发酵体系中的动态变化情况、代谢产物抗氧化活性以及其转化机理,以此来改善传统中药制品“大、黑、多”的问题。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
灰树花菌株(Grifola frondosa)51616:中国微生物菌种保藏管理中心;对羟基苯甲醇标准品:美国Sigma公司;其余试剂均为国产分析纯。
1.1.2 培养基
斜面培养基:去皮马铃薯200 g/L,葡萄糖20 g/L,琼脂20 g/L,蛋白胨2 g/L,MgSO·47H2O 1 g/L,KH2PO4 2 g/L,pH自然,灭菌锅内120 ℃、105 kPa、灭菌30 min。
种子培养基:葡萄糖30 g/L,蛋白胨2 g/L,酵母膏6 g/L,MgSO·47H2O 1 g/L,KH2PO42 g/L,pH自然,灭菌锅内120 ℃、105 kPa、灭菌30 min。
发酵(液体)培养基:葡萄糖50 g/L,蛋白胨5 g/L,酵母膏10 g/L,MgSO·47H2O 1 g/L,KH2PO4 2 g/L,pH自然,灭菌锅内120 ℃、105 kPa、灭菌30 min。
1.2 仪器与设备
UV-7502PC紫外可见分光光度计:上海欣茂仪器有限公司;BPCL-2-JZ-TGC微弱发光测量仪:北京建新力拓科技有限公司;Spectromax190酶标仪:美国Molecular Devices公司;CP114电子天平:奥豪斯仪器(上海)有限公司;pHs-3C pH计:上海鸿盖仪器有限公司;BXM-30R立式灭菌锅:上海博讯实业有限公司医疗设备厂;TG2-16G低速离心机:上海安亭科学仪器厂:SW-CJ-1D净化工作台:苏州净化设备有限公司;Agilent 1100高效液相色谱仪:美国Agilent公司。
1.3 方法
1.3.1 培养方法
斜面培养:从母种试管中取出绿豆般的菌丝,接在斜面中部,在25 ℃生化培养箱中培养13~15 d,长势好的菌种放入4 ℃冰箱保存。
种子活化:取斜面菌种(除去老菌)无菌条件下接到种子培养基中,一支斜面只能接种到一瓶100 mL种子培养基中。放到25 ℃、150 r/min的恒温摇瓶柜内培养3~4 d。发酵培养:取10 mL(10%)种子液在无菌条件下接种,置于25 ℃、150 r/min的恒温摇瓶柜内培养。
1.3.2 分析方法
(1)菌丝体生物量测定
将发酵液用滤纸过滤,用蒸馏水冲洗3~5次,60 ℃烘干至质量恒定,并称质量。
(2)胞外多糖含量测定
取上述滤液,加入4倍体积分数95%乙醇,于4 ℃冰箱中静置24 h。然后离心(4 000 r/min,15 min),去除上清液,再用体积分数95%乙醇清洗沉淀3次,最后将沉淀在60 ℃下烘干,再加蒸馏水溶解,用苯酚-硫酸法[22]测定胞外多糖含量。
(3)发酵液还原力、DPPH、羟自由基清除率、超氧阴离子自由基清除率、过氧化氢清除率测定
还原力测定参考OYAIZU M[23]的方法并略有改动。取200μL样品,稀释至1mL,加入pH为6.6的磷酸盐缓冲液与1%铁氰化钾溶液各2.5mL混匀,放入50℃水浴锅中20~30 min,取出加入10%三氯乙酸溶液2.5 mL混匀,3 000 r/min离心10 min,取上清液2.5 mL,加入蒸馏水与0.1%氯化铁溶液各2.5 mL混匀,静置10 min后在700 nm处测吸光度值。
DPPH自由基清除率参照SHARMAO P[24]的DPPH法并略有改动。取样品20 μL稀释至200 μL,加入2 mol/L DPPH溶液(溶剂:无水乙醇)混匀,室温下避光反应30 min,取200 μL反应液放于酶标板中,在波长515 nm下测定其吸光度值。
羟自由基清除率采用邻菲罗啉—抗坏血酸—H2O2体系,超氧阴离子自由基清除率采用邻苯三酚—鲁米诺—碳酸盐缓冲液体系,过氧化氢清除率采用H2O2—鲁米诺—碳酸盐缓冲液体系。
(4)高效液相色谱检测条件
取1 mL发酵液进行膜过滤用于HPLC检测,色谱柱:Agilent TC-C1(84.6 mm×250 mm,5 μm);流动相:0.1%磷酸-水(A)和乙腈(C)。洗脱梯度:0~35 min C:3%~30%;35~45 min,C:30%~70%。流速1 mL/min,柱温30 ℃,进样量20 μL,检测波长221 nm。
(5)HA的利用率计算方法
测定HA含量后,计算HA的利用率,其计算公式如下:
1.3.3 数据统计分析
试验数据采用Excel2010进行分析,并用Origin Pro9.0软件作图。不同平均值之间利用IBM SPSS Statistics 22.0软件进行差异显著性分析。
2 结果与分析
2.1 不同HA添加量对发酵产物还原力和生物量的影响

图1 不同对羟基苯甲醇添加量对灰树花发酵产物还原力和生物量的影响
Fig. 1 Effect of different p-hydroxybenzyl alcohol addition on reducing capacity and biomass
以未添加HA为对照组,向灰树花发酵液体系中添加0.2 g/L的对羟基苯甲醇,每隔2 d对灰树花发酵液进行动态测定分析,HA添加对胞外生物量和胞外多糖的影响如图2所示。从图2(A)可知,灰树花深层发酵过程中,最初的生物量基本无差别(P>0.05),说明菌丝体生长缓慢;在4~14 d生物量快速增加,此段时间内实验组生物量一直显著高于对照组(P<0.05);发酵10 d时,实验组灰树花生物量达到(1.98±0.05)g/L,比对照组含量高65.2%,当培养14 d后,实验组灰树花生物量达到(2.79±0.02)g/L,比对照组高39.5%(P<0.05),说明HA添加可以促进灰树花菌丝体生长且在第10天促进效果更好。从图2(B)中可以看出,灰树花深层发酵过程中,最初的EPS产量无很大差别(P>0.05),实验组在6~14 d EPS产量迅速增长,显著高于对照组(P<0.05)。实验组在14 d时EPS含量达到最大值(3.51±0.02)g/L,比对照组含量高164.2%(P<0.05),由此可以看出HA的添加促进了胞外多糖的合成,并能延长胞外多糖的合成时间,这可能是由于HA可以作为碳源供发酵过程微生物生长。
由图1可知,灰树花发酵液还原力随HA添加量的不同而呈现差异性。当HA添加量在0~0.2 g/L时,发酵液还原力和生物量随着HA添加量的增加而增大;当添加质量浓度为0.2 g/L时,灰树花生物量达到最大,为(0.65±0.02)g/L,还原力达到0.97±0.01,相比未添加HA时分别提高了133.69%和72.25%,之后随着HA质量浓度的增加,生物量反而有所减少,还原力也在下降说明HA浓度过高会明显地抑制菌丝体生长和抗氧化活性。结果表明,当HA添加量在0.05~0.25 g/L可以促进菌丝量的产生,HA的最佳添加量为0.2 g/L。
2.2 HA添加对胞外多糖和生物量的影响
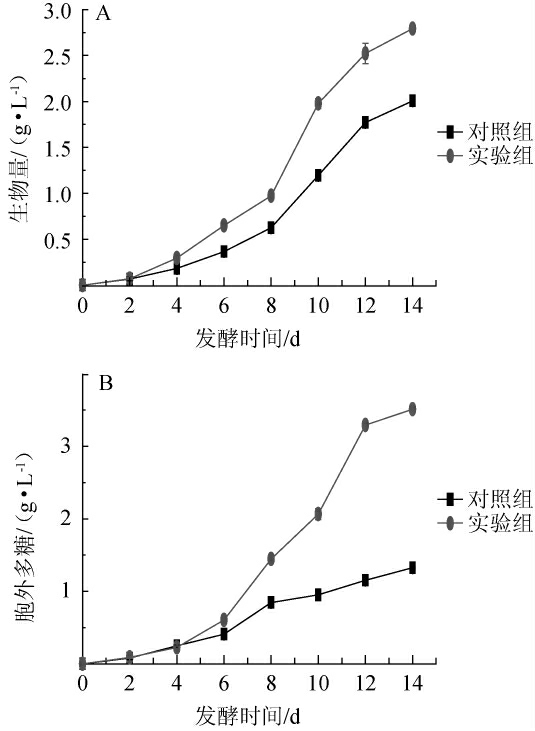
图2 对羟基苯甲醇添加对生物量(A)和胞外多糖(B)的影响
Fig. 2 Effect of p-hydroxybenzyl alcohol addition on biomass (A)and exopolysaccharide content (B)
2.3 HA添加对DPPH自由基清除率和还原力的影响
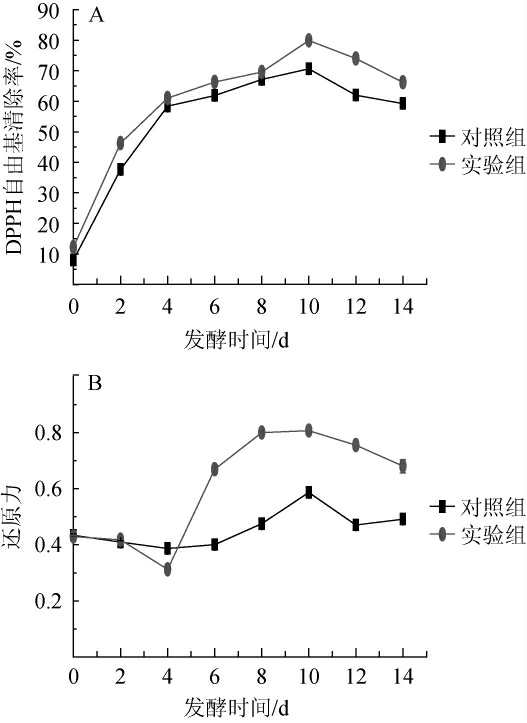
图3 对羟基苯甲醇添加对DPPH自由基清除率(A)和还原力(B)的影响
Fig. 3 Effect of p-hydroxybenzyl alcohol addition on DPPH radical scavenging rate (A) and reducing capacity (B)
以未添加HA为对照组,向灰树花发酵液体系中添加0.2 g/L HA,每隔2 d对灰树花发酵液进行动态测定分析HA添加对DPPH自由基清除率和还原力的影响,结果如图3所示。图3A结果显示,0~10 d,实验组和对照组DPPH自由基清除率均随发酵时间延长而增大,当发酵到第10天,对照组和实验组DPPH自由基清除率分别达到最大值,分别为(70.65±0.01)%和(79.85±0.01)%,实验组相对于对照组提高了13.02%。图3B结果显示,0~4 d实验组和对照组的还原力均下降,4~10 d,实验组和对照组还原力均升高,且实验组还原力显著高于对照组(P<0.05),当发酵到第10天,对照组和实验组还原力达到最大值,分别为0.59±0.01和0.81±0.01,且实验组相对于对照组提高了37%。由此可知,HA添加不仅可以提高发酵液DPPH自由基清除率,同时也增强了发酵液的还原力。
2.4 发酵液的超氧阴离子自由基、羟自由基以及过氧化氢清除率
添加HA发酵10 d之后发酵液的超氧阴离子自由基、羟自由基以及过氧化氢清除率如图4所示。结果显示,实验组超氧阴离子自由基、羟自由基以及过氧化氢清除率分别提高了41.1%、22.3%以及528%。因此向灰树花发酵液中添加0.2 g/L对羟基苯甲醇进行深层发酵10 d之后的灰树花发酵液整体清除自由基能力增强。
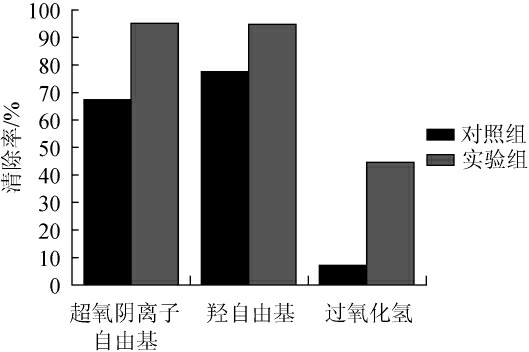
图4 发酵液的超氧阴离子自由基、羟自由基以及过氧化氢清除率
Fig. 4 The superoxide anion free radical, hydroxyl free radical and hydrogen peroxide scavenging rate of fermentation broth
2.5 灰树花发酵过程中HA的利用率
利用高效液相色谱测定HA在发酵液中的剩余含量,从而计算其利用率,结果如图5所示。
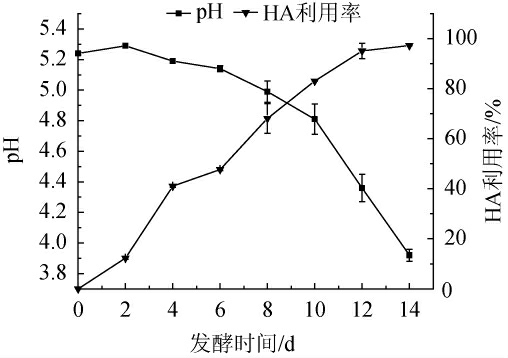
图5 灰树花发酵过程中pH变化以及对羟基苯甲醇利用率变化
Fig. 5 Changes of pH during Grifola frondosa fermentation and utilization of p-hydroxybenzyl alcohol
由图5可知,0~4 d时,HA利用率近40%,发酵液pH无明显变化;4~10 d,HA利用率逐渐升高达到83.1%,发酵液pH下降至4.81;10~14 d,HA持续被利用;当发酵到达14 d时,HA几乎被利用完毕,利用率可达97.27%,此时发酵液的pH降至4.0以下。这是由于0~4 d菌丝体生长缓慢,次级代谢产物少,所以发酵液的pH变化不明显。随着发酵的进行,HA逐渐被利用完毕,培养基中氮源、生长因子等营养成分也不足以支撑灰树花进行次级代谢,此时的灰树花利用活性物质维持基本代谢,有机酸变多,pH降至4.0以下,达到发酵终点。由此可以看出,HA在灰树花深层发酵体系中几乎可以被完全吸收利用。
3 结论
本研究利用灰树花发酵转化天麻成分HA,测定其转化前后发酵液抗氧化活性变化及其对生物量和胞外多糖产量的影响动态分析。试验结果表明:当HA添加量为0.2 g/L,发酵时间为10 d,其还原力最强,最大还原力可达到0.81±0.01。动态分析结果显示0.2 g/L的HA可以显著促进灰树花生物量和胞外多糖的产生,分别提高了65.2%和164.2%。其次,0.2 g/L的HA的添加可以明显提高DPPH自由基、羟自由基、超氧阴离子自由基、过氧化氢清除率和还原力,这与HA在灰树花深层发酵体系中能够促进灰树花胞外多糖、胞外蛋白等抗氧化活性物质的生成有关。在整个发酵过程中通过HPLC测定HA的利用率高达97.27%,几乎被完全转化。
[1]MAO G H,REN Y,FENG W W,et al.Antitumor and immunomodulatory activity of a water-soluble polysaccharide from Grifola frondosa[J].Carbohydr Polym,2015,134:406-412.
[2]FANG J P,WANG Y,LV X F,et al.Structure of a β-glucan from Grifola frondosa and its antitumor effect by activating dectin-1/syk/nf-κb signaling[J].Glycoconjugate J,2012,29(5-6):365-377.
[3]GARY D,HONG L,ANEDREW S,et al.A phase I/II trial of a polysaccharide extract from Grifola frondosa(maitake mushroom)in breast cancer patients:immunological effects[J].J Cancer Res Clin Oncol,2009,135(9):1215-1221.
[4]ZHANG W N,LU Y M,ZHANG Y P,et al.Antioxidant and antitumour activities of exopolysaccharide from liquid-cultured Grifola frondosa, by chemical modification[J]. Int J Food Sci Technol, 2016, 51(4): 1055-1061.
[5]YEH J Y,HSIEH L H,WU K T,et al.Antioxidant properties and antioxidant compounds of various extracts from the edible basidiomycete Grifola frondosa(maitake)[J].Molecules,2011,16(4):3197-3211.
[6]FAN Y N,WU X Y,ZHANG M,et al.Physical characteristics and antioxidant effect of polysaccharides extracted by boiling water and enzymolysis from Grifola frondosa[J].Int J Biol Macromol,2011,48(5):798-803.
[7]NANBA H,KODAMA N,SCHARD D.Effects of maitake(Grifola frondosa)glucan in HIV-infected patients[J].Mycoscience,2000,41(4):293-295.
[8] KONNO S,TORTORELIS G, FULLERTONSA, et al. A possible hypoglycaemic effect of maitake mushroom on type 2 diabetic patients[J].Diabet Med,2001,18(12):1010.
[9]ZHANG Y,XU X B,WANG N,et al.Preparation of two groups of Gastrodia elata BL.extracts and their effects on Grifola frondosa in submerged culture[J].Food Machin,2012,28(1):150-153.
[10] LIU C L, LIU M C, ZHU P L. Determination of gastrodin, p-hydroxybenzyl alcohol, vanillyl alcohol, p-hydroxylbenzaldehyde and vanillin in tall gastrodia tuber by high-performance liquid chromatography[J].Chromatographia,2002,55:317-320.
[11]王亚威,李志峰,何明珍,等.天麻化学成分研究[J].中草药,2013,44(21):74-76.
[12]李艳等.天麻成分对羟基苯甲醇抗实验性脑血栓形成及抗炎作用研究[J].昆明医科大学学报,2015,36(1):28-31.
[13]蒋石.天麻酚性成分对脑缺血致脑内炎症损伤的保护作用及机制研究[D].昆明:云南中医学院,2015.
[14]郭营营,蒋石,林青,等.天麻中对羟基苯甲醇抗血小板凝集的作用及机制研究[J].时珍国医国药,2014,25(1):4-7.
[15]GAO Q L,KE C Z.Enhancement of polysaccharides production in ganoderma lucidum by the addition of ethyl acetate extracts from Eupolyphaga sinensis and Catharsius molossus[J].Appl Microbiol Biot,2007,74(3):572-577.
[16]HSIEH C Y,LIU C J,TSENG M H,et al.Effect of olive oil on the production of mycelial biomass and polysaccharides of Grifola frondosa under high oxygen concentration aeration[J].Enzyme Microbial Technol,2006,39:434-439.
[17]POSTEMSKY P,CURVETTO N.Enhancement of wheat grain antioxidant activity by solid state fermentation with Grifola spp[J].J Medicinal Food,2014,17(5):543-549.
[18]李国红,沈月毛.发酵三七中的皂苷成分研究[J].中草药,2005,36(4):499-500.
[19]WANG N,WU T X,ZHANG Y,et al.Experimental analysis on the main contents of Rhizoma gastrodiae extract and inter-transformation throughout the fermentation process of Grifola frondosa[J]. Arch Pharmacal Res,2013,36(3):314-321.
[20]XU X B,WU T X,WANG N.The effect of exopolysaccharide biosynthesis and related enzyme activities of Grifola frondosa by the addition of ethanol extracts from traditional Chinese medicine, Gastrodia tuber[J].Afr J Biotechnol,2012,11:3656-3662.
[21]ZHANG Y, WANG N, WU T X. Effect of the extracts from Gastrodia elata BL.On mycelial growth and polysaccharide biosynthesis by Grifola frondosa[J].Afr J Microbiol Res,2012,6:379-384.
[22]DUBOIS M,GILLES K A,HAMILTON J K,et al.Colorimetric method for determination of sugars and related substances[J].Anal Chem,1956,28:350-356.
[23] OYAIZU M. Studies on products of browning reaction: antioxidative activities of produets of browning reaction prepared from glucosamine[J].Jpn J Nutr,1986,44:307-315.
[24]SHARMAO P,BHAT T K. DPPH antioxidant assay revisited[J].Food Chem,2009,113(4):1202-1205.