燕麦(Avena sativa L.)是一种禾本科燕麦属一年生的全价营养谷物[1],研究发现,日常饮食摄入燕麦产品可以有效预防肥胖症及其并发症[2],燕麦中的β-葡聚糖能够清除人体内的自由基[3]、促进血液循环、降低胆固醇[4],从而降低心脑血管疾病的发病率[5];且其具有丰富的生物活性成分,如燕麦生物碱、燕麦皂苷、多酚、黄酮等[6]。黄酮作为一种重要的活性物质[7],具有抗氧化[8]、抑菌[9]、抗病毒[10]、降血脂[11]、提高免疫力[12]、消炎[13]、护肝[14]、治疗脑血栓[15]的功能。
使用微生物发酵谷物不仅可以改善其生理活性,还可能赋予其独特的风味和质地。冠突散囊菌(Eurotium cristatum)俗称“金花”[16],是散囊菌属的一种真菌[17],也是存在于茯砖茶中使其产生特征风味的优势益生菌[18]。王吉成等[19]研究发现,冠突散囊菌可以显著性提高桑叶中的黄酮含量;王家琛等[20]研究发现,冠突散囊菌固态发酵燕麦能显著提高其多酚含量。苯丙氨酸解氨酶(phenylalanine ammonia lyase,PAL)是类黄酮合成途径上游的关键酶,杨慧芹等[21]研究了攀援型和矮生型四棱豆在遭受干旱时苯丙氨酸解氨酶活性和黄酮含量的关系,发现PAL活性与总黄酮之间存在显著的正相关。
国内外有很多研究人员利用微生物发酵研发新产品[23-24],本研究利用冠突散囊菌固态发酵燕麦,以黄酮含量为考察指标,通过单因素试验和正交试验优化燕麦固态发酵条件,并探讨发酵过程中黄酮含量与苯丙氨酸解氨酶活力动态变化的相关性,为燕麦加工提供理论依据。
1 材料与方法
1.1 材料与试剂
裸燕麦:黑龙江黑土香燕麦产业股份有限公司;冠突散囊菌(Eurotium cristatum):分离自湖南安化白沙溪茶厂的茯砖茶,保存于食品科学与生物技术湖南省重点实验室。
芦丁(纯度99%):北京索莱宝科技有限公司;无水乙醇、聚乙烯吡咯烷酮、L-苯丙氨酸、四硼酸钠、三氯化
铝、乳酸、醋酸钾、硼酸、石英砂、乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)、甘油(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
SPX-25085-Ⅱ生化培养箱:上海新苗医疗器械制造有限公司;DGG-9070A电热恒温鼓风干燥箱:上海森信实验仪器有限公司;XMTD数显恒温水浴锅:上海浦东物理光学仪器厂;FW135中草药粉碎机:天津市泰斯特仪器有限公司;RXⅡSeries高速低温冷冻离心机:日本HITACHI公司;SP-752型紫外可见分光光度计:上海光谱仪器有限公司。
1.3 试验方法
1.3.1 燕麦固态发酵工艺
将50 g裸燕麦于水中浸泡12 h,沥水后置于500 mL三角瓶中,在121 ℃条件下灭菌25 min,然后分别接入冠突散囊菌,混匀,于28 ℃条件下发酵。
1.3.2 冠突散囊菌固态发酵燕麦条件优化单因素试验
按照方法1.3.1发酵燕麦,依次考察发酵时间(1 d、2 d、3 d、4 d、5 d、6 d、7 d、8 d、9 d、10 d、11 d、12 d)、冠突散囊菌接种量(0.5%、1%、1.5%、2%、2.5%)、基质pH值(4.0、5.0、6.0、7.0、8.0)及发酵温度(24 ℃、26 ℃、28 ℃、30 ℃、32 ℃)对燕麦黄酮含量的影响。初始发酵条件为接种量1%、基质pH值为5.0、发酵温度28 ℃。
1.3.3 冠突散囊菌固态发酵燕麦条件优化正交试验
为确定燕麦的最佳发酵条件,在单因素试验的基础上,以黄酮含量(Y)为考察指标,选择发酵温度(A)、基质pH值(B)、接种量(C)和发酵时间(D)进行4因素4水平正交试验,正交试验因素与水平见表1。
表1 冠突散囊菌固态发酵燕麦条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for solid-state fermentation conditions optimization of oat by Eurotium cristatum
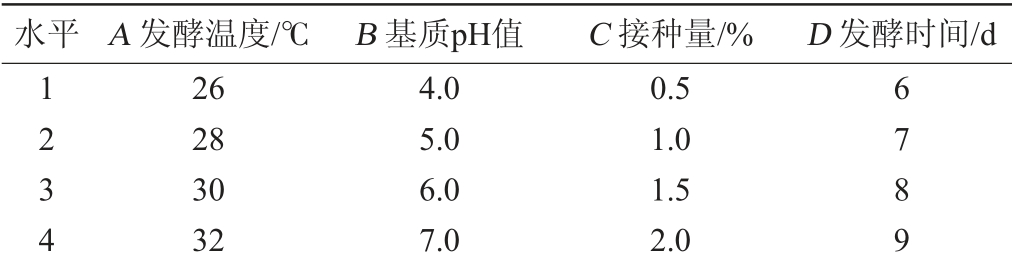
水平 A 发酵温度/℃ B 基质pH值 C 接种量/% D 发酵时间/d 1234 26 28 30 32 4.0 5.0 6.0 7.0 0.5 1.0 1.5 2.0 6789
1.3.4 燕麦黄酮含量的测定
芦丁标准曲线的绘制:准确称取芦丁10 mg,用无水乙醇溶解并定容至10 mL,得到质量浓度为1.00 mg/mL的芦丁标准溶液,分别吸取标准溶液0、0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL于10 mL比色管中,分别加2 mL 0.1 mol/L的AlCl3溶液,再加入3 mL 1 mol/L的醋酸钾溶液,无水乙醇补充至10 mL,避光静置30 min后,于波长420 nm处测定吸光度值[25]。以芦丁质量浓度(x)为横坐标,吸光度值(y)为纵坐标,绘制芦丁标准曲线,得到回归方程:y=0.082 4x+0.000 8(R2=0.997 4),R2>0.99,线性关系良好,可用于黄酮含量的测定。
样品中黄酮的提取:发酵后的燕麦置于烘箱45 ℃条件下烘干10 h,粉碎后过40目,得到发酵的燕麦干粉,取10 g燕麦干粉置于三角瓶,加入100 mL体积分数为80%的乙醇,50 ℃条件下浸提3 h,过滤,收集滤液,以体积分数80%的乙醇补足至100 mL为待测样品溶液。
样品中黄酮的测定:吸取待测样品溶液1 mL置于10 mL比色管中,加入2mL0.1mol/L的AlCl3溶液,再加入3mL1mol/L的醋酸钾溶液,无水乙醇补充至10 mL,避光静置30 min后,于波长420 nm处测定吸光度值。根据芦丁标准曲线回归方程计算黄酮的含量。
1.3.5 苯丙氨酸解氨酶活力的测定[26]
取不同发酵时间培养的发酵燕麦10g,加10.0mL0.1mol/L的硼酸缓冲液与适量石英砂,研磨匀浆后,4 ℃、10 000 r/min条件下离心8 min,取1 mL上清液为酶提取液,加1.0 mL 0.02 mol/L的L-苯丙氨酸,用0.1 mol/L硼酸缓冲液定容至10.00 mL,空白不加酶液,40 ℃恒温水浴60 min,使用紫外分光光度计测定波长290 nm处的吸光度值。
苯丙氨酸解氨酶活力定义:以每小时每毫升增加0.01吸光度值为一个酶活力单位(U)。
1.3.6 数据处理使用SPSS软件进行相关性分析,Pearson相关系数证明其相关性。
2 结果与分析
2.1 冠突散囊菌固态发酵燕麦条件优化单因素试验
2.1.1 发酵时间对燕麦黄酮含量的影响
不同发酵时间对燕麦黄酮含量的影响结果如图1所示。
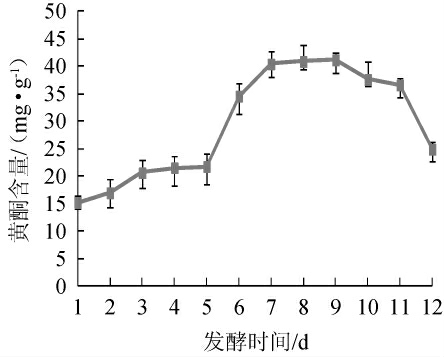
图1 不同发酵时间对燕麦黄酮含量的影响
Fig. 1 Effect of different fermentation time on flavones content in oat
由图1可知,3种微生物发酵燕麦后,随着发酵时间的延长,黄酮含量均呈先上升后下降的趋势,冠突散囊菌固态发酵燕麦第9天时,黄酮含量达到最高,为41.21 mg/g,是未发酵燕麦的2.7倍;冠突散囊菌发酵的燕麦中黄酮含量上升,可能是因为冠突散囊菌发酵时产生的苯丙氨酸解氨酶等降低了细胞壁对黄酮类化合物溶出的阻滞作用,从而使得黄酮含量增加[26];冠突散囊菌在生长代谢的过程中利用其他营养物质如淀粉、多糖进行生物转化而生成黄酮类物质[27]。发酵10 d后,燕麦黄酮含量开始下降,可能是发酵后期营养物消耗导致黄酮类化合物被利用为营养基质所致[28]。因此,选择最佳发酵时间为7 d。
2.1.2 接种量对燕麦黄酮含量的影响
不同接种量对燕麦黄酮含量的影响结果如图2所示。
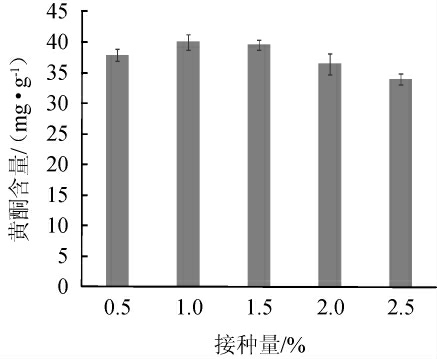
图2 不同接种量对燕麦黄酮含量的影响
Fig.2 Effect of different inoculum on flavones content in oat
由图2可知,随着冠突散囊菌接种量的增大,燕麦黄酮含量呈先上升后下降的趋势,当接种量为1.0%时,燕麦黄酮含量最高,为40.03 mg/g;当接种量>1.0%之后,燕麦黄酮含量降低,分析原因可能是接种量较大,导致菌株营养和基质溶氧量不足,冠突散囊菌之间对基质的营养进行竞争,发酵能力下降,燕麦黄酮含量降低[29-30]。因此,选择最佳接种量为1.0%。
2.1.3 基质pH值对燕麦黄酮含量的影响
不同基质pH值对燕麦黄酮含量的影响结果如图3所示。
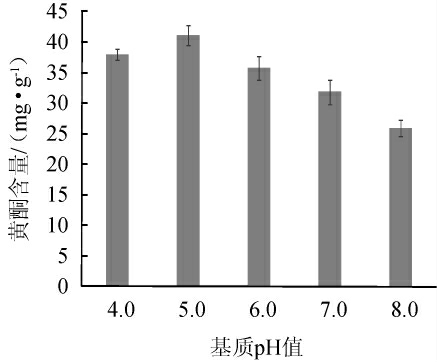
图3 不同基质pH值对燕麦黄酮含量的影响
Fig. 3 Effect of substrates with different pH values on flavones content in oat
由图3可知,随着燕麦基质pH值的增加,燕麦黄酮含量呈先上升后下降的趋势,当基质pH值为5.0时,燕麦黄酮含量最高,为41.16 mg/g。当pH>5.0之后,燕麦黄酮含量降低,分析原因可能是冠突散囊菌更适合在弱酸环境中生长,其产酶过程及酶促反应均会受pH环境的影响,pH过高和过低均会抑制酶促反应的效率[31],从而导致燕麦黄酮含量较低。因此,应选择基质的最佳pH值为5.0。
2.1.4 发酵温度对燕麦黄酮含量的影响
不同发酵温度对燕麦黄酮含量的影响结果如图4所示。
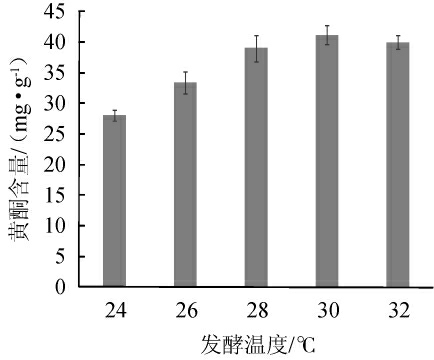
图4 不同发酵温度对燕麦黄酮含量的影响
Fig. 4 Effect of different fermentation temperature on flavones content in oat
由图4可知,随着发酵温度的升高,燕麦黄酮含量呈先上升后略微下降的趋势,当发酵温度为30 ℃时,燕麦黄酮含量最高,为41.21 mg/g。说明冠突散囊菌在30 ℃时生长状况较好,能够有效利用营养物质,使得酶促反应效率较高;当温度为32 ℃时,黄酮含量略微下降,可能是温度略高影响了菌体生长,从而对黄酮类物质的积累造成了影响[32]。因此,选择30 ℃为最佳发酵温度。
2.2 冠突散囊菌固态发酵燕麦条件优化正交试验
在单因素试验的基础上,以黄酮含量(Y)为考察指标,选择发酵温度(A)、基质pH值(B)、接种量(C)及发酵时间(D)为考察因素进行4因素4水平的正交试验,试验结果与分析见表2,方差分析见表3。
表2 冠突散囊菌固态发酵燕麦条件优化正交试验结果与分析
Table 2 Results and analysis of orthogonal experiments for solid-sate fermentation conditions optimization of oat by Eurotium cristatum
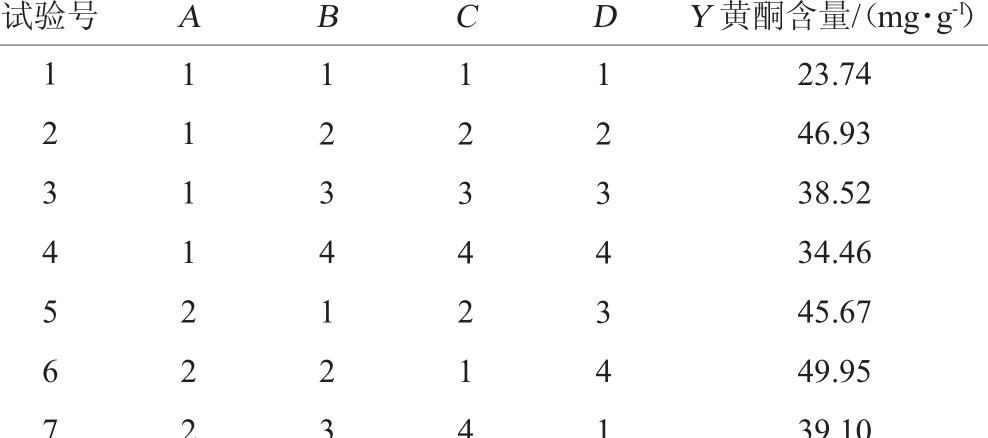
试验号 A B C D Y 黄酮含量/(mg·g-1)1 2 3 4 5 6 7 1 1 1 1 2 2 2 1 2 3 4 1 2 3 1 2 3 4 2 1 4 1 2 3 4 3 4 1 23.74 46.93 38.52 34.46 45.67 49.95 39.10
续表
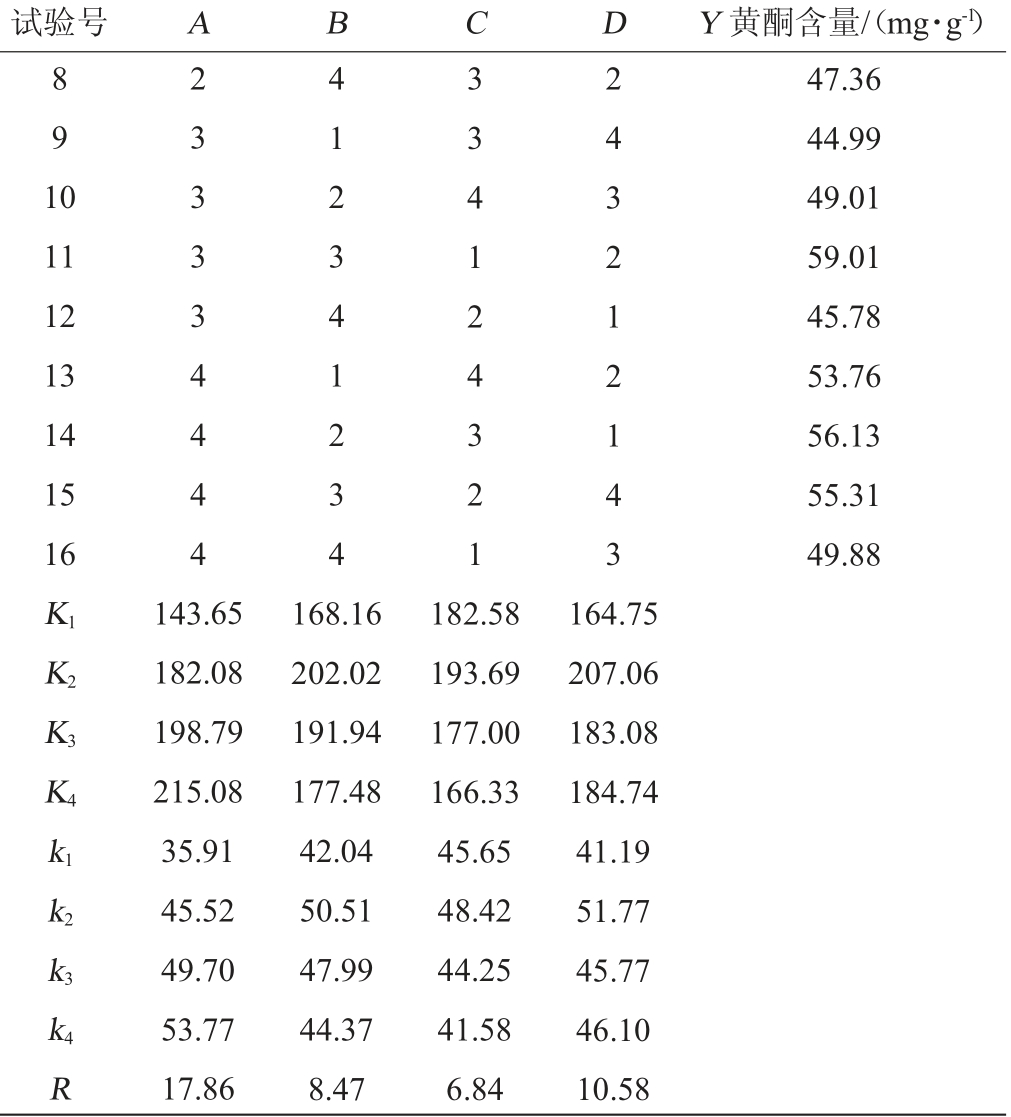
试验号 A B C D Y 黄酮含量/(mg·g-1)8 9 1 0 11 12 13 14 15 16 2 3 3 3 3 4 4 4 4 4 1 2 3 4 1 2 3 4 3 3 4 1 2 4 3 2 1 2 4 3 2 1 2 1 4 3 47.36 44.99 49.01 59.01 45.78 53.76 56.13 55.31 49.88 K1K2K3K4 k1 k2 k3 k4R 143.65 182.08 198.79 215.08 35.91 45.52 49.70 53.77 17.86 168.16 202.02 191.94 177.48 42.04 50.51 47.99 44.37 8.47 182.58 193.69 177.00 166.33 45.65 48.42 44.25 41.58 6.84 164.75 207.06 183.08 184.74 41.19 51.77 45.77 46.10 10.58
表3 正交试验结果方差分析
Table 3 Variance analysis of orthogonal experiments results
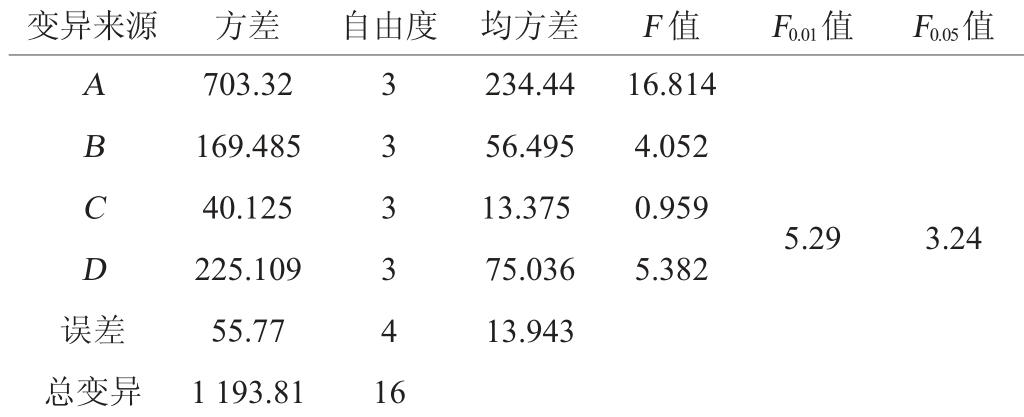
变异来源 方差 自由度 均方差 F 值 F0.01值 F0.05值ABCD误差234.44 56.495 13.375 75.036 13.943 16.814 4.052 0.959 5.382 5.29 3.24总变异703.32 169.485 40.125 225.109 55.77 1 193.81 3 3 3 3 4 1 6
由表2可知,燕麦黄酮含量影响因素的主次顺序为A(发酵温度)>D(发酵时间)>B(基质pH值)>C(接种量),试验组最佳水平组合为A3B3C1D2;而通过极差分析得出的最佳水平组合为A4B2C2D2。经验证,最佳水平组合为A3B3C1D2,即发酵温度30 ℃,基质pH值6.0,接种量0.5%,发酵时间7 d,在此最优发酵条件下,燕麦黄酮含量最高,为58.13 mg/g,是未发酵燕麦的3.8倍。由表3可知,发酵温度、发酵时间对燕麦黄酮含量的影响极显著(P<0.01);基质pH值对燕麦黄酮含量的影响显著(P<0.05),而接种量对燕麦黄酮含量的影响不显著(P>0.05)。
2.3 不同发酵时间对苯丙氨酸解氨酶活性的影响
苯丙氨酸解氨酶是黄酮类化合物合成的第一个关键酶,对苯丙氨酸解氨酶活性与黄酮含量变化进行相关性分析,结果如图5所示。
由图5可知,随着发酵时间的延长,丙氨酸解氨酶活性呈先上升后缓慢下降的趋势,在第7天达到最高,为50.9 U/mL。
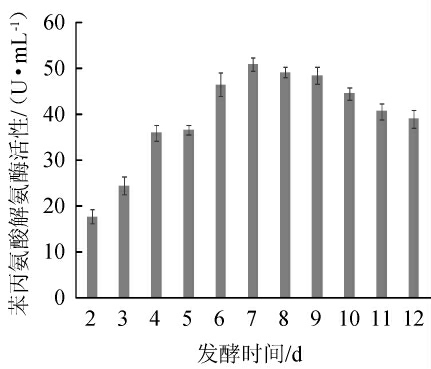
图5 发酵过程中苯丙氨酸解氨酶活性的变化
Fig. 5 Changes of phenylalanine ammonia lyase activity during fermentation
由图1、图5可知,苯丙氨酸解氨酶活性及黄酮含量均随着发酵时间的增加呈先增加后下降的趋势,黄酮含量与苯丙氨酸解氨酶活性间的相关性分析结果见表4。
表4 黄酮含量与苯丙氨酸解氨酶活性间的相关性分析
Table 4 Correlation analysis between phenylalanine ammonia lyase activity and flavones content
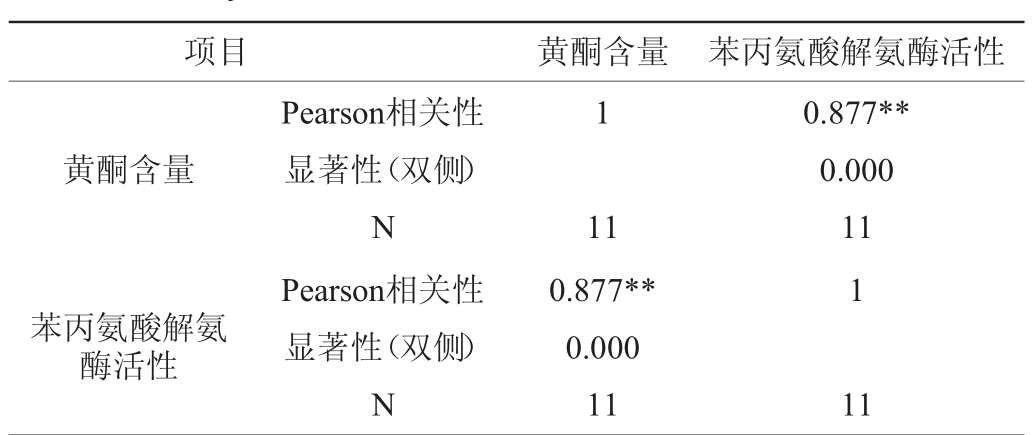
注:“**”表示极显著相关(P<0.01);N为样品数量。
项目 黄酮含量 苯丙氨酸解氨酶活性1黄酮含量0.877**0.000 11 1苯丙氨酸解氨酶活性Pea rson相关性显著性(双侧)N Pearson相关性显著性(双侧)N 11 0.877**0.000 11 11
由表4可知,Pearson相关系数>0.8(P<0.01),表现为显著正相关,说明发酵过程中黄酮含量的变化与苯丙氨酸解氨酶活性的变化密切相关,所以使用冠突散囊菌发酵燕麦时,苯丙氨酸解氨酶活性的增加能提高黄酮含量。
3 结论
利用冠突散囊菌对燕麦进行固态发酵,能够提升燕麦中的黄酮含量。冠突散囊菌固态发酵燕麦的最优条件为发酵温度30 ℃、基质pH值为6.0、接种量0.5%、发酵时间7 d,在此最优发酵条件下,燕麦黄酮含量最高,为58.13 mg/g,较优化前提高41.06%,是未发酵燕麦的3.8倍。在冠突散囊菌发酵过程中,黄酮含量的变化与苯丙氨酸解氨酶活性的变化呈显著正相关。
[1]史晓萌,陈建国,梁寒峭,等.燕麦发酵前后营养成分及风味物质分析[J].食品科技,2018,43(5):169-174.
[2]石振兴,朱莹莹,任贵兴.燕麦中减肥降脂的功能成分研究进展[J].食品安全质量检测学报,2018,9(7):1567-1571.
[3]许尨,关健,薛淑静,等.燕麦活性物质研究进展[J].农产品加工,2014,45(8):52-53.
[4]钟婷.燕麦的营养保健功能与综合利用[J].首都医药,2012,19(14):11-12.
[5]齐冰洁,刘景辉.燕麦β-葡聚糖研究进展[J].中国农业科技导报,2007,9(2):69-72.
[6]朱礼艳.燕麦中活性成分的提取、分离与结构鉴定[D].无锡:江南大学,2012.
[7]吴秋敏,苏平,刘芸.黄酮的抗氧化性和促氧化性研究进展[J].食品工业科技,2014,35(24):379-383.
[8] KARIMI E, JAAFAR H Z E, GHASEMZADEH A. Chemical composition,antioxidant and anticancer potential of Labisia pumila,variety alata,under CO2,enrichment[J].NJAS-Wagen J Life Sc,2016,78:85-91.
[9]王鸿飞,刘飞,徐超,等.费菜总黄酮及其不同极性提取物抑菌活性研究[J].中国食品学报,2013,13(5):124-128.
[10]王晓丹,夏晓玲,赵玉娇,等.蒲公英有机萃取物的抗甲型H1N1 流感病毒作用[J].中国现代应用药学,2015,32(12):1423-1427.
[11]雷燕妮.黄芩总黄酮对高血脂大鼠的降血脂作用研究[J].动物医学进展,2014,35(7):64-68.
[12]韦翠萍,周德华.沙苑子黄酮对衰老模型小鼠的自由基代谢及免疫力的影响[J].中国全科医学,2010,13(2):160-162.
[13]冯媛媛,陈存.红景天黄酮类化合物及药理活性研究进展[J].中药材,2014,37(4):700-705.
[14]李静,张朝辉,段筱杉,等.大叶藻黄酮对酒精性肝损伤的保护作用[J].水产学报,2016,40(5):799-806.
[15]罗岗,黄祎诺,王建军,等.洋葱黄酮类提取物对大鼠脑出血后血肿周围活化小胶质细胞及炎症因子的抑制作用[J].中国中西医结合杂志,2016,36(7):854-860.
[16]刘菲,薛志慧,叶倩林,等.“发花”对白茶风味品质的影响研究[J].茶叶科学,2016,36(3):301-311.
[17]黄彦,石瑞,苏二正.冠突散囊菌的研究与应用进展[J].生物加工过程,2017,15(1):49-56.
[18]吴凯为,杨立娜,朱力杰,等.冠突散囊菌在发酵茶中应用的研究进展[J].食品研究与开发,2018,39(1):189-193.
[19]王吉成,刘轩,唐劲天,等.桑叶发酵前后总黄酮、总酚酸含量变化及抗氧化活性研究[J].中国民族民间医药,2014,23(23):15-18.
[20]王家琛,刘素纯,刘善鑫.冠突散囊菌发酵燕麦对多酚含量影响的研究[J].中国酿造,2017,36(8):104-108.
[21]杨慧芹,王莎莎,张建波,等.烟草多酚代谢对干旱和低温胁迫的响应差异及其比较[J].基因组学与应用生物学,2015,34(3):645-654.
[22]赵则海,邱卓荣,陈雄伟,等.攀援型和矮生型四棱豆苯丙氨酸解氨酶活性和黄酮含量的研究[J].生态环境学报,2011,20(11):1670-1674.
[23] ZHANG N, LI D, ZHANG X Q, et al. Whole oats as a synbiotic food rich in lactic acid bacteria and prebiotic by solid-state fermentation[J].Food Funct,2015,6(8):2620-2625.
[24]史燕,张淑丽,王海宽.以全燕麦为基质的干酪乳杆菌固态发酵研究[J].天津科技大学学报,2014,29(6):16-20.
[25]赵恩泽,金时,魏作富,等.木豆叶总黄酮测定方法的比较研究[J].植物研究,2011,31(4):499-502.
[26]杜晨晖,闫艳,冯前进,等.葛根芩连汤发酵前后总黄酮和总生物碱含量变化研究[J].中华中医药杂志,2016,31(11):4850-4853.
[27]许亮.枸杞果酒发酵过程中黄酮与多糖含量的变化动力学及其发酵条件优化[D].杨凌:西北农林科技大学,2011.
[28]卢颖.红曲霉固态发酵燕麦功能成分的生物转化[D].广州:华南理工大学,2016.
[29]闵钟熳,贾笑雨,解铁民,等.微生物发酵法提取米糠粕中可溶性膳食纤维的研究[J].中国酿造,2017,36(8):53-56.
[30]魏丽娟,杨国辉,王德功,等.中药黄芪渣固态发酵工艺条件的优化[J].黑龙江畜牧兽医,2015(19):217-219.
[31]胡敏,郝林,贾丽艳.枯草芽孢杆菌产细菌素发酵条件的优化[J].食品科学,2014,35(9):198-202.
[32]陈显群,羊悦,杨胜利.中药蝉花菌株筛选及发酵条件优化研究[J].浙江化工,2015,46(2):18-21.