固定化技术是现代工业上广泛使用的一类新型生物技术[1-2],酵母的固定化研究利用物理、化学等方法将酵母细胞约束或者限制在一定的空间内,使细胞仍能保留其催化活性,并且具有能被反复利用的活力。酿酒酵母固定化细胞具有代谢快、反应快、抗污染能力强,能够连续使用,有利于产物分离的特点,并且逐渐已被广泛的应用于食品与发酵工业中[3-6]。常用的固定化包埋剂采用海藻酸钠、卡拉胶、羟甲基纤维素钠等多糖胶[7-9]。魔芋胶[10-11]是一种黏度较高的新型多糖胶,魔芋粉溶解形成的胶状多糖细腻,和海藻酸钠组合具有一定的柔软性和圆滑性,颗粒疏松多孔,便于酵母呼吸作用,能通过缝隙利用游离的单糖作能源维持生命活动。
魔芋中含有大量的魔芋多糖,为天然高分子化合物,具有较好的黏性,能与水结合成胶体溶液,可用于食品稳定剂[11-14]、增稠剂[15]、胶凝剂[16]、石油萃取黏胶剂[17-18]。魔芋中的多糖主要为葡甘露聚糖,其水解产物魔芋寡糖,现已逐步被用于改善人体肠道内环境,通过调节肠道微生物菌群来治疗当前大量的慢性疾病[19-21],解决肠道微生物菌群失调间接与其他疾病相关的问题[22-25]。魔芋粉水解产物中会有还原性单糖[26]的存在,降低寡糖的纯度和使用效果,不利于市场的开发。
本实验采用海藻酸钠和魔芋粉组合固化交联剂,包埋高浓度的酿酒酵母,通过三级反应柱对酶法水解的魔芋粉水解产物进行单糖去除实验,采用生物降解法快速、高效降解,避免较多副产物的生成和缩短样品处理周期。实验分析了固定化酵母细胞的活性能力;采用薄层层析(thin layer chromatography,TLC)法测试了固定化酵母对魔芋粉水解产物中单糖的去除,为后续低聚糖混合物的分离、纯化提供可行性技术路线。
1 材料与方法
1.1 材料与试剂
酿酒酵母(Saccharomyces cerevisiae)GY-1:云南师范大学生科学院微生物实验室通过离心喷雾干燥设备制备。
β-甘露聚糖酶(10 000 U/g):昆明爱科特生物科技有限公司;海藻酸钠(分析纯):上海润捷化学试剂有限公司;魔芋精粉(食品级):丽江玉元食品有限公司;CaCl(2分析纯):成都临江化工厂;葡萄糖(分析纯),3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):国药集团化学试剂有限公司;甘露糖、甘露二糖、甘露三糖、甘露六糖(纯度均为≥95%):南京草本源生物科技有限公司;魔芋胶(含有2%~3%的还原糖):实验室通过β-甘露聚酶水解20%浓度的魔芋粉制备形成的低聚糖水解液。
1.2 仪器与设备
CJJ-931四联磁力加热搅拌器:江苏金坛市金城国胜实验仪器厂;DK-98-II电热恒温水浴锅:天津市泰斯特仪器有限公司;CX22LEDRFSI奥林巴斯显微镜:日本OLYMPUS公司;DHP-9082电热恒温培养箱:上海一恒科学仪器有限公司;CP1502电子称:奥豪斯仪器(上海)有限公司;TGL-16B高速离心机:上海安亭科学仪器厂;NDJ-1旋转黏度计:上海群昶科学仪器有限公司;多级离子交换柱1.8 cm×35 cm×3根(每根装液体积为32.0 mL):上海方畦仪器有限公司;S100-11B+TH1013型微量泵:保定迪创电子科技有限公司。
1.3 方法
1.3.1 固定化酵母GY-1的制备
取100 mL的40 ℃水溶解酵母,在磁力搅拌器上混合搅拌30 min,再称取1%的海藻酸钠和相应比例的魔芋粉(各组合比例见表1),混合,加入混有酵母粉水溶液中,搅拌混合1 h,使用微量泵滴到4%CaCl2溶液中,在低温条件下交联反应10 h,观察固定化酵母颗粒硬度、形状、大小、颗粒光滑程度。
表1 固定化酵母GY-1的海藻酸钠、魔芋粉及酵母配比
Table 1 Ratio of sodium alginate, konjac powder and yeast for immobilized yeast GY-1

项目A组合海藻酸钠1%+1%酵母B组合海藻酸钠1%+5%酵母C组合海藻酸钠1%+10%酵母D组合海藻酸钠1%+15%酵母魔芋粉/% 2 1 0.5 2 1 0.5 2 1 0.5 2 1 0.5 0 0 0 0
1.3.2 分析检测
(1)还原糖含量的测定
取魔芋粉水解产物进行适当稀释,取3支试管,两支试管中每支试管装入0.2 mL稀释液,一支试管装入0.2 mL蒸馏水,每支试管加入3 mL DNS试剂,沸水浴条件下煮沸5 min,冷却,补水使反应体积总体积为15 mL,在波长540 nm条件下测定吸光度值,计算酶解液中还原糖的含量。
(2)糖度的测定
糖度测定是一种快速的方法,可通过在线测定,比还原糖测定快捷,实验中采用糖度计对寡糖溶液进行监控,为工业化生产检测提供快捷思路,简化生产环节。以水为空白校正调零,取水解液放在糖度计测得。
(3)魔芋胶黏度的测定
分别取0.2 g、0.4 g、0.6 g、0.8 g、1.0 g、1.2 g、1.4 g、1.6 g、1.8 g、2.0 g魔芋精粉加入100 mL的60 ℃热水中,混合均匀,B型磁力搅拌子在溶液中搅拌4 h,溶液溶胀混合均匀,冷却至室温(25 ℃),使用转子黏度计测定黏度。
(4)固定化酵母死亡率的测定
实验采用美兰法测定固定化酵母的死活细胞,将包埋形成的不同浓度的固定化酵母GY-1颗粒用研钵捣碎后,取酵母液0.2 mL放入试管中,加入1.0 mL美兰试剂,混合均匀,取样做水封片,在40×高倍镜下观察酵母细胞着色情况,如果细胞染成蓝色表明是死细胞,计算视野中细胞总数和死细胞个数。
(5)固定化酵母活性的测试
配制3%葡萄糖和0.5%(NH)42SO4的培养基溶液100 mL装入300 mL的锥形瓶中,共配制13瓶,包扎进行灭菌、冷却;再分别称取5.0 g、10.0 g、15.0 g、20.0 g固定化酵母添加到培养液中,每个梯度做3瓶,最后设置一组不添加固定化酵母颗粒作为空白对照互组;实验样品全部在30 ℃恒温静置培养48 h,分别在6 h、12 h、24 h、48 h取样测定反应液中的还原糖和称瓶质量计算二氧化碳的产生量。
1.3.3 柱式反应器流速对固定化酵母利用单糖能力的影响
将三个反应柱串联固定在铁架台上,每个反应柱中装满固定化酵母颗粒,进口和出口都置于装有糖液的烧杯中,利用微量泵对糖液进行循环,当糖液依次经过反应柱时,可利还原单糖渗透进入颗粒中被胶粒中的酵母吸附利用,从而达到降解利用单糖的目的。采用将柱子首尾相连,利用微量泵联结形成回路,分别在2.5 mL/min、5.0 mL/min和7.5 mL/min的流速条件下,进行固定化酵母利用单糖能力测试,以糖度计快速测定反应柱中的糖度,通过糖度的下降程度反映流速对固定化酵母利用单糖能力的影响,其工艺流程见图1。
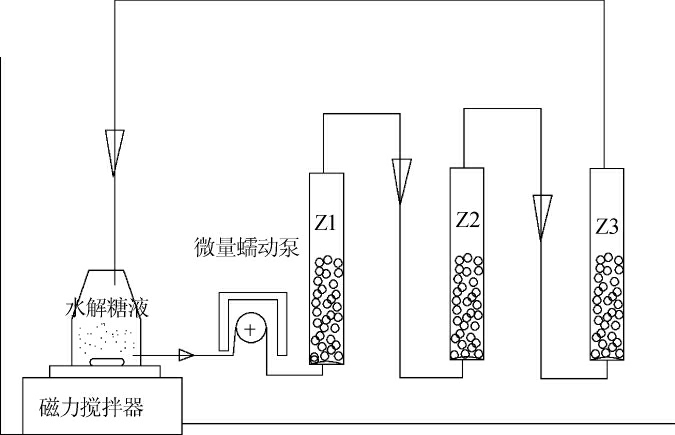
图1 固定化酵母利用单糖工艺流程
Fig. 1 Technological process of monosaccharide utilized by immobilized yeast
1.3.4 不同魔芋胶浓度对固定化酵母利用单糖能力的影响
取魔芋粉制备的高浓度魔芋寡糖溶液配制2%、4%、6%、8%的溶液各500 mL,在30 ℃的水浴锅中保温,通过微量泵连接到柱式反应器中进行固定化酵母利用单糖实验,每隔60 min取100 μL测定还原糖,考察不同的魔芋胶浓度对固定化酵母利用单糖能力的影响。
1.3.5 固定化酵母利用单糖分析
取β-甘露聚糖酶在50 ℃水解10%魔芋50 min,升温至90 ℃保温10 min灭酶、过滤、离心,取上清液过0.22 μm滤膜,获得点样样品;取离心的β-甘露聚酶水解液100 mL,温度保温控制在30 ℃,过串联反应柱,通过微量泵控制泵流速为2.5 mL/min,循环反应40 min,取过滤柱Z3的样品离心,并对离心上清液过0.22 μm滤膜,获得点样样品,按照薄层层析(TLC)法分析产物组成;标准品为甘露糖、甘露二糖和甘露三糖,其他样品为葡聚糖酶、纤维素酶的水解产物作为对照。
2 结果与分析
2.1 魔芋胶黏度分析
魔芋粉溶解到水中形成高黏度的魔芋胶多糖,流动性较差,具有包埋剂的效果,而且魔芋胶具有润滑性,制备的颗粒具有一定的硬度和光滑度。实验分别取0.2 g、0.4 g、0.6 g、0.8 g、1.0 g、1.2 g、1.4 g、1.6 g、1.8 g、2.0 g魔芋粉加入100 mL热水中,溶解形成魔芋胶,检测不同浓度的魔芋胶黏度,结果见图2。由图2可知,2%的魔芋胶黏度能达到30 000 mPa·s以上,呈胶状,无流动性。

图2 不同魔芋胶粉含量对黏度的影响
Fig. 2 Effect of different konjac power concentrations on viscosity
2.2 固定化酵母颗粒物理性能比较
选用海藻酸钠和魔芋粉作为固化交联剂,并固定海藻酸钠的浓度为1%,调整不同浓度魔芋粉的配比分析颗粒的光滑度和硬度,并对包埋酵母的数量进行了检测,结果见表2。由表2可知,添加10%和15%酵母粉进行固定化制备形成的颗粒硬度较柔软,不利于使用;而添加1%酵母粉进行固定化制备形成的颗粒硬度合适,但包埋的酵母个数少,也不利于酵母快速利用单糖,缩短生产工艺时间。在对5%酵母粉进行固定化制备形成的颗粒进行分析,表明加入2%的魔芋粉形成的颗粒较好,颗粒均匀,粒度平均直径为4~5 mm。采用美兰法测定固定化酵母GY-1的死亡率,1%固定化酵母颗粒中死亡率在17%~20%;10%固定化酵母颗粒中死亡率在15%~29%,而5%固定化酵母死亡率在9%~11%。根据酵母颗粒硬度、光滑程度和酵母细胞的死亡率,综合考虑选用5%的酵母+1%海藻酸钠+2%魔芋粉作为固定化颗粒配比组合来制备固定化酵母GY-1。
表2 固定化酵母GY-1颗粒物理形态分析
Table 2 Physical morphology analysis of immobilized yeast GY-1 particles
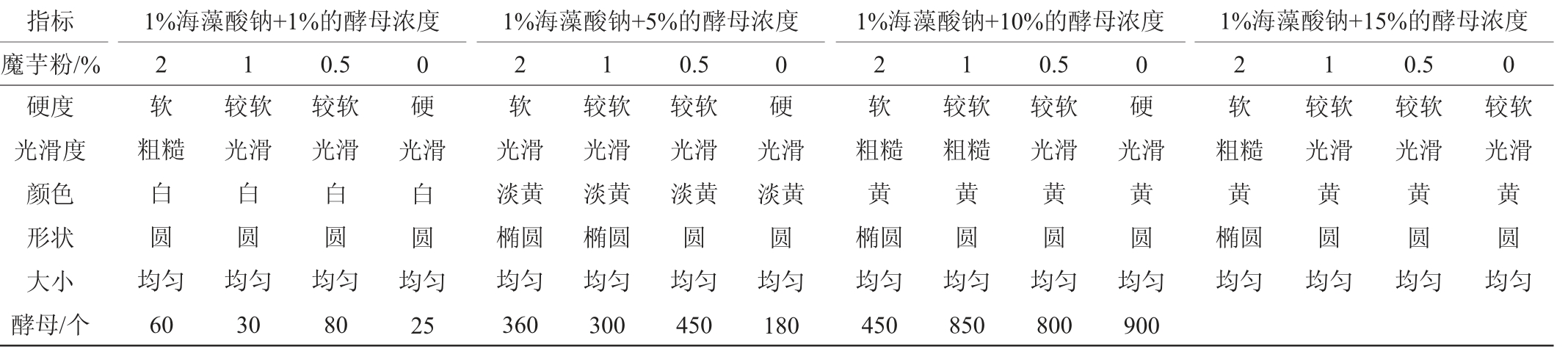
指标1%海藻酸钠+1%的酵母浓度1%海藻酸钠+5%的酵母浓度1%海藻酸钠+10%的酵母浓度魔芋粉/% 0 0 0 1%海藻酸钠+15%的酵母浓度2 1 0.5 2 1 0.5 2 1 0.5 2 1 0.5 0硬度光滑度颜色形状大小酵母/个软粗糙白圆均匀60较软光滑白圆均匀30较软光滑白圆均匀80硬光滑白圆均匀25软光滑淡黄椭圆均匀360较软光滑淡黄椭圆均匀300较软光滑淡黄圆均匀450硬光滑淡黄圆均匀180软粗糙黄椭圆均匀450较软粗糙黄圆均匀850较软光滑黄圆均匀800硬光滑黄圆均匀900软粗糙黄椭圆均匀较软光滑黄圆均匀较软光滑黄圆均匀较软光滑黄圆均匀
续表

1%海藻酸钠+15%的酵母浓度2 1 0.5 2 1 0.5 2 1 0.5 2 1 0.5 0死亡/个死亡率/%指标1%海藻酸钠+1%的酵母浓度1%海藻酸钠+5%的酵母浓度1%海藻酸钠+10%的酵母浓度魔芋粉/% 0 0 0 10 17 5 5 17 14 17.5 20 33 9 60 10 40 9 20 11 68 15 180 21 120 15 260 29
2.4 固定化酵母GY-1利用还原单糖能力测定
通过添加固定化酵母颗粒到3%的葡萄糖溶液中进行静置培养,分析固定化酵母利用还原单糖的能力测试,培养时间为48 h,结果见图3。由图3A可知,培养前后还原糖含量差异较大,48 h后固定化酵母添加量为20%的反应瓶中,还原糖含量由30 mg/mL下降至10 mg/mL左右,还原糖利用率为66%;由图3B可知,随着培养时间的延长,二氧化碳产生量在稳定增加,表明固定化酵母的降解能力没有因为包埋而丧失。
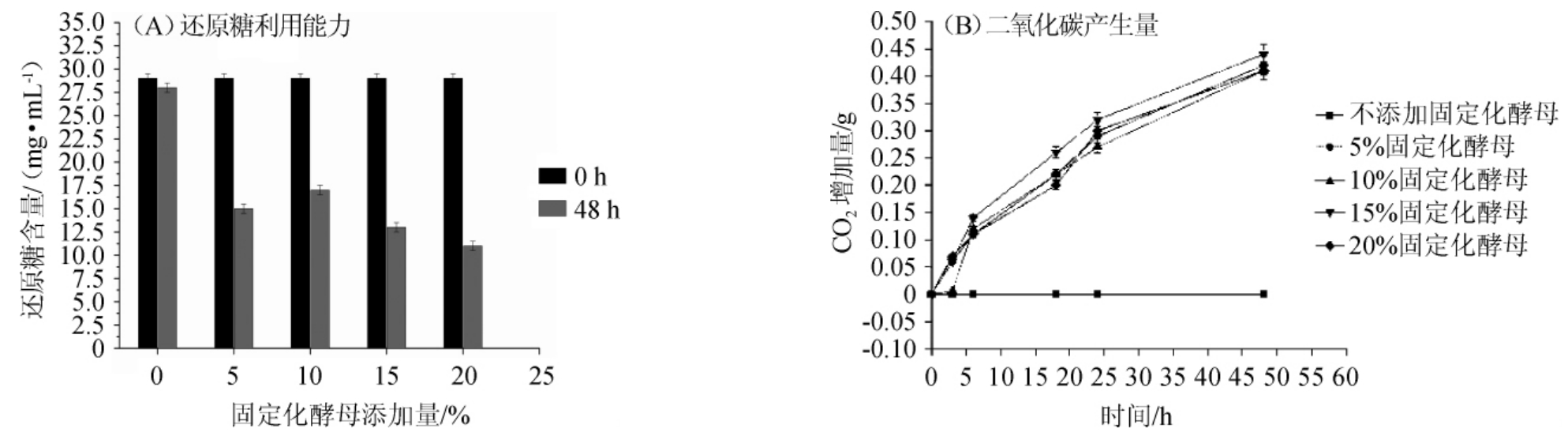
图3 固定化酵母GY-1对还原单糖的利用能力
Fig. 3 Utilization capacity of immobilized yeast GY-1 on reducing monosaccharides
2.5 流速对固定化酵母GY-1利用单糖的影响
为缩短固定化酵母利用单糖的周期,实验采用动态法进行降解,采用三级柱式反应器进行研究酵母对单糖的分解能力。选用反应体系总体积100 mL魔芋寡糖离心溶液,糖度为12.3°Bx,分别通过Z1柱、Z2柱和Z3柱,通过微量蠕动泵采用2.5 mL/min、5.0 mL/min和7.5 mL/min 的流量进入反应柱,单个整个循环时间为分别为40 min、20 min、13.8 min。由图4可知,采用蠕动泵进行动态循环,糖液的流速越快,酵母和物料接触时间短,导致柱中的还原糖分解缓慢,相应的柱Z1、柱Z2和柱Z3的糖浓度具有较大差异,柱Z1、柱Z2和柱Z3的溶液中还原糖逐渐降低。研究发现,寡糖溶液的流量对酵母利用有影响。由图4a可知,流量为2.5 mL/min时,经过40 min的平衡和固定化酵母的吸附、利用,糖的浓度曲线趋于平衡,平缓降解,糖度为10°Bx;由图4b可知,流速为5 mL/min时,相应的寡糖浓度变为11.3 °Bx;由图4c可知,流速为7.5 mL/min时,相应的寡糖浓度变为11.3 °Bx。所以,过反应柱的流量大,循环时间短,有利于还原糖的轻度降解。由图4d可知,单位时间柱式反应器降解还原糖的效率分析可以看出,采用低流量水解效率要高于高流量水解效率。因此,实验选择2.5 mL/min流速用于反应柱去除单糖的研究参数。
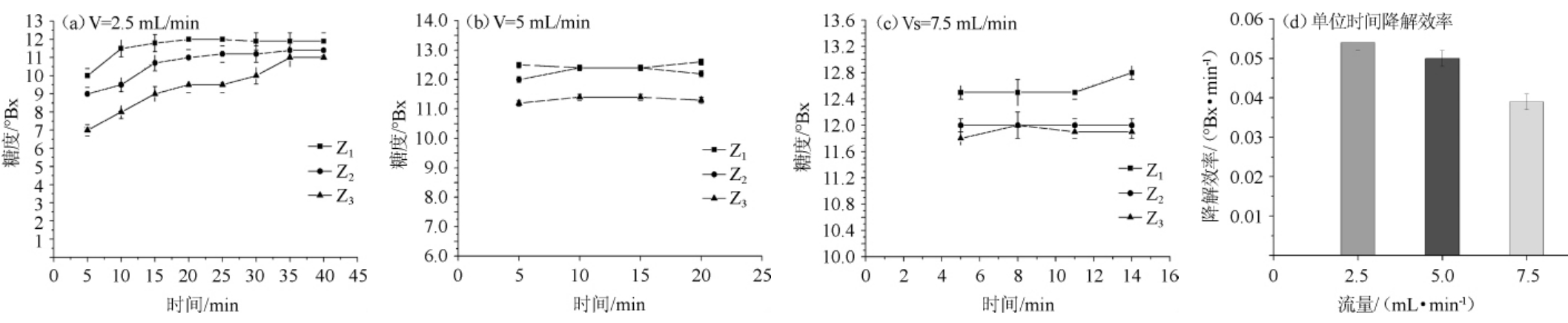
图4 流速对固定化酵母降解还原糖能力的影响
Fig. 4 Effect of flow rate on reducing sugars degradation of immobilized yeast
2.6 魔芋寡糖浓度对固定化酵母利用单糖能力的分析
由图5可知,2%、4%、6%、8%浓度的寡糖液中,还原糖含量随着柱式反应器中酵母的利用程度呈下降趋势,形成的曲线呈线性关系。通过对每个浓度的降解曲线进行线性拟合,得方程关系见表4。由表4可知,斜率Ka>Kb>Kc≈Kd可以看出采用固定化酵母利用还原糖,其降解能力平缓温和,低浓度的寡糖降解效率稍高于高浓度,但随着浓度的增加,降解的效率是趋于一致的,而且由曲线呈线性关系可知该固定化酵母水解温和,可根据曲线控制酵母的生物转化时间。由于采用5%的酵母制作的固定化颗粒,酵母浓度较高,但由于酵母细胞处于包埋状态,没有过快的增殖效应,水解平缓,降解的还原糖趋势是稳定的,其降解曲线呈线性关系。浓度越高,单糖利用效率越趋近。因此,完全可在高浓度的寡糖溶液直接添加固定化处理,有利于生产成本的降低。

图5 固定化酵母对还原糖降解的曲线方程
Fig. 5 Degradation curve of reducing sugar by immobilized yeast
表4 固定化酵母对还原糖降解曲线
Table 4 Degradation curve equations of reducing sugar by immobilized yeast
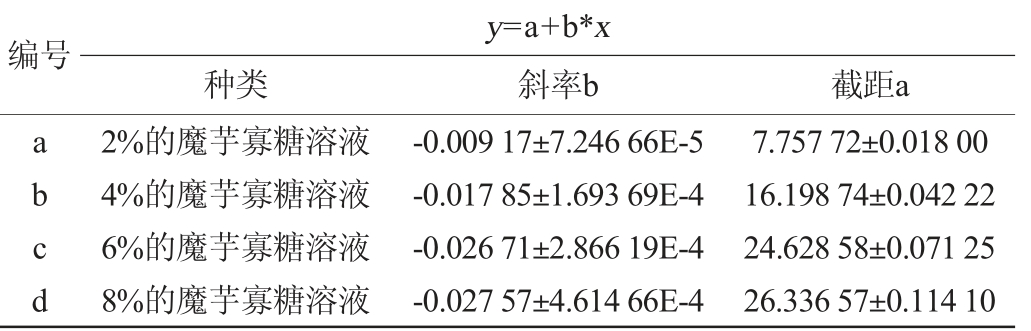
编号y=a+b*x种类 斜率b 截距a abcd 2%的魔芋寡糖溶液4%的魔芋寡糖溶液6%的魔芋寡糖溶液8%的魔芋寡糖溶液-0.009 17±7.246 66E-5-0.017 85±1.693 69E-4-0.026 71±2.866 19E-4-0.027 57±4.614 66E-4 7.757 72±0.018 00 16.198 74±0.042 22 24.628 58±0.071 25 26.336 57±0.114 10
为了缩短固定化酵母利用魔芋寡糖溶液中的单糖时间,实验分析了6 h的酵母利用单糖的能力,结果见图6。

图6 还原糖降解率的变化趋势
Fig. 6 Changing trend of degradation rate of reducing sugars
由图6可知,6 h后在2%、4%、6%、8%的寡糖溶液中还原糖含量分别下降了(42.77±1.70)%、(39.53±1.69)%、(38.83±1.73)%、(38.03±1.68)%,表明通过串联柱式反应器能在短时间内有效降解魔芋寡糖中的单糖,避免其他副产物的产生,缩短了产品生产周期。
2.7 魔芋寡糖产物的分析
根据β-1,4糖苷键的水解特性,选择纤维素酶、β-葡聚糖酶和β-甘露聚糖酶进行了水解魔芋粉,对比水解产物中还原单糖的浓度。由图7可知,选用的纤维素酶、β-葡聚糖酶和β-甘露聚糖酶水解的产物中都存在单糖;酵母固定化采用高密度酵母进行酵解,设计时间短,无酒精等副产物产生,但有少量有机酸产物,后期通过膜处理,保证了产品的纯度和品质。甬道11、12为甘露聚糖酶水解产物通过固定化酵母处理,单糖被充分利用消耗掉,没有出现单糖的斑点,表明单糖已经被酵母利用,选用固定化酵母处理的工艺是可行的。
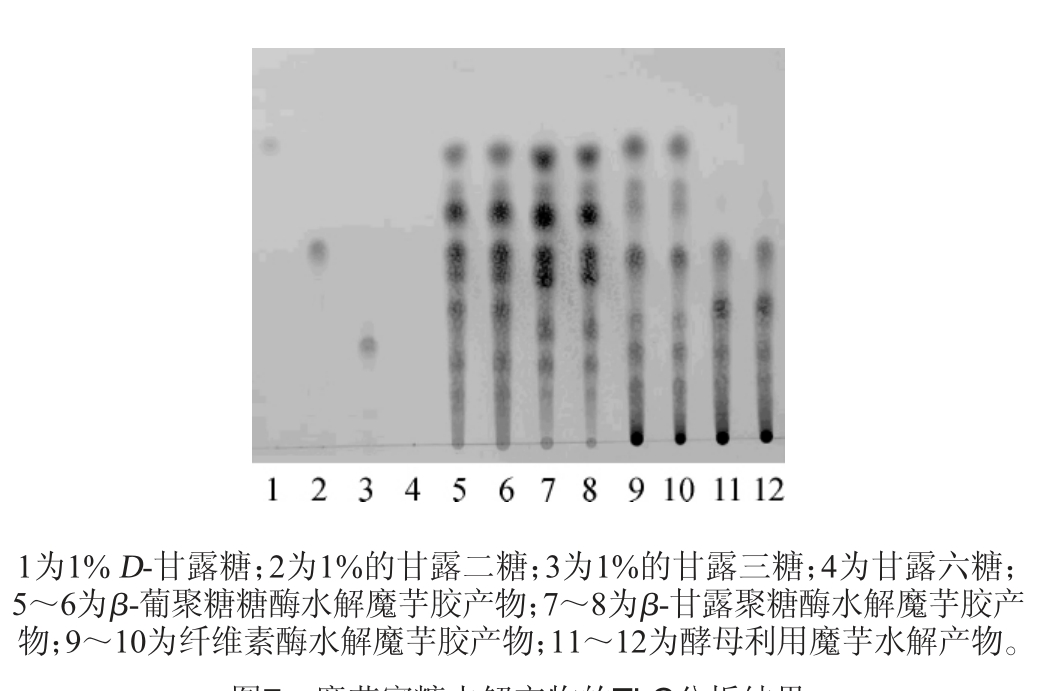
图7 魔芋寡糖水解产物的TLC分析结果
Fig. 7 TLC analysis results of konjac oligosaccharides
3 结论
本研究针对魔芋粉水解产物中伴随着还原单糖的出现,采用固定化的酿酒酵母进行生物法去除单糖,同时利用固定化大颗粒特性进行产物分离,采用魔芋粉、海藻酸钠和酵母粉剂按照一定比例混合制备固定化酵母。实验分析了固定颗粒的硬度、光滑程度、包埋的酵母数量、死亡率、酵母利用单糖活力测定和固定化酵母在三级反应柱内受泵流量影响还原糖降解的差异分析。实验结果表明,2%的魔芋粉+1%海藻酸钠+5%酵母粉组合形成的固定化酵母颗粒均匀,直径为4~5 mm,包埋的酵母死亡率低于10%;在充满固定化酵母颗粒的反应柱中,通过动态法去除寡糖中的还原性单糖,选用低速流量为2.5 mL/min对100 mL魔芋水解液中的单糖和固定化酵母循环接触,加大接触面积,40 min后溶液中的糖度由12°Bx下降至10°Bx;对酵母处理的水解液通过薄层层析(TLC)法检测,以没有酵母利用的样品为对照进行比较,发现固定化酵母GY-1能够利用单糖(葡萄糖、甘露糖),对二糖以上聚合体不能利用,可达到纯化魔芋寡糖的目的,表明该工艺技术路线是可行的。根据该技术路线进行放大工艺,完全可以用于其他种类单糖去除工艺,对产品的纯化、简化工艺路线具有一定的指导意义。
[1]贾东旭,王腾,孙嘉诚,等.耐高温葡萄糖异构酶的全细胞固定化条件研究[J].食品与发酵工业,2018(6):8-15.
[2]SANTOS E L I,ROSTRO-ALANÍS M,PARRA-SALDÍVAR R,et al.A novel method for bioethanol production using immobilized yeast cells in calcium-alginate films and hybrid composite pervaporation membrane[J].Bioresource Technol,2018,247:165-173.
[3]孔军,李子杰,中西秀树,等.固定化酶新技术—酿酒酵母孢子微胶囊固定化酶技术[J].食品与发酵工业,2017,43(1):257-265.
[4]李娜,李树立,郭忠鹏.固定化酵母细胞发酵啤酒的初步研究[J].中国酿造,2007,26(9):18-21.
[5] EJAZ U, AHMED A, SOHAIL M. Statistical optimization of immobilization of yeast cells on corncob for pectinase production[J].Biocat Agr Biotechnol,2018,14:450-456.
[6]WANG S K,WANG X,TAO H H,et al.Heterotrophic culture of Chlorella pyrenoidosa using sucrose as the sole carbon source by co-culture with immobilized yeast[J].Bioresource Technol,2018,249:425-430.
[7]赵亚,石启龙.牛蒡丝瓜汁复合饮料稳定剂的筛选[J].粮油加工,2010(10):111-113.
[8]陈茜,匡映,肖满,等.植物多糖气凝胶的吸附性能研究[J].食品工业科技,2017,38(11):96-102.
[9]倪学文,毛亚茹.魔芋葡甘聚糖-海藻酸钠复配体系协效性研究[J].江苏农业科学,2007(3):213-215.
[10] KRUK J, KACZMARCZYK K, PTASZEK A, et al. The effect of temperature on the colligative properties of food-grade konjac gum in water solutions[J].Carbohydr Polym,2017,174:456-463.
[11] WILLIAMS P A. Gums: Properties and Uses. In: Caballero B, Finglas PM, Toldrá F, editors. Encyclopedia of Food and Health[M]. Oxford:Academic Press;2016:283-289.
[12]蒋昌禄.魔芋高产栽培技术[J].植物医生,2018(2):23-24.
[13]王子青.临沧市魔芋丰产栽培技术[J].云南农业科技,2018(3):25-27.
[14] SHI C, ZHU P, CHEN N, et al. Preparation and sustainable release of modified konjac glucomannan/chitosan nanospheres[J]. Int J Biol Macromol,2016,91:609-614.
[15]娄在祥,王洪新.甘露聚糖的改性及应用[J].山东食品发酵,2006,142(3):31-35.
[16]岳振峰,赵谋明,彭志英.功能性低聚糖研究进展[J].食品科学,1999(9):21-25.
[17]黄德娟,谈华平.功能性低聚糖[J].生物学通报,2005,40(12):19-21.
[18]许牡丹,柯蕾.甘露低聚糖的酶法制备与研究进展[J].食品研究与开发,2005,26(4):163-166.
[19] LIU D, GAO H, TANG W, et al. Plant non-starch polysaccharides that inhibit key enzymes linked to type 2 diabetes mellitus[J].Ann NY Acad Sci,2017,1401(1):28-36.
[20] SORENMO K U, KRISTIANSEN V M, COFONE M A, et al. Canine mammary gland tumours;a histological continuum from benign to malignant;clinical and histopathological evidence[J]. Veter Compar Oncol,2009,7(3):162-172.
[21] COFFIN C M, DAVIS J L, BORINSTEIN S C. Syndrome-associated soft tissue tumours[J].Histopathology,2014,64(1):68-87.
[22]WU Y,PAN L,SHANG Q H,et al.Effects of isomalto-oligosaccharides as potential prebiotics on performance,immune function and gut microbiota in weaned pigs[J]. Animal Feed Sci Technol, 2017, 230: 126-135.
[23]陈秀霞,尹业师,朱立颖,等.益生菌及人体肠道菌群对低聚甘露糖的降解[J].中国微生态学杂志,2016,28(7):746-751.
[24]秦清娟,徐小青,张媛,等.魔芋葡甘低聚糖毒理学及肠道益生性评价[J].食品科学,2014,35(21):244-248.
[25]吴士.魔芋甘露低聚糖与枯草芽孢杆菌对肠上皮细胞损伤的协同修复作用[D].武汉:华中农业大学,2017.
[26]何丹,郭雄,杨双莲,等.酶法制备魔芋甘露寡糖和产物分析[J].中国酿造,2013,32(5):85-88.