抗菌肽也称为肽类抗生素,是由生物体产生的具有抗菌活性的小分子蛋白质,并且是宿主先天性非特异性防御系统的重要组成部分。抗菌肽的氨基酸数目通常<100,带有正电荷,具有杀伤细菌、真菌、原生动物,抑制病毒繁殖,特异性抑制某些肿瘤细胞生长的作用,且对艾滋病也有一定的抑制作用[1-2]。抗菌肽的发现为医药用途提供了新的希望。目前,对于乳源性抗菌肽的研究主要集中在乳铁蛋白抗菌肽,少数几种乳酪蛋白源抗菌肽以及从干酪或酸乳等乳制品中分离得到的抗菌肽。这些乳源性抗菌肽都对G+和G-菌具有强烈的抑制作用[3]。乳源性抗菌肽的发现改变过去对单一的乳蛋白营养功能评价,具有良好的应用前景。
驼乳蛋白是生物活性肽的丰富来源。驼乳蛋白主要分为乳清蛋白和酪蛋白。其中,驼乳乳清蛋白占总蛋白的30%左右,并富含如乳铁蛋白,乳过氧化物酶,脂肪球膜蛋白,溶菌酶和免疫球蛋白等保护性蛋白[3]。研究表明,骆驼乳乳清蛋白酶解物具有抗肿瘤[4]、抗糖尿病[5]、抗感染性[6]、抗氧化[7]、抗炎抗菌[8]、降血压[9]、提高免疫力[10]等作用。目前,国内对驼乳营养成分,理化特性及其生物学特性的研究较多,但对驼乳乳清蛋白酶解的研究较少。且已发表的驼乳蛋白源生物活性肽的研究主要集中在降血压肽和抗氧化活性肽上,而对于其抗菌功能肽的研究尚未报道。由于在酶解过程中不同蛋白酶的作用位点不同,导致蛋白的水解程度有所差异,所得酶解产物的氨基酸含量和功能特征也有所差别,因此有必要筛选水解程度和抑菌条件最佳的蛋白酶,并确定其酶解规律及最适酶解条件。
本试验选用胃蛋白酶、胰蛋白酶、碱性蛋白酶和木瓜蛋白酶对驼乳乳清蛋白进行酶解,以水解度(degree of hydrolysis,DH)为评价标准,以抑菌率为抑菌效果评价指标。根据单因素结果,筛选出较为合适的酶,通过响应面法优化其酶解条件,初步确定制备驼乳乳清蛋白抗菌肽的最佳工艺参数,为进一步研究驼乳乳清蛋白抗菌肽的功能特性提供参考。
1 材料与方法
1.1 材料与试剂
驼乳乳清蛋白:采集内蒙古阿拉善新鲜骆驼乳,后经实验室提取获得乳清蛋白。
胃蛋白酶(10 000 U/g)、胰蛋白酶(250 U/g)、碱性蛋白酶(200 000 U/g)、木瓜蛋白酶(6 000 U/g):北京索莱宝科技有限公司;大肠杆菌(E.coli)ATCC 25922、LB液体培养基:广东环凯微生物科技有限公司;1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH):美国Sigma公司;NaCl、HCl、NaOH等(均为分析纯):国药集团化学试剂有限公司。
1.2 仪器与设备
SQ510C高压灭菌锅:重庆雅马科技有限公司;GHP-9270恒温培养箱:上海一恒科学仪器有限公司;JC-HH-S24恒温水浴锅:济南精诚实验仪器有限公司;5811FN279354冷冻离心机:德国Eppendorf公司;SCIENTZ-10N冷冻干燥机:宁波新芝生物科技股份有限公司;PB-10PH计:赛多利科学仪器(北京)有限公司;SynergyH1酶标仪:雷康恒泰(北京)商贸有限公司;SW-CJ-FD超净工作台:苏州安泰空气技术有限公司。
1.3 实验方法
1.3.1 乳清蛋白的制备
取出储存在-20 ℃的驼乳样品300 mL,做3组平行试验,4 ℃、12 000 r/min离心15 min,弃去上层脂肪,制得脱脂乳。将获得的脱脂乳于45 ℃水浴锅中加热30 min。根据等电点法,用1 mol/L HCl调脱脂乳pH至4.4,调节pH过程中不断搅拌,4 ℃、8 000 r/min离心20 min。收集离心后的上清液,即为等电点(pH4.4)沉淀酪蛋白后的乳清蛋白样品。将得到的乳清蛋白于-80 ℃冰箱预冻24 h后,放入冷冻干燥机中,在-50 ℃、2~10 Pa条件下真空冷冻干燥,得到驼乳乳清蛋白冻干粉。
1.3.2 驼乳清蛋白的酶法水解
乳清蛋白粉→加蒸馏水溶解→调节pH(4.4)→设定水浴温度→加蛋白酶水解→灭酶(100 ℃、10 min)→离心(4 ℃、8 000 r/min、30 min)→水解液→冻干
1.3.3 水解度的测定
本试验将采用邻苯二甲醛(o-phthaldialdehyde,OPA)法[11-12]测定水解度,计算公式为:
其中:h为水解过程中,每克蛋白被断裂的肽键数,mmol/g;htot为每克蛋白质所含的总肽键数,通常地,乳清蛋白质的htot为8.8 mmol/g蛋白。
1.3.4 抑菌率的测定
参考郑健[13]的方法,采用试管法检测抗菌活性。首先进行菌种活化,在无菌操作下,将保存的大肠杆菌E.coli(ATCC 25922)接种于已经配制好的LB液体培养基中培养,在37 ℃培养箱中培养18~24 h,传3代后4 ℃备用;采用平板菌落计数法计算出原菌液的菌体浓度(CFU)并测定相应的吸光度值OD600nm值;根据测定的菌悬液OD600nm值,用85%的无菌生理盐水稀释该菌悬液,使其最终的菌数调到106 CFU/mL。
在8 mL灭菌LB液体培养基中加入1 mL菌悬液,再加入1 mL样品溶液,混匀后,在37 ℃条件下培养并且每相隔4 h取出一次测定OD600 nm值,以加无菌水为空白,以未经过酶解处理的乳清蛋白为对照,根据下列公式计算抗菌活性。![]() ×100%(OD值为3次平行实验平均值)
×100%(OD值为3次平行实验平均值)
1.3.5 DPPH自由基的清除能力
参考BOUGATEF A等[14]的方法,称取19.7 mg DPPH溶解于无水乙醇中,在避光条件下定容于250 mL棕色容量瓶中,摇匀,配制成浓度为2×10-4 mol/L的溶液,保存于冰箱中。准确将2 mL DPPH·溶液和2 mL酶解液到15 mL试管中,混合并振荡均匀,避光静置30 min后,取三组平行样在波长517 nm处测定样品的吸光度值Ai,使用等体积的无水乙醇溶液代替DPPH·无水乙醇溶液作为空白组,使用等体积蒸馏水代替酶解液作为对照组,在波长517 nm处分别测定其吸光度值。
DPPH自由基清除率的计算公式如下:
DPPH自由基清除率
式中:Ai为样品组吸光度值;Aj为空白组吸光度值;A0为对照组吸光度值。
1.3.6 单因素试验设计
每种蛋白酶一共设定5个影响因素,5个水平试验,固定其中4个因素改变1个因素,以水解度为评价指标[15-17]。胃蛋白酶、胰蛋白酶、碱性蛋白酶、木瓜蛋白酶水解条件的优化试验设计见表1。![]()
表1 不同蛋白酶的作用条件优化单因素试验
Table 1 Single factor experiments for working conditions optimization of different proteases
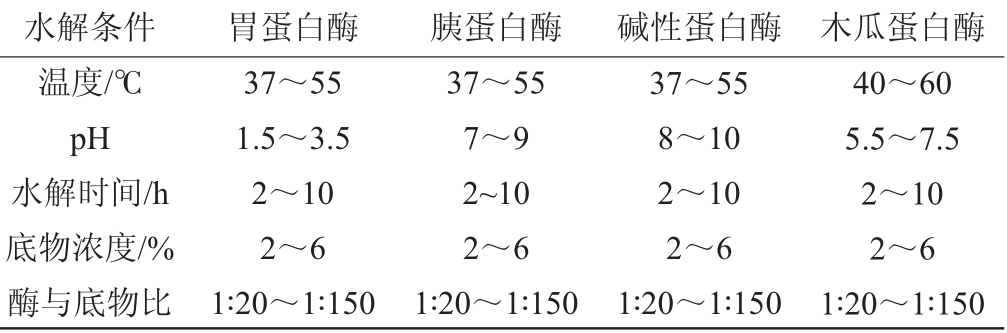
水解条件 胃蛋白酶 胰蛋白酶 碱性蛋白酶 木瓜蛋白酶温度/℃pH水解时间/h底物浓度/%酶与底物比37~55 1.5~3.5 2~10 2~6 1∶20~1∶150 37~55 7~9 2~10 2~6 1∶20~1∶150 37~55 8~10 2~10 2~6 1∶20~1∶150 40~60 5.5~7.5 2~10 2~6 1∶20~1∶150
1.3.7 获得抗菌肽最佳蛋白酶的选择
通过单因素确定胰蛋白酶、胃蛋白酶、碱性蛋白酶和木瓜蛋白酶4种蛋白酶的最佳水解条件。以抑制率为评价指标,筛选出酶解驼乳清蛋白制备抗菌肽的最佳蛋白酶。同时,以DPPH自由基的清除率为评价指标,测定各蛋白酶酶解液的抗氧化能力。
1.3.8 制备抗菌肽酶解单因素试验
利用筛选出的蛋白酶酶解驼乳乳清蛋白,分别考察温度、时间、pH、底物浓度和酶浓度对抑菌率的影响,确定了最佳的蛋白酶酶解物的抑菌率单因素水平。
1.3.9 响应面试验
根据单因素试验结果,用Box-Behnken中心组合设计原理,选择对驼乳乳清蛋白水解物的抑菌率影响较大的3个因素:pH值、温度、时间为自变量,以抑菌率为响应值进行响应面设计,采用Design-Expert 8.05b软件进行响应面试验。试验因素与水平设计见表2。
表2 胃蛋白酶酶解条件优化响应面试验因素与水平
Table 2 Factors and levels of response surface experiments for pepsin hydrolysis conditions optimization

水平 A 酶解pH值 B 酶解温度/℃ C 酶解时间/h-1 0 1 1 2 3 35 40 45 2 4 6
2 结果与分析
2.1 各蛋白酶单因素试验结果
2.1.1 不同酶解温度对驼乳乳清蛋白水解度的影响
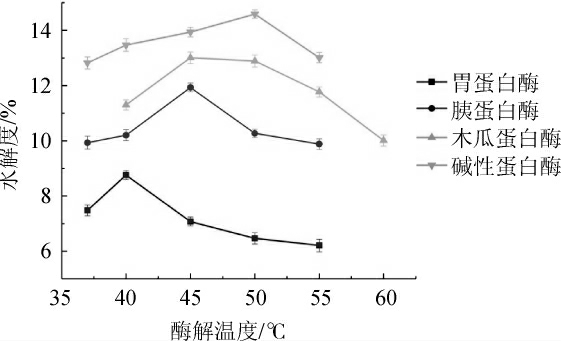
图1 不同酶解温度对驼乳乳清蛋白水解度的影响
Fig. 1 Effect of different hydrolysis temperature on hydrolysis degree of camel whey protein
由图1可知,4种蛋白酶的水解度均随着酶解温度的升高呈先增大后减小的趋势,胃蛋白酶的水解度在40 ℃时达到最大值,胰蛋白酶和木瓜蛋白酶的水解度在45 ℃时达到最大值,而碱性蛋白酶的水解度则在50 ℃时达到最大。其原因是由于在一定的温度范围内,温度升高反应物分子获得能量,反应速率加快,从而使水解度增大,但温度过高会导致蛋白酶变性失活,从而使反应速率下降,水解度降低[18]。木瓜蛋白酶在45 ℃和50 ℃时的水解度没有显著性差异(P<0.05),考虑到酶解温度越高酶的活性越不稳定,因此胃蛋白酶、胰蛋白酶、木瓜蛋白酶和碱性蛋白酶的较适酶解温度分别为40 ℃、45 ℃、45 ℃和50 ℃。
2.1.2 不同酶解pH值对驼乳乳清蛋白水解度的影响
酶解pH值过低或者过高都会使酶失活从而影响酶的作用效果。在最佳pH条件下,酶保持其最优的空间结构,酶活性中心与底物的结合最好,因此,在最适pH条件下,酶具有最佳的催化活性。由图2可知,不同的蛋白酶对酸碱环境的要求不同,胃蛋白酶、木瓜蛋白酶、胰蛋白酶和碱性蛋白酶分别在pH=2、pH=6、pH=8.5和pH=9.5时水解度达到最大值。

图2 不同酶解pH值对驼乳乳清蛋白水解度的影响
Fig. 2 Effect of different hydrolysis pH on hydrolysis degree of camel whey protein
2.1.3 不同酶解时间对驼乳乳清蛋白水解度的影响

图3 不同酶解时间对驼乳乳清蛋白水解度的影响
Fig. 3 Effect of different hydrolysis time on hydrolysis degree of camel whey protein
由图3可知,随着酶解时间的延长,水解度呈先上升后趋于平缓的下降趋势。对于木瓜蛋白酶来说在4 h时与乳清蛋白完全作用,之后随反应时间的延长水解度呈下降趋势;而对于其他蛋白酶来说,水解度则在6 h时基本与蛋白质完全作用,而后水解度的变化趋于缓慢。这是由于随着水解的进行,水解的底物浓度逐渐减小,蛋白酶的特异性催化位点减少,蛋白酶在水解过程中逐渐失活[19],因此时间过短会导致水解不彻底,蛋白酶的作用发挥不完全;水解时间过长,会导致酶丧失活性,产生的多肽过会抑制蛋白酶水解。综合考虑,确定胃蛋白酶、胰蛋白酶和碱性蛋白酶的最佳水解时间为6 h,木瓜蛋白酶的最佳水解时间为4 h。
2.1.4 不同底物浓度对驼乳乳清蛋白水解度的影响
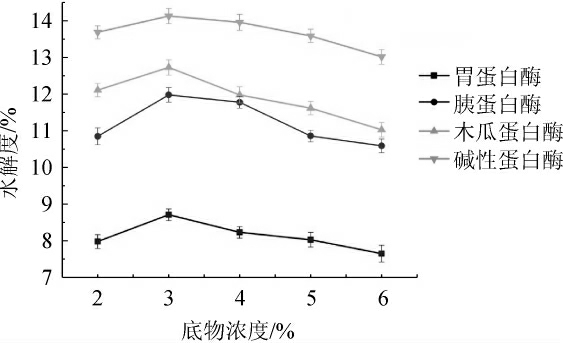
图4 不同底物浓度对驼乳乳清蛋白水解度的影响
Fig. 4 Effect of different substrate concentration on hydrolysis degree of camel whey protein
由图4可知,底物浓度对水解度的影响与温度相同,即随着底物浓度的增加,水解度呈先增大后减小的趋势。这是由于当底物浓度较低时,酶与底物结合的概率较小,因此水解度较低,所以增加底物的量会使水解度增大;当底物浓度过高时,与底物结合的蛋白酶的量有限,导致水解不彻底,且蛋白质溶液的黏度增大,影响蛋白酶的扩散,从而对水解反应有抑制作用。因此最终选择各酶的底物浓度为3%。
2.1.5 酶与底物比对驼乳乳清蛋白水解度的影响
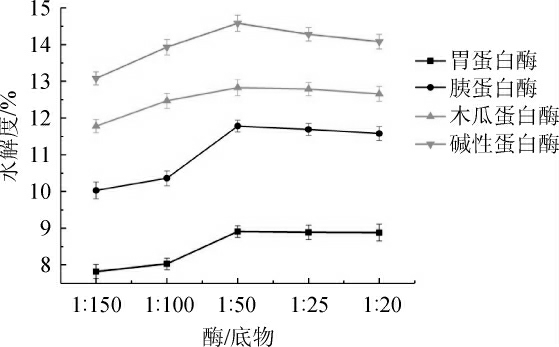
图5 不同酶与底物比对驼乳乳清蛋白水解度的影响
Fig. 5 Effect of different enzyme and substrate concentration rate on hydrolysis degree of camel whey protein
由图5可知,随着酶添加量的增多,在一定范围内水解度呈上升趋势,当胃蛋白酶、胰蛋白酶和木瓜蛋白酶的酶与底物浓度比超过1∶50时,水解度的变化不显著(P>0.05),只有碱性蛋白酶在酶与底物浓度比超过1∶50时水解度有下降趋势。这是由于当酶的添加量较低时,酶与底物作用小,不能完全水解蛋白质,但考虑到经济因素酶的添加量不宜过多,因此选用1∶50为4种酶的最佳酶与底物比。
2.2 蛋白酶水解物的抑菌效果
各蛋白酶水解物的抑菌效果与DPPH·清除率的结果见表3。由表3可知,各蛋白酶对驼乳乳清蛋白抑菌效果的影响顺序为胃蛋白酶>胰蛋白酶>木瓜蛋白酶>碱性蛋白酶。这是由于不同蛋白酶水解的作用效果不同,酶切位点不同,从而产生的功能性肽就不同。胃蛋白酶水解物的抑菌率为82.12%,且有一定的抗氧化活性(DPPH·清除率为49.17%)。木瓜蛋白酶的水解产物的抗菌活性较低仅为10%,碱性蛋白酶不会水解出具有抗菌活性的肽段,而其酶解液却具有抗氧化活性。由于本实验的目的是筛选抗菌肽,因此选用胃蛋白酶进行单因素和响应面试验。
表3 蛋白酶水解物的抑菌率结果
Table 3 Antibacterial rate results of hydrolysis products prepared with different proteases
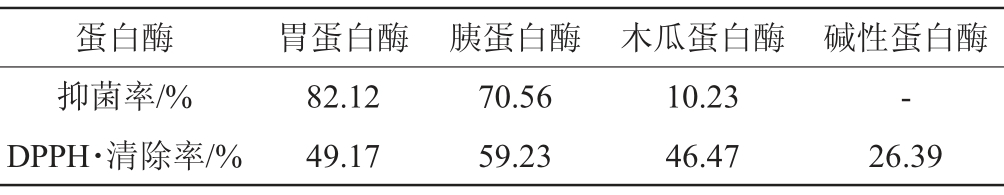
注:“-”表示无抑菌活性。
蛋白酶 胃蛋白酶 胰蛋白酶 木瓜蛋白酶 碱性蛋白酶抑菌率/%DPPH·清除率/%82.12 49.17 70.56 59.23 10.23 46.47-26.39
2.3 胃蛋白酶抑菌实验结果
2.3.1 不同温度对驼乳乳清蛋白酶解液抑菌率的影响
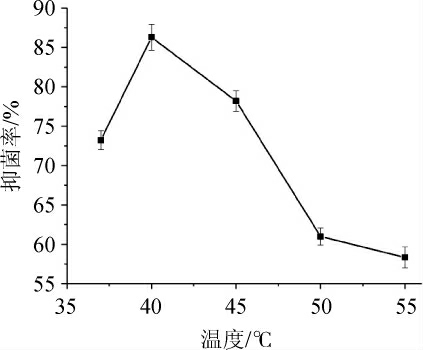
图6 不同温度对酶解液抑菌率的影响
Fig. 6 Effect of different temperature on hydrolysis degree and antibacterial rate of hydrolysate
从图6可知,当温度从37 ℃升至40 ℃时,驼乳乳清蛋白的水解度与其酶解液的抑菌率随温度的升高而增加,40 ℃时水解度最大,抗菌活性最强。之后随温度的升高水解度和抑菌率均呈下降趋势,至55 ℃时抑菌率较低,仅为58.33%。这可能是由于在一定温度范围内,温度升高有利于酶解的进行,但过高的温度会导致酶变性,使其活性减弱,从而导致水解速率降低,释放的抑菌物质减少,故此最佳抑菌温度为40 ℃。
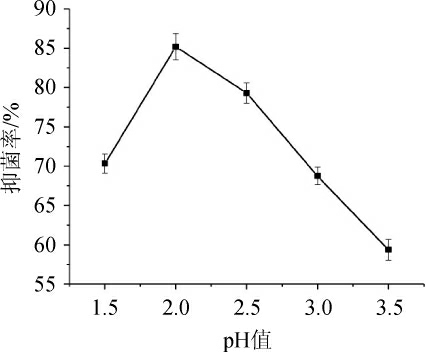
图7 不同pH值对酶解液抑菌率的影响
Fig. 7 Effect of different pH value on hydrolysis degree and antibacterial rate of hydrolysate
2.3.2 pH对驼乳乳清蛋白酶解液抑菌率的影响从图7可知,驼乳乳清蛋白水解度和乳清蛋白酶解液的抗菌活性均随着pH值的升高呈先增加后降低的趋势。当pH值为2.0时水解度和抑菌率均达到最高,分别为8.21%和84.96%,之后呈下降趋势。这是由于pH继续升高,会使酶的活性降低,乳清蛋白中的大分子物质未被水解,也会导致获得的乳清蛋白肽的量减少[20],因此最佳的pH为2.0。
2.3.3 不同水解时间对驼乳乳清蛋白酶解液抑菌率的影响
从图8可知,随着酶解时间的延长,水解度与抑菌率均呈先上升后下降的趋势。当酶解时间为4 h时,水解产物的水解度达到最大值,抑菌活性最强(82.69%)。随着水解时间的延长,抗菌活性逐渐减弱,可能是由于水解初期,通过胃蛋白酶的作用获得的肽键数目较多,而随着反应时间的延长肽键被酶解作用断开,水解产物中的游离氨基酸相对含量增加,可能会使产生的抗菌肽被进一步水解,从而破坏其原本具有抗菌活性肽段结构上的完整性[21-22]。因此最佳的水解时间为4 h。
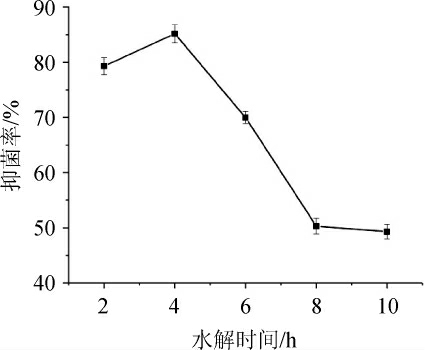
图8 不同水解时间对水解度及酶解液抑菌率的影响
Fig. 8 Effect of different hydrolysis time on hydrolysis degree and antibacterial rate of hydrolysate
2.3.4 不同底物浓度对驼乳乳清蛋白酶解液抑菌率的影响
由图4可知,当底物浓度为3%时乳清蛋白的水解度达到最大,表明此时酶活性最强;从图9可知,当底物浓度为4%时,得到的酶水解产物的抗菌活性最强(87.25%),表明此时水解得到的抗菌活性物质较多。故最佳抑菌底物浓度为4%。

图9 不同底物浓度对酶解液抑菌率的影响
Fig. 9 Effect of different substrate concentration on hydrolysis degree and antibacterial rate of hydrolysate
2.3.5 酶与底物比对驼乳乳清蛋白酶解液抑菌率的影响
从图10可知,当酶与底物比为1∶50时水解度达到最大值,但酶解产物的抗菌活性则是在酶与底物比为1∶100时最高,随着酶与底物比再增加,抗菌活性逐渐降低。这可能是因为在酶浓度较低时,酶分子所能结合的底物较少,而过量的蛋白酶使一部分具有抗菌活性的肽段被再次分解为活性更小的肽或者氨基酸,从而降低抑菌活性[21]。所以最佳的酶与底物比为1∶100。
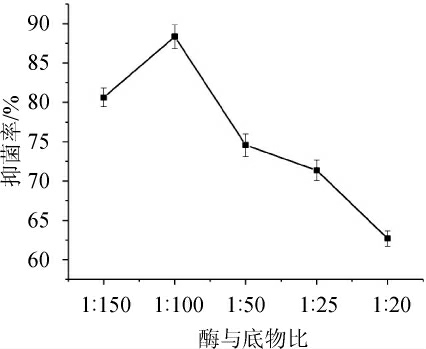
图10 不同酶与底物比对酶解液抑菌率的影响
Fig. 10 Effects of different enzyme and substrate concentration rate on hydrolysis degree and antibacterial rate of hydrolysate
通过以上单因素试验结果可以得出胃蛋白酶水解驼乳乳清蛋白的最佳条件为酶解温度为40 ℃、酶解pH为2.00、酶解时间为4 h,酶解底物浓度为4%,酶与底物浓度比为1∶100。根据单因素结果进行正交试验选出影响较大的因素进行响应面试验确定最终的水解条件。
2.4 响应面试验设计结果
根据单因素试验结果,选择对驼乳乳清蛋白水解度影响较大的3个因素:pH值(A)、温度(B)、时间(C)为评价因素,以抑菌率(Y)为评价指标,采用Design-Expert 8.05b软件进行响应面试验。试验的因素水平如表4所示。
表4 胃蛋白酶酶解条件优化响应面试验设计及结果
Table 4 Design and results of response surface experiments for pepsin hydrolysis conditions optimization
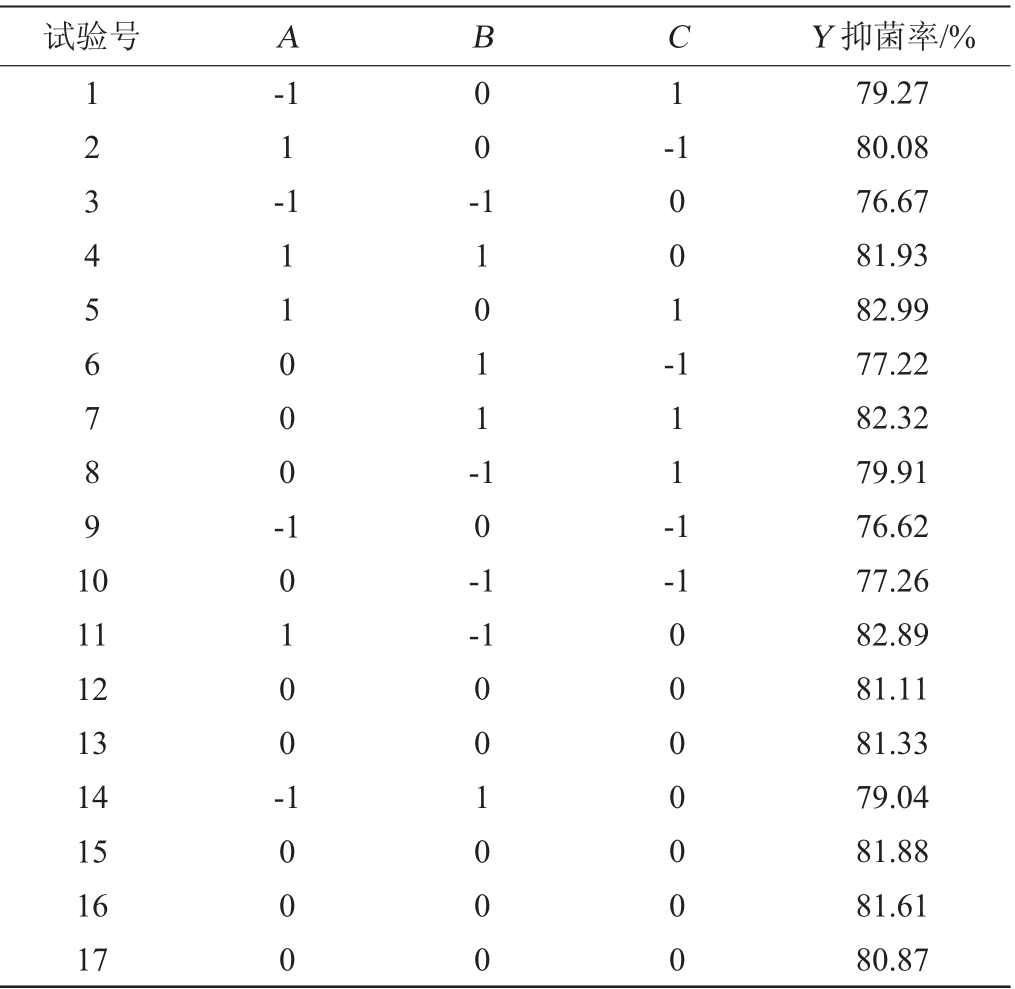
试验号 A B C Y 抑菌率/%1234567891 0-1 1-1 00-1-1 11000-11011-001-10100-10-1 111-1-1 11 12 13 14 15 16 17-1 1000 001000 0000000 79.27 80.08 76.67 81.93 82.99 77.22 82.32 79.91 76.62 77.26 82.89 81.11 81.33 79.04 81.88 81.61 80.87
通过统计分析软件Design-Expert 8.05b进行数据分析,建立二次响应面模型为:Y=3.16+9.896 25A+3.0465B+0.89188C-0.61AB+0.0325AC+0.06125BC-0.3325A2-0.0358B2-0.321 88C2。回归分析与方差分析结果及交互作用的响应面分析,结果见表5和图11。
表5 回归模型方差分析
Table 5 Variance analysis of the regression model
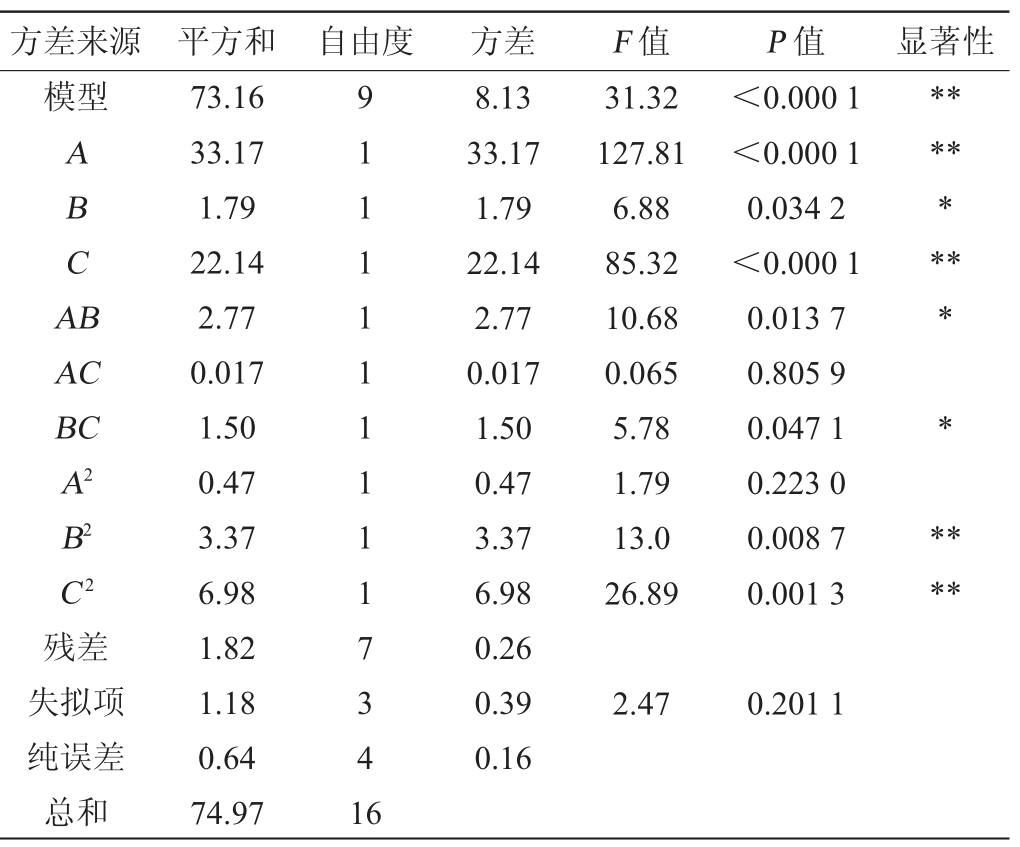
注:“**”表示差异极显著(P<0.01);“*”表示差异显著(P<0.05)。
方差来源 平方和 自由度 方差 F 值 P 值 显著性模型ABCA B*******AC BC A2 B2 C2残差失拟项纯误差总和73.16 33.17 1.79 22.14 2.77 0.017 1.50 0.47 3.37 6.98 1.82 1.18 0.64 74.97 91111111117341 6 8.13 33.17 1.79 22.14 2.77 0.017 1.50 0.47 3.37 6.98 0.26 0.39 0.16 31.32 127.81 6.88 85.32 10.68 0.065 5.78 1.79 13.0 26.89<0.000 1<0.000 1 0.034 2<0.000 1 0.013 7 0.805 9 0.047 1 0.223 0 0.008 7 0.001 3* * ****2.47 0.201 1
由表5可知,该模型回归显著(P<0.000 1),失拟项不显著,且该模型R2=97.58%,R2Adj=94.46%,说明该模型与实验拟合良好,可用于该反应的理论推测。由表5的F值大小可以得到影响抑菌率的各因素主次顺序为pH(A)>时间(C)>温度(B),其中一次项因素中A、C对抑菌率影响极显著(P<0.01),B对抑菌率影响显著(P<0.05),交互项中AB和BC对抑菌率影响显著(P<0.05),平方项中B2和C2对抑菌率的影响均为极显著(P<0.01)。在此基础上优化胃蛋白酶最佳酶解条件参数为:酶解温度为40 ℃、酶解pH为3.00、酶解时间为5.3 h,抑菌率为83.64%,在此条件下进行酶解,抑菌率为83.91%。试验模型与实际数据拟合良好,试验误差小仅为0.27%,建立的模型可以对实际工艺进行预测。

图11 各因素交互作用对抑菌率的影响的响应面图及等高线
Fig. 11 Response surface plots and contour line of effects of interaction between each factors on antibacterial rate
3 结论
本试验以水解度为指标,确定了胃蛋白酶、胰蛋白酶、碱性蛋白酶和木瓜蛋白酶4种蛋白酶的酶解最佳条件;以大肠杆菌E.coli(ATCC 25922)的抑菌率为指标确定了胃蛋白酶为驼乳乳清蛋白抗菌肽制备酶,并通过单因素试验和响应面法获得了胃蛋白酶最佳酶解条件参数:酶解温度为40 ℃、酶解pH为3.00、酶解时间为5.3 h,酶解底物浓度为4%,酶与底物浓度比为1∶100,此条件下抗菌肽的抑菌率为83.91%。本试验为驼乳蛋白源抗菌肽的制备提供了工艺参数,为驼乳蛋白附加值的提升提供了新思路,更是为驼乳产业的多元化发展奠定了理论基础。至于驼乳蛋白源抗菌肽的结构及其对其他致病菌的抑制性有待今后进一步研究。
[1]邱晓燕.抗菌肽的免疫功能和应用前景[J].生物学通报,2002,37(1):24-25.
[2] ZHOU N, TIELEMAN D P, VOGEL H J. Molecular dynamics simulations of bovine lactoferricin: turning a helix into a sheet[J]. Biometals,2004,17(3):217.
[3]KAPPELER S.Compositional and structural analysis of camel milk proteins with emphasis on protective proteins[M]//The Mathematical Legacy of Leon Ehrenpreis.Milan:Springer,1998:125-150.
[4] SALWA M Q, LINA A F K. Antigenotoxic and anticytotoxic effect of camel milk in mice treated with cisplatin[J].Saudi J Biol Sci,2010,17(2):159-166.
[5]NONGONIERMA A B,PAOLELLA S,MUDGIL P,et al.Identification of novel dipeptidyl peptidase IV (DPP-IV) inhibitory peptides in camel milk protein hydrolysates[J].Food Chem,2018,244:340.
[6] ALMAHDY O, ELFAKHARANY E M, ELDABAA E, et al. Examination of the activity of camel milk casein against hepatitis C virus(Genotype-4a) and its apoptotic potential in hepatoma and hela cell lines[J].Hepatitis Monthly,2011,11(9):724-730.
[7]HOMAYOUNITABRIZI M,ASOODEH A,SOLTANI M.Cytotoxic and antioxidant capacity of camel milk peptides: Effects of isolated peptide on superoxide dismutase and catalase gene expression[J]. J Food Drug Anal,2017,25(3):567.
[8] JRAD Z, HATMI H E, ADT I, et al. Effect of digestive enzymes on antimicrobial, radical scavenging and angiotensin I-converting enzyme inhibitory activities of camel colostrum and milk proteins[J]. Dairy Sci Technol,2014,94(3):205-224.
[9]ALHAJ O A,METWALLI A A,ISMAIL E A,et al.Angiotensin converting enzyme-inhibitory activity and antimicrobial effect of fermented camel milk (Camelus dromedarius)[J].Int J Dairy Technol,2018,71(1): 27-35.
[10] EBAID H, ABDELSALAM B, HASSAN I, et al. Camel milk peptide improves wound healing in diabetic rats by orchestrating the redox status and immune response[J].Lipids Health Dis,2015,14(1):132.
[11]林虬,黄薇,宋永康,等.棉籽蛋白水解物水解度3 种测定方法的比较[J].福建农业学报,2011,26(6):1076-1080.
[12]袁斌,吕桂善.蛋白质水解度的简易测定方法[J].基因组学与应用生物学,2002,21(2):113-115.
[13]郑健.卵转铁蛋白抗菌活性肽的制备及其抑菌活性的研究[D].长春:吉林大学,2011.
[14]BOUGATEF A,NEDJAR-ARROUME N,MANNI L,et al.Purification and identification of novel antioxidant peptides from enzymatic hydrolysates of sardinelle(Sardinella aurita)by-products proteins[J].Food Chem,2010,118(3):559-565.
[15]吕振磊,刘朝龙,王雨生,等.响应面法优化紫贻贝蛋白酶解工艺条件[J].食品科学,2012(10):61-66.
[16] JRAD Z, HATMI H E, ADT I, et al. Anti-microbial activity of camel milk casein and its hydrolysates[J].Acta Alimentaria,2015,44:609-616.
[17]ABDEL-HAMID M,GODA H A,GOBBA C D,et al.Antibacterial activity of papain hydrolysed camel whey and its fractions[J].Int Dairy J,2016,61:91-98.
[18]左继红.微波辅助蛋白酶水解反应工艺和反应器的研究[D].无锡:江南大学,2008.
[19] MULLALLY M M, O'CALLAGHAN D M, FITZGERALD R J, et al.Zymogen activation in pancreatic endoproteolytic preparations and influence on some whey protein hydrolysate characteristics[J].J Food Sci,2010,60(2):227-233.
[20]梁英红.具有抗菌活性的乳清蛋白肽的酶法制备及分离技术研究[D].大庆:黑龙江八一农垦大学,2013.
[21]吴红洋,姜太玲,胡惠茗,等.响应面法优化酶解花椒籽蛋白制备降血压肽工艺[J].食品科学,2014,35(21):180-185.
[22]AMADO I R G,VÁZQUEZ J A,GONZÁLEZ M P,et al.Production of antihypertensive and antioxidant activities by enzymatic hydrolysis of protein concentrates recovered by ultrafiltration from cuttlefish processing wastewaters[J].Biochem Eng J,2013,76(4):43-54.