鱼糜制品是受众多消费者青睐的一款鱼类产品,目前我国的加工鱼糜制品(如鱼卷、鱼饼、鱼糕、鱼丸等)已经有了一定的规模[1],但天然腌制发酵的鱼糜产品含有亚硝酸盐,对人体有害。所以从生产过程中控制亚硝酸盐的投放量,同时采用微生物降解的方式成为控制亚硝酸盐含量的有效途径之一[2]。
研究发现,将乳酸菌接种到鱼肉中,亚硝酸盐含量可以得到显著的降解[3],并且接种单一菌种的乳酸菌和接种复合菌种的乳酸菌效果是不一样的[4]。乳酸菌降解亚硝酸盐的方式分为酸降解和酶降解[5]。许女等[6]研究了19株植物乳杆菌(Lactobacillus plantarum)降解亚硝酸盐和生物胺的功能特性及相关基因的携带情况,筛选得到优良菌株并混合接种用于发酵青鱼鱼糜,发酵后的鱼肉香肠中亚硝酸盐、腐胺和尸胺的含量都明显的降低;KIM H S等[7]研究了6种发酵剂对发酵香肠中亚硝酸盐降解的影响,结果发现,乳酸片球菌(Pediococcus acidilactici)、戊糖片球菌(Pediococcus pentosaceus)和肉葡萄球菌(Staphylococcus carnosus)等发酵可以消耗发酵香肠中残留的亚硝酸盐。因此,优化挑选具备高效降解亚硝酸盐的乳酸菌具有重要的实践意义。
本研究以巴浪鱼干为材料,从中分离筛选高效降解亚硝酸盐的乳酸菌,采用生理生化试验和分子生物学方法对其进行鉴定,并考察该乳酸菌的生长特性及最适降解亚硝酸盐条件。以未添加乳酸菌的鱼糜为空白对照,使用该乳酸菌发酵鱼糜,采用单因素和正交试验设计优化鱼糜发酵条件,为工业化生产发酵鱼糜产品控制亚硝酸盐含量和提升产品品质提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
巴浪鱼干(蓝圆鲹干制品):厦门市集美市场,采集后放在无菌的自封袋中,4 ℃保存;AAA金线鱼鱼糜:泉州龙富港水产品有限公司。
1.1.2 试剂
MRS固(液)体培养基:广东环凯生物科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:天根生化科技(北京)有限公司。
1.2 仪器与设备
PHX150生化培养箱:宁波莱福科技有限公司;BagMixer 400VW均质器:法国INTERSCIENCE公司;TP-1102/214电子分析天平、PB-10 pH计:德国赛多利斯公司;UV-2000紫外可见分光光度计:上海尤尼科仪器有限公司;TC-96/G/H(b)C基因扩增仪:杭州博日科技有限公司;GenoSens1860凝胶图像分析系统:上海勤翔科学仪器有限公司;SC-1212水平电泳槽仪:北京凯元信瑞仪器有限公司。
1.3 试验方法
1.3.1 乳酸菌的分离
在超净工作台取25 g巴浪鱼干放入无菌均质袋,加入225 mL无菌生理盐水磨碎均质,梯度稀释,用接种环挑取10-2、10-4、10-6梯度稀释液分别划线于含1%CaCO3的MRS固体培养基,37 ℃厌氧静置培养48 h[8]。选择溶钙圈较大且呈白色或乳白色的单菌落在MRS固体培养基上进行分离纯化,直到长出较纯的单个菌落。
1.3.2 生理生化试验
对分离得到的与乳酸菌基本特征相一致的细菌菌落进行生理生化试验[9]。
1.3.3 降解亚硝酸盐乳酸菌的筛选
对分离得到的乳酸菌进行进一步筛选,获得能高效降解亚硝酸盐的乳酸菌。初筛:将乳酸菌菌悬液(菌体浓度106 CFU/mL)按5%(V/V)接种量接种至含有50 μg/mL亚硝酸盐的100 mL MRS液体培养基中,37 ℃厌氧静置培养,每隔12 h测定一次亚硝酸盐含量[10]。复筛:将MRS液体培养基中的亚硝酸盐质量浓度提高至100 μg/mL,其余步骤相同[11]。以未接种的空白MRS液体培养基作对照(CK),采用盐酸萘乙二胺法测定亚硝酸盐含量[12]。
1.3.4 乳酸菌的分子生物学鉴定
对筛选得到的亚硝酸盐降解能力最强的菌株进行分子生物学鉴定。按照细菌基因组DNA提取试剂盒的说明书提取乳酸菌DNA,以其为模板进行聚合酶链式反应(polymerase chain reaction,PCR)扩增[13],将PCR扩增产物送至厦门铂金生物技术有限公司进行测序。使用BLAST程序将测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)数据库中进行同源性比对搜索,选取同源性较高的模式菌株,使用MEGA 7.0分析软件中的邻接(neighbor joining,NJ)法构建系统发育树[14]。
1.3.5 菌株R6的生长特性研究
生长曲线的测定:按5%的接种量将菌株R6菌悬液接种于MRS液体培养基中,37 ℃厌氧静置培养,每隔4 h取一定量的菌液并稀释至合适的倍数,测定其OD600nm值[8],测量至24 h为止。
培养温度对菌株R6生长的影响:按5%的接种量将菌株R6菌悬液接种于MRS液体培养基中,分别在不同培养温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃)条件下厌氧静置培养18 h后,取一定量的菌液稀释至合适的倍数,测定其OD600nm值[15]。
NaCl含量对菌株R6生长的影响:按5%的接种量将菌株R6菌悬液接种于不同NaCl含量(0、5%、10%、15%、20%、25%)的MRS液体培养基中,37 ℃厌氧静置培养18 h后,取一定量的菌液稀释至合适的倍数,测定其OD600nm值[15]。
1.3.6 不同发酵条件对菌株R6降解亚硝酸盐能力的影响
按5%的接种量将菌株R6菌悬液接种于含有150 μg/mL亚硝酸钠的100 mL MRS液体培养基中,并分别在不同发酵温度(15 ℃、20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)和不同初始pH值(4.0、4.5、5.0、5.5、6.0、6.5)的条件下培养。培养16 h和24 h分别取样,以未接种的培养基作空白对照,检测培养基中亚硝酸盐的含量,研究发酵温度和初始pH值对菌株R6降解亚硝酸盐的影响[10]。
1.3.7 发酵鱼糜加工工艺
取冷冻鱼糜于4 ℃半解冻后,将水分调整为80%,空擂5min,按鱼糜质量添加3%食盐和10%淀粉,继续擂溃10min。对照组于30 ℃放置30 h,45 ℃水浴1 h后转移至90 ℃水浴20 min[16],加热完成后立即置于冰水浴中冷却,在4 ℃冰箱冷藏过夜。实验组以菌株R6为发酵剂,在食盐擂溃前按1%的接种量接种菌株R6(108 CFU/mL),其余步骤与对照组相同。擂溃过程中应控制鱼糜样品温度≤10 ℃[17]。
1.3.8 发酵鱼糜工艺条件优化
单因素试验[18]:采用单因素轮换法依次考察发酵温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃)、发酵时间(10 h、15 h、20 h、25 h、30 h)与发酵剂菌株R6接种量(0.5%、1.0%、1.5%)对鱼糜中亚硝酸盐降解的影响。对鱼糜中亚硝酸盐降解率进行测定[19],亚硝酸盐降解率计算公式如下:
降解率=![]()
式中:W0为发酵前鱼糜中亚硝酸盐的含量,mg/g;W1为发酵后鱼糜中亚硝酸盐的含量,mg/g。
正交试验[20]:在单因素试验的基础上,以亚硝酸盐降解率为评价指标,采用L9(34)正交试验设计考察发酵温度(A)、发酵时间(B)、发酵剂接种量(C)对菌株R6降解鱼糜中亚硝酸盐含量的影响,使用Minitab15软件进行分析,试验因素与水平见表1。
表1 发酵鱼糜工艺条件优化正交试验因素与水平
Table 1 Factors and levels of orthogonal experiments for process conditions optimization of fermented surimi

水平 A 发酵温度/℃ B 发酵时间/h C 接种量/%123 30 35 40 10 20 30 0.5 1.0 1.5
1.3.9 感官评价
根据食品感官评价的要求,选取培训过食品感官检验相关知识的专业参评人员10名,对发酵鱼糜制品进行品尝评价,满分100分。感官评价标准见表2[21]。
表2 发酵鱼糜的感官评价标准
Table 2 Sensory evaluation standards of fermented surimi

分值/分 外观 滋味 气味 口感18~25滋味丰富,无酸败味11~17滋味较丰富,稍有酸败味3~10滋味较寡淡,酸败味较重0~2鱼糜组织完整、结实,无褐变鱼糜组织较完整、结实,无褐变鱼糜组织略不完整、较软烂,轻微褐变鱼糜组织不完整、糜烂,褐变严重滋味不明显,酸败味明显香味浓郁,无腐败、哈败气味香味较淡,有轻微腐败、哈败气味香味很淡,腐败、哈败气味较重无香味,腐败、哈败气味很重鱼糜结实,咀嚼性好,不粘牙鱼糜较结实,咀嚼性较好,稍粘牙鱼糜较软烂,咀嚼性较差,粘牙鱼糜糜烂,咀嚼性很差,很粘牙
2 结果与分析
2.1 乳酸菌分离筛选
2.1.1 乳酸菌的分离
从MRS固体培养基上挑取10株有透明圈、乳白色或淡黄色、表面光滑、边缘较整齐,扁平的单菌落进行革兰氏染色试验和过氧化氢酶试验[22],从中共筛选出3株革兰氏阳性、过氧化氢酶阴性、无芽孢的菌株,分别标记为R2、R4和R6。
2.1.2 生理生化试验
对分离菌株进行生理生化试验,结果见表3。
表3 菌株的生理生化试验结果
Table 3 Physiological and biochemical experiments results of strains
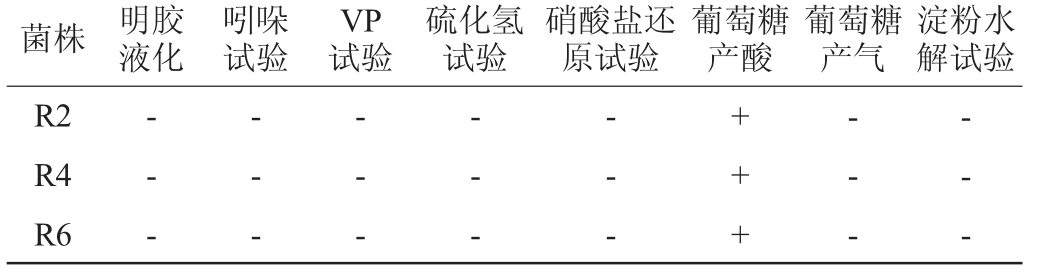
注:“-”表示结果呈阴性;“+”表示结果呈阳性。
菌株 明胶液化吲哚试验VP试验硫化氢试验硝酸盐还原试验葡萄糖产酸葡萄糖产气淀粉水解试验R2 R4 R6- - -- - -- - -- - -- - -+++- - -- - -
由表3可知,菌株R2、R4、R6都可以利用葡萄糖产酸但不产气,均不能使明胶液化、不产硫化氢、不能水解淀粉,吲哚试验、VP试验、硝酸盐还原试验均为阴性,根据《乳酸细菌分离鉴定及实验方法》[9]和《伯杰细菌鉴定手册》[23]初步判定菌株R2、R4、R6均为乳酸菌。
2.2 降解亚硝酸盐乳酸菌的筛选及鉴定
2.2.1 高效降解亚硝酸盐乳酸菌的筛选
菌株R2、R4和R6对亚硝酸盐(50 μg/mL)的降解能力如表4所示。
表4 3株乳酸菌在MRS培养基中的亚硝酸盐降解率
Table 4 Nitrite degradation rates of 3 kinds of lactate acid bacteria in MRS media
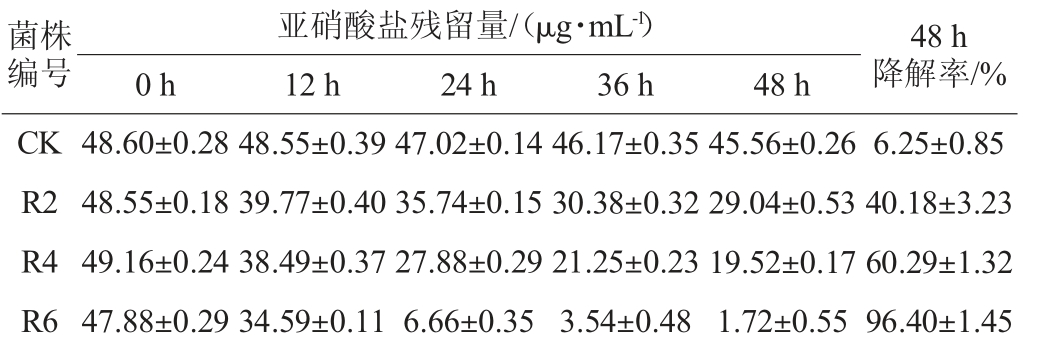
菌株编号亚硝酸盐残留量/(μg·mL-1)0 h 12 h 24 h 36 h 48 h 48 h降解率/%CK R2 R4 R6 48.60±0.28 48.55±0.18 49.16±0.24 47.88±0.29 48.55±0.39 39.77±0.40 38.49±0.37 34.59±0.11 47.02±0.14 35.74±0.15 27.88±0.29 6.66±0.35 46.17±0.35 30.38±0.32 21.25±0.23 3.54±0.48 45.56±0.26 29.04±0.53 19.52±0.17 1.72±0.55 6.25±0.85 40.18±3.23 60.29±1.32 96.40±1.45
由表4可知,乳酸菌R2、R4、R6在含有约50 μg/mL亚硝酸盐的MRS液体培养基中培养48 h后对亚硝酸盐的降解率分别为40.18%、60.29%、96.40%,其中乳酸菌R4及R6对亚硝酸盐的降解率较高。为进一步考察乳酸菌R4、R6的亚硝酸盐降解能力,将MRS液体培养基中亚硝酸盐的含量提高至100 μg/mL[24],测定发酵液中亚硝酸盐的残留量,结果见图1。
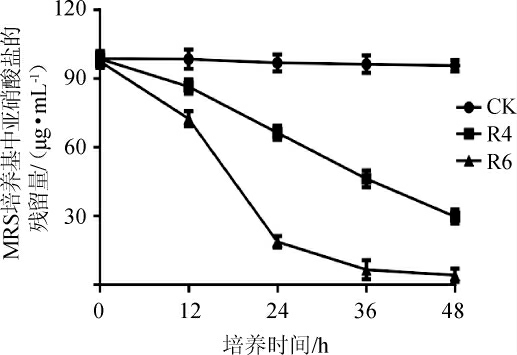
图1 2株乳酸菌在MRS培养基中的亚硝酸盐降解率
Fig. 1 Nitrite degradation rates of 2 kinds of lactate acid bacteria in MRS media
由图1可知,乳酸菌R6较乳酸菌R4能高效降解亚硝酸盐,乳酸菌R6发酵48 h时,亚硝酸盐降解率为95.84%。因此,选择乳酸菌R6进行进一步研究。
2.2.2 菌株R6的分子生物学鉴定
对菌株R6的16S rDNA PCR扩增产物进行测序,测序结果在NCBI数据库中通过BLAST进行检索比对,选取同源性较高的模式菌株构建系统发育树[25],结果如图2所示。
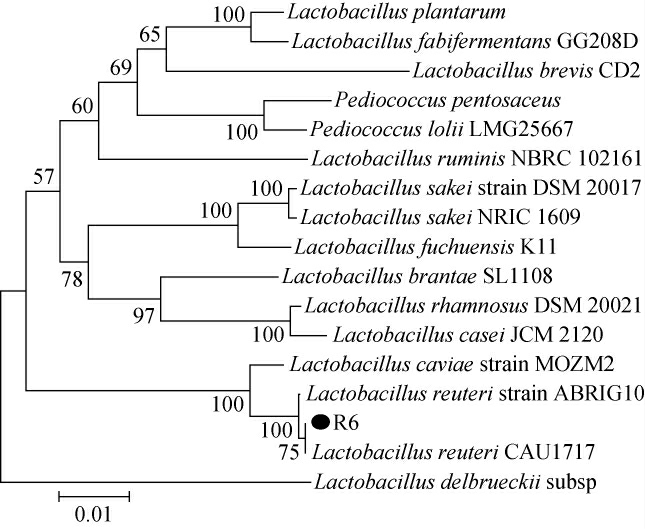
图2 乳酸菌R6基于16S rDNA序列的系统发育树
Fig. 2 Phylogenetic tree of lactate acid bacteria R6 based on 16S rDNA sequences
由图2可知,菌株R6与罗伊氏乳杆菌(Lactobacillus reuteri)聚于一支,亲缘关系近,因此,鉴定菌株R6为罗伊氏乳杆菌(Lactobacillus reuteri)。
2.3 菌株R6生长特性
2.3.1 菌株R6的生长曲线
菌株R6的生长曲线见图3。由图3可知,菌株R6的菌体密度随着培养时间的延长而逐渐增大,在培养4 h之前为迟滞期,培养4 h后开始进入对数生长期,培养8 h后,菌株R6生长进入稳定期,菌体密度值最大,OD600 nm值为1.566,是菌体的最佳收获时期。
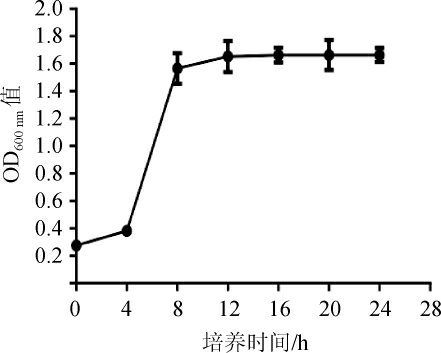
图3 菌株R6的生长曲线
Fig. 3 Growth curve of strain R6
2.3.2 培养温度对菌株R6生长的影响
培养温度对菌株R6生长的影响,结果见图4。由图4可知,菌株R6在培养温度15~40 ℃范围内均可生长,当培养温度为35 ℃时,菌体密度最大,OD600 nm值为1.752;当培养温度为20 ℃时,菌株R6有微弱的生长,OD600nm值为0.629;当培养温度高于40 ℃之后,菌株R6仍有一定的生长能力,但是生长受到抑制。综上所述,菌株R6的适宜生长温度范围为20~40 ℃,最适生长温度为35 ℃。
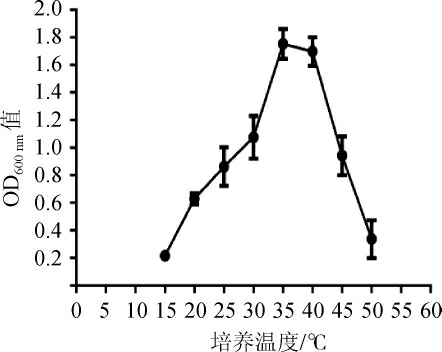
图4 培养温度对菌株R6生长的影响
Fig. 4 Effect of culture temperature on the growth of strain R6
2.3.3 NaCl含量对菌株R6生长的影响
NaCl含量对菌株R6生长的影响,结果见图5。由图5可知,菌株R6适宜生长的NaCl含量为0~15%,当NaCl含量>20%之后,乳酸菌R6基本无生长迹象。NaCl耐受性高于凌空等[26]的研究结果(NaCl耐受含量<8%)。
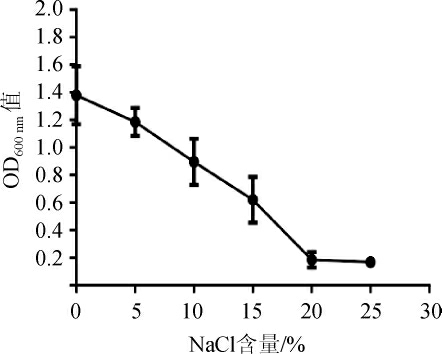
图5 NaCl含量对菌株R6生长的影响
Fig. 5 Effect of NaCl content on the growth of strain R6
2.4 不同发酵条件对菌株R6降解亚硝酸盐的影响
2.4.1 发酵温度对菌株R6降解亚硝酸盐的影响
发酵温度对菌株R6降解亚硝酸盐的影响,结果见图6。由图6可知,菌株R6在不同发酵温度条件下对亚硝酸盐的降解能力不同。当发酵温度在30~35 ℃范围内时,菌株R6对亚硝酸盐降解率为40.30%~57.50%,明显高于其他温度时的亚硝酸盐降解率,这表明发酵温度是影响菌株R6降解亚硝酸盐的一个重要因素。同时,菌株R6对亚硝酸盐的降解率随着培养时间的延长而升高,且菌株R6发酵16 h和24 h时,均在35 ℃条件下对亚硝酸盐的降解率最大,发酵16 h时,亚硝酸盐降解率为47.00%,发酵24 h时,亚硝酸盐降解率为57.50%。

图6 发酵温度对菌株R6降解亚硝酸盐的影响
Fig. 6 Effect of fermentation temperature on nitrite degradation of strain R6
2.4.2 初始pH值对菌株R6降解亚硝酸盐的影响
初始pH值对菌株R6降解亚硝酸盐的影响,结果见图7。由图7可知,菌株R6对亚硝酸盐的降解能力受初始pH值的影响明显。当初始pH值为5.5时,菌株R6发酵16 h和24 h后,亚硝酸盐降解率均为最高,发酵16 h后亚硝酸盐降解率为33.90%,发酵24 h后亚硝酸盐降解率为60.30%;当初始pH值<4.5时,菌株R6对亚硝酸盐的降解效果不明显;当初始pH值>6.0时,菌株R6对亚硝酸盐的降解能力减弱。分析原因可能是分离到的菌株R6对亚硝酸盐的降解可能以亚硝酸还原酶(nitrite reductase,NiRs)降解为主,而酸降解发挥着次要的作用[27]。
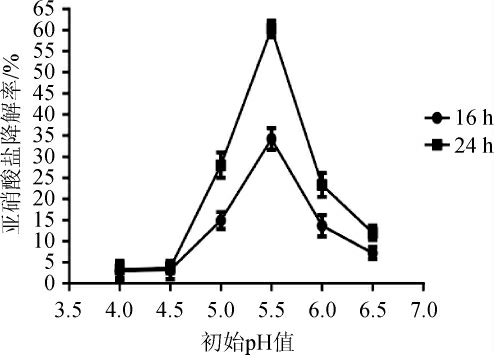
图7 初始pH值对菌株R6降解亚硝酸盐的影响
Fig. 7 Effect of initial pH value on nitrite degradation of strain R6
2.5 发酵鱼糜工艺条件优化
2.5.1 发酵温度对菌株R6降解鱼糜中亚硝酸盐的影响
发酵温度对菌株R6降解鱼糜中亚硝酸盐降解的影响,结果见图8。由图8可知,当发酵温度为20 ℃时,菌株R6对亚硝酸盐的降解率为45.00%;当发酵温度低于35 ℃时,菌株R6对亚硝酸盐的降解率随发酵温度的升高而提高;当发酵温度达到35 ℃时,菌株R6对亚硝酸盐的降解能力最强,降解率为49.10%;当发酵温度高于35 ℃之后,菌株R6对亚硝酸盐的降解率开始降低。分析原因可能是低温不利于菌株R6的生长,所以发酵温度低于25 ℃时,亚硝酸盐的降解率都不太高,随着发酵温度的升高,菌株R6开始大量繁殖,大量产酸,NiRs的活性增强,亚硝酸盐降解率也开始升高,特别是当发酵温度上升至35 ℃时,菌株R6对亚硝酸盐的降解作用最佳,这与王磊等[28]研究的最佳发酵温度为30 ℃不同。当发酵温度持续上升至高于35 ℃之后,菌株R6的生长和NiRs的活性又受到温度的抑制,导致亚硝酸盐的降解率降低。所以最适发酵温度为35 ℃。
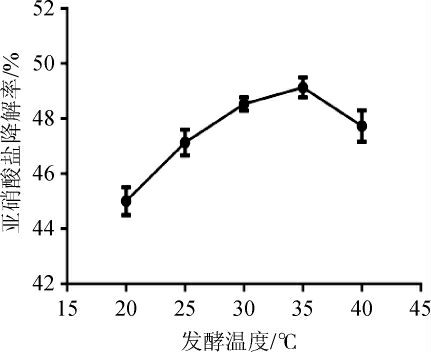
图8 不同发酵温度对发酵鱼糜中亚硝酸盐降解率的影响
Fig. 8 Effect of different fermentation temperature on degradation rates of nitrite in fermented surimi
2.5.2 发酵时间对菌株R6降解鱼糜中亚硝酸盐的影响
发酵时间对菌株R6降解鱼糜中亚硝酸盐的影响,结果见图9。由图9可知,随着发酵时间的延长,鱼糜中亚硝酸盐降解率先升高后趋于平缓。当发酵时间为30 h,亚硝酸盐降解率最高,为49.20%,但发酵时间>30 h之后,可能导致发酵鱼糜的风味口味变差[29]。所以选择最适发酵时间为30 h。
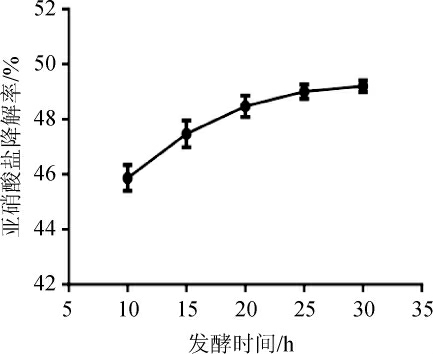
图9 不同发酵时间对发酵鱼糜中亚硝酸盐降解率的影响
Fig. 9 Effect of different fermentation time on degradation rates of nitrite in fermented surimi
2.5.3 发酵剂接种量对菌株R6降解鱼糜中亚硝酸盐的影响
将菌株R6作为发酵剂接种到鱼糜中,研究发酵剂接种量对发酵鱼糜中亚硝酸盐降解率的影响,结果见图10。由图10可知,当菌株R6接种量为1.0%时,亚硝酸盐的降解率最高,为49.13%,继续增加菌株R6的接种量,亚硝酸盐降解率也没有明显升高。因此,选择发酵剂最适接种量为1.0%。
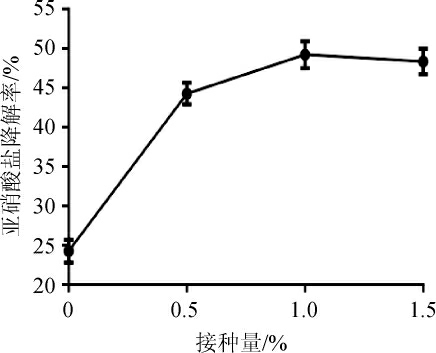
图10 不同接种量对发酵鱼糜中亚硝酸盐降解率的影响
Fig. 10 Effect of different inoculum on degradation rates of nitrite in fermented surimi
2.5.4 发酵鱼糜工艺条件优化正交试验
在单因素试验的基础上,选择发酵温度(A)、发酵时间(B)、发酵剂接种量(C)3个因素为考察因素,亚硝酸盐降解率为考察指标,进行3因素3水平的正交试验,以确定最优的工艺参数[30]。正交试验结果与分析见表5,方差分析见表6。
表5 发酵鱼糜工艺条件优化正交试验结果与分析
Table 5 Results and analysis of orthogonal experiments for process condition optimization of fermented surimi

试验号 A B C 亚硝酸盐降解率/%123456789k1 111222333 123123123 123231312 29.33±0.43 58.00±0.26 34.00±0.14 31.33±0.23 28.00±0.39 43.33±0.17 36.67±0.24 16.00±0.25 38.67±0.34 k2 k3R 40.44 34.22 30.45 10.00 32.44 34.00 38.67 6.22 29.55 42.67 32.89 13.11
由表5可知,发酵温度、发酵时间、发酵剂接种量的极值R分别为10.00、6.22、13.11,因此,各个因素对试验结果的影响主次顺序为C>A>B,即发酵剂接种量>发酵温度>发酵时间。发酵鱼糜最佳工艺条件组合为A1B3C2,即发酵温度30 ℃、发酵时间30 h、菌株R6接种量1.0%。
表6 正交试验结果方差分析
Table 6 Variance analysis of orthogonal experiment results
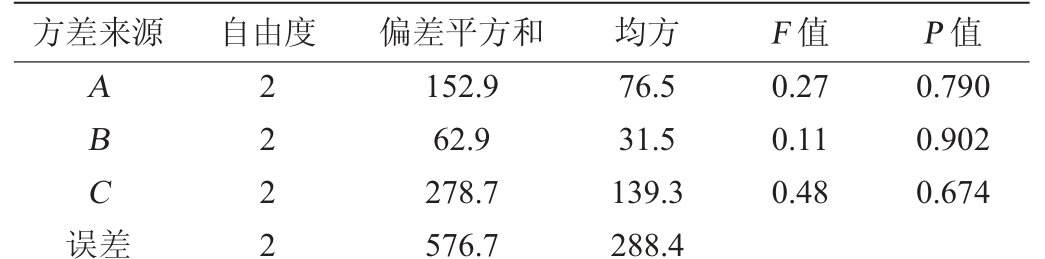
方差来源 自由度 偏差平方和 均方 F 值 P 值ABC误差2222 152.9 62.9 278.7 576.7 76.5 31.5 139.3 288.4 0.27 0.11 0.48 0.790 0.902 0.674
由表6可知,发酵温度、发酵时间、发酵剂接种量这3个因素对亚硝酸盐降解率均无显著性影响(P>0.05),且发酵时间对试验结果影响最小。
2.5.5 最优工艺条件验证
采用最优发酵条件制备鱼糜,发酵鱼糜中亚硝酸盐残留量为0.52 mg/kg,降解率为65.33%,感官评分为87.3分,与正交试验结果一致。而未添加乳酸菌的空白对照的鱼糜中亚硝酸盐残留量为1.13 mg/kg,降解率为24.26%,感官评分为73.7分。说明腌制鱼糜中加入乳酸菌作发酵剂,不仅可以降低亚硝酸盐含量,同时能够改善鱼糜制品的感官品质,得到风味和品质俱佳的鱼糜制品。
3 结论
从传统腌制巴浪鱼干中筛选出3株乳酸菌,其中乳酸菌R6亚硝酸盐降解能力最强,培养48 h后,亚硝酸盐降解率为96.40%,经分子生物学鉴定为罗伊氏乳杆菌(Lactobacillus reuteri)。菌株R6的最适生长温度为35 ℃,可耐受20%NaCl;降解亚硝酸盐的最适温度为35 ℃,最适初始pH值为5.5。乳酸菌R6发酵鱼糜的最优工艺条件为菌株R6接种量1.0%、发酵温度30 ℃、发酵时间为30 h,在此最优条件下,菌株R6发酵后的鱼糜中亚硝酸盐含量由1.50 mg/kg降低至0.52 mg/kg,降解率为65.33%,感官评分为87.3分。
[1]米红波,王聪,仪淑敏,等.淀粉在鱼糜制品中的应用研究进展[J].食品与发酵工业,2018,44(1):291-295.
[2]刘彩红,樊晓盼,王思雨,等.替代亚硝酸盐生产安全腌肉制品的研究现状[J].食品安全质量检测学报,2015,6(2):534-539.
[3] SAMPELS S. The effects of processing technologies and preparation on the final quality of fish products[J].Trends Food Sci Tech,2015,44(2):131-146.
[4]WANG Z X,SHAO Y Y.Effects of microbial diversity on nitrite concentration in pao cai, a naturally fermented cabbage product from China[J].Food Microbiol,2018,72:185-192.
[5]柳念,陈佩,高冰,等.乳酸菌降解亚硝酸盐的研究进展[J].食品科学,2017,38(7):290-295.
[6]许女,李田田,贾瑞娟,等.降解亚硝酸盐和生物胺乳杆菌筛选及其改善鱼肉香肠品质效果[J].农业工程学报,2018,34(15):304-312.
[7]KIM H S,HUR S J.Effect of six different starter cultures on the concentration of residual nitrite in fermented sausages during in vitro human digestion[J].Food Chem,2018,239:556-560.
[8]曾承露,李锋,黄德娜,等.盐酸菜中降胆固醇、亚硝酸盐乳酸菌筛选及功能特性研究[J].中国酿造,2017,36(7):37-41.
[9]凌代文,东秀珠.乳酸菌分类鉴定及实验方法[M].北京:中国轻工业出版社,1999:45-47.
[10]姚荷,谭兴和,张春艳,等.发酵蔬菜中乳酸菌降解亚硝酸盐的研究进展[J].中国酿造,2018,37(7):22-25.
[11]吴慧昊,牛锋,陈姗姗,等.高效降亚硝酸盐乳酸菌的驯化复筛及菌株鉴定[J].食品科学,2016,37(19):160-165.
[12]国家食品药品监督管理总局,国家卫生和计划生育委员会.GB 5009.33—2016 食品中亚硝酸盐与硝酸盐的测定[S].北京:中国标准出版社,2016.
[13] SCARPELLINI M, MORA D, COLOMBO S, et al. Development of genus/species-specific PCR analysis for identification of Carnobacterium strains[J].Curr Microbiol,2002,45(1):24-29.
[14]陈曦,周彤,许随根,等.贵州酸肉中具有高亚硝酸盐降解和耐受能力乳酸菌的筛选与鉴定[J].中国食品学报,2018,18(2):256-264.
[15]朴泓洁,黄存辉,金清.肠膜明串珠菌发酵对四川泡菜品质的影响[J].食品科技,2018,43(8):31-35.
[16]张弦.复合乳酸菌发酵鱼肉香肠的工艺及品质研究[D].厦门:集美大学,2016.
[17] FENG J H, CAO A L, CAI L Y, et al. Effects of partial substitution of NaCl on gel properties of fish myofibrillar protein during heating treatment mediated by microbial transglutaminase[J].LWT-Food Sci Tech,2018,93:1-8.
[18]XIAO Y,LI P,ZHOU Y,et al.Effect of inoculating Lactobacillus pentosus R3 on N-nitrosamines and bacterial communities in dry fermented sausages[J].Food Control,2018,87:126-134.
[19]张洵.发酵鱼糜的风味改良研究[D].无锡:江南大学,2013.
[20]邵彦春,周崇禅,陈福生,等.稀醪低盐发酵鳀鱼鱼露工艺优化及其特征分析[J].中国农学通报,2018,34(8):104-110.
[21]张晓鸣.食品感官评定[M].北京:中国轻工业出版社,2006:5-98.
[22]崔喜艳.基础生物化学实验方法和技术[M].北京:中国林业出版社,2008:76-80.
[23]RE 布坎南,E 吉本斯.伯杰细菌鉴定手册[M].北京:科学出版社,1984:660.
[24]LI L,WEN X,WEN Z,et al.Evaluation of the biogenic amines formation and degradation abilities of Lactobacillus curvatus from Chinese bacon[J].Front Microbiol,2018,9:1-9.
[25]KUMAR S,STECHER G,TAMURA K.MEGA7:Molecular evolutionary genetics analysis version 7.0 for bigger datasets[J]. Mol Biol Evol,2016,33(7):1870-1874.
[26]凌空,翟磊,姚粟,等.新疆传统发酵食品中乳酸菌的分离鉴定及其生长代谢特性[J].食品与发酵工业,2017,43(3):123-129.
[27]姚荷,谭兴和,张春艳,等.发酵蔬菜中乳酸菌降解亚硝酸盐的研究进展[J].中国酿造,2018,37(7):22-25.
[28]王磊,刘学军.草鱼肉发酵香肠的发酵工艺研究[J].食品工业科技,2011,32(2):172-174,177.
[29]王博,章智华,王浩,等.镜鲤鱼鱼糜肠发酵过程中品质特性及凝胶特性的变化[J].食品工业科技,2017,38(24):89-94.
[30]PEREA-SANZ L,MONTERO R,BELLOCH C,et al.Nitrate reduction in the fermentation process of salt reduced dry sausages:Impact on microbial and physicochemical parameters and aroma profile[J].Int J Food Microbiol,2018,282:84-91.