牛栏山二锅头属于清香型白酒,凭借清香纯正、口味甘冽、酒体醇厚等特点,逐渐成为我国北方清香型的代表性白酒之一,在国内具有较高的知名度[1-2]。牛栏山二锅头主要以大曲作为糖化发酵剂,经过糖化、发酵、蒸馏和储存等步骤制得。大曲是二锅头酿造中的主要糖化剂,是富含微生物菌系、酶系和曲香物质的微生态制品,具有糖化、发酵、生香等功能[3],是白酒中微生物的主要来源。然而传统微生物分离方法对大曲中微生物的研究还有一定的缺陷,大曲中的微生物经过长期的驯化,早已适应了高温、低含水量及不同pH值等特殊环境,而在人工培养模式下,由于培养条件难以完全模拟出大曲的制曲环境,往往会造成部分微生物无法正常生长,导致微生物可培养性不高等现象[4]。
目前,随着分子生物学技术的发展及运用,人们对大曲微生物菌系的研究逐渐由传统微生物分离转变为依靠分子生物学技术的免培养方法。近几年来,以基因文库、聚合酶链式反应-变性梯度凝胶电泳(polymerase chain reaction-denaturing gradient gel electrophoresis,PCR-DGGE)、高通量测序为主的分子生物学技术手段逐渐应用于大曲微生物的研究中,有效解决了纯培养技术在微生物分离种类和数量方面的不足[5-8],如罗惠波等[9]利用内部转录间隔区(internal transcribed spacer,ITS)基因文库研究了清香型大曲真菌群落结构,确定出汾酒大曲真菌全部属于酵母目和毛霉菌目,清茬、后火和红心曲真菌群落结构存在明显差异;兰玉倩等[10]利用PCR-DGEE技术解析清香型大曲生产过程中酵母群落结构,确定了清香型大曲制作过程中存在7个真菌分类属,并介绍了各属微生物的变化规律;乔晓梅等[11]采用高通量测序法分析了清香大曲真菌群落结构,确定了清香大曲主要真菌类群。这些研究方法可以避免在传统培养过程中富集、培养及分离等步骤中所造成的微生物多样性丢失、种群构成发生变化等局限,能够更直接可靠的反映样品微生物的原始组成情况。
本研究采用高通量测序技术,利用免培养方法,从牛栏山大曲中原核生物和真核生物两个方面入手,系统分析牛栏山大曲菌系组成,同时根据不同微生物所占比例关系,确定出了牛栏山大曲中主体微生物,为牛栏山大曲质量控制及制曲工艺提供一定的基础数据,同时也为牛栏山大曲微生物分离纯化等工作提供数据指导。
1 材料与方法
1.1 材料与试剂
清香型酿酒生产大曲:取牛栏山不同酿酒班生产大曲,按“四分法”混合取样[12],用无菌封口袋封装,-80 ℃保藏备用;土壤基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒(FastDNA SPIN Kit for Soil):美国Mpbio公司;DNA引物:北京天跟生化科技有限公司;冰乙酸(分析纯):北京化工厂;乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、三羟甲基氨基甲烷(Tris):上海生工生物工程有限公司。
1.2 仪器与设备
JY600型基础型电泳仪:郑州博邦科贸有限公司;ChampGelTM全自动凝胶成像仪:北京赛智创业公司;1-14k高速冷冻离心机:德国Eppendorf公司;Illumina MiSeq测序仪:北京奥维森基因科技有限公司;0.45 μm过滤膜:Milipore公司;Milli-Q IQ7000超纯水系统:美国Millipore公司;Fast-Prep-24 5G匀浆仪:美国MP Biomedicals公司。
1.3 实验方法
1.3.1 大曲总DNA提取
从混合大曲样品中随机称取6份(每份1 g),经Fastprep处理后,采用土壤基因组DNA提取试剂盒(FastDNA SPIN Kit for SoiL)提取总DNA。
1.3.2 大曲高通量测序
大曲样品中微生物种类繁多,真核微生物和原核微生物共存,因此本研究对大曲样品总DNA的ITS1区和16S rDNA V3/V4区进行PCR扩增,扩增引物及反应条件见表1。
将6份大曲总DNA混合后,进行ITS1区和16S rDNA V3/V4区片段扩增,产物库检合格后,利用Illumina MiSeq PE300进行细菌、真菌高通量测序(北京奥维森公司)。原始测序序列通过Fastqc进行质量检测去除低质量Reads(过滤标准:Q20≥90%)。通过Cope软件(Connecting Overlapped Pair-End,V1.2.3.3),进行序列拼接及过滤后利用Mothur软件以平均邻近聚类算法(average neighbor clustering algorithm)在0.03(或97%的相似度)水平下对Clean Tags进行操作分类单元(operational taxonomic units,OTU)的聚类,统计各个样品每个OTU中的丰度信息。选取分析数据中每个OTU中一个有代表性的序列,通过Blast比对,获得每一个OTU种名。
表1 高通量测序引物序列
Table 1 Primer sequences of high throughput sequencing

测序片段 引物 反应条件16S rDNA V3/V4 95 ℃、5 min;(94 ℃、50 s,50 ℃、1 min,72 ℃、45 s)×30循环;72 ℃、5 min,冷却至4 ℃ITS1 5'-GTACTCCTACGGGAGGCAGCA-3'(F)5'-GTGGACTACHVGGGTWTCTAAT-3'(R)5'-CTTGGTCATTTAGAGGAAGTAA-3'(F)5'-TGCGTTCTTCATCGATGC-3'(R)94 ℃、5 min;(94 ℃、50 s,50℃、1 min,72 ℃、40 s)×30循环;72 ℃、10 min,冷却至4 ℃
2 结果与分析
2.1 大曲微生物聚类分析
大曲总DNA经电泳检测合格后,利用Illumina MiSeq PE300进行细菌、真菌高通量测序,根据97%相似度将不同测序序列进行聚类分析。经分析表明,从牛栏山大曲中共获得真核OTU 69种,原核OTU 358种,说明牛栏山大曲中原核微生物多样性远高于真核。
2.2 大曲原核微生物多样性
样品中原核微生物358 种OTU 主要由放线菌门(Actinobacteria)、变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)和拟杆菌门(Bacteroidetes)4类组成,其具体分布见表2。
表2 大曲原核微生物分类
Table 2 Classification of prokaryotic microorganism from Daqu

菌种分类 拉丁名 所占总OTU比例/%变形菌门放线菌门厚壁菌门拟杆菌门Proteobacteria Actinobacteria Firmicutes Bacteroidetes 25.42 21.79 46.65 6.15
通过表2可以看出,大曲中厚壁菌门所占OTU数量最多,为46.65%,变形菌门和放线菌门分别为25.42%和21.79%,拟杆菌门数量最少,为6.15%。同时,对所获得OTU进一步进行种属分析,结果见图1所示。
通过对358种原核OTU进行种属比对,挑选OTU数占原核总OTU数1%以上的序列进行多样性分析。如图2所示,共有14种OTU占1%以上,其总和可占总OTU的83%,因此可以认为14种OTU能够代表大曲主体原核微生物。
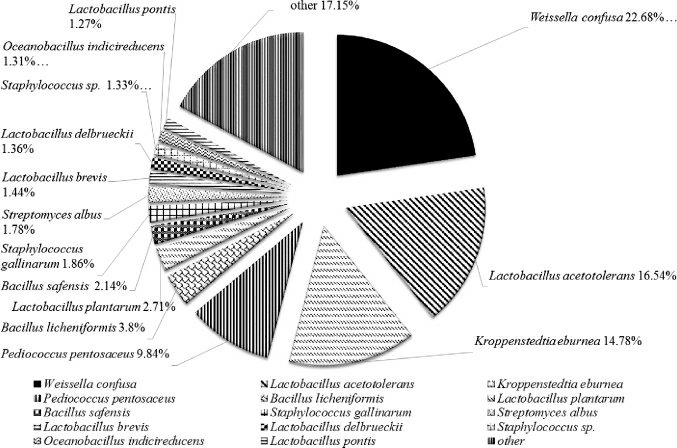
图1 大曲原核微生物种属分布饼图
Fig. 1 Species distribution pie chart of prokaryotic microorganism from Daqu
14种OTU的菌属主要可分为乳酸菌、放线菌、芽孢杆菌、葡萄球菌这4大类,其中乳酸菌种类较多,由7种组成,放线菌、芽孢杆菌和葡萄球菌种类较为接近,均为2~3种。在种属分布上,乳酸菌所占比例较多,维斯氏菌(Weissella confusa)、耐酸乳杆菌(Lactobacillus acetotolerans)和戊糖片球菌(Pediococcuspentosaceus)分别占大曲总OTU的22.68%、16.54%和9.84%;放线菌(Kroppenstedtia eburnea)可在大曲中占14.78%;以地衣芽孢杆菌(Bacillus licheniformis)和沙福芽孢杆菌(Bacillus safensis)为主的芽孢杆菌仅占3.80%和2.14%。整体看来,牛栏山大曲中优势原核微生物较为明显,乳酸菌类在牛栏山大曲中占据了主导地位,同时含有一定量的高温放线菌,而芽孢杆菌则在大曲中含量较低。在牛栏山酒酿造过程中,大曲中的大量乳酸菌进入到发酵过程中能够为发酵微生物提供营养物质并维持发酵的平衡。目前已有研究表明,乳酸菌自身可以合成一类具有活性的多肽和蛋白质类物质,呈现不可逆的杀菌作用方式,有效地抑制酒醅中杂菌生长[14],另外当乳酸菌和酵母菌共同发酵时,能够有效地提高发酵样品中的酸、醇、酯等风味物质产量;同时乳酸菌自溶所产生的营养物质可供酵母所利用,自溶后产生的酶类、活性成分和多种酸性多糖磷酸质,具有一定的糖化作用,在一定程度上提高了酒醅其余微生物对淀粉的利用[15-16];并且其产生的多种有机酸是乳酸乙酯及其他香味成分合成的重要基础物质。
2.3 大曲真核微生物多样性
在本研究中,共获得真核微生物OTU 69种,共分为9个目,其具体组成见表3。
通过表3可以看出,牛栏山大曲中酵母目OTU所占比例最多,达到了56.52%,其次为散囊菌目15.94%,毛霉菌目8.70%,其余类别所占比例相对较低。对所获得OTU数据进一步进行种属分析。通过对69种OTU进行种属比对,挑选OTU数量前10的OTU进行系统分析,如图2所示。
表3 大曲真核微生物分类
Table 3 Classification of eukaryotic microorganism from Daqu
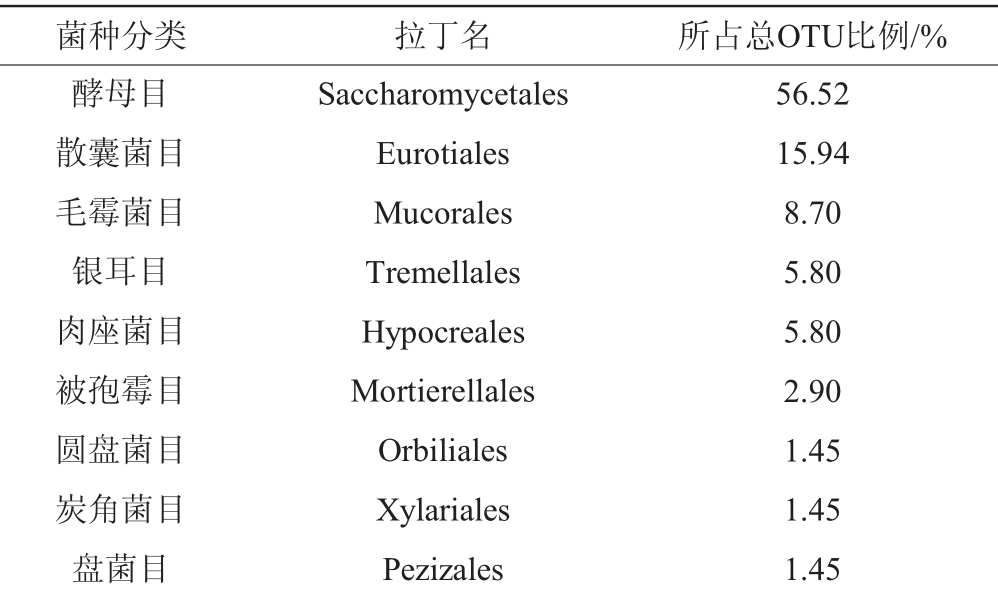
菌种分类 拉丁名 所占总OTU比例/%酵母目散囊菌目毛霉菌目银耳目肉座菌目被孢霉目圆盘菌目炭角菌目盘菌目Saccharomycetales Eurotiales Mucorales Tremellales Hypocreales Mortierellales Orbiliales Xylariales Pezizales 56.52 15.94 8.70 5.80 5.80 2.90 1.45 1.45 1.45
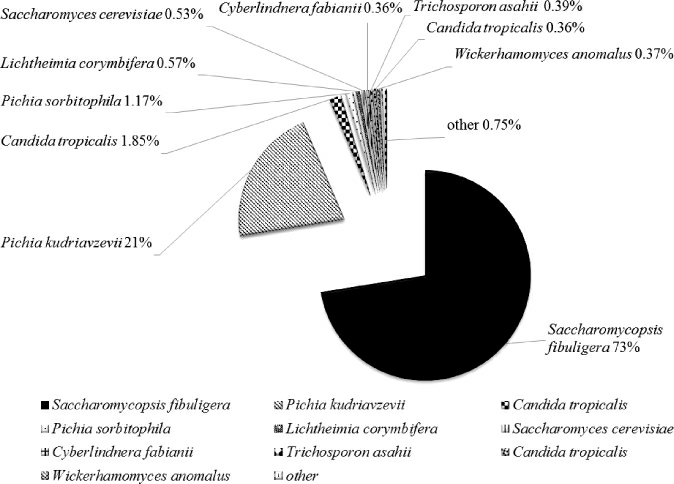
图2 大曲真核微生物种属分布饼图
Fig. 2 Species distribution pie chart of eukaryotic microorganism from Daqu
由图2可知,在大曲真菌OTU中,前10种OTU总和可占大曲真菌总OTU的99.25%,因此可以认为这10种OTU能够真实反映大曲中真菌的种属分布情况。在大曲真菌种属组成中,扣囊覆膜酵母(Saccharomycopsis fibuligera)数量最多,可占大曲真菌总量的73%,其次为库氏毕赤酵母(Pichia kudriavzevii)可占21%,两种真菌共占大曲总量的94%,因此可以认为这两种菌是牛栏山大曲的主体真菌,而其余真菌,如假丝酵母(Candida tropicalis)、酿酒酵母(Saccharomyces cerevisiae)、横梗霉(Lichtheimia corymbifera)以及异常维克汉姆酵母(Wickerhamomyces anomalus)等,虽然在大曲高通量中能够检测到,但所占比例较低,仅在1%以下,在大曲真菌中并不占优势。扣囊覆膜酵母被认为是清香型大曲制曲前期的主要微生物,虽然其产酒精能力不强,但香味浓郁,可使白酒风味更加丰富,同时已有研究表明,扣囊覆膜酵母能产α-淀粉酶,能分解生料和熟料淀粉,也能产生糖化酶,将淀粉分解为葡萄糖[17-18],说明扣囊覆膜酵母在制曲过程中可以利用生料淀粉产生糖化酶、淀粉酶,将原料中的淀粉转化为葡萄糖,为大曲的正常制作提供多种糖类物质,同时也是成品曲中酶类的重要产生菌;库氏毕赤酵母属于生香酵母类,在产酯产香方面具有较强能力,能够利用发酵环境中的糖类、氨基酸、蛋白质及醇类物质,在发酵前期生成大量以乙酸乙酯为主体的酯类及少量酸类、酚类等化合物,起到为基酒增香的重要作用[19-20]。
3 结论
本研究利用高通量测序技术,从分类学角度系统研究了牛栏山大曲真核和原核微生物多样性分布,确定了大曲中菌系组成。结果表明原核生物在大曲中多样性远高于真核,共获得358种原核OTU,而真核仅为69种。微生物种属分布表明,大曲中原核微生物主要可分为乳酸菌类群、放线菌类群、芽孢杆菌类群和葡萄球菌类群,其中乳酸菌类群所占比例较高,维斯氏菌(W.confuse)、耐酸乳杆菌(L. acetotolerans)和戊糖片球菌(P. pentosaceus)3种乳酸菌总和可占大曲原核总OTU的49.06%,同时大曲中还存在一定量的高温放线菌(K.eburnea);在真核微生物组中,扣囊覆膜酵母(S.fibuligera)和库氏毕赤酵母(P.kudriavzevii)是牛栏山大曲中的主要微生物,横梗霉(L.corymbifera)、酿酒酵母(S.cerevisiae)及异常维克汉姆酵母(W.anomalus)、假丝酵母(C.tropicalis)所占比例较低。
大曲制作过程繁杂,培养周期长,在开放的环境中,其所包含的微生物种类十分丰富,制曲原料、器具、空气均是大曲微生物的主要来源。牛栏山大曲采用了低温制曲工艺,制曲温度最高不超过40~50 ℃,适宜的温度、制曲工艺及独特菌群环境形成了牛栏山大曲特有的菌群结构。因此,对牛栏山大曲进行系统研究,将有助于解析出二锅头酒口味甘洌、酒体醇厚的原因,同时也可以为今后大曲的质控及强化制曲等提供基础数据支撑。
[1]胡佳音,周森,王瑛,等.牛栏山二锅头大茬酒醅发酵过程中细菌群落结构分析[J].中国酿造,2018,37(9):39-42.
[2]廖永红,杨春霞,胡佳音,等.气相色谱-质谱法分析比较牛栏山牌清香型二锅头酒和浓香型白酒中的香味成分[J].食品科学,2012,33(6):181-185.
[3]明红梅,董瑞丽,许德富,等.主成分分析法在大曲质量评价体系中的应用[J].中国酿造,2010,29(8):120-123.
[4]赵东,杨蓉.白酒酿造微生物培养技术研究[J].酿酒,2014,41(6):21-25.
[5]ZHANG L,WU C,DING X,et al.Characterisation of microbial communities in Chinese liquor fermentation starters Daqu,using nested PCR-DGGE[J].World J Microbiol Biot,2014,30(12):3055-3063.
[6] MENG Z,XIONG Z H,ZHONG Q D,et al.Application of PCR-DGGE to analysis of bacteria community structure of Daqu[J]. Food Ferment Ind,2010,36(10):159-162.
[7] ZHANG L, HUANG J, ZHOU R, et al. Evaluating the feasibility of fermentation starter inoculated with Bacillus amyloliquefaciens for improving acetoin and tetramethylpyrazine in Baoning bran vinegar[J]. Int J Food Microbiol,2017,255:42-50.
[8]XIONG X,HU Y H,YAN N,et al.PCR-DGGE analysis of the microbial communities in three different Chinese"Baiyunbian"liquor fermentation starters[J].J Microbiol Biot,2014,24(8):1088-1091.
[9]罗惠波,王彩虹,甄攀,等.基于ITS 基因文库法研究清香型大曲真菌群落结构[J].酿酒科技,2014(5):31-35.
[10]兰玉倩,樊丹敏,刘志磊,等.应用PCR-DGGE 指纹技术解析清香型大曲生产过程中酵母群落结构[J].中国酿造,2012,31(10):156-159.
[11]乔晓梅,赵景龙,杜小威,等.高通量测序法对清香大曲真菌群落结构的分析[J].酿酒科技,2015(4):28-31.
[12]吴谋成.食品分析与感官评定[M].北京:中国农业出版社,2002:7-10
[13]易华西,张兰威,杜明,等.乳酸菌细菌素抗菌潜力挖掘研究进展[J].中国食品添加剂,2010,98(1):73-76.
[14]任大勇,李昌,秦艳青,等.乳酸菌益生功能及作用机制的研究进展[J].中国兽药杂志,2011,45(2):47-50.
[15]尹胜利,杜鉴,徐晨.乳酸菌的研究现状及其应用[J].食品科技,2012,37(9):25-29.
[16]DOBERNE L,GREENFIELD M S,SCHULZ B,et al.Enhanced glucose utilization during prolonged glucose clamp studies[J]. Diabetes,1981,30(10):829-835.
[17]木霉T-1 和酵母菌混和发酵生产发酵蔗渣饲料研究[J].安徽农业科学,2010,38(3):1249-1251.
[18]毛青种,俞关松.拟内孢霉酵母的特性和在黄酒酿造中的作用研究[J].酿酒,2013,40(3):59-61.
[19]陆振群.产酯类酵母的选育[D].芜湖:安徽工程大学,2012.
[20]唐洁,王海燕,徐岩.酿酒酵母和异常毕赤酵母混菌发酵对白酒液态发酵效率和风味物质的影响[J].微生物学报,2012,39(7):921-930.