乳酸菌(lactic acid bacteria)细菌素(bacteriocins)是乳酸菌经由核糖体合成和翻译后修饰而成的一类具有抑制细菌作用的多肽或蛋白类物质(antimicrobial peptides)[1]。根据细菌素的热稳定性、抑菌谱、胰蛋白酶敏感性和抑菌机理等特性可将其分为羊毛硫抗生素类(classⅠ)如乳酸链球菌素(Nisin),不含羊毛硫氨酸的多肽类(classⅡ),热敏感的大分子蛋白(>30 kDa)(Class Ⅲ)和复合型细菌素(class Ⅳ)四类[1]。目前,乳酸菌细菌素唯一实现产业化的是Ⅰ类羊毛硫抗生素类中的Nisin,并广泛应用于食品防腐。而Ⅱ类乳酸菌细菌素相比于Ⅰ类、Ⅲ类和Ⅳ类细菌素具有更强的稳定性和抑菌活性以及更广的抑菌谱,比如对单增李斯特菌(Listeria monocytogenes)具有强烈的抑制作用,故对其挖掘和研究已成为当今细菌素领域的热点[2]。但是到目前为止Ⅱ类乳酸菌细菌素的产量较低,不能满足工业生产的需求,因此其生物合成产量是目前的研究重点。
对微生物的代谢网络进行调控是提高代谢产物合成量的重要策略,如切断产物副反应途径;优化营养物质和培养条件;增强关键酶的活性等。通过这些策略,许多微生物代谢产物的产量得到了大幅度的提高[3-5]。目前,在提高乳酸菌Ⅱ类细菌素产量策略方面,绝大多数研究是通过筛选最优碳源、氮源成分;优化培养条件等方法。近些年来随着对细菌素合成和降解代谢研究逐渐深入,尤其是对Ⅱ类细菌素生物合成基因簇的研究有了突破性的进展,例如目前已经克隆得到了植物乳杆菌细菌素生物合成基因簇的绝大部分基因,并且大部分基因的功能也得到了验证[6-7],这使得通过改造Ⅱ类细菌素的合成代谢及降解途径来提高细菌素产量成为可能。本文主要综述了目前Ⅱ类乳酸菌细菌素生物合成和降解途径,并从代谢调控角度提出提高Ⅱ类乳酸菌细菌素产量的可行性策略,为提高Ⅱ类乳酸菌细菌素产量提供一个全新、重要的途径,也为Ⅱ类乳酸菌细菌素工业化生产奠定基础。
1 Ⅱ类细菌素分类及其特性
乳酸菌Ⅱ类细菌素是一类由核糖体合成的,分子质量<10 kDa,具有热稳定性的多肽类物质。COTTER P D等[8]根据Ⅱ类细菌素性质,将其分为四类:Ⅱa类片球菌素、Ⅱb两肽细菌素、Ⅱc环状细菌素和Ⅱd非片球菌素线性多肽(见表1),这一分类也被大多数学者所认可。
表1 乳酸菌Ⅱ类细菌素分类
Table 1 Classification of class II bacteriocins of lactic acid bacteria

分类 描述 代表Ⅱa类Ⅱb类Ⅱc类Ⅱd类含有Y-G-N-G-V-X-C-X-K/N-X-X-C-保守序列的类片球菌素由两条肽链组成的双肽细菌素具有较强的热稳定性、抗蛋白酶水解性以及抗李斯特菌性质的环状细菌素非片球菌素线性多肽Curvacin A、Pediocin PA-1、Enterocin A等Lactococcin G、Plantaricin EF、Plantaricin JF等Carnocyclin A、EnterocinAS-48等Lactococcin A、Enterocin EJ97、Enterocin B等
1.1 Ⅱa类细菌素
Ⅱa细菌素是由革兰氏阳性细菌产生的肽类物质。近年来,由于其能有效的抑制单增李斯特菌(Listeria monocytogenes)、金黄色葡萄球菌(Staphylococcus aureus)、蜡样芽孢杆菌(Bacillus cereus)等食品腐败或致病菌而备受关注,被认为是一种具有巨大潜力的天然食品防腐剂。它由37~55个氨基酸组成,在N末端含有Y-G-N-G-V-X1-C-X2-K/N-X3-X4-C(Y为酪氨酸;G为甘氨酸;N为天冬酰胺;V为缬氨酸;X为任意氨基酸;C为半胱氨酸;K为懒氨酸)保守氨基酸残基,被称为“片球菌素序列框区域(pediocin box)”。在Ⅱa类细菌素的N末端还含有一个由两个半胱氨酸形成的二硫键。同时,Ⅱa类细菌素除了在运输过程中将引导序列切除外,不在进行任何修饰。C末端是一个疏水或两亲的区域,与N末端相比具有较差的保守型。JOHNSEN L等[9]研究发现,C末端与特异性结合目标菌有关,而N末端的“片球菌素序列框区域”则与非特异性结合细胞膜有关。目前,Sakacin P、Carnobacteriocin B2、Curvacin A等Ⅱa类细菌素的三维结构已经确定,并且三维结构的变化被认为是不同Ⅱa细菌素特异性的基础[10-12]。此外,少数Ⅱa类细菌素(Pediocin PA-1、Enterocin A和Sakacin G)在C末端还含有第二个二硫键,这个二硫键赋予这些细菌素更广的抑菌谱和耐热性[13-14]。因为在高温条件下,含有一个二硫键细菌素的α-螺旋(位于C末端,与抗菌活性相关)会瓦解,但C末端的第二个二硫键能够维持α-螺旋的稳定性。
由于Ⅱa类细菌素具有广谱、高效等特点,已成为继Nisin之后最具开发潜力的天然食品防腐剂。在欧美国家,Pediocin PA-1已经在肉制品和奶酪制品中得到应用。因此,将Ⅱa类细菌素与其他防腐技术相结合构成多重防腐系统来增强防御效果并扩大其应用范围,以及提高合成量来满足工业化需求将成为未来研究的重点。
1.2 Ⅱb类细菌素
Ⅱb类细菌素是由两条肽链组成的双肽细菌素,最初是在乳酸菌的代谢产物中被发现,两条肽链各自的氨基酸残基数目一般<40,如Plantaricin S分别由26/24个氨基酸残基组成[15]。但是,也有一些Ⅱb类细菌素至少含有一条肽链的氨基酸残基数>50,如Brochocin C[16]。这两条肽链只有相互结合成复合体后才具有强烈的抑菌活性,单独一条肽链无活性或活性很低。目前,Lactococcin G、Plantaricin EF、Plantaricin JK等Ⅱb类细菌素的三维结构已经被阐明,Ⅱb类细菌素的两条肽链是通过保守序列GxxxG相互作用而结合在一起,并且GxxxG序列与抑菌活性密切相关[17-19]。ROGNE P等[19]将Plantaricin JF中GxxxG序列的甘氨酸残基替换成其他氨基酸后,发现Plantaricin JK的活性大幅度降低,认为这是由于GxxxG中甘氨酸残基的替换导致两条肽链的结合被中断,致使抑菌活性降低。
目前对双肽细菌素的应用研究已有较多报道,如Lacticin 3147在干酪的应用[20];Lactocin 705在碎牛肉中的应用等[21]。但是到目前为止,并没有商业化产品的出现,主要原因还是产量较低。因此,对提高双肽细菌素产量及抑菌能力的研究将是现阶段研究的热点。
1.3 Ⅱc类细菌素
Ⅱc类细菌素是具有较强的热稳定性、抗蛋白酶水解性以及抗李斯特菌性质的环状细菌素,因此其不同于由酶合成的环状抗菌肽,如短杆菌肽、抗霉枯草菌素等。Ⅱc类细菌素需要通过翻译后修饰才能形成成熟的细菌素,通常是由N末端和C末端通过共价连接后形成环状骨架。目前,运用核磁共振、X射线衍射等方法已经得到了Carnocyclin A和EnterocinAS-48这两个环状细菌素的结构。研究显示Ⅱc类细菌素的结构中存在着有序重复的α-螺旋[22-23]。目前有8个Ⅱc类细菌素已经被鉴定,其中6个来源于乳酸菌(Gassericin A、Reutericin 6、Enterocin AS-48、Enterocin 4、Carnocyclin A 和Lactocyclicin Q),另外两个为Cirularin A(来源于拜氏梭菌)和Butyrivibriocin AR(来源于溶纤维丁酸弧菌)[1]。有研究人员将这8个细菌素的氨基酸序了进行对比后发现,N末端区域具有较高的相似性,预测这一区域可能含有两个不同的螺旋结构。
Ⅱc类细菌素独特的环状结构,赋予了其良好的抗菌特性,成为继Ⅱa类细菌素之后又一个具有应用潜力的细菌素。因此未来应该深入研究其抗菌特性、抑菌机理及提高生物合成量,为日后工业化生产和应用打下基础。
1.4 Ⅱd类细菌素
根据COTTER P D的分类,将非片球菌素线性多肽归类为Ⅱd类细菌素,但是这一类型细菌素序列没有明显的相似性。因此,一些研究人员将Ⅱ类细菌素只分为三个亚类(Ⅱa、Ⅱb、Ⅱc),并不含有Ⅱd这一亚类[24]。不过,NISSENMEYER J等[25]保留了Ⅱd这一亚类,将31种细菌素归类入Ⅱd类细菌素,其中29种来源于乳酸菌,2种源于金黄色葡萄球菌(见表2)。对于Ⅱd类细菌素的归类目前没有统一的标准,因此进一步研究Ⅱd类细菌素在核酸序列、氨基酸序列以及抑菌机理上是否存在着相似性,可为这一亚类的存在提供理论依据。
表2 Ⅱd类乳酸菌细菌素的微生物来源
Table 2 Microorganisms sources of class Ⅱd bacteriocins of lactic acid bacteria

细菌素 合成菌株Lactococcin A LsbA and LsbB Lacticin Q Lacticin Z Lactococcin 972 Lactococcin B Lacticin RM Enterocin B Bac32 Enterocin L50A Enterocin L50B Enterocin Q Enterocin RJ-11 Mesenterocin 52B Dextranicin 24 Mesentericin B105 Leucocin B-TA33a Acidocin 1B Acidocin CH5 Acidocin A Carnobacteriocin A Bacteriocin OR-7 Cripacin A Divergicin 750 Enterocin EJ97 BHT-B Bovicin 255 Micrococcin GO5 Weissellicin 110 Aureocin A70 Aureocin A53乳酸乳球菌(Lactococcus lactis)乳酸乳球菌(Lactococcus lactis)乳酸乳球菌(Lactococcus lactis)QU5乳酸乳球菌(Lactococcus lactis)QU14乳酸乳球菌(Lactococcus lactis)IPLA972乳酸乳球菌亚种(Lactococcus lactis subsp.lactis)9B4乳酸乳球菌亚种(Lactococcus lactis subsp.lactis)EZ26尿肠球菌(Urine enterococcus)T136尿肠球菌(Urine enterococcus)VRE200尿肠球菌(Urine enterococcus)L50尿肠球菌(Urine enterococcus)L50尿肠球菌(Urine enterococcus)L50尿肠球菌(Urine enterococcus)RJ-11肠系膜明串珠菌亚种(Leuconostoc mesenteroides subsp.mesenteroides)FR52肠系膜明串珠菌亚种(Leuconostoc mesenteroides subsp.mesenteroides)J24肠系膜明串珠菌(Leuconostoc mesenteroides)Y105肠系膜明串珠菌(Leuconostoc mesenteroides)TA33a嗜酸乳杆菌(Lactobacillus acidlophilus)GP1B嗜酸乳杆菌(Lactobacillus acidlophilus)CH51嗜酸乳杆菌(Lactobacillus acidlophilus)TK9201栖鱼肉杆菌(Carnobacterium piscicola)LV17A唾液乳杆菌(Lactobacillus salivarius)NRRL B-50514卷曲乳杆菌(Lactobacillus crispatus)JCM2009广布肉食杆菌(Bacillus diffusa)粪肠球菌(Enterococcus faecalis)EJ97大鼠链球菌(Streptococcus rattus)及其突变菌解没食子酸链球菌(Streptococcus gallolyticus)LRC0255微球菌(Micrococcus)GO5食窦魏斯氏菌(Weissella cibaria)110金黄色葡萄球菌(Staphylococcus aureus)A70金黄色葡萄球菌(Staphylococcus aureus)A53
2 乳酸菌Ⅱ类细菌素生物合成及降解途径
乳酸菌细菌素是核糖体合成的一类肽类代谢产物。因此,它的合成首先是在核糖体上进行的,随后通过转运系统对其进行加工和运输,最后才形成具有活性的细菌素。而乳酸菌细菌素的降解则是由乳酸菌蛋白酶系统完成的,可能被水解成氨基酸,用于细菌自身利用,这将导致细菌素不能得到有效积累。
2.1 生物合成途径
通常来说,Ⅱ类细菌素的合成首先需在特定环境因素刺激下,比如信号分子浓度需达到一定阈值时,细菌素基因才开始转录。与此同时,组成细菌素的氨基酸在氨酰转运核糖核酸合成酶的参与下共价地与转运核糖核酸(transfer ribonucleic acid,tRNA)形成氨酰-tRNA,之后氨酰-tRNA结合到信使核糖核酸(messenger ribonucleic acid,mRNA)(含有细菌素合成的遗传密码,用于指导特定细菌素氨基酸序列的合成)的特殊位点上,核糖体结合到mRNA分子合成起始序列上,并由此开始读码,沿着密码序列合成前体肽。但这个前体肽不具备生物活性,需要进行加工和转运后才能形成成熟的细菌素。首先腺苷三磷酸(adenosine triphosphate,ATP)结合转运蛋白(ATP-binding cassette transporter,ABCT)的蛋白水解区域结合前体肽的引导序列,触发三磷酸腺苷(ATP)水解,随后转运蛋白的构象发生改变,导致引导序列被切除,同时在辅助蛋白的协助下,成熟的细菌素被运送至胞外(见图1)[26]。
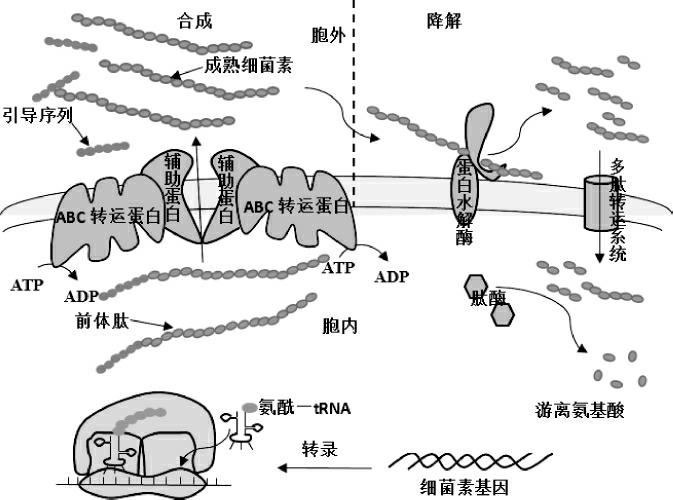
图1 乳酸菌Ⅱ类细菌素生物合成及降解途径
Fig. 1 Biosynthesis and degradation pathways of class Ⅱbacteriocins of lactic acid bacteria
前体肽的引导序列由18~27个氨基酸残基组成,被认为是细菌素加工和转运的信号肽,并且含有一个保守的双甘氨酸残基,这些双甘氨酸残基可能作为转运系统的识别信号。前体肽作为细菌素的前体物质,它的合成影响着细菌素的产量。因此,增加前体肽的合成量是提高细菌素产量一个重要策略。但是,前体肽在胞内大量积累会对细菌素的合成产生反馈抑制,虽然目前还没有明确的报道证明这种反馈抑制的存在,不过从其他一些次级代谢产物的合成过程推测(例如阿维菌素的合成受到胞内反馈抑制的影响[27]),这种反馈抑制应该存在于细菌素的合成过程。所以,在增加前体肽合成量后,将前体肽及时进行加工及运送至胞外是提高成熟细菌素产量的必要条件。
典型的Ⅱ类细菌素ABC转运蛋白含有715~724个氨基酸,并且在N端和C端具有高度的同源性,也是ABC转运蛋白发挥活性的关键部位[28]。C端含有200个末端氨基酸残基组成的保守ATP结合区域;N端是一个疏水的跨膜结构域,其中外延的150个氨基酸负责切割引导序列。VENEMA K等[29]对ABC转运蛋白的N端进行了功能研究证实了这一功能,认为N末端只参与切割,不参与转运。HAVARSTEIN L S等[30]认为,细菌素的切割和转运是一个整体的加工过程,引导序列是进行切割和释放的一个识别信号。辅助蛋白含有460个氨基酸,也具有高度的同源性,C端是一个亲水域,N端是个跨膜的疏水域,推测它具有辅助细菌素跨膜转运或加工前体肽的作用。PAL G等[31]在体外研究辅助蛋白功能时发现辅助蛋白并不参与前体肽切割,可能对成熟细菌素的跨膜转运有作用。不过,辅助蛋白具体发挥何种功能目前还不是十分清楚。
2.2 降解途径
乳酸菌细菌素的降解是由乳酸菌蛋白水解系统参与完成,这个蛋白水解系统分三个步骤对细菌素进行降解[32]。首先,胞外的细菌素在蛋白水解酶的作用下被水解成小肽(如寡肽、二肽、三肽等);之后,这些小肽通过多肽转运系统转运至胞内;最后,在胞内肽酶的作用下,小肽可能被水解成氨基酸,被菌体自身利用(见图1)。
目前,一些乳酸菌的蛋白水解酶基因已经被克隆和鉴定出来,包括乳酸乳球菌和副干酪乳杆菌的蛋白水解酶PrtP,瑞士乳杆菌的蛋白水解酶PrtH,鼠李糖乳杆菌的蛋白水解酶PrtR,嗜热链球菌的蛋白水解酶PrtS以及保加利亚乳杆菌的蛋白水解酶PrtB[32]。并且,一些乳酸菌可能还含有两种以上的蛋白水解酶,这些蛋白水解酶是细菌素降解过程中最为关键的酶。如果能使这些蛋白水解酶活性或表达量降低,可使细菌素在胞外大量积累。但是,目前对蛋白水解酶调控细菌素活性的研究报道很少,也不清楚细菌素被蛋白酶降解后的片段大小。因此,这些片段具体是通过哪个多肽转运系统进入胞内,以及这些片段在胞内是否被内肽酶降解成氨基酸,还是发挥其他特殊功能还需要深入研究。
3 代谢调控增加Ⅱ类细菌素产量的策略
一般而言,代谢调控增加Ⅱ类细菌素产量的策略可以从以下几个方面入手:增加底物浓度,提高前体物的供应;改造转运系统,解除细菌素胞内抑制;切断细菌素降解途径,加强细菌素胞外积累。
3.1 增加底物浓度,提高前体物的供应
细菌素是由核糖体合成的蛋白质或多肽类物质,因此氨基酸可作为细菌素的底物,增加其供应量可以促进细菌素前体物的积累。VUYST L[33]研究发现,向培养基中加入适量的丝氨酸、苏氨酸和半胱氨酸能使Nisin的产量提高2倍,认为这三种氨基酸作为底物直接参与Nisin的合成,从而提高Nisin的产量。并且,半胱氨酸相比其他的氨基酸促进效果更佳明显,原因可能是细菌自身对于胱氨酸合成比丝氨酸和苏氨酸更加复杂。但是VAZQUEAZ J A等[34]研究发现,只有半胱氨酸和色氨酸能够刺激Nisin的合成,这与VUYST L[33]的结果不一致,原因可能是氨基酸并不仅仅只作为细菌素的底物发挥作用,还可能发挥着其他一些功能[35]。如对细菌素合成、释放及调控过程中相关酶的诱导。尽管目前没有明确的报道证明氨基酸能够诱导细菌素合成过程中相关酶的活性,但从氨基酸对其他微生物代谢产物合成的影响猜测(如甲硫氨酸通过诱导头孢菌素C生物合成过程中异青霉素N合成酶、脱乙酰氧头孢菌素C合成酶等而产生刺激作用;色氨酸在麦角生物碱合成中作为底物和诱导物而起作用;亮氨酸在杆菌肽合成过程中起着诱导作用[36-37]),某些氨基酸能够通过诱导相关酶的活性而对细菌素的产量产生影响。猜测氨基酸可能对细菌素加工和释放过程中ABCT转运蛋白和辅助蛋白,以及细菌素的调控蛋白(信号肽、组氨酸蛋白激酶、响应调节蛋白)具有诱导作用,因为这些蛋白或酶都是细菌素形成过程中的关键蛋白或酶,它们活性增强都能够促进细菌素的合成。
目前,虽然氨基酸的添加有利于细菌素的合成已经得到证实,不过一般认为氨基酸只作为底物而起到促进作用。但是研究发现,氨基酸所起的作用并不是单纯的作为底物,还可能具有诱导关键酶的作用,并且这一作用可能超出它作为细菌素合成底物的单一作用。
3.2 改造转运系统,解除胞内反馈抑制
由核糖体合成的前体肽需要经过一系列加工和释放才能形成具有活性的细菌素,这一过程需要ABCT转运蛋白和一个辅助蛋白参与。研究表明,将这两个蛋白的基因敲出后,突变菌株完全失去了细菌素合成的能力,说明这两个蛋白对细菌素的合成具有重要的影响。此外,研究报道指出,微生物的代谢产物如果在胞内积累就会形成反馈抑制,降低该产物的合成。因此,能够及时的将胞内的产物运送出胞外,可以解除胞内的反馈抑制,提高产物的合成水平。目前,通过过表达转运系统来提高对产物的转运能力,增加代谢产物的合成量已有很多成功的案例。如QIU J等[27]将ABC转运蛋白AvtAB过表达,结果使阿维霉素的产量提高了两倍;LI M等[38]过表达麦芽糖运输型ABC转运蛋白后,依维霉素和阿维霉素的产量也分别提高。但是很少研究涉及通过改造细菌素转运系统来提高细菌素产量的报道。相信通过增加ABCT转运蛋白和辅助蛋白基因拷贝数,从而增加转运系统的表达量,解除细菌素胞内反馈抑制,是增加细菌素产量的一个重要策略。
过表达技术一般分为三个步骤:①目的基因的克隆与提取;②含目的基因过表达载体的构建及转化;③过表达产物的验证。现今,绝大部分乳酸菌细菌素的ABC转运蛋白和辅助蛋白基因已经被鉴定和克隆出来,而且具有很高的同源性,并且也有很多技术成熟的乳酸菌表达载体的出现。因此,利用过表达乳酸菌细菌素转运系统的来提高细菌素产量的策略在理论和实际造作上都是可行的,这一策略也为提高Ⅱ类细菌素产量的研究提供新的思路。
3.3 切断降解途径,加强产物胞外积累
研究显示,当乳酸菌培养到稳定期后期的时候,细菌素的活性会大幅度降低[39]。原因可能是由于在稳定期后期,环境中的营养物质缺乏,不足以满足自身需求,因此需要水解环境中的肽类物质(如细菌素)为自身提供所需的氨基酸。这就需要乳酸菌蛋白酶系统的参与。而蛋白酶水解系统中的蛋白水解酶则是水解细菌素的关键酶,也对细菌素活性的调控有着重要的作用。VUKOTIC G 等[40]研究了蛋白酶PrtP对乳球菌素LcnB活性的影响,发现敲出PrtP基因的菌株,细菌素的产量得到了很大的提高,这说明蛋白酶对细菌素的产量确实能起到调控作用。因此,可以利用基因敲除技术或添加蛋白酶抑制剂来敲除或降低蛋白酶的活性,从而切断细菌素的降解途径,提高细菌素在胞外的积累。但是,蛋白酶将细菌素水解成小肽后,是否进一步将其水解成氨基酸供自身利用还是发挥其他功能就不得而知。有一种可能是当细菌素在胞外大量积累时,由于细菌素自身不能通过细胞膜进入胞内,因此由胞外蛋白酶将其水解成小片段后运送至胞内,然后这些小肽作为反馈信号,抑制细菌素合成中某些关键酶的活性,从而导致细菌素停止合成,起到反馈抑制作用。
目前,对细菌素降解途径的研究报道较少,尤其是细菌素降解对细菌素合成调控的研究更加缺乏。但是,细菌素的水解产物不仅仅只作为细菌的营养物质被利用,还可能作为反馈抑制的信号分子调控细菌素的合成。因此,研究细菌素的降解途径,尤其是胞外蛋白酶对细菌素合成调控研究为提高细菌素产量提供一个新的策略和方向。
4 总结
乳酸菌Ⅱ类细菌素产量低,一直是限制其工业化生产的障碍之一。很多研究通过对碳源、氮源等代谢进行调控来提高细菌素产量,但是提高幅度有限,仍不能达到工业化生产要求。而利用异源表达技术来提高产量存在安全隐患,并且表达产物活性普遍较低。近些年对Ⅱ类细菌素生物合成和降解过程的深入研究,特别是对Ⅱ类细菌素基因簇研究的日益完善,使之从Ⅱ类细菌素合成和降解途径入手,通过改造细菌素生物合成及降解途径来提高产量成为可能。通过增加底物浓度,提高前体物供应;改造转运系统,解除胞内反馈抑制;切断降解途径,增加产物胞外积累等方法来增加Ⅱ类细菌素的产量。这些策略将为提高Ⅱ类细菌素产量提供新的途径和思路,也为Ⅱ类细菌素工业化生产奠定基础。
[1]REA M C,ROSS R P,COTTER P D,et al.Classification of bacteriocins from Gram-positive bacteria[M].New York:Springer,2011:29-53.
[2]ZHANG J,YANG Y,YANG H,et al.Purification and partial characterization of bacteriocin Lac-B23, a novel bacteriocin production by Lactobacillus plantarum J23,isolated from Chinese traditional fermented milk[J].Front Microbiol,2018,9(1):2165.
[3]张建志.代谢工程改造大肠杆菌、酪丁酸梭菌生产苯乳酸和正丁醇[D].北京:中国农业大学,2017.
[4]NI Z J,ZHANG X,LIU F,et al.Effect of co-overexpression of nisin key genes on nisin production improvement in Lactococcus lactis LS01[J].Probiot Antimicrob Protein,2017,9(2):204-212.
[5] GUO W L, ZHANG Y B, LU J H, et al. Optimization of fermentation medium for nisin production from Lactococcus lactis subsp. lactis using response surface methodology (RSM) combined with artificial neural network-genetic algorithm(ANN-GA)[J].Afr J Biotechnol,2013,38(9):6264-6272.
[6]DEVI S M,HALAMI P M.Genetic variation of pln loci among probiotic Lactobacillus plantarum group strains with antioxidant and cholesterollowering ability[J].Probiot Antimicrob Protein,2017,1(10):1-12.
[7] SINGH N P, TIWARI A, BANSAL A, et al. Genome level analysis of bacteriocins of lactic acid bacteria[J].Comput Biol Chem,2015,56(6):1-6.
[8] COTTER P D,HILL C, ROSS R P. Bacteriocins: developing innate immunity for food[J].Nat Rev Microbiol,2005,3(10):777-788.
[9]JOHNSEN L,FIMLAND G,NISSEN-MEYER J.The C-terminal domain of pediocin-like antimicrobial peptides(class IIa bacteriocins)is involved in specific recognition of the C-terminal part of cognate immunity proteins and in determining the antimicrobial spectrum[J]. J Biol Chem, 2005,280(10):9243-9250.
[10]UTENG M,HAUGE H H,MARKWICK P R L,et al.Three-dimensional structure in lipid micelles of the pediocin-like antimicrobial peptide sakacin P and a sakacin P variant that is structurally stabilized by an inserted C-terminal disulfide bridge[J].Biochemistry,2003,42(39):11417-11426.
[11] SPRULE T,KAWULKA K E, GIBBS A C, et al. NMR solution structure of the precursor for carnobacteriocin B2, an antimicrobial peptide from Carnobacterium piscicola[J].Eur J Biochem,2004,271(9):1748-1756.
[12]HAUGEN H S,FUMLAND G,NISSEN-MEYER J,et al.Three-dimensional structure in lipid micelles of the pediocin-like antimicrobial peptide curvacin A[J].Biochemistry,2005,44(49):16149-16157.
[13] SIMON L, FREMAUX C, CENATIEMPO Y, et al. Sakacin G, a new type of antilisterial bacteriocin[J]. Appl Environm Microbiol, 2002,68(12):6416-6420.
[14]KAUR K,ANDREW L C,WISHART D S,et al.Dynamic relationships among type IIa bacteriocins:temperature effects on antimicrobial activity and on structure of the C-terminal amphipathic α helix as a receptorbinding region[J].Biochemistry,2004,43(28):9009-9020.
[15]JIMENEZ-DIAZ R,RUIZ-BARBA J L,CATHCART D P,et al.Purification and partial amino acid sequence of plantaricin S, a bacteriocin produced by Lactobacillus plantarum LPCO10,the activity of which depends on the complementary action of two peptides[J].Appl Environm Microbiol,1995,61(12):4459-4463.
[16] MCCORMICK J K, POON A, SAILER M, et al. Genetic characterization and heterologous expression of brochocin-C,an antibotulinal,twopeptide bacteriocin produced by Brochothrix campestris ATCC 43754[J]. Appl Environm Microbiol,1998,64(12):4757-4766.
[17]FIMLAND N,ROGNE P,FIMLAND G,et al.Three-dimensional structure of the two peptides that constitute the two-peptide bacteriocin plantaricin EF[J].BBA-Protein Proteom,2008,1784(11):1711-1719.
[18]ROGENE P,FIMLAND G,NISSEN-MEYE J,et al.Three-dimensional structure of the two peptides that constitute the two-peptide bacteriocin lactococcin G[J].BBA-Protein Proteom,2008,1784(3):543-554.
[19]ROGNE P,HAUGEN C,FIMLAND G,et al.Three-dimensional structure of the two-peptide bacteriocin plantaricin JK[J].Peptides,2009,30(9):1613-1621.
[20] ASPRI M, OCONNOR P M, FIELD D, et al. Application of bacteriocin-producing Enterococcus faecium isolated from donkey milk,in the bio-control of Listeria monocytogenes in fresh whey cheese[J].Int Dairy J,2017,73(10):1-9.
[21] VIGNOLO G, FADDA S, DE KAIRUZ M N, et al. Control of Listeria monocytogenes in ground beef by'Lactocin 705',a bacteriocin produced by Lactobacillus casei CRL 705[J].Int J Food Microbiol,1996,29(2):397-402.
[22]MARTIN-VISSCHER L A,GONG X,DUSZYK M,et al.The three-dimensional structure of carnocyclin A reveals that many circular bacteriocins share a common structural motif[J].J Biol Chem,2009,284(42):28674-28681.
[23] JIMENEZ M, BARRACHI-SACCILOTTO A C, VALDIVIA E, et al.Design,NMR characterization and activity of a 21-residue peptide fragment of bacteriocin AS-48 containing its putative membrane interacting region[J].J Pept Sci,2005,11(1):29-36.
[24]HENG N C K,WESCOMBE P A,BURTON J P,et al.The diversity of bacteriocins in Gram-positive bacteria[M]. New York: Springer, 2007:45-92.
[25]NISSEN-MEYER J,ROGENE P,OPPEGARD C,et al.Structure-function relationships of the non-lanthionine-containing peptide (class II)bacteriocins produced by gram-positive bacteria [J].Curr Pharmaceut Biotechnol,2009,10(1):19-37.
[26]吴清平,黄静敏,张菊梅,等.细菌素的合成与作用机制[J].微生物学通报,2010,37(10):1519-1524.
[27]QIU J,ZHUO Y,ZHU D,et al.Overexpression of the ABC transporter AvtAB increases avermectin production in Streptomyces avermitilis[J].Appl Microbiol Biot,2011,92(2):337-345.
[28]DRIDER D,FIMLAND G,HECHARD Y,et al.The continuing story of class IIa bacteriocins[J]. Microbiol Molr Biol Rev, 2006, 70(2): 564-582.
[29] VENEMA K, KOK J, MARUGG J D, et al. Functional analysis of the pediocin operon of Pediococcus acidilactici PAC1.0:PedB is the immunity protein and PedD is the precursor processing enzyme[J]. Mol Microbiol,1995,17(3):515-522.
[30]HAVARSTEIN L S,DIEP D B,NES I F.A family of bacteriocin ABC transporters carry out proteolytic processing of their substrates concomitant with export[J].Mol Microbiol,1995,16(2):229-240.
[31]PAL G,SRIVASTAVA S.In vitro activity of a recombinant ABC transporter protein in the processing of plantaricin E pre-peptide[J]. Arch Microbiol,2015,197(6):1-7.
[32]SAVIJOKI K,INGMER H,VARMANEN P.Proteolytic systems of lactic acid bacteria[J].Appl Microbiol Biotechnol,2006,71(4):394-406.
[33]VUYST L.Nutritional factors affecting nisin production by Lactococcus lactis subsp.lactis NIZO 22186 in a synthetic medium[J]. J Appl Bacteriol,1995,78(1):28-33.
[34] VAZQUEAZ J A, CABO M L, GONZALEZ M P, et al. The role of amino acids in nisin and pediocin production by two lactic acid bacteria:a factorial study[J].Enzyme Microb Technol,2004,34(3):319-325.
[35] YI H,HAN X, YANG Y, et al. Effect of exogenous factors on bacteriocin production from Lactobacillus paracasei J23 by using a resting cell system[J].Int J Mol Sci,2013,14(12):24355-24365.
[36]廖福荣.甲硫氨酸在头孢菌素C 生物合成中的作用[J].国外医药(抗生素分册),2000,21(6):255-257,265.
[37]胡春霞.氮,磷和色氨酸对醉马草内生真菌共生体生长及麦角生物碱含量的影响[D].兰州:兰州大学,2013.
[38]LI M,CHEN Z,ZHANG X,et al.Enhancement of avermectin and ivermectin production by overexpression of the maltose ATP-binding cassette transporter in Streptomyces avermitilis[J]. Bioresource Technol,2010,101(23):9228-9235.
[39]YANG E,FAN L,YAN J,et al.Influence of culture media,pH and temperature on growth and bacteriocin production of bacteriocinogenic lactic acid bacteria[J].AMB Express,2018,8(1):10.
[40]VUKOTIC G,MIRKOVIC N,JOVCIC B,et al.Proteinase PrtP impairs lactococcin LcnB activity in Lactococcus lactis BGMN1-501: new insights into bacteriocin regulation[J].Front Microbiol,2015(6):1-8.