黄酒,作为世界三大古酒之一,有着丰富的营养成分,且酒度较低,故既可用做食品调味品,也能用做传统健康食品[1]。目前,黄酒的产地和消费主要集中在浙江、江苏两带,且其产量逐年可观,产品越来越多样化,包装更多元化。随着国内居民生活水平与健康意识的不断提高,健康、绿色、营养的消费观念已成为主流,黄酒不断更新发展[2]。广东客家黄酒中含有丰富的维生素族,对女性来说,长期饮用有很好的美容抗衰老效果。由于客家黄酒酒精度较为适中,还可作为药引子加以使用。目前在广东客家黄酒的产地主要集中在河源梅州一带,家家户户都会酿造属于自己的黄酒,不仅可以自己饮用,还可作为特产赠送给亲朋好友;客家人称黄酒为老酒,在当地,客家黄酒也被称为“月子酒”或者“鸡子酒”,适量饮用能够很好地让产妇在坐月子期间恢复元气,更加亮眼美丽[3]。有研究表明是黄酒之所以具有的较高抗氧化力,主要源于其所含的几种活性酚物质,酚物质易消耗氧,降低氧含量[4]。有报道表明,黄酒可发生美拉德反应,其产物有一定的抗氧化功能[5],但是由于缺乏系统科学的探究,故而黄酒特有的保健功效尚未被证实[6]。本实验对黄酒的抗氧化性进行研究,以广东客家黄酒为原料来探究其体外的抗氧化能力,从而为更深层次的探究广东客家黄酒提供了有力的基础,有助于人们能科学地认识黄酒的保健功能,也为更深入研究黄酒的功能打下基础。
1 材料与方法
1.1 材料与试剂
牛血清蛋白(bovine serumal bumin,BSA)、2,2'-联氮-双(3-乙基-苯并噻唑啉-6-磺酸)二铵盐(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonate)diammonium,ABTS)、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、维生素E(vitamin E,VE)(均为分析纯):美国Sigma公司;邻苯三酚、乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)、没食子酸丙酯(propyl gallate,PG)、3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(均为分析纯):阿拉丁试剂(上海)有限公司;广东客家黄酒:梅州市龙轩实业有限公司;福林酚试剂盒:合肥博美生物科技有限公司。
1.2 仪器与设备
TU-1901型紫外可见分光光度计:北京普析通用仪器有限公司;GM-1.0A隔膜真空泵:天津市津腾实验设备有限公司;DK-98II型电热恒温水浴锅:天津市泰斯特仪器有限公司;KDN-103F型自动定氮仪、308型消化炉:上海纤检仪器有限公司;TG16-WS台式高速离心机:湖南湘仪实验室仪器开发有限公司;LGJ-12型真空冷冻干燥机:北京松源华兴生物技术有限公司。
1.3 实验方法
1.3.1 ABTS+自由基清除能力[7]
ABTS+溶液的配制:采用2.45 mmol/L过硫酸钾溶液溶解0.384 1 g ABTS,配制7 mmol/L的ABTS+储备液,室温、避光条件下静置14 h待用。用10 mmol/L、pH为7.4磷酸盐缓冲溶液(phosphate buffered solution,PBS)稀释 ABTS+储备液,使其吸光度值在波长734 nm处达0.700。
样品测定:为评价广东客家黄酒的ABTS+的清除能力,以VE作为阳性对照,在20μL、40μL、60μL、80μL的黄酒中分别加入水至4 mL,即体积分数为5μL/mL、10μL/mL、15μL/mL、20μL/mL,加入到等体积的ABTS+充分混匀30 s,空白对照为4 mL ABTS+溶液和4 mL蒸馏水,分别测定于波长734 nm处的吸光度值。ABTS+的清除率计算公式如下:
式中:U为ABTS+的清除率,%;U0为空白对照的吸光度值;
Ux为待测样品的吸光度值。
1.3.2 DPPH自由基清除能力[7-8]
为评价广东客家黄酒的DPPH自由基清除能力,在0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL的黄酒中分别加入水至2 mL,即体积分数为0.05 mL/mL、0.1mL/mL、0.15 mL/mL、0.2 mL/mL、0.25 mL/mL,加入等体积的浓度为0.1 mmol/L的DPPH溶液,混匀后在室温下避光反应0.5 h,取上清液在波长517 nm处测定吸光度值;空白对照组为2 mL的无水乙醇和2 mL样品液,以100μg/mL的VE溶液作为阳性对照。DPPH自由基清除率计算公式如下:
式中:X为DPPH自由基的清除率,%;A0为乙醇溶液替代样液的吸光度值;Ax为待测样品的吸光度值;Ax0为空白对照组的吸光度值。
1.3.3 超氧阴离子自由基清除能力[7-9]
在0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL的黄酒分别加入水至1 mL,即体积分数为0.1 mL/mL、0.2 mL/mL、0.3 mL/mL、0.4 mL/mL、0.5 mL/mL,加入pH为8.2的Tris-HCl溶液5.0 mL,于25℃条件下保温20 min后立即加入相同温度的50 mmol/L邻苯三酚溶液1 mL,摇匀,在25℃条件下恒温水浴继续保持5 min,再加8 mol/L HCl溶液1 mL终止反应。在波长325 nm处测出各样品的吸光度值,由此算出邻苯三酚溶液的吸光度值随着时间的变化率。用超纯水调零,以100μg/mL没食子酸溶液为阳性对照。超氧阴离子自由基清除率计算公式如下:
式中:X为超氧阴离子的清除率,%;A 0为蒸馏水代替样液的吸光度值,Ax0为蒸馏水代替邻苯三酚溶液所得本底的吸光度值;Ax为待测样品的吸光度值。
1.3.4 羟自由基清除能力[10-11]
在0.05 mL、0.10 mL、0.20 mL、0.30 mL的黄酒中分别加入水至1 mL,即体积分数为0.05 mL/mL、0.10 mL/mL、0.20 mL/mL、0.30 mL/mL,分别加入2.25 mmol/L的FeSO4、9 mmol/L的水杨酸-乙醇溶液和8.8 mmol/L H2O2各1 mL,摇匀,在37℃条件下静置30 min,以超纯水调零,测出波长510 nm处的样品吸光度值[9]。用2 mL蒸馏水作为空白,以100μg/mL VE溶液作为阳性对照[10]。羟自由基清除率计算公式如下:
式中:X为羟自由基清除率,%;Ax为样品液吸光度值;Ax0为蒸馏水代替H2O2所得本底的吸光度值;A 0为蒸馏水代替样液的吸光度值。
1.3.5 还原能力测定[12-13]
在0.1 mL、0.2 mL、0.3 mL、0.4 mL、0.5 mL的黄酒中分别加入水至1 mL,即体积分数为0.1 mL/mL、0.2 mL/mL、0.3 mL/mL、0.4 mL/mL、0.5 mL/mL,将样品与pH值为6.6、浓度为0.2 mol/L、体积为2.5 mL的磷酸和30 mmol/L铁氰化钾2.5 mL混合,在50℃水浴条件中进行反应,20 min后加入0.6 mol/L三氯乙酸(trichloroacetic acid,TCA)2.5 mL并混匀。取2.5 mL的混合液,与2.5 mL蒸馏水、0.5 mL 6 mmol/L FeCl3混合,测出波长700 nm处吸光度值,以100μg/mL的VE溶液作为阳性对照。
1.3.6 测定金属离子鳌合能力[14-16]
在0.235 mL、0.47 mL、0.705 mL、0.94 mL的黄酒分别加入水至4.7 mL,即体积分数为0.05 mL/mL、0.10 mL/mL、0.20 mL/mL、0.30 mL/mL,分别与2 mmol/L的FeCl2溶液0.1 mL、5 mmol/L菲啰嗪(Ferrozine)溶液0.2 mL反应,静置20 min后,测出562 nm处吸光度值,以1 mmol/L EDTA作为阳性对照。吸光度值越高,则反映待测样品的金属离子鳌合能力越大,其计算公式如下:
式中:X为金属离子螯合能力,%;Ax为样品溶液吸光度值;Ax0为用蒸馏水替代Ferrozine溶液吸光度值;A0为用蒸馏水替代样品吸光度值。
2 结果与分析
2.1 ABTS+清除能力
广东客家黄酒对ABTS+的清除率,结果见图1。由图1可知,随着黄酒体积分数在5~20μL/mL范围的增加,黄酒对ABTS+清除率随之增加,并当广东客家黄酒添加量增至20μL/mL时其ABTS+清除率与VE相当。VE清除ABTS+的半抑制浓度(50%inhibiting concentration,IC50)值为(6.84±0.04)μL,而广东客家黄酒清除ABTS+的IC50值为(6.83±0.07)μL。结果表明,广东客家黄酒的ABTS+清除率与VE基本相当。
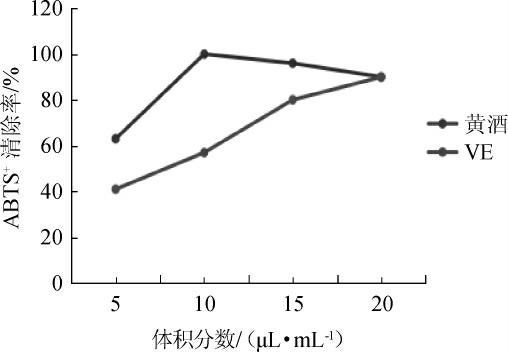
图1 广东客家黄酒清除ABTS+自由基能力
Fig.1 Scavenging ability of Guangdong Hakka Huangjiu on ABTS+free radical
2.2 DPPH自由基清除能力
广东客家黄酒与VE对DPPH自由基的清除率,结果见图2。由图2可知,当黄酒体积分数为0.05~0.15 mL/mL时,广东客家黄酒对DPPH自由基的清除能力低于VE;当黄酒体积分数为0.2 mL/mL,二者对DPPH自由基的清除能力相当;当黄酒的体积分数超过0.2 mL/mL之后,广东客家黄酒对DPPH自由基的清除能力有所下降。广东客家黄酒及VE的IC50值分别为(0.14±0.02)mL、(0.14±0.01)mL。结果表明,广东客家黄酒的ABTS+清除率与VE基本相当。
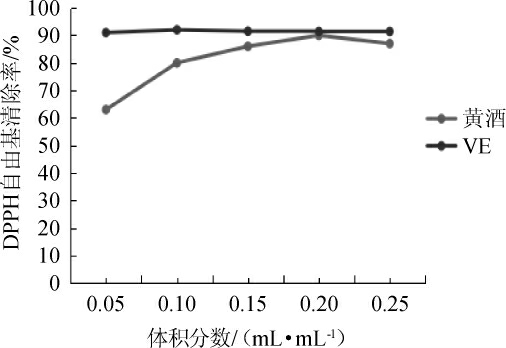
图2 广东客家黄酒清除DPPH自由基能力
Fig.2 Scavenging ability of Guangdong Hakka Huangjiu on DPPH free radical
2.3 超氧阴离子自由基清除能力
超氧阴离子自由基具有毒性,能使机体发生氧中毒,引发多种疾病[17]。广东客家黄酒与没食子酸对超氧阴离子自由基清除率,结果见图3。由图3可知,随着黄酒体积分数在0.1~0.5 mL/mL范围的增加,黄酒对超氧阴离子自由基清除率随之增加,但始终高于没食子酸。广东客家黄酒和没食子酸清除超氧阴离子自由基IC50值分别为(0.27±0.05)mL和(0.53±0.01)mL。结果表明,广东客家黄酒对超氧阴离子自由基清除率高于没食子酸。
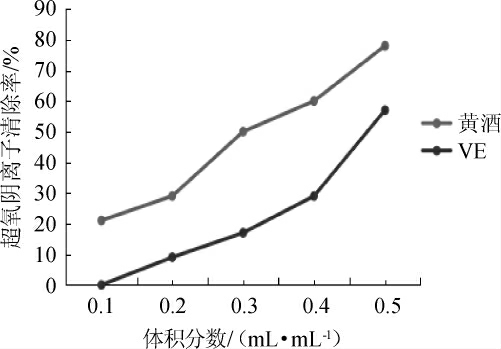
图3 广东客家黄酒清除O2-·能力
Fig.3 Scavenging ability of Guangdong Hakka Huangjiu on superoxide anion free radical
2.4 羟自由基清除能力
羟自由基能破坏机体的DNA、核酸等生命物质,从而引发机体的多种疾病[18]。广东客家黄酒与VE对羟自由基清除率,结果见图4。由图4可知,随着黄酒体积分数在0.05~0.20 mL/mL范围内增加,广东客家黄酒和VE清除羟自由基的能力都在上升并清除率相当。在黄酒体积分数>0.2 mL/mL之后,黄酒清除羟自由基的能力有所下降。广东客家黄酒与VE清除羟自由基的IC50值分别为(0.16±0.09)mL和(0.15±0.09)mL。结果表明,广东客家黄酒的羟自由基清除率与VE基本相当。
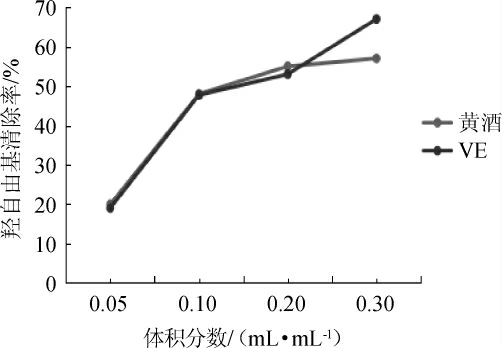
图4 广东客家黄酒清除OH-·能力
Fig.4 Scavenging ability of Guangdong Hakka Huangjiu on hydroxyl free radical
2.5 还原能力
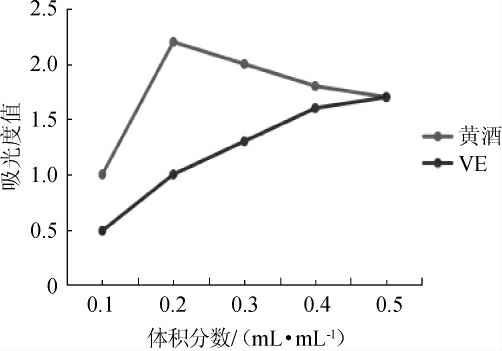
图5 广东客家黄酒还原能力
Fig.5 Reducing power of Guangdong Hakka Huangjiu
待测样品的吸光度值可与其还原能力有关[19]。广东客家黄酒与VE还原能力,结果见图5。由图5可知,对比广东客家黄酒、VE的吸光度值变化曲线可知,当黄酒体积分数>0.3 mL/mL以后,广东客家黄酒的还原能力与VE相当。结果表明,广东客家黄酒的还原能力与VE相当。
2.6 金属离子鳌合能力
当有其他相互竞争、能发生反应的络和剂存在时,会使Fe2+与Ferrozine溶液反应形成的物质颜色变淡[20]。广东客家黄酒与EDTA对金属离子螯合能力,结果见图6。由图6可知,金属离子的螯合能力最高,广东客家黄酒IC50值为(1.61±0.01)mL,相比于EDTA(IC50值为(0.14±0.02)mL),其金属离子螯合能力甚小。结果表明,广东客家黄酒的金属离子螯合能力低于EDTA。
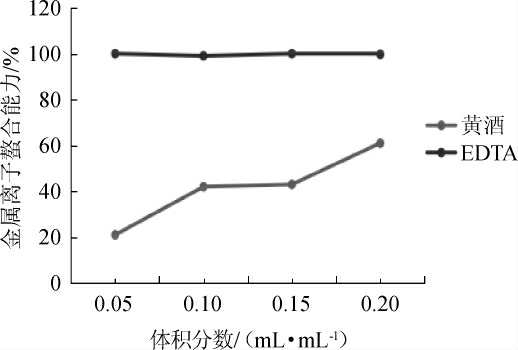
图6 广东客家黄酒的金属鳌合能力
Fig.6 Metal ion chelating ability of Guangdong Hakaa Huangjiu
3 结论
经过试验证明,广东客家黄酒有着较好的抗氧化作用,不但还原能力强,对ABTS+自由基、DPPH自由基、超氧阴离子自由基和羟自由基等的清除作用明显。结果表明,客家黄酒清除ABTS+、DPPH、O2-、OH自由基及金属离子的螯合能力的IC50值分别为(6.83±0.07)μL、(0.14±0.02)mL、(0.27±0.05)mL、(0.16±0.09)mL及(1.61±0.01)mL,客家黄酒还原力为2.1。结果表明广东客家黄酒有着较好的体外抗氧化性能。
[1]倪赞.中国黄酒保健功能的研究[D].杭州:浙江大学,2006.
[2]孟如杰.黄酒中抗氧化活性物质的研究[D].无锡:江南大学,2008.
[3]冯爱军.广东客家娘酒中风味物质研究[D].福州:福建农林大学,2011.
[4]阙斐.黄酒的抗氧化活性及其中的酚类物质[D].杭州:浙江大学,2006.
[5]孙常雁.乳清蛋白肽美拉德反应产物的制备及其抗氧化作用机理研究[D].哈尔滨:东北农业大学,2014.
[6]SRIDEVI C,CHAKRABORTY M K.Extractable protein from tobacco and aspects of its nutritional quality[J].Liquor Making,1985,11(1):19-28.
[7]PUŠKAŠ V,JOVIC′S,ANTOV M,et al.Antioxidative activity of red wine with the increased share of phenolic compounds from solid parts of grape[J].Chem Ind Chem Eng Quart,2010,16(1):65-71.
[8]孔美兰,刘谋泉,张福平,等.超声波提取杨梅色素及其清除超氧阴离子作用[J].食品工业,2015,36(1):58-62.
[9]韩少华,朱靖博,王妍妍.邻苯三酚自氧化法测定抗氧化活性的方法研究[J].中国酿造,2009,28(6):155-157.
[10]曹龙辉.广东客家黄酒抗氧化性及其中抗氧化肽的研究[D].广州:仲恺农业工程学院,2015.
[11]LUQMAN S,KUMAR R,et al.Attenuation of hydroxyl radical formation by extracted constituent of Moringa oleifera Lam[J].Curr Chem Biol,2011,5(3):213-218.
[12]谢广发,朱成钢,胡志明,等.黄酒的体外抗氧化性及其机理研究[J].食品与发酵工业,2005,2(10):5-8.
[13]郭婉.清爽型银耳黄酒酿造关键工艺及其体外抗氧化研究[D].福州:福建农林大学,2014.
[14]GUZMAN-MENDZE B,JARAMILLO-FLORES M E,CHEL-GUERRERO L,et al.Comparison of physicochemical properties,antioxidant and metal-chelating activities of protein hydrolysates from Phaseolus lunatus and hard-to-cook Phaseolus vulgaris[J].Int J Food Sci Technol,2014,49(8):1859-1868.
[15]任娜,郭丽萍,刘玉环,等.国产葡萄酒清除自由基作用的研究[J].食品科学,2009,30(15):90-93.
[16]林燕如,丁利君.番石榴叶中黄酮类物质提取及抗氧化性研究[J].现代食品科技,2007(23)10:58-60.
[17]陈成,殷子建,徐速.浅析黄酒的历史及营养价值[J].酿酒,2002,29(1):2-3.
[18]MOHAMMADIM,KARR A L.Superoxide anion generation in effective and ineffective soybean root nodules[J].J Plant Physiol,2001,158(8):1023-1029.
[19]PATRICIA V,EDUARDA F,FELIX C,et al.Antioxidant activity of Hypericum androsaemum infusion:scavenging activity against superoxide radical,hydroxyl radical and hypochlorous acid[J].Biol Pharm Bull,2002,25(10):1320-1323.
[20]宋以玲.黄酒原料和菌种与发酵工艺对抗氧化活性的影响[D].扬州:扬州大学,2012.