利用耐受性酵母生产乙醇在成本和便利性方面具有一定的优势,如耐酸酵母在酸性条件下(pH<4)发酵产乙醇可最大限度地减少细菌污染的风险和降低消毒的成本[1-3]。另外,酵母对盐的耐受性(如硫酸钠)也是工业生产生物乙醇和酿酒业的重要研究内容之一。产乙醇酵母菌包括酿酒酵母(Saccharomyces cerevisiae)和非酿酒酵母(non-Saccharomyces),国内外对酿酒酵母的乙醇、酸、盐、糖胁迫已有广泛的研究[4-8]。大多数酿酒酵母能在pH 2.5~8.5生长,但它们属于嗜酸性生物,在酸性条件下生长会更好,其生长的最适pH范围为pH 4.0~6.0。在葡萄酒酿造期间,酿酒酵母常在发酵开始阶段受到低pH胁迫。非酿酒酵母对环境胁迫的耐受性研究,主要集中在对一些毕赤酵母(Pichia pastoris)、假丝酵母(Candida)和汉森酵母(Hansenula polymorpha)的研究[9-10]。LIC等[11]研究毕赤酵母A16对金属锌的耐受性,结果表明,毕赤酵母A16可以在0.5 mmol/L锌环境中去除96.09%的锌;LIC等[12]研究毕赤克鲁维酵母(Pichia kluyver)对多种盐和高温的耐受性,结果表明,毕赤克鲁维酵母可以在44 ℃和0.1 mol/L KNO3、Na2SO4以及0.2 mol/L的NaCl、KCl、NaNO3、K 2SO4、MgCl2条件下正常生长,生长量达到3.64 g/L。
研究发现有些种类的东方伊萨酵母比酿酒酵母具有高的耐受性,如耐高温、耐酸碱等[13-16],因此在工业发酵生产生物乙醇和丁二酸上有着极其重要的地位[17]。MIAO Y等[16]利用高通量转录组对东方伊萨酵母耐乙醇的能力进行研究,结果表明,东方伊萨酵母耐受10%vol乙醇。KOUTINASM等[15]研究发现,东方伊萨酵母菌MF-121在含高浓度硫酸钠的酸性介质(pH=2.0)中或在高温(温度为43℃)条件下能够产生大量的乙醇,具有较好的耐受性。
前期实验已对分离自甜酒酿的东方伊萨酵母FJ-J-3进行了耐乙醇、耐高温的研究[18],发现菌株FJ-J-3能够耐受16%vol的初始乙醇含量,但是不能耐高温。为了进一步了解菌株FJ-J-3对环境条件的耐受性,对该菌株进行了pH和硫酸钠(Na2SO4)的耐受性研究,为菌株发酵生产乙醇的进一步开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
东方伊萨酵母菌(Issatchenkia orientalis)FJ-J-3:本实验室分离自甜酒曲。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)培养基[19]:葡萄糖20 g,酵母浸粉10 g,蛋白胨20 g,琼脂粉32 g,蒸馏水定容至1 L,115℃灭菌15 min。
液体YPD培养基:YPD培养基中不加琼脂粉。
发酵培养基:葡萄糖20 g,酵母浸粉10 g,蛋白胨20 g,蒸馏水定容至1 L,115℃灭菌20 min。
胁迫发酵培养基:葡萄糖50 g,酵母浸粉10 g,蛋白胨20 g,蒸馏水定容至1 L,115 ℃灭菌15 min后,用H2SO4和NaOH调培养基的pH值分别为2.0、4.0、6.0、8.0。在不同pH条件下分别配制Na2SO4含量分别为2%、4%、6%的培养基,以不加Na2SO4的培养基为对照。
1.1.3 试剂
酵母浸出粉(生化试剂):英国OXOID公司;蛋白胨、葡萄糖(均为生化试剂):北京鸿润宝顺科技有限公司;硫酸钠(Na2SO4)(分析纯):上海影佳实业发展有限公司。
1.2 仪器与设备
GC-2010气相色谱(gas chromatography,GC)仪(配带氢火焰离子化检测器(flame ionization detector,FID)、微机工作站、RTX R-5色谱柱(30 m×0.32 mm×0.5μm)):日本岛津公司。GN-9080隔水式恒温培养箱:上海精宏实验设备有限公司;HNY-2102c恒温培养振荡器:天津欧诺仪器股份有限公司;H.H.S-214B电热恒温水浴锅:上海医疗器械股份有限公司;H2050R台式高速冷冻离心机:湖南长沙湘仪离心机仪器有限公司;UV-5500可见光分光光度计:上海元析仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌锅:上海申安医疗器械厂。
1.3 方法
1.3.1 菌种活化
将保藏的东方伊萨酵母菌(Issatchenkia orientalis)FJ-J-3解冻后,划线于YPD固体培养基上,28℃条件下培养24 h后重复活化一次。在活化好菌种的培养基上挑取单菌落特征明显的I.orientalis FJ-J-3接种于装有25 mL YPD液体培养基的100 mL锥形瓶中,于28℃、170 r/min条件下培养至OD600 nm值=0.4时,10 000 r/min、4 ℃条件下离心10 min,弃上清,用5 mL无菌水洗涤菌体两次并制备OD600 nm值=1.0的种子液。
1.3.2 pH及盐胁迫对酵母菌生长的影响
取1 mL种子液分别接种于16种YPD胁迫发酵培养基中,装液量为25 mL/100 mL,于28℃、170 r/min条件下培养,每隔12 h定时取样测定I.orientalis FJ-J-3的OD600 nm值和乙醇含量。
1.3.3 测定方法
菌体生物量:利用分光光度计法,在波长600 nm处测定其吸光度值。
乙醇含量:按照参考文献[20]的方法进行测定。
2 结果与分析
2.1 pH为2.0条件下不同盐含量对菌株FJ-J-3的影响
当培养基pH=2.0时,东方伊萨酵母FJ-J-3在不同的Na2SO4的含量培养基中的生长状况及乙醇含量结果见图1。
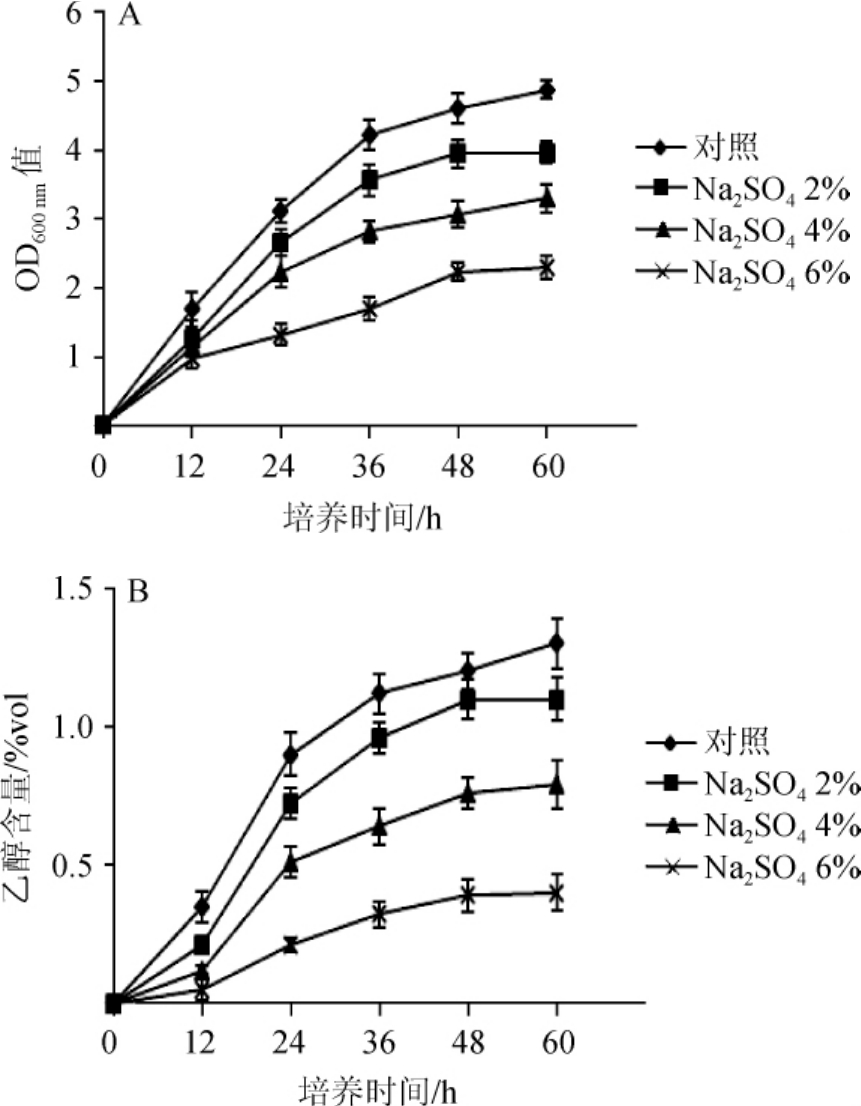
图1 菌株FJ-J-3在p H为2.0的不同Na2SO4含量培养基中的生长曲线(A)及乙醇含量(B)
Fig.1 Growth curve(A)and ethanol content(B)of strain FJ-J-3 in medium with pH 2.0 and different Na2SO4 contents
由图1A可知,在培养基pH=2.0的条件下,菌株FJ-J-3在不含Na2SO4的对照组培养基中生物量最大,OD600 nm值达到4.87;随着Na2SO4含量的增加细胞生长越慢,在含有6%Na2SO4的盐培养基中,菌株FJ-J-3的生长严重受到抑制,最大OD600 nm值=2.3。由图1B可知,在培养基pH=2.0的条件下,Na2SO4含量会影响菌株FJ-J-3发酵产乙醇,Na2SO4含量越高,乙醇产量越低。即当Na2SO4含量为0、2%、4%、6%时,菌株FJ-J-3培养到60 h时乙醇产量分别为1.3%vol、1.1%vol、0.79%vol、和0.4%vol。由此可见,菌株FJ-J-3在pH=2.0的培养基中Na2SO4盐耐受较弱。
2.2 pH为4.0条件下不同盐含量对菌株FJ-J-3的影响
当培养基pH=4.0时,东方伊萨酵母FJ-J-3在不同的盐含量培养基中的生长状况及乙醇含量结果见图2。
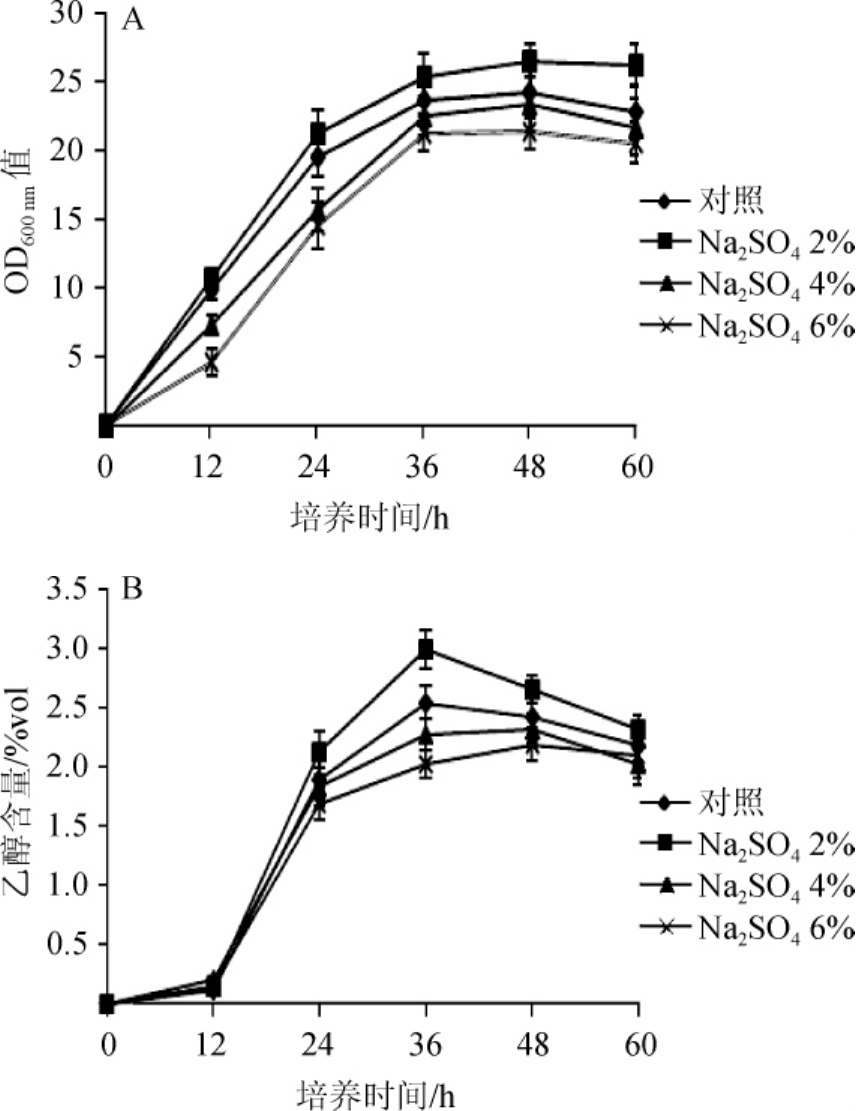
图2 菌株FJ-J-3在pH为4.0的不同Na2SO4含量培养基中的生长曲线(A)及乙醇含量(B)
Fig.2 Growth curve(A)and ethanol content(B)of strain FJ-J-3 in medium with pH 4.0 and different Na2SO4 contents
由图2A可知,菌株FJ-J-3在培养基pH=4.0的条件下,当Na2SO4含量为2%时,菌株FJ-J-3的OD600 nm值最大,且最大OD600 nm值为26.5;对照培养基中菌株FJ-J-3的最大OD600nm值为24.1;当Na2SO4含量为4%、6%时,菌株FJ-J-3的最大OD600nm值分别为23.2、21.3。由此得出,菌株FJ-J-3在偏酸(pH=4.0)的环境中生长良好,且在这种环境中,菌株对盐的耐受性增加,即使在6%盐含量的情况下菌株仍能旺盛生长,说明一定的酸可以增加菌株对盐的胁迫的耐受性。
由图2B可知,菌株FJ-J-3在培养基pH=4.0的条件下,当培养基中Na2SO4含量为2%时,菌株FJ-J-3的乙醇产量最大,在发酵36 h时乙醇产量达到最大(2.99%vol),而对照组、Na2SO4含量分别为4%、6%的条件下乙醇产量则分别为2.54%vol、2.27%vol、2.02%vol。由此得出,在偏酸(pH=4.0)的环境中少量的盐可以促进菌株发酵产乙醇,而高浓度的盐对菌株的乙醇发酵有一定的影响。
2.3 pH为6.0条件下不同盐含量对菌株FJ-J-3的影响
当培养基pH=6.0时,东方伊萨酵母FJ-J-3在不同的盐含量培养基中的生长状况及乙醇含量结果见图3。
由图3A可知,当培养基pH=6.0时,菌株FJ-J-3的生长状况受盐浓度影响较小。当Na2SO4含量为6%时,菌株FJ-J-3生长最好,最大OD600 nm值为27.5;对照组的最大OD600 nm值为24.3;当Na2SO4含量为2%、4%时,菌株FJ-J-3的最大OD600nm值分别为22.6、21.2。因菌株FJ-J-3的最佳生长pH为6.0,因此在这种环境中菌株的生长受盐胁迫的影响较小,这种最佳的pH使得菌株能够耐受较高的Na2SO4含量。
由图3B可知,在pH=6.0的培养基中,当Na2SO4含量为6%时,菌株FJ-J-3的乙醇产量也最高,达到2.93%vol;对照组中菌株FJ-J-3的最高乙醇产量达到2.55%vol;当Na2SO4含量为2%、4%时,菌株FJ-J-3的最高乙醇产量分别为1.97%vol、1.76%vol。说明在pH=6.0的条件下,菌株FJ-J-3对Na2SO4的耐受性增加。
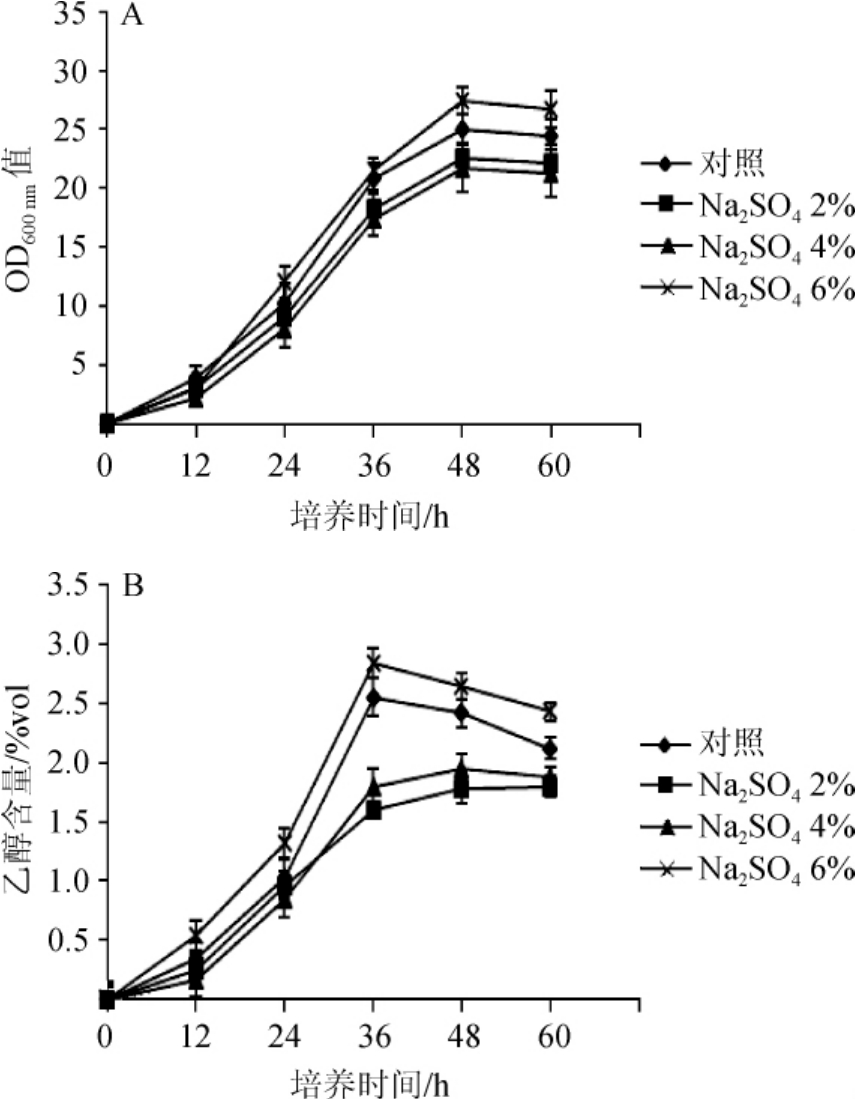
图3 菌株FJ-J-3在pH为6.0的不同Na2SO4含量培养基中的生长曲线(A)及乙醇含量(B)
Fig.3 Growth curve(A)and ethanol content(B)of strain FJ-J-3 in medium with pH 6.0 and different Na2SO4 contents
2.4 pH为8.0条件下不同盐含量对菌株FJ-J-3的影响
当培养基pH=8.0时,东方伊萨酵母FJ-J-3在不同的盐含量培养基中的生长状况及乙醇含量结果见图4。
由图4A可知,当培养基pH=8.0时,菌株FJ-J-3的生长受到一定的影响,在前12 h菌株生长缓慢,分析原因可能是由于培养基的碱性,导致菌株不能很快进入生长阶段,需要一段时间的适应和调整。12 h以后菌株逐渐适应环境,进入生长期,然而菌株的生长量与pH=4.0和pH=6.0环境的生长量仍然有所不同。当Na2SO4含量为2%时,菌株FJ-J-3的OD600 nm值最大,为20.9;其次为对照(OD600 nm为18.6)。当Na2SO4含量为4%和6%时,菌株FJ-J-3的最大OD600 nm值分别为17.9和15.4。由此可见,在6%盐浓度培养基中菌体的生长受影响较大。这说明偏碱的环境菌株对盐的耐受性减弱。
由图4B可知,由于菌体生长受到影响,所以在培养基pH=8.0时,菌株FJ-J-3在不同盐浓度培养基中的乙醇产量也受到影响。菌株FJ-J-3在Na2SO4含量为2%的培养基中乙醇产量高于其他3组,乙醇产量最高达到2.34%vol。由此得出,在偏酸或偏碱的环境中,少量的盐可以提高菌株发酵产乙醇的能力。
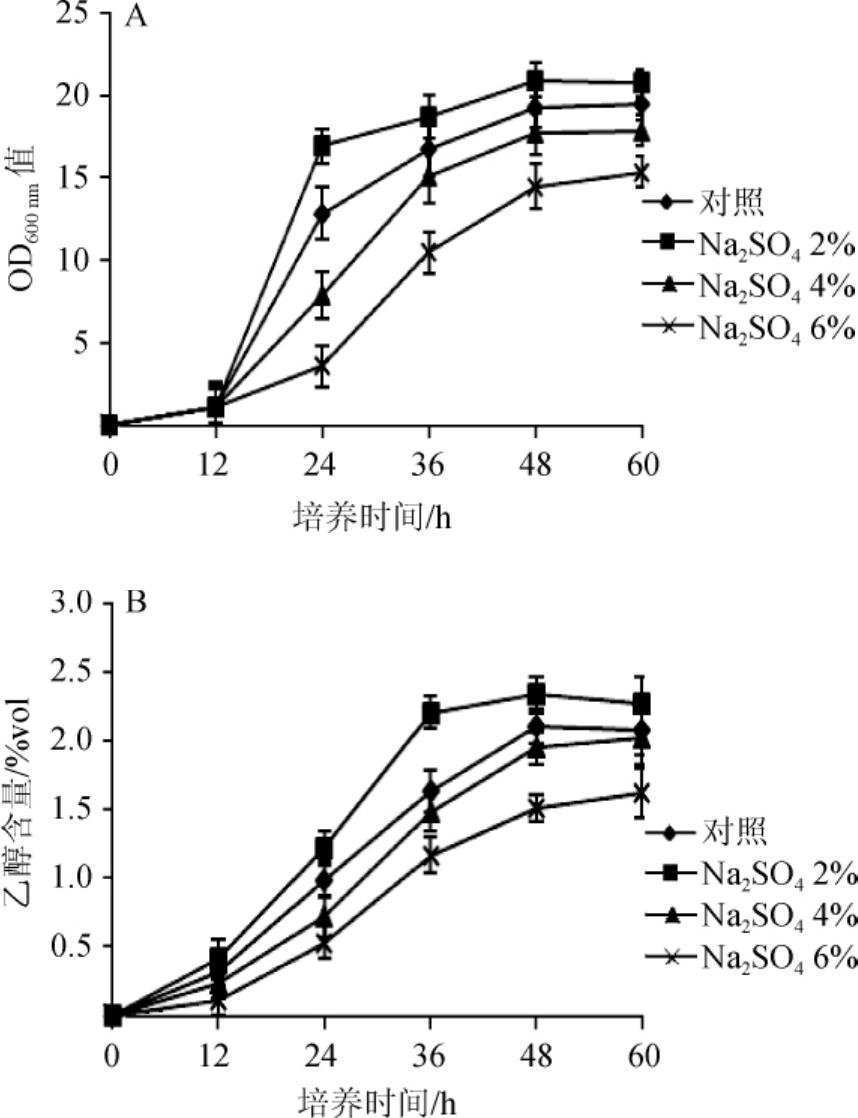
图4 菌株FJ-J-3在pH为8.0的不同Na2SO4含量培养基中的生长曲线(A)及乙醇含量(B)
Fig.4 Growth curve(A)and ethanol content(B)of strain FJ-J-3 in medium with pH=8.0 and different Na2SO4 contents
3 结论
该研究对东方伊萨酵母(Issatchenkia orientalis)FJ-J-3的pH、盐耐受性进行了研究。结果表明,东方伊萨酵母FJ-J-3对环境胁迫有一定的耐受性,当pH为2.0、不含Na2SO4时,OD600 nm值(4.8)和乙醇产量(1.3%vol)最高;当pH为4.0、Na2SO4含量为2%时,OD600 nm值(26.5)和乙醇产量(3.0%vol)最高;当pH为6.0、Na2SO4含量为6%时,OD600 nm值(27.5)和乙醇产量(2.9%vol)最高;当pH为8.0、Na2SO4含量为2%时,OD600 nm值(20.9)和乙醇产量(2.3%vol)最高。在pH=4.0和pH=6.0培养条件下具有较好的盐耐受性,在pH=2.0和pH=8.0的条件下,菌株FJ-J-3对盐的耐受性减弱。本研究为菌株发酵生产乙醇的进一步开发利用提供理论依据。
[1]张强,郭元,韩德明,等.酿酒酵母乙醇耐受性的研究进展[J].化工进展,2014,33(1):187-191.
[2]OLOFSSON K,BERTILSSON M,GUNNAR L,et al.A short review on SSF-an interesting process option for ethanol production from lignocellulosic feedstocks[J].Biotechnol Biofuels,2008,1(1):7.
[3]BALAT M,BALAT H,ÖZ C.Progress in bioethanol processing[J].Prog Energ Combust,2008,34(5):551-573.
[4]彭源德,朱作华,唐守伟,等.耐高温、高浓度酒精酵母的选育与耐受性能初步鉴定[J].中国麻业科学,2010,32(3):135-142.
[5]HOHMANN S,MAGER W H.Yeast stress responses[J].Febs J,1997,272(11):2639-2647.
[6]CARMELO V,BOGAERTS P,SÁ-CORREIA I,et al.Activity of plasma membrane H+-ATPase and expression of PMA1 and PMA2 genes in Saccharomyces cerevisiae cells grown at optimal and low pH[J].Arch Microbiol,1996,166(5):315-230.
[7]熊国通,苗英杰,吴祖芳,等.乙醇胁迫下酿酒酵母(Sc131)生长状态和基因的表达[J].中国食品学报,2018,18(8):247-253.
[8]李莉莉,叶美莉,叶燕锐,等.酿酒酵母乙醇发酵性能与胁迫耐性的相关性[J].华南理工大学学报,2011,39(9):134-139.
[9]李王强,刘月,孟祥栓,等.新疆塔城地区乳源酵母菌的分离、鉴定及其抗胁迫特性[J].食品工业科技,2018,39(22):99-106.
[10]VASKAR M,DOROTA R,GUIDO A.Phenotypic landscape of nonconventional yeast species for different stress tolerance traits desirable in bioethanol fermentation[J].Biotechnol Biofuels,2017,10(1):216.
[11]LIC,YU J,WANG D,et al.Efficient removal of zinc by multi-stresstolerant yeast Pichia kudriavzevii A16[J].Bioresource Technol,2016,206:43-49.
[12]LIC,LIL,YANG X,et al.Effect of inorganic salt stress on the thermotolerance and ethanol production at high temperature of Pichia kudriavzevii[J].Ann Microbiol,2018,68(5):305-312.
[13]KURTZMAN,ROBNET C P,BASEHOARPOWERS C J.Phylogenetic relationships among species of Pichia,Issatchenkia and Williopsis determined from multigene sequence analysis,and the proposal of Barnettozyma gen.nov.,Lindnera gen.nov.and Wickerhamomyces gen.nov.[J].Fems Yeast Res,2008,8(6):939-954.
[14]ISONO N,HAVAKAWA H,USAMI A,et al.A comparative study of ethanol production by Issatchenkia orientalis strains under stress conditions[J].J Biosci Bioeng,2012,113(1):76-78.
[15]KOUTINAS M,PATSALOU M,STAVRINOU S.et al.High temperature alcoholic fermentation of orange peel by the newly isolated thermotolerant Pichia kudriavzevii KVMP10[J].Lett Appl Microbiol,2016,62(1):75-83.
[16]XIAO H,SHAO Z,JIANG Y.et al.Exploiting Issatchenkia orientalis SD108 for succinic acid production[J].Microb Cell Factor,2014,13(1):121.
[17]MIAO Y,XIONG G,LIR,et al.Transcriptome profling of Issatchenkia orientalis under ethanol stress[J].AMB Expr,2018,8:39.
[18]姚淑敏,徐凯峰,宋晴晴,等.东方伊萨酵母FJ-J-3发酵特性的研究[J].中国酿造,2017,36(12):92-95.
[19]杨革.微生物学实验教程(第三版)[M].北京:科学出版社,2018:145-146
[20]陈国通,毛琼玲,左书瑞,等.气相色谱法测定低酒精度饮料中乙醇的含量[J].食品与机械,2018,34(2):58-61.