固定化细胞技术即用一种合适的材料将具有生物活性的细胞固定在其中,使微生物活细胞具有一定的活动空间、便于保存、可重复使用,微生物的生长代谢和繁殖不受影响的一门综合高新技术[1]。固定化细胞技术在20多年前已经开始被广泛研究和应用,根据被固定的材料(如微生物细胞或各种酶),可以选择不同的固定化载体[2-3]。常用的固定化方法包括海藻酸钙凝胶法[4]、琼脂凝胶法[5-6]、明胶-戊二醛交联法、磁性材料修饰法[7]、微管阵列膜法[8]、聚乙烯醇(polyvinyl alcohol,PVA)包埋法[9-10]和多孔壳聚糖[3]等。固定化细胞旨在将活细胞限制在特定区域内,以增加细胞密度、积累次生代谢物、减少机械剪切对活细胞的损伤,在细胞恢复和再利用方面发挥突出的优点,因此,在分批和连续发酵过程中发挥显著的优势[2,11-12]。固定化酵母已应用于酿酒、苹果酒、葡萄酒和啤酒等工业酿造行业[1],虽然该技术在一定程度上降低了酿酒行业的工艺成本,但是不同固定化材料对酒的风味和有效成分的稳定等问题还未完全解决,固定化细胞的工业应用还很有限[1,4,13-16],因此,寻找适合工业应用的低成本聚合物不但决定固定化细胞生物催化功能的稳定性,而且对固定化细胞技术的应用也发挥关键的作用。
本研究采用海藻酸钙凝胶法、琼脂凝胶法、明胶-戊二醛交联法和聚乙烯醇包埋法对酿酒酵母(Saccharomyces cerevisiae)1308进行固定,通过比较4种固定化方法,选择低成本、性能优越的固定方法。在此基础上,进一步优化固定化条件,并将固定化酵母用于分批和连续发酵生产乙醇。通过对酿酒酵母最佳固定材料的筛选和应用研究,以期为固定化细胞方法在工业方面的应用提供一定的参考。
1 材料和方法
1.1 材料与试剂
1.1.1 菌种
酿酒酵母(Saccharomyces cerevisiae)1308:甘肃省科学院生物所的中国工业微生物保藏中心甘肃分中心(Gansu center of industrial culture collection,GSICC),保藏编号为GSICC 51902。
1.1.2 试剂
海藻酸钙(分析纯),琼脂(生化试剂):青岛水产加工厂;聚乙烯醇(化学纯):兰州维尼纶厂;明胶(化学纯):上海明胶厂;玉米粉(工业级):陇西酒精厂;淀粉酶(2 000 U/g)、糖化酶(50 000 U/g):无锡酶制剂厂。
1.1.3 培养基
麦芽汁培养基:青岛海博生物技术有限公司。
发酵培养基(玉米糖化醪):经筛孔直径2 mm的锤式粉碎机粉碎后的玉米粉按照料液比1∶3(g∶mL)加入90℃热水,按总料0.1%的比例加入淀粉酶,保温1 h,再煮沸1 h,冷却至60℃加入糖化酶,酶用量为每克醪液300 U,糖化时间1 h,糖化温度为30℃。糖含量约为18%~20%,121℃高压灭菌15 min后备用。
1.2 仪器与设备
Primo Star普通光学显微镜:德国蔡司公司;TU-1950八联池-紫外分光光度计:北京谱析通用仪器有限责任公司;XL-20扫描电镜:荷兰Philips公司;柱式生物反应器:连续发酵柱式生物反应器(有机玻璃加工而成的,单柱有效使用体积约为100 mL(10.5 cm×3.5 cm),高径比是3∶1,三级串联。每一级均有夹套,夹套中用流动的恒温水保温,培养基由蠕动泵从底部泵入,从顶部通过胶皮管泵入下一级):自制。
1.3 方法
1.3.1 酵母菌的增殖
将酵母菌1308接种于麦芽汁培养基,于28~30℃、200 r/min条件下培养24 h。
1.3.2 固定化方法及比较
海藻酸钙凝胶法[17]:在90 mL含量为1%、2%、3%、4%、5%的海藻酸钙溶液中分别加入10 mL酵母菌增殖液(8.0×107 CFU/mL),混合均匀,用蠕动泵通过硅橡胶管吸入后挤出,并滴入40 mL 4.0%氯化钙溶液中,钙化4~8 h,即成直径2~3 mm的均匀珠体,用无菌水洗涤备用。
琼脂凝胶法[18]:取10 mL酵母菌增殖液加入90 mL 6%的琼脂溶液中,混合均匀后倒入培养皿中铺平板,待凝固后切成约3 mm3的小方块,用无菌水冲洗后备用。
明胶-戊二醛交联法[18]:取10 mL酵母菌增殖液加入90 mL 10%明胶溶液中,混合均匀后倒入培养皿中铺平板,待凝固后切成约3 mm3的小方块,然后加入90 mL 0.5%戊二醛溶液在室温条件下交联20 min,用无菌水冲洗后备用。
PVA包埋法[19]:分别取10 mL酵母菌增殖液加入90 mL含量为4%、5%、6%、8%、10%、12%、15%、20%的改良PVA溶液中,混合均匀后倒入培养皿中铺平板,然后在-30~-20℃条件下冷冻2~8 h,取出后切成约3 mm3的小方块备用。
固定化方法的比较:采用4种固定化方法对酵母1308进行固定,并对固定化酵母进行分批发酵,共发酵5批次,每批次发酵36 h,分别在12 h、24 h和36 h取样测定发酵液中的细胞总数、乙醇含量并求出乙醇生产能力[10-11],发酵5批次后观察各种凝胶的机械强度[4,19]。
1.3.3 固定化酵母的稳定性
将20 g固定化酵母接种于含200mL发酵培养基的500mL三角瓶中,每批次于30℃、200 r/min条件下培养48 h,共发酵82批次(164 d),测定发酵液中的乙醇含量、残糖含量和细胞总数,并求出乙醇的生产能力[10-11],以研究固定化酵母的稳定性。
1.3.4 固定化酵母的发酵
分批发酵:取发酵82批次的固定化酵母20 g接种于含200 mL发酵培养基的500 mL三角瓶中;同时,以接种量为10%的未固定化酵母增殖液(8.0×107 CFU/mL)作为对照,分别于30 ℃、200 r/min条件下培养72 h,分别在0 h、12 h、24 h、36 h、48 h、60 h和72 h取样,测定发酵液中的乙醇含量、细胞总数和残糖含量来研究固定化酵母分批发酵的代谢过程,每个处理重复3次。
连续发酵:国内外多采用柱式生物反应器进行连续发酵试验[12-13]。第一级柱中PVA固定化细胞的填充量为40 g,第二级柱中填充量为30 g,第三级柱中填充量为20 g。在试验中连续供给玉米糖化醪,流速控制在20 mL/h,培养基在柱中的滞留时间为3 h,发酵温度30℃,发酵120 d。每天取样,测定发酵液中的乙醇含量、残糖含量、pH值和细胞总数,并求出乙醇生产能力。
1.3.5 分析检测方法
残糖含量:采用3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定[20]。乙醇含量:采用比重法测定。细胞总数:采用血球计数板法测定。固定化细胞形态:采用光学显微镜和扫描电镜观察细胞形态。
1.3.6 数据处理
实验数据采用SPSS 22软件的单因素方差分析对测量变量统计分析;采用双变量相关性分析方法分析各变量间的相关性。采用Origin 2016软件作图。
2 结果与分析
2.1 固定化方法的比较
本实验选择4种有代表性的固定化方法对酵母1308进行固定,并通过固定化酵母分批发酵(24 h)对4种固定化方法进行比较,结果见表1。
由表1可知,不同固定化材料固定酵母,在发酵24 h后,细胞数量均由原来的8.0×107 CFU/g凝胶增加了一个数量级。其中海藻酸钙凝胶法酵母细胞总数最高,细胞数为9.1×108 CFU/g凝胶;PVA包埋法次之,细胞总数为6.5×108 CFU/g凝胶。在4种固定化方法中,海藻酸钙凝胶法固定的酵母1308乙醇生产能力最高[27.6 mg/(g·h)],PVA包埋法次之[24.0 mg/(g·h)],但其凝胶块完整,有弹性,具有理想的机械强度。因此,从细胞总数、乙醇含量、乙醇生产能力和机械强度综合考虑,海藻酸钙凝胶法和PVA包埋法效果较好。进一步研究不同海藻酸钙含量和PVA含量对固定化酵母乙醇生产能力的影响(24 h),结果见图1。
表1 不同固定化方法的比较
Table 1 Comparison of different immobilization methods

注:不同小写字母表示组间差异显著(P<0.05)。下同。
固定化方法细胞总数/(CFU·g-1凝胶)乙醇生产能力/[mg·(g·h)-1]乙醇含量/%vol机械强度海藻酸钙凝胶法琼脂凝胶法明胶-戊二醛交联法PVA包埋法9.1×108 5.9×108 1.3×108 6.5×108 27.6±0.5a 24.0±0.3b 15.5±0.6c 24.0±0.6b 8.4±0.2a 7.3±0.1b 4.7±0.1c 7.3±0.3b珠体裂口,手捏易碎发软,一碰即碎脆软,手捏即碎有弹性,凝胶块完整
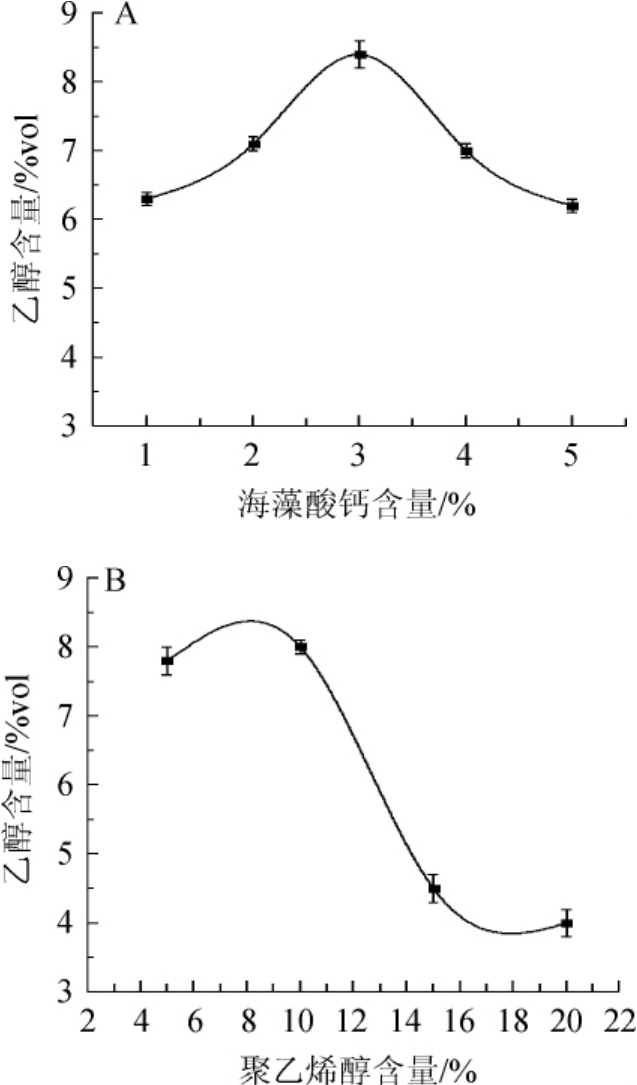
图1 不同海藻酸钙(A)和聚乙烯醇(B)含量对固定化酵母产乙醇的影响
Fig.1 Effects of different sodium alginate(A)and polyvinyl alcohol(B)contents on ethanol production of immobilized yeast
由图1可知,海藻酸钙及聚乙烯醇含量对固定化酵母的乙醇生产能力影响显著(P<0.05)。当海藻酸钙含量为3%时,固定化酵母的乙醇产量最高,为8.5%vol;当PVA含量在10%左右,固定化酵母的乙醇产量较高。
综上所述,海藻酸钙凝胶法制备的珠体催化活性高,乙醇生产能力也强。但珠体机械强度差,长期使用易裂缝、破碎,所以不适合工业应用。而PVA包埋法虽然催化活性略低于海藻酸钙珠体,但其机械强度好,且制备方法简单、原料丰富、成本低等,是工业应用的一种相对理想的载体。与HERKOMMEROVA K等[9]的研究结果一致,PVA材料固定酵母不但使酵母保持好的细胞活性和生产力,而且还使酵母能够长期廉价地保存,是工业应用极具潜力的一种方法。
进一步研究PVA含量对固定化酵母乙醇生产能力的影响,并对PVA包埋法固定化酵母(24 h)的乙醇产量、酵母细胞总数及其组织状态进行比较,结果见表2。
表2 聚乙烯醇含量对的固定化酵母的影响
Table 2 Effect of polyvinyl alcohol contents on immobilized yeast
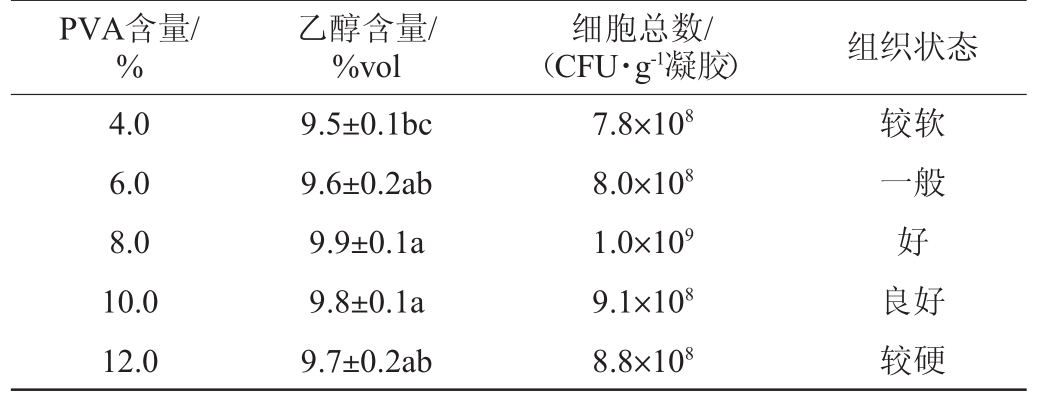
PVA含量/%乙醇含量/%vol细胞总数/(CFU·g-1凝胶) 组织状态4.0 6.0 8.0 10.0 12.0 9.5±0.1bc 9.6±0.2ab 9.9±0.1a 9.8±0.1a 9.7±0.2ab 7.8×108 8.0×108 1.0×109 9.1×108 8.8×108较软一般好良好较硬
由表2可知,当PVA含量为8%时,固定化酵母细胞的乙醇产量(9.9%vol)及细胞总数(1.0×109 CFU/g凝胶)均最高,凝胶组织状态较好。因此,最佳PVA含量为8%。在此最佳固定化条件下,对PVA固定化酵母与游离酵母的乙醇生产能力进行比较,结果见表3。
表3 8%聚乙烯醇固定化酵母与游离酵母乙醇生产能力的比较
Table 3 Comparison of ethanol production capacity between 8%polyvinyl alcohol-immobilized yeast and free yeast

发酵时间/h乙醇生产能力/[mg·(g·h)-1]8%PVA固定化酵母 游离酵母12 24 36 30.3±1.2a 24.3±0.7b 18.6±1.3c 0.7±0.3c 9.9±0.5b 10.1±0.7a
由表3可知,8%PVA固定化酵母的乙醇生产能力高于游离酵母,分析原因可能是因为固定化酵母细胞浓度高于游离细胞,所以乙醇生产能力显著高于游离细胞(P<0.05),说明高浓度的酵母细胞也是实现高浓度乙醇连续发酵的重要策略之一[2,21]。
2.2 8%PVA固定化酵母的稳定性
由于固定化酵母是一种生物活性载体,其活性尽管能重复增殖,但也有一定的时间,为了观察其反应的稳定性,将8%PVA固定化酵母在1 L反应容器中进行分批发酵82批次,每次发酵48 h,共计使用164 d,随机抽取7批次的试验结果见表4。
表4 8%聚乙烯醇固定化酵母的稳定性试验
Table 4 Stability tests of 8%polyvinyl alcohol-immobilized yeast
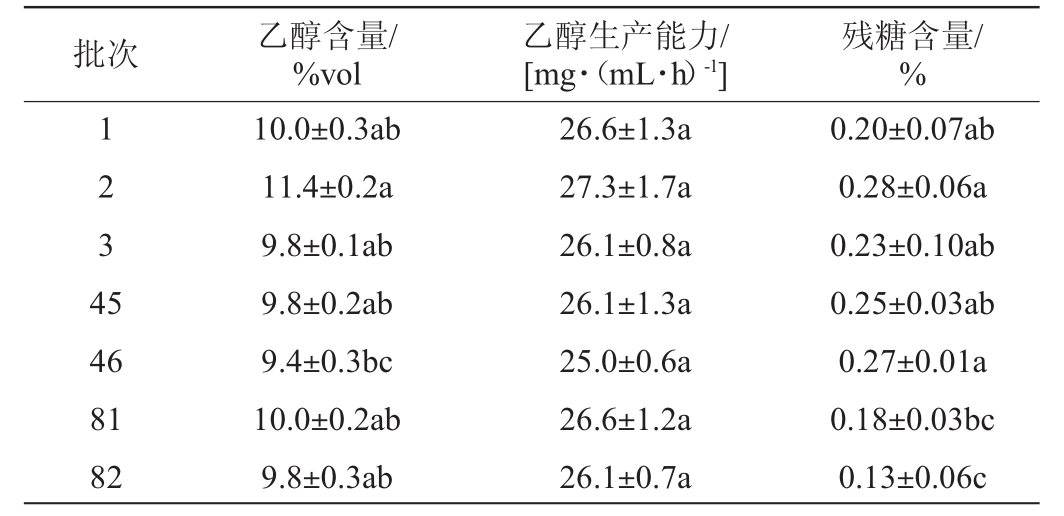
批次 乙醇含量/%vol乙醇生产能力/[mg·(mL·h)-1]残糖含量/%1 2 3 4 5 46 81 82 10.0±0.3ab 11.4±0.2a 9.8±0.1ab 9.8±0.2ab 9.4±0.3bc 10.0±0.2ab 9.8±0.3ab 26.6±1.3a 27.3±1.7a 26.1±0.8a 26.1±1.3a 25.0±0.6a 26.6±1.2a 26.1±0.7a 0.20±0.07ab 0.28±0.06a 0.23±0.10ab 0.25±0.03ab 0.27±0.01a 0.18±0.03bc 0.13±0.06c
由表4可知,相同发酵时间的各批次8%PVA固定化酵母的乙醇含量、乙醇生产能力重复性较好;经分批发酵持续82批次,共计164 d的长期使用,8%PVA固定化酵母的活性和机械强度保持不变,表现出良好的稳定性,说明PVA是一种优良的固定化载体材料。
2.3 8%PVA固定化酵母的形态特征
为进一步说明PVA是比较适合细胞固定化的材料,对PVA固定化酵母和PVA材料进行显微观察,结果见图2。

图2 8%聚乙烯醇固定化酵母在光学显微镜(A)和扫描电镜(B、C)下的形态
Fig.2 Morphology of 8%polyvinyl alcohol-immobilized yeast by under optical(A)and scanning electron(B and C)
从图2(A)可以看出,酵母镶嵌在PVA固定化材料内。从图2(B)可以看出,固定化酵母在PVA材料中的生长繁殖状态,在开始生长时,一个酵母细胞占据一个网格,随着酵母细胞生长繁殖,网格扩张,最后在网格洞中长成一团酵母细胞。表明PVA固定化材料有很好的张力,长时间使用也不易破裂。从图2(C)可以看出,PVA材料本身具有网状、多空的特点,此特点有利于细胞的固定、有利于培养基的传递和通气。综上观察,也证实了PVA是非常适合细胞固定化的材料。
2.4 8%PVA固定化酵母分批发酵
以游离酵母为对照,取分批发酵第82批的8%PVA固定化酵母,分别测定其在发酵0、12 h、24 h、36 h、48 h、60 h、72 h的乙醇含量、残糖含量和酵母细胞总数的变化情况,结果见图3。
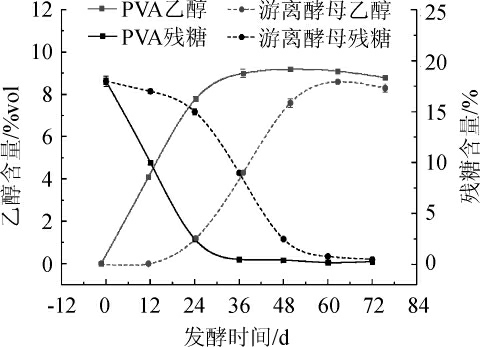
图3 8%聚乙烯醇固定化酵母和游离酵母发酵过程中乙醇、残糖含量的变化
Fig.3 Changes of ethanol and residual sugar content of 8%polyvinyl alcohol-immobilized yeast and free yeast during fermentation
由图3可知,在一定范围内,随着发酵时间的增加,乙醇含量不断增加,残糖量不断减少,且乙醇含量越高,残糖量越低。而8%PVA固定化酵母的乙醇产量显著高于游离酵母,残糖量显著低于游离酵母(P<0.05)。根据工业生产对成熟醪液的要求,以发酵液乙醇含量达到7%vol~8%vol为标准,可以确定游离酵母的发酵周期为48~52 h,而8%PVA固定化酵母的发酵周期是22~26 h,发酵周期缩短一半,表明8%PVA固定化酵母的发酵速度高于游离酵母,与前期研究结果一致[10,15]。
8%PVA固定化酵母在发酵开始,PVA凝胶中的细胞总数达到108 CFU/g凝胶,且在发酵过程中仍有少量增殖,细胞总数保持在9.1×108 CFU/g凝胶水平以上,是游离酵母细胞浓度的100多倍。研究发现,8%PVA固定化酵母发酵液中酵母总数要低于游离酵母的数倍,表明在发酵过程中起主要作用的是高浓度的固定化酵母,而不是从凝胶中泄露到发酵液中的少量游离酵母。因此,使得8%PVA固定化酵母具有高速发酵特性。
2.5 8%PVA固定化酵母连续发酵
由图4可知,在120 d的连续发酵过程中,8%PVA固定化酵母一直保持稳定发酵能力。发酵流出液中的残糖量和乙醇产量保持平稳,乙醇含量达到10%vol,平均残糖量<1%,平均乙醇生产能力>20 mg/(mL·h)。PVA固定化酵母连续发酵乙醇的生产能力高于国内外传统发酵乙醇方法[10,12][2.0 mg/(mL·h)]和先进的游离细胞连续发酵[7 mg/(mL·h)],因此,PVA固定化酵母不仅具有很高的反应活性和很好的反应稳定性,而且载体具有十分理想的机械强度,PVA固定化细胞具有较高的工业应用价值[9]。
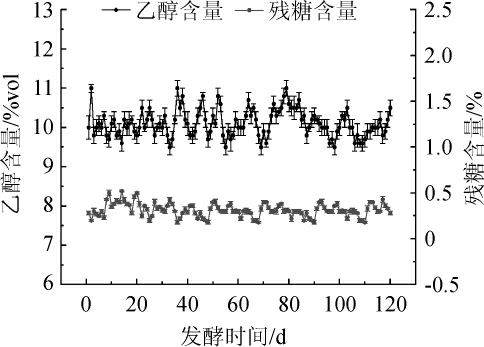
图4 8%聚乙烯醇固定化酵母连续发酵过程中乙醇产量和残糖含量的变化
Fig.4 Changes of ethanol and residual sugar contents of 8%polyvinyl alcohol-immobilized yeast during continuous fermentation
3 结论
本研究采用海藻酸钙凝胶法、琼脂凝胶法、明胶-戊二醛交联法和聚乙烯醇(PVA)包埋法对酿酒酵母(Saccharomyces cerevisiae)1308进行固定,通过对4种固定化方法进行对比发现,PVA是最佳固定化载体材料。PVA最优添加量为8%,8%PVA固定化酵母生物具有较好的稳定性。分批发酵其稳定使用期>164 d,可连续重复使用82批次以上。连续发酵的稳定性在4个月以上。其在分批发酵和连续发酵过程中,乙醇生产能力和稳定性均优于游离酵母细胞。
[1]JAIME M G,TERESA G M,MAURICIO J C,et al.Yeast immobilization systems for alcoholic wine fermentations:Actual trends and future perspectives[J].Front Microbiol,2018,9:1-13.
[2]TRAN C T H,NOSWORTHY N,BILEK M M M,et al.Covalent immobilization of enzymes and yeast:Towards a continuous simultaneous saccharification and fermentation process for cellulosic ethanol[J].Biomass Bioenerg,2015,81:234-241.
[3]姚晓瑞宁,高飞飞,王斌,等.多孔壳聚糖固定酵母蛋白酶条件的优化及酶学性质分析[J].中国酿造,2017,36(1):146-150.
[4]先元华,朱玉洁,梁宗余.不同固定化酵母载体对啤酒风味成分影响研究[J].中国酿造,2015,34(4):47-50.
[5]UYGUN D A,AKDUMAN B,UYGUN M,et al.Immobilization of alcohol dehydrogenase onto metal-chelated cryogels[J].J Biomat Sci-Polym E,2015,26(7):446-457.
[6]NAWAZ M A,KARIM A,AMAN A,et al.Continuous degradation of maltose:improvement in stability and catalytic properties of maltase(alpha-glucosidase)through immobilization using agar-agar gel as a support[J].Bioproc Biosyst Eng,2015,38(4):631-638.
[7]BALDIKOVA E,POSPISKOVA K,LADAKIS D,et al.Magnetically modified bacterial cellulose:A promising carrier for immobilization of affinity ligands,enzymes,and cells[J].Mat Sci Eng C-Mat Biol Appl,2017,71:214-221.
[8]CHEN C C,WU C H,WU J J,et al.Accelerated bioethanol fermentation by using a novel yeast immobilization technique:Microtube array membrane[J].Process Biochem,2015,50(10):1509-1515.
[9]HERKOMMEROVÁK,ZEMANCIKOVÁJ,SYCHROVÁH,et al.Immobilization in polyvinyl alcohol hydrogel enhancesyeaststorage stability and reusability of recombinant laccase-producing S.cerevisiae[J].Biotech Lett,2018,40(2):405-411.
[10]NAKAGAWA K,KATAYAMA T,YAMAMOTO T,et al.Alcoholic fermentation by yeast is improved by immobilization in freeze-dried poly(vinyl alcohol)foam[J].J Chem Eng Jpn,2016,49(7):707-713.
[11]ARIYAJAROENWONG P,LAOPAIBOON P,LAOPAIBOON L.Capability of sweet sorghum stalks as supporting materials for yeast immobilization to produce ethanol under various fermentation processes[J].J Taiwan Inst Chem Eng,2015,49:79-84.
[12]SINGH R S,SINGH R P,KENNEDY J F.Immobilization of yeast inulinase on chitosan beads for the hydrolysis of inulin in a batch system[J].Int J Biol Macromol,2017,95:87-93.
[13]ALMONACID S F,NÁJERA A L,YOUNG M E,et al.A comparative study of stout beer batch fermentation using free and microencapsulated yeasts[J].Food Bioproc Technol,2012,5(2):750-758.
[14]CLEMENTZ A L,AIMARETTI N R,MANUALE D,et al.Optimization of ethanol fermentation from discarded carrots using immobilized Saccharomyces cerevisiae[J].Int J Energ Environ Eng,2015,6(2):129-135.
[15]田梁,赵华,郑雅元,等.序批式固定化菌液态发酵白酒工艺的研究[J].中国酿造,2017,36(5):109-112.
[16]叶世超,薛婷,何文锦,等.固定化酵母R36酒精发酵工艺研究[J].中国酿造,2013,32(8):67-69.
[17]蒋莹子,韦欢芯,花鹏,等.羟甲基甲壳素/海藻酸钙固定化双歧杆菌的研究与应用[J].科学技术与工程,2018,18(11):37-43.
[18]孙万儒,王祯祥,张渝英,等.产青霉素酰化酶的大肠杆菌AS1.76的固定化[J].微生物学报,1980,20(4):407-414.
[19]王建龙,施汉昌.聚乙烯醇包埋固定化微生物的研究及进展[J].工业微生物,1998,28(2):35-38.
[20]祝英,王治业,孙智敏,等.多菌发酵马铃薯渣生产蛋白饲料的研究[J].中国饲料,9:40-44.
[21]俞建良,吉海瑞,张栩,等.固定化酵母高浓度乙醇多级连续发酵控制策略研究[J].中国酿造,2013,32(1):25-28.