放线菌(Actinobacteria)的次级代谢产物种类丰富,骨架结构新颖多样,生物学活性显著,是发现药物先导化合物的重要来源[1-2]。放线菌FJS31-2是实验室前期鉴定的一株产新型卤化II型聚酮类抗生素zunyimycins A、B、C的菌株(结构见图1)[3-4]。研究表明,zunyimycins具有较强的抗耐甲氧西林金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,MRSA)和抗肿瘤生物活性[4]。通过antiSMASH软件分析Streptomyces sp.FJS31-2的基因组信息发现,该菌除具有zunyimycins合成基因簇(biosynthetic gene clusters,BGCs)外,该菌染色体上还存在多个其他化合物的BGCs[5]。基于链霉菌(Streptomyces sp.)基因组信息进行化合物的重新挖掘,是发现新抗生素的重要途径。泥质链霉菌(Streptomyces argillaceus)ATCC 12956能够产生一种具有抗肿瘤活性的先导化合物光神霉素(mithramycin),BECERRIL A等[6]对该菌基因组进行测序和重新挖掘发现两个新的化合物抑菌霉素(antimycins)(cluster 27)和异海绵烯(isorenieratene)(cluster 26);江冰娅等[7]对醌霉素产生菌Streptomyces sp.CPCC 200497产生的次级代谢产物进行再次勘探时发现并鉴定了两种吡咯里西啶类生物碱bohemamine和bohe mamine B。亢文佳等[8]通过扫描链霉菌(Streptomyces sp.)TP-A0365的基因组序列,找到一个新的负责吡嗪酮类合成的非核糖体肽合成酶(nonribosomalpeptide synthesis,NRPS)编码基因,通过敲除NRPS基因,对比突变菌株和原始菌株的发酵粗提液,发现一个新的吡嗪酮类化合物(provalin)。
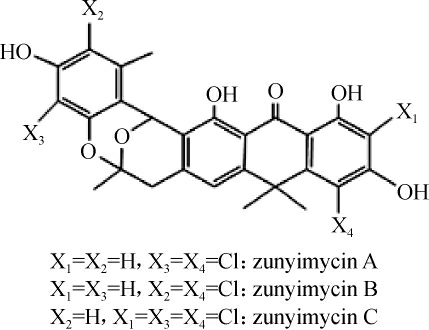
图1 zunyimycins A、B和C的化学结构
Fig.1 Chemical structure of zunyimycins A,B and C
近年来世界各地出现多种“超级细菌”,它们对大多数抗生素都产生耐药性,给临床上病原菌感染等疾病的治疗带来巨大的挑战[9]。大环内酯类抗生素是一类重要的抗感染、抗病毒、抗肿瘤、免疫刺激等活性的药物[10-11]。但随着临床的滥用,导致细菌耐药性的出现,开发或修饰获得新的大环内酯类药物极为重要[12-13]。放线菌来源的抗生素类药物在临床治疗耐药病原菌感染和抗肿瘤等重大疾病方面发挥着重要作用[14]。HAXELL M A等[15]首次从吸水链霉菌(S.hygroscopicus)ATCC 53718中分离、鉴定得到的多环内酯类化合物UK-78623,研究发现其同系物具有较好的抗秀丽隐杆线虫(Caenorhabditis elegans)的活性,而对其抗菌活性未见报道。因此,本研究继续对zunyimycins产生菌Streptomyces sp.FJS31-2的次级代谢产物进行重新挖掘,在前期优化发酵条件的基础上,对该菌的次级代谢产物UK-78623进行分离,采用质谱(massspectrum,MS)法和1D和2D核磁共振(nuclear magnetic resonance,NMR)技术对其结构进行了准确解析,并对其抗菌活性进行测定,为大环内酯类药物的开发提供新的资源。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株
供试菌株:链霉菌(Streptomyces sp.)FJS31-2(菌保号:CGMCC 4.7321,Genebank号:no.PRJNA320463),分离自贵州省特殊生境梵净山海拔800 m的土样中;测试菌株:金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923、小肠结肠炎耶尔森氏菌(Yersinia enterocolitica)ATCC 23715、大肠杆菌(Escherichia coli)ATCC 25922、粪链球菌(Streptococcus faecalis)ATCC 32001、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 27853、白色念珠菌(Candida albicans),均为本实验室保存。
1.1.2 培养基
固体发酵培养基(改良的GYM链霉素培养基):葡萄糖4 g,CaCO3 2 g,麦芽抽提物10 g,酵母抽提物4 g,微量元素预混液(ZnSO4·7H2O 2 g,FeSO4·7H2O 2 g,MnCl2·4H2O 2 g,CuSO4·5H2O 2 g,Na2B4O7·10H2O 2 g,(NH4)6Mo7O24·4H2O 2 g,去离子水定容至1 L)0.5 mL,腐殖酸浸出液10 mL,玉米汁100 mL,琼脂粉18 g,去离子水定容至1 L,115℃灭菌30 min。
GYM链霉素液体培养基:葡萄糖4 g,酵母提取物4 g,麦芽提取物10 g,去离子水定容至1 L,115℃灭菌30 min。
LB液体培养基:胰蛋白胨10 g,酵母提取物5 g,NaCl 10 g,去离子水定容至1 L,121℃灭菌30 min。LB固体培养基:在LB液体培养基中加入琼脂粉20 g。
1.1.3 主要试剂
GF254薄层层析(thin layer chromatography,TLC)硅胶板、柱层析用硅胶:青岛谱科分离材料有限公司;葡聚糖凝胶Sephadex LH-20:北京满仓科技有限公司;甲醇、乙醇、氯仿、乙酸乙酯、丙酮等(均为分析纯):成都科龙化工试剂厂;甲醇、乙腈等(均为色谱纯):北京迈瑞达公司;环丙沙星药敏纸片(5μg):英国OXOID公司。
1.2 仪器与设备
Agilent 1220 Infinity LC VL高效液相色谱(high performance liquid chromatography,HPLC)仪、1200HPLC/6520 QTOFMS液质(liquid chromatography-mass spectrometry,LC-MS)联用仪:美国安捷伦公司;AV III,Ascend 500 HD 500 MHz核磁共振仪:德国Bruker公司;DZ-900英培摇床:太仓市实验设备厂;R-210旋转蒸发仪:瑞士步其公司;BSP-400培养箱:上海博讯设备仪器厂;E002092超级洁净工作台:苏州市金净净化设备科技有限公司;Direct-Q5UV超纯水机:美国密理博公司;SCIENTZ-15T超声波提取机:宁波新芝公司;MLS-3781L-PC自动蒸汽灭菌器:日本松下公司。
1.3 方法
1.3.1 菌株的活化与发酵
将斜面保藏的Streptomyces sp.FJS31-2划线接种于固体发酵培养基平板中,28℃静置培养4 d。将活化好的Streptomyces sp.FJS31-2接种至固体发酵培养基中,装液量为200 mL/500 mL,28℃静置培养7 d后,捣碎培养基混匀,继续培养10 d。
1.3.2 代谢产物分离纯化
捣碎发酵培养基中加入等体积的乙酸乙酯,置于超声波提取机中,在搅拌转速250 r/min、超声功率400 W条件下,超声破碎萃取24 h,间隙时间为1.0 s,共萃取2次,收集萃取液,置于旋转蒸发仪中,40℃减压浓缩,回收萃取液,得到发酵粗提浸膏32 g。
用少量的丙酮及甲醇溶解发酵粗提浸膏(32 g)后,与硅胶粉(100~200目)搅拌混匀,溶剂挥发完全后进行正相硅胶柱层析(200~300目,1.3 kg),依次按氯仿-丙酮中氯仿体积分数100%、95%、90%、80%、67%、50%、33%、0进行梯度洗脱,每个梯度洗脱3 L,每瓶收集150 mL,流速为1滴/s。将洗脱液分别在40℃条件下真空浓缩,依次标上记号,浓缩后进行TLC分析,根据比移(retention factor,Rf)值合并显色情况相似的组分,共合并得10个组分,依次标记为Fr.1~Fr.10。Fr.1~Fr.8,Fr.10已分离出新化合物zunyimycinA、B、C等[4],因此选择Fr.9进一步纯化。
将组分Fr.9(4.224 g)用尽量少的甲醇溶解后,经葡聚糖凝胶Sephadex LH-20(200 g)柱层析,甲醇洗脱,流速为8滴/s,5 mL/管收集,经TLC检测,根据Rf值合并显色情况相似的组分,共合并得2个组分,标记为组分Ⅰ和组分Ⅱ,经HPLC分析显示,组分Ⅰ和Ⅱ在保留时间分别为5.972 min和20.1 min,组分Ⅰ为已发表化合物BE-24566B[4],选择组分Ⅱ进行进一步纯化。
组分Ⅱ(171 mg)经葡聚糖凝胶Sephadex LH-20(150 g)柱层析,甲醇∶氯仿=1∶1(V/V)洗脱,流速为8滴/s,5 mL/管收集,经TLC分析,合并Rf值=0.5的化合物,最终得到化合物1(79 mg)。
1.3.3 代谢产物结构解析
核磁共振(NMR)分析:化合物1用丙酮溶解后,转移至干净的核磁管中抽干溶剂,加入0.5 mL氘代氯仿后测试1D NMR,包括13C NMR、1H NMR、无畸变极化转移增强(distortionlessenhancementby polarization transfer,DEPT)谱。
电喷雾质谱(electrospray ionization mass spectrometry,ESI-MS)测定:样品加热气化,进入离子化室,随后电离,扫描范围为100~1 000 m/z,得到化合物的分子离子峰及其他离子碎片。
1.3.4 抑菌活性的测定
采用滤纸片法测定化合物1的抑菌能力。
将金黄色葡萄球菌、小肠结肠炎耶尔森氏菌、大肠杆菌、粪链球菌、铜绿假单胞菌分别接种于LB液体培养基中,37℃、200 r/min培养6~8 h,白色念球菌接种于GYM液体培养基中,28℃、200 r/min培养6~8 h。取10 mL新鲜菌液与40 mL即将凝固(约45~55℃)的LB固体培养基分别混匀后迅速倒板。
将滤纸片打孔(孔直径为6 mm)于121℃条件下高压灭菌30 min;将化合物1溶于甲醇中,使化合物1的终质量浓度为1 mg/mL,将滤纸片浸泡其中,取出滤纸片,溶剂挥发干后,采用无菌镊子将滤纸片分别贴于含有菌液的LB固体培养基表面,轻轻按压,使其贴平,做好标记。平板置于37℃培养箱中倒置培养24 h,以甲醇为阴性对照,环丙沙星为阳性对照。根据抑菌圈的有无及大小,判定抗菌活性的强弱,当抑菌圈≥6 mm时,具有抑菌作用。
2 结果与分析
2.1 化合物的TLC分析
以氯仿∶丙酮=3∶1(V/V)为展开剂,经TLC分析得到化合物1共79 mg,化合物1的薄层层析色谱图如图2所示。
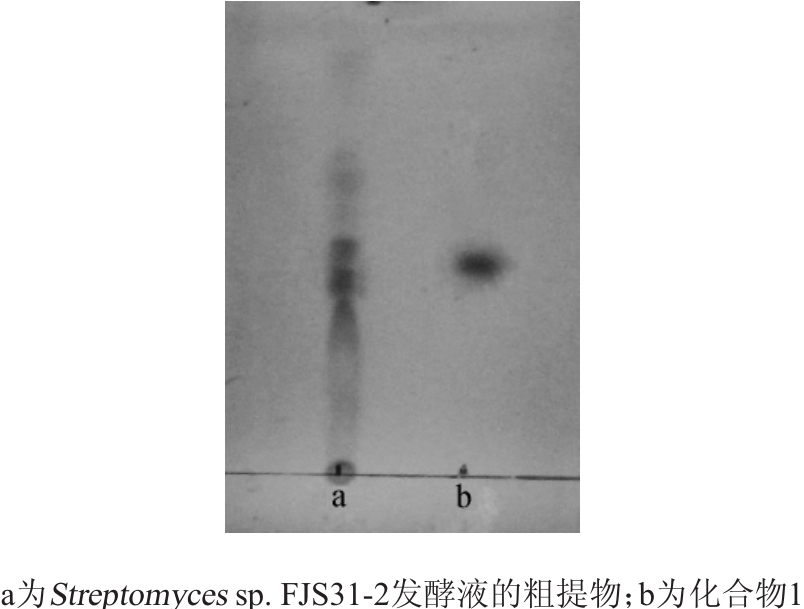
图2 发酵液的粗提物和化合物1的薄层层析色谱图
Fig.2 TLC chromatogram of crude extract of fermentation broth and
compound 1
由图2可知,化合物1的Rf值约为0.5,在8%硫酸乙醇溶液中显色后呈深棕色,TLC的结果表明,化合物1为单一的化合物。
2.2 化合物1的结构解析
化合物1为白色固体粉末,易溶于氯仿、丙酮,ESI-MS得出m/z:707.3[M+Na]+和1391[2M+Na]+,相对分子质量为684。分子式:C39H54O9,不饱和度为12。1H-NMR(500 MHz,CHCl3-d1):根据氢质子化学位移δ 0.70(3H,d,J=6.6 Hz,H-15a),0.89-0.97(2H,m,H-18),1.02(3H,d,J=6.7 Hz,H-12a),1.21(3H,br d,J=1.8 Hz,H-46),1.22(3H,d,J=2.0 Hz,H-47),1.55(3H,s,H-14a),1.61(3H,s,H-29),1.68(3H,d,J=6.6 Hz,H-28),可以推断该分子具有8个甲基;根据1.82-1.85(4H,m,H-18),1.83-1.91(1H,m,H-24),1.84-1.87(1H,m,H-4a),1.93(3H,br d,J=8.9 Hz,H-20),2.24-2.29(2H,m,H-16),2.40-2.48(1H,m,H-12),2.62(1H,dt,J=14.0,6.96 Hz,H-31),可以看到该分子具有4个亚甲基,其中两个为化学不等价;根据3.22(1H,br t,J=10.3 Hz,H-22),3.32-3.35(1H,m,H-2),3.52(3H,s,5a),3.59(1H,s,H-25),3.60-3.65(1H,m,H-17),3.94-4.00(2H,m,H-5),4.04(1H,d,J=5.6 Hz,H-6),这7组氢信号可以判断该分子具有6个杂原子,从化学位移可以初步推断为氧原子。根据4.62-4.73(2H,m,H-8a),4.94(1H,br d,J=10.5 Hz,H-23),4.96-5.01(1H,m,H-15),5.29-5.32(1H,m,H-19),5.32-5.36(1H,m,H-11),5.41(1H,br d,J=1.5 Hz,H-3),5.45-5.49(1H,m,H-27),5.73-5.77(1H,m,H-10),5.76-5.79(1H,m,H-9),可以初步推断该分子不存在芳香结构,而是具有4个碳碳双键。结合碳谱13C-NMR(125 MHz,CHCl3-d1):δ 177.8(C-30),173.9(C-1),可以判断化合物具有2个羰基。142.5(C-11),139.8(C-8),137.5(C-14),136.0(C-30),133.1 (C-6),124.8 (C-27),123.5(C-9),120.4(C-15),119.5(C-10),118.4(C-3),100.2(C-21),与氢谱一并证明确实存在4个碳碳双键。80.4(C-25),80.2(C-7),76.0(C-22),5.3(C-23),68.5(C-19),68.2(d,J=12.8 Hz,C-17),57.8(C-5a),48.5(C-13),45.6(C-2),证明该分子除2个羰基氧外,还具有6个氧原子,其中一个为羟基;根据37.7(C-18),36.5-35.7 (m,C-20,12),34.6 (C-31),34.3(C-16),22.3(C-12a),19.9 (C-4a),19.2 (C-32),19.0 (C-33),15.6(C-14a),13.2(C-15a),13.0(C-28),10.7(C-29),可以判断该化合物具有一个酯键。综合氢谱、碳谱化学位移及耦合常数可以判断该化合物是具有5元环的大环内酯类化合物。根据天然产物数据库SciFinder检索,化合物1结构特征与文献报道的多环内酯类化合物UK-78623一致[13],推定化合物1为UK-78623,化学结构见图3。
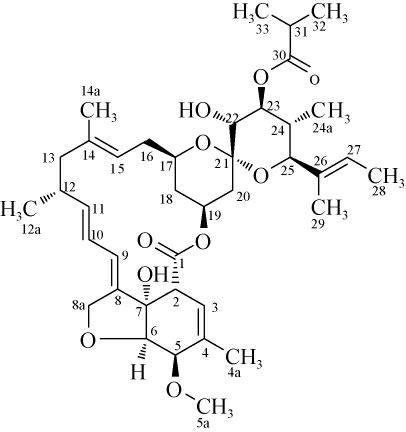
图3 化合物1的化学结构
Fig.3 Chemical structure of compound 1
2.2 抗菌活性分析
采用滤纸片法对化合物1的抗菌活性进行测试,结果见表1。
表1 化合物1的抑菌活性结果
Table 1 Results of antibacterial activity of compound 1

注:“-”表示对该菌无抑制作用;“NT”表示未测试。
项目化合物1阳性对照阴性对照抑菌圈直径/mm E.coli S.faecalis S.aureus Y.enterocolitica P.aeruginosa C.albicans-----NT-NT-NT-25.2±0.11 24.9±0.08-NT-NT-
由表1可知,化合物1对金黄色葡萄球菌、大肠杆菌、粪链球菌、铜绿假单胞菌、白色念珠菌无明显抑制作用,而对小肠结肠炎耶尔森氏菌具有抑制作用,抑菌圈直径为25.2 mm。阳性对照环丙沙星对小肠结肠炎耶尔森氏菌的抑菌圈直径为24.9 mm,化合物1和阳性对照环丙沙星的抑菌效果相当。
小肠结肠炎耶尔森氏菌(Y.enterocolitica)是少数几种能在冷藏温度下生长的的肠道致病菌之一,即“冰箱病”[16-17]。其感染后可引起胃肠道症状、呼吸系统、心血管系统等疾病,甚至引起急性阑尾炎、败血症及死亡[18-19],因此该菌被列为重要的食源性病原菌。近年来Y.enterocolitica在临床各类标本中存在耐多种抗菌药物,并且耐药性日益严重,需要引起关注[20]。因此,化合物UK-78623具有创制为临床抗小肠结肠炎耶尔森氏菌药物的潜力。
3 结论
本研究从II型卤化聚酮类抗生素zunyimycins产生菌链霉菌(Streptomyces sp.)FJS31-2的发酵物中分离纯化得到1个多环内酯类化合物UK-78623,首次报道了化合物UK-78623具有显著的抗小肠结肠炎耶尔森氏菌的活性(25.2±0.11 mm),且与阳性药物环丙沙星抑菌效果(24.9±0.08 mm)相当,表明该化合物具有成药潜力,可为临床该菌的治疗提供先导化合物。
[1]OCHOA J L,SANCHEZ L M,KOO B M,et al.Marine mammal microbiota yields novel antibiotic with potent activity against Clostridium difficile[J].ACS Infect Dis,2018,4(1):59-67.
[2]KWON Y J,SOHN M J,KOSHINO H,et al.AN483,a new anti-MRSA compound from Streptomyces sp.[J].J Antibiot,2016,69(10):762-764.
[3]王荫荫,王苗,钱声艳,等.链霉菌Streptomyces sp.FJS31-2产卤化二型聚酮类化合物的发酵条件优化[J].中国酿造,2017,36(1):66-69.
[4]LU Y H,SHAO M Y,WANG Y Y,et al.Zunyimycins B and C,New chloroanthrabenzoxocinones antibiotics against methicillin-resistant Staphylococcus aureus and Enterococci from Streptomyces sp.FJS31-2[J].Molecules,2017,22(2):251.
[5]LU Y H,YUE C W,SHAO M Y,et al.Molecular genetic characterization of an anthrabenzoxocinones gene cluster in Streptomyces sp.FJS31-2 for the biosynthesis of BE-24566B and zunyimycin ale[J].Molecules,2016,21(6):711.
[6]BECERRIL A,ALVAREZ S,BRANA A F,et al.Uncovering production of specialized metabolites by Streptomyces argillaceus:Activation of cryptic biosynthesis gene clustersusing nutritional and genetic approaches[J].Plos one,2018,13(5):e0198145.
[7]江冰娅,赵薇,李书芬,等.链霉菌Streptomyces sp.CPCC 200497次级代谢产物Bohemamines的分离和鉴定[J].中国医药生物技术,2016,11(5):394-399.
[8]亢文佳,吴晟,华会明,等.基于基因组挖掘的一个新的吡嗪酮类天然产物的发现[J].有机化学,2016,36(7):1696-1699.
[9]KELLYC,CHALMERS JD,CROSSINGHAM I,etal.Macrolide antibiotics for bronchiectasis[J].Cochrane Database Syst Rev,2018,3,Cd012406.
[10]GIACANIL,CICCATESE G,SALAZAR C P,et al.Enhanced molecular typing of treponema pallidum subspecies pallidum strains from 4 italian hospitals shows geographical differences in strain type heterogeneity,widespread resistance to macrolides,and lack of mutations associated with doxycycline resistance[J].Sex Transmit Dis,2018,45(4):237-242.
[11]FOIK IP,TUSZYNSKAI,FEDER M,etal.Novel inhibitorsof the rRNA ErmC'methyltransferase to block resistance to macrolides,lincosamides,streptogramine B antibiotics[J].Eur J Med Chem,2018,146(2):60-67.
[12]PAWLOWSKIA C,STOGIOS P J,KOTEVA K,et al.The evolution of substrate discrimination in macrolide antibiotic resistance enzymes[J].Nat Commun,2018,9(1):112.
[13]THONG K L,TAN L K,OOI P T.Genetic diversity,virulotyping and antimicrobial resistance susceptibility of Yersinia enterocolitica isolated from pigs and porcine products in Malaysia[J].J Sci Food Agr,2018,98(1):87-95.
[14]HAXELL M A,BISHOP B F,BRYCE P,et al.C-13 beta-acyloxymilbemycins,a new family of macrolides.Discovery,structural determination and biological properties[J].J Antibiot,1992,45(5):659-670.
[15]DUAN R,LIANG J,ZHANG J,et al.Prevalence of Yersinia enterocolitica bioserotype 3/O:3 among children with diarrhea,China,2010-2015[J].Emerg Infect Dis,2017,23(9):1502.
[16]LUCIANIM,SCHIRONE M,PORTANTIO,et al.Development of a rapid method for the detection of Yersinia enterocolitica serotype O:8 from food[J].Food Microbiol,2018,73(8):85-92.
[17]JUN J W,PARK S C,WICKLUND A,et al.Bacteriophages reduce Yersinia enterocolitica contamination of food and kitchenware[J].Int J Food Microbiol,2018,271(8):33-47.
[18]FRAZAO M R,ANDRADE L N,DARINIA L,et al.Antimicrobial resistance and plasmid replicons in Yersinia enterocolitica strains isolated in Brazil in 30 years[J].Brazil J Infect Dis,2017,21(4):477-480.
[19]LUNEC A.Superbugs and superdrugs-SMi's sixth annual conference.A focuson antibacterials[C].Idrugs:the investigational drugsjournal,2004,7(4):323-326.
[20]JACKSON S A,CROSSMAN L,ALMEIDA E L,et al.Diverse and abundant secondary metabolism biosynthetic gene clusters in the genomes of marine sponge derived Streptomyces spp.isolates[J].Marine Drugs,2018,16(2):67.