罗汉果(Siraitia grosvenorii)为广西桂林特产,味甘,性凉,是我国的传统中药,富含维生素C(vitamin C,VC)、糖、氨基酸等多种成分,以及蒽醌、黄酮、多糖、甜甙和多酚等活性物质[1-2],具有止咳祛痰、抗氧化、保肝、抗癌、降脂和减肥[3-4]等作用。近年来研究发现,罗汉果提取物对糖尿病动物有降血糖作用,可调节人体糖代谢[5-7]。α-淀粉酶抑制剂能有效抑制唾液淀粉酶和胰淀粉酶在肠道中的活性,减缓食物中碳水化合物的水解和消化,减少糖分吸收,降低血糖和血脂水平,可用于糖尿病、高血脂、肥胖的预防和治疗[8-9]。内生菌(endophyticbacteria)是栖居于健康植物组织内而对植物不造成任何实质性危害并与植物建立和谐共生关系的微生物[10]。研究表明植物内生菌有可能产生具有降糖活性的代谢产物,可作为降糖活性物质筛选的来源[11]。
目前,罗汉果内生菌方面的研究较少,蒋智[12]从罗汉果根部内生菌中筛选出了两株产罗汉果甜甙V的菌株;张昌志等[13]从罗汉果根中筛选出了产环糊精葡萄糖基转移酶的菌株;范彩琴等[14]从罗汉果果实内生菌中筛选出多株抗氧化活性较高的菌株。由此可见,罗汉果内生菌可作为多种活性物质筛选的微生物资源,有待开发与利用。
本研究对罗汉果内生真菌进行分离,筛选产α-淀粉酶抑制剂的菌株,并追踪菌株发酵产物降糖的有效部位,旨在能够找出一种可用于治疗或缓解糖尿病的新药物,并为罗汉果内生菌的进一步开发利用奠定基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
新鲜的罗汉果植株和果实:于2016年10月采自广西桂林市龙胜县。
1.1.2 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:取去皮土豆200 g,切块,煮沸30 min,8层纱布过滤,加入20 g葡萄糖,20 g琼脂,定容至1 L,pH值自然,121℃灭菌30 min。
发酵培养基:PDA液体培养基,pH值自然,121℃灭菌30 min。
1.1.3 主要试剂
α-淀粉酶(40 U/mL):上海蓝季生物科技发展有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):国药集团化学试剂有限公司;阿卡波糖(5 mg/mL):杭州中美华东制药有限公司;石油醚、乙酸乙酯、正丁醇(均为分析纯):上海润捷化学试剂有限公司。
1.2 仪器与设备
BXM-30R型立式压力蒸汽灭菌锅:上海博讯实业有限公司医疗设备厂;HZ200LB型恒温摇床、HP400S型生化培养箱:武汉瑞华仪器设备有限责任公司;UV mini-1240型紫外分光光度计:日本岛津公司;KQ-500VDE型双频数控声波清洗器:昆山市超声器有限公司。
1.3 方法
1.3.1 罗汉果内生菌分离纯化
用自来水将罗汉果根洗净、晾干,使用体积分数75%乙醇浸泡1 min,无菌水冲洗一次,次氯酸钠浸泡13 min,无菌水冲洗3次,再用体积分数75%乙醇浸泡1 min,无菌水冲洗3次,完成表面灭菌处理。取最后一次洗涤材料的无菌水涂布于PDA培养基上,作为阴性对照,将表面灭菌处理后的罗汉果材料剪碎接种到PDA培养基上,然后置于28℃恒温培养箱中培养,定期观察生长情况,待材料周围长出菌落,则进行分离纯化得到罗汉果内生菌,最后将分离出的菌株接种到PDA试管斜面中4℃保藏待用。
1.3.2 α-淀粉酶抑制剂产生菌的筛选
内生菌的发酵:将筛选出的内生菌活化后接种到装液量为200 mL/500 mL三角瓶的发酵培养基中,28℃、150 r/min条件下培养7 d。发酵结束后减压抽滤得到发酵液,采用打洞法和Bernfeld法进行α-淀粉酶抑制剂产生菌的筛选。
打洞法[15]:将2%淀粉溶液与4%琼脂溶液等体积混匀加热溶解,精确量取40 mL倒平板,待完全凝固后用直径为1 cm打孔器呈正三角形状打孔备用。将发酵液与1 mg/mL α-淀粉酶液等体积混合,37℃水浴30 min,取0.4 mL注入平板中的孔洞中,37℃恒温反应24 h(蒸馏水作阴性对照,1 mg/mL阿卡波糖作阳性对照)。反应完后用稀碘液显色,显色后采用直尺测量平板透明圈大小,根据平板上透明圈的有无以及与对照组透明圈大小的对比判断发酵液中是否含有α-淀粉酶抑制剂以及作用的强弱。
Bernfeld法[16-18]:精确量取0.25 mL样品与1 mg/mL α-淀粉酶溶液等体积混合,37℃温浴10 min后加入预热至37℃的1.5%可溶性淀粉溶液0.5 mL,37℃温浴5 min,加入DNS溶液1 mL,沸水浴5 min,迅速冷却至室温,稀释10倍后静置30 min,于波长540 nm处测定OD540 nm值,记为V样。以蒸馏水代替供试溶液测定OD540 nm值记为V max;以蒸馏水代替供试溶液和α-淀粉酶溶液测定OD540nm值记为V min;以蒸馏水代替α-淀粉酶溶液测定OD540nm值记为V本,计算样品对α-淀粉酶的抑制率R,计算公式如下:
1.3.3 α-淀粉酶抑制剂活性部位的追踪[19]
将筛选所得菌株的1 L发酵液分别减压抽滤,得到发酵液和菌丝体。
菌丝体在50℃恒温烘干后,研磨粉碎,称取10 g样品,分别采用500 mL的蒸馏水和体积分数70%的乙醇溶液置于50℃超声波清洗器中浸提30 min,重复3次,减压浓缩10倍,分别得到菌丝体水提物和醇提物,采用打洞法检测其是否对α-淀粉酶具有抑制活性,以判断菌丝体是否具有α-淀粉酶抑制活性。
发酵液浓缩至500 mL,再依次使用石油醚、乙酸乙酯和正丁醇3种有机溶剂等体积分别萃取3次,合并萃取液,减压浓缩得到石油醚相、乙酸乙酯相、正丁醇相和萃取后剩余的水相共4种浸膏。称取一定量各相的浸膏,用蒸馏水配制成质量浓度为1 mg/mL的待测液,采用Bernfeld法检测发酵液的各萃取相对α-淀粉酶的抑制活性。以质量浓度为1 mg/mL的阿卡波糖溶液作为阳性对照组,同时以不加α-淀粉酶溶液作为空白对照组和以水代替发酵液作为阴性对照组。
1.3.4 α-淀粉酶抑制剂活性部位化学成分分析
将具有α-淀粉酶抑制活性的有效相浸膏制成水悬液,采用颜色反应或沉淀反应进行化学成分研究。具体实验方法参考文献[20]。
1.3.5 α-淀粉酶抑制剂产生菌株初步鉴定
采用点植法将菌株接种于PDA平板培养基上,28℃条件下培养3 d,观察菌株菌落形态,并在光学显微镜下观察菌体形态,对菌株进行初步鉴定。
2 结果与分析
2.1 罗汉果内生菌分离纯化结果
从罗汉果根中分离纯化得到10株内生菌,分别编号为PD-1~PD-10。
2.2 α-淀粉酶抑制剂产生菌筛选结果
采用打洞法筛选α-淀粉酶抑制剂产生菌,结果见图1和表1。采用Bernfeld法筛选α-淀粉酶抑制剂产生菌,结果见表1。
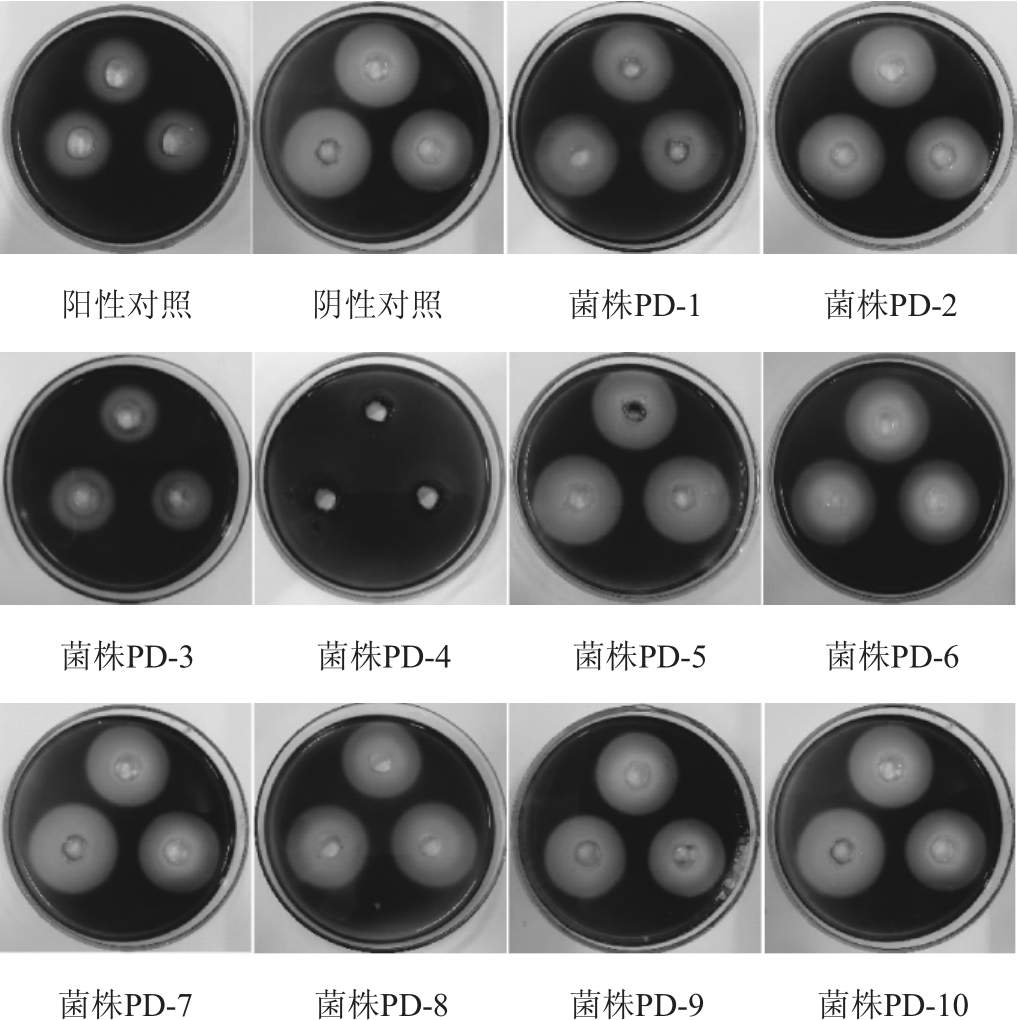
图1 基于打洞法α-淀粉酶抑制剂产生菌的筛选结果
Fig.1 Screening results of theα-amylase inhibitors-producing strain by hole drilling method
表1 α-淀粉酶抑制剂产生菌筛选结果
Table 1 Screening results of theα-amylase inhibitors-producing strain
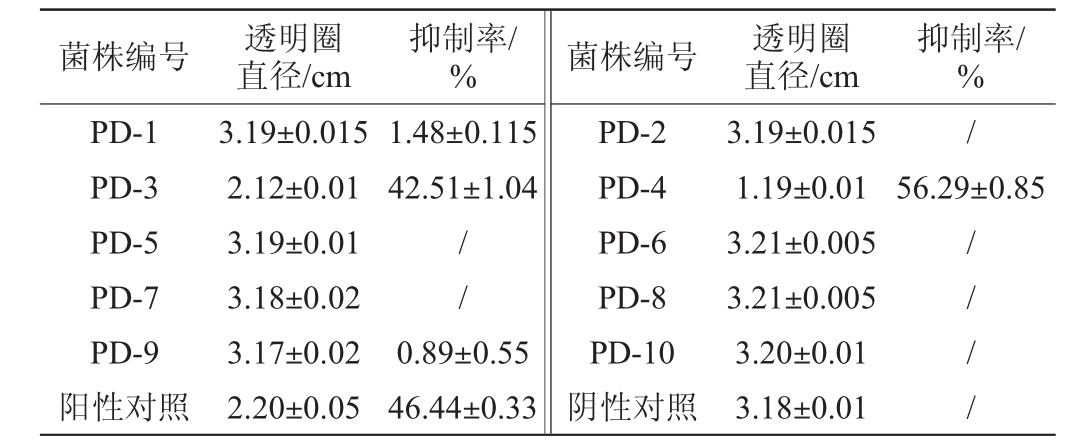
注:“/”代表无抑制率。
菌株编号 透明圈直径/cm抑制率/%菌株编号透明圈直径/cm抑制率/%PD-1 PD-3 PD-5 PD-7 PD-9阳性对照3.19±0.015 2.12±0.01 3.19±0.01 3.18±0.02 3.17±0.02 2.20±0.05 1.48±0.115 42.51±1.04/56.29±0.85/ /0.89±0.55 46.44±0.33 PD-2 PD-4 PD-6 PD-8 PD-10阴性对照3.19±0.015 1.19±0.01 3.21±0.005 3.21±0.005 3.20±0.01 3.18±0.01/ / / /
由图1和表1可知,分离的10株菌株中,菌株PD-3和PD-4的透明圈直径分别为2.12 cm和1.19 cm,较阿卡波糖阳性对照(2.2 cm)小;对α-淀粉酶的抑制率分别为42.51%和56.29%,与阿卡波糖(46.44%)相比,具有较强的α-淀粉酶抑制活性。两种方法的测定结果相同,说明它们都对α-淀粉酶具有较强的抑制活性;而其他菌株的透明圈直径与阴性对照一样,且α-淀粉酶抑制率极低或无,说明它们均无α-淀粉酶抑制活性。因此,选取菌株PD-3和PD-4进行进一步的研究。
2.3 α-淀粉酶抑制剂活性部位的追踪
2.3.1 菌株菌丝体提取物α-淀粉酶抑制活性测定结果
以水代替发酵液作为阴性对照组,采用打洞法测定菌株PD-3与PD-4的菌丝体水提物与醇提物对α-淀粉酶的抑制活性,结果表明,菌株PD-3水提物与醇提物的透明圈直径分别为(3.19±0.01)cm、(3.21±0.005)cm;菌株PD-4水提物与醇提物的透明圈直径分别为(3.18±0.02)cm、(3.19±0.01)cm;与阴性对照(3.18±0.01)cm相比,菌株PD-3与PD-4的菌丝体水提物与醇提物均对α-淀粉酶无抑制活性。
2.3.2 菌株发酵液α-淀粉酶抑制活性测定结果
采用Bernfeld法测定菌株PD-3与PD-4的发酵液各萃取相对α-淀粉酶的抑制活性,结果如图2所示。
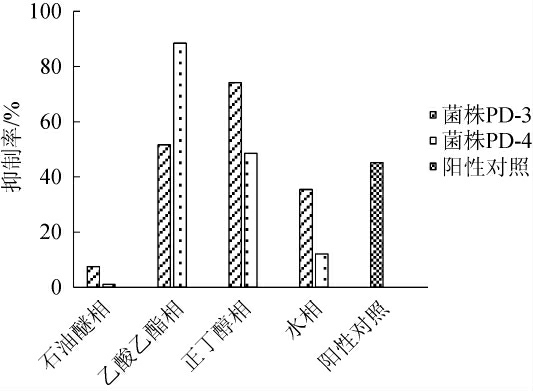
图2 菌株PD-3与PD-4发酵液α-淀粉酶的抑制结果
Fig.2 Inhibiting results of fermentation broth of strain PD-3 and PD-4 onα-amylase
由图2可知,当供试液质量浓度为1 mg/mL时,与阳性对照阿卡波糖(45.17%)相比,菌株PD-3抑制α-淀粉酶的有效相为正丁醇相,其α-淀粉酶抑制活性最高,为74.19%,其次为乙酸乙酯相(51.61%),其他相活性低;菌株PD-4抑制α-淀粉酶的有效相为乙酸乙酯相,其α-淀粉酶抑制活性最高,为88.46%,其次为正丁醇相(48.52%),其他相活性低。结果表明,两株菌发酵液经萃取后活性成分得到初步纯化和富集,最终获得菌株PD-3、PD-4发酵液对α-淀粉酶抑制活性较高的有效相分别为正丁醇相和乙酸乙酯相。
2.4 α-淀粉酶抑制剂活性部位化学成分分析结果
表2 有效相中α-淀粉酶抑制剂活性化学成分分析结果
Table 2 Analysis results of active chemical composition of α-amylase inhibitors in effective phases

化学成分 菌株PD-3 菌株PD-4蛋白质氨基酸多肽还原糖多糖有机酸鞣质类酚类化合物甾体或三萜类化合物黄酮类- - - + + - - - - +- - - + - - - + - +
续表

注:“+”表示有此成分,“-”表示无此成分。
化学成分 菌株PD-3 菌株PD-4醌类生物碱香豆素与萜类内酯化合物- - -+ - -
由表2可知,初步判断菌株PD-3的有效相正丁醇相中主要含有多糖、黄酮等化学成分,菌株PD-4的有效相乙酸乙酯相中主要含有还原糖、黄酮、酚和醌等化学成分。
2.5 菌株形态观察结果
菌株PD-3与PD-4形态观察结果见图3。
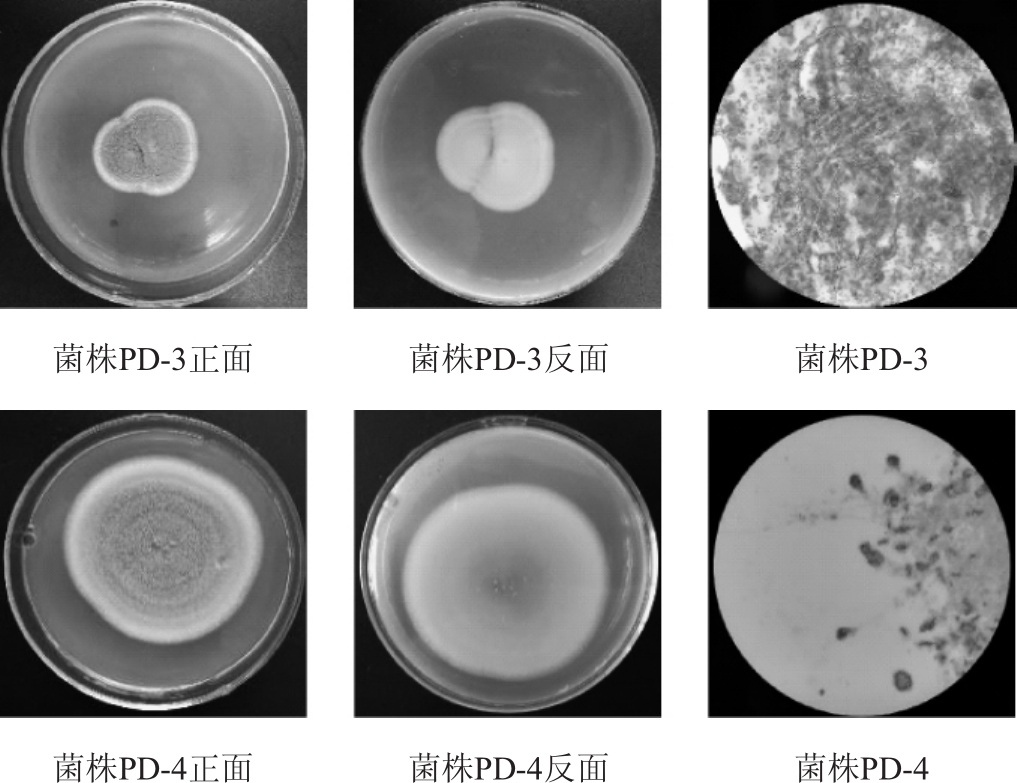
图3 菌株PD-3与PD-4的菌落及菌丝形态
Fig.3 Colonies and mycelium morphology of strain PD-3 and PD-4
由图3可知,菌株PD-3菌落表面为灰绿色,边缘白色,背面微黄色,菌丝顶部有多细胞的分生孢子梗,孢子串生呈卵圆形。菌株PD-4菌落正面灰绿色,呈环状往外生长,背面黄色,菌丝体无隔,菌丝顶部有多细胞的分生孢子梗,孢子卵圆形。初步鉴定菌株PD-3与PD-4均为青霉属(Penicillium)。
3 结论
从罗汉果根中分离纯化得到10株内生菌,采用打孔法和Bernfeld法从中筛选出2株产α-淀粉酶抑制剂的菌株PD-3和PD-4,两菌株发酵液对α-淀粉酶的抑制率分别为42.51%和56.29%;具有α-淀粉酶抑制活性的均为发酵液,菌丝体没有α-淀粉酶抑制活性;发酵液经有机溶剂萃取、初步纯化后,当供试液质量浓度为1 mg/mL时,菌株PD-3的正丁醇相对α-淀粉酶的抑制率最高,为74.19%,而菌株PD-4的乙酸乙酯相对α-淀粉酶的抑制率最高,为88.46%,经有机溶剂萃取可对菌株产物实现初步的纯化和富集,较1 mg/mL阿卡波糖对α-淀粉酶的抑制率(45.17%)高,表明罗汉果内生真菌发酵产物具有较强的α-淀粉酶抑制活性;有效相化学成分分析结果显示,菌株PD-3的有效相正丁醇相主要含有多糖、黄酮等化学成分,菌株PD-4的乙酸乙酯相主要含有还原糖、黄酮、酚和醌等化学成分,具体哪种化学成分起到降糖作用有待于进一步的研究。两菌株经形态观察均初步鉴定为青霉属(Penicillium)。
[1]何伟平,朱晓韵,何超文.罗汉果的应用研究进展及产品开发中存在的问题[J].食品工业科技,2012,33(11):400-402.
[2]钮彪.两种传统中药的化学成分及其药理活性研究[D].北京:中国科学院大学,2017.
[3]SUNBS,CHENY P,WANGY B,etal.Anti-obesity effectsof mogrosides extracted from the fruits of Siraitia grosvenorii(Cucurbitaceae)[J].Afr J Pharm Pharmacol,2012,6(20):1492-1501.
[4]张静,吴友良,张婵娟,等.罗汉果药理活性研究进展[J].中国药业,2010,19(20):84-86.
[5]张俐勤,戚向阳,陈维军,等.罗汉果皂苷提取物对糖尿病小鼠血糖、血脂及抗氧化作用的影响[J].中国药理学通报,2006,22(2):237-240.
[6]POONGUNRAN J,PERERA H K I,JAYASINGHE L,et al.Bioassayguided fractionation and identification ofα-amylase inhibitors from Syzygium cumini leaves[J].Pharmaceut Biol,2017,55(1):206.
[7]贾彦凤.鹰嘴豆α-淀粉酶抑制剂CL-AI的制备、生物学特性及立体结构解析[D].南京:南京农业大学,2016.
[8]LIU S,LID,HUANG B,et al.Inhibition of pancreatic lipase,α-glucosidase,α-amylase,and hypolipidemic effects of the total flavonnids from Nelumbo nucifera leaves[J].J Ethnopharmacol,2013,149(1):263-269.
[9]时东方.药用植物白鲜皮和罗汉果主要化学成分提取分离及生物活性研究[D].长春:东北师范大学,2016.
[10]SHAHZAD R,KHAN A L,BILAL S,et al.Inoculation of abscisic acid-producing endophytic bacteria enhances salinity stress tolerance in Oryza sativa[J].Environ Exper Botany,2017,136:68-77.
[11]PATEL J K,ARCHANA G.Diverse culturable diazotrophic endophytic bacteria from Poaceae,plants show cross-colonization and plant growth promotion in wheat[J].Plant Soil,2017,417(1-2):1-18.
[12]蒋智.产甜甙V罗汉果内生真菌的研究[D].桂林:广西师范大学,2015.
[13]张昌志,范彩琴,龙楚媚,等.罗汉果内生菌中产环糊精葡萄糖基转移酶菌株的筛选及产酶条件优化[J].中国酿造,2018,37(5):97-102.
[14]范彩琴,张昌志,龙楚媚,等.罗汉果内生真菌的分离及其发酵产物的抗氧化活性研究[J].中国酿造,2017,36(12):46-50.
[15]苏照环.海洋生境分泌α-淀粉酶抑制剂微生物的筛选及活性成分纯化的研究[D].桂林:广西师范大学,2013.
[16]STERCHI E E,STCHER W,BOND J S.Meprins,membeance-bound and secreted astacinmetall oproeinases[J].Mol Aspect Med,2008,29(5):309-328.
[17]王宁丽,魏鉴腾,祝潇,等.基于碘-淀粉显色的α-淀粉酶抑制剂筛选方法研究及应用[J].中国海洋药物,2017,36(5):75-78.
[18]吴慧平,王洪兰,张喆,等.夏枯草迷迭香酸成分分析及其对α-糖苷酶活性影响研究[J].中药材,2011,34(11):1712-1715.
[19]高义霞,陶超楠,郑婷,等.乳苣不同溶剂提取物对α-淀粉酶的抑制作用及光谱研究[J].食品工业科技,2018,39(7):104-109.
[20]杨小良,刘振飞.鬼灯笼叶与茎的化学成分分析[J].中国民族民间医药,2017,26(14):39-41.