全球化石能源储备的急剧消耗,以及过度使用化石能源带来的环境污染,这使得人们对新型清洁能源的开发以及相关的研究日趋亟切。利用玉米、木薯等淀粉类粮食作物生产生物乙醇,是发展生物能源的一种途径,但这会带来较为严重的粮食压力。木质纤维素是地球上存量巨大的生物质资源之一,理论上可将其水解成可发酵的糖,从而进一步转化为乙醇[1]。木质纤维素在自然界中的含量极其丰富,利用木质纤维素发酵的乙醇可缓解能源危机,同时减缓粮食压力,确保经济的可持续发展,但由于技术瓶颈,木质纤维素也是当前利用率相对较低的生物质资源[2]。因此,提高木质纤维素的利用,是我国新资源发展战略之一[3]。
物理化学的方法水解木质纤维素的工艺条件苛刻,环境污染大,不适合大批量工业生产[4]。生物法是指直接利用微生物或微生物所产的酶来水解木质纤维素。由于作用的媒介是微生物或酶,因此与物理化学法相比,生物法具有工艺条件温和、操作简单、耗能低、有害副产物少等优点,但生物法转化的技术依赖于高效纤维素酶的发掘。
纤维素酶在自然界中分布广泛,存在于许多微生物、植物及昆虫中。白蚁作为一种以纤维素原料为食物的昆虫,其肠道内的微生物菌群具有发达的纤维素酶系[5-8]。有研究者已从白蚁体内分离得到大量具有纤维素酶活性的可培养共生菌,并成功对白蚁的内源性纤维素酶进行异源表达[9-11]。黄小晖等[12]从白蚁肠道中分离出一株链霉菌(Streptomyces),其纤维素酶酶活为583 U/mL;李丹红等[13]从象白蚁(Nasutitermes sp.)肠道中分离得到菌群,其纤维素酶酶活为0.5 U/mL;POURRANMEZAN Z等[14]从锯白蚁肠道分离出芽孢杆菌(Bacillus)B5B和不动杆菌(Acinetobacter)L9B,纤维素酶酶活分别为1.47 U/mL、1.22 U/mL。
因此,本研究从广西柳州本地的台湾乳白蚁(Coptotermes formosanus)体内分离筛选一株纤维素降解菌,对其进行鉴定,并绘制该菌株的生长曲线及测定纤维素酶活力。为生物降解纤维素方面的研究提供相关的理论依据和新的菌种资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
台湾乳白蚁(Coptotermes formosanus)75只:广西科技大学校园桦树。
1.1.2 试剂
蛋白胨、酵母膏(生化试剂):英国Oxoid公司;琼脂(生化试剂):美国英杰Invitrogen公司;预混脱氧核糖核酸(deoxyribonucleic acid,DNA)聚合酶(0.1 U/μL)、胶回收试剂盒:天根生化科技(北京)有限公司;DL5000 DNA Marker:宝生物工程(大连)有限公司;细菌微量生理生化鉴定管:杭州滨和微生物试剂有限公司;血平板:广东环凯微生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
初筛液体培养基:蛋白胨3.0 g/L,酵母提取物0.5 g/L,(NH4)2SO4 2.0 g/L,KH2PO4 4.0 g/L,CaCl2 0.3 g/L,MgSO4 0.3 g/L,纤维素钠(c arboxy methyl cellulose-Na,CMC-Na)10.0 g/L,pH 7.0。
初筛固体培养基:在初筛液体培养基中加入琼脂18.0g/L。
复筛液体养基:CMC-Na20g/L,KH2PO42.0g/L,(NH4)2SO4 1.4 g/L,MgSO4 0.3 g/L,CaCl2 0.3 g/L,FeSO4 0.005 g/L,MnSO4 0.016 g/L,ZnCl2 0.017 g/L,pH 7.0。
复筛固体培养基:在复筛液体培养基中加入琼脂18.0g/L。
滤纸降解培养基:(NH4)2SO4 2.0 g/L,NaCl 0.5 g/L,KH2PO4 1.0 g/L,MgSO4 0.5 g/L,定量滤纸6 cm×1 cm。
LB培养基:蛋白胨10.0 g/L,酵母提取物5.0 g/L,NaCl 10.0 g/L,pH 7.4。
种子培养基:蛋白胨3.0 g/L,酵母提取物5.0 g/L,MgSO4 5.0 g/L,CMC-Na 10 g/L,KCl 5.0 g/L,NaNO3 3.0 g/L,K 2HPO4 1.0 g/L,pH自然。
发酵培养基:CMC-Na 10.0 g/L,蛋白胨8.0 g/L,酵母提取物4.0 g/L,K 2HPO4 1.0 g/L,pH自然。
以上培养基均于121℃高压蒸汽灭菌20 min。
1.2 仪器与设备
Tpersonal聚合酶链式反应(polymerase chain reaction,PCR)仪:德国Biometra公司;DYY-6D型电泳仪:济南东仪实验室设备有限公司;ZXRD-B5210鼓风干燥箱:上海双旭电子有限公司;H1850R台式高速冷冻离心机:湖南湘仪离心机仪器有限公司;ZHJH-C1112C超净工作台、HWY-2112全温度恒温调速摇床柜:上海智城分析仪器制造有限公司;LRH-250生化培养箱:广东省医疗器械厂。
1.3 方法
1.3.1 纤维素降解菌的筛选和分离纯化
初筛:分别使用无菌水和无菌磷酸盐缓冲液(phosphate buffered saline,PBS)(Na2HPO4 8 mmol/L、NaCl 136 mmol/L、KH2PO4 2 mmol/L、KCl 2.6 mmol/L,pH=7.4)清洗台湾乳白蚁,再将台湾乳白蚁置于无菌研钵中研磨至糜烂状,然后加入0.85%生理盐水,收集研磨液。将收集的研磨液加入初筛液体培养基中,于37℃、120 r/min条件下培养24 h。取培养液涂布于初筛固体培养基,于37℃条件下倒置培养48 h。
复筛:将所得分离菌的单菌落接种于复筛液体培养基培养,之后涂布于复筛固体培养基进行纯化培养并保藏菌种,培养条件同上。
1.3.2 菌株鉴定
形态观察:将分离菌株划线于复筛固体培养基平板划线,于37℃条件下倒置培养48 h观察单菌落形态。将分离菌株编号,接种到LB液体培养基中,37℃、120 r/min条件下培养72 h,取样,进行革兰氏染色观察。
生理生化鉴定:参考文献[15]对分离菌株进行生理生化测试,根据细菌生化管说明书判断实验结果。
分子生物学鉴定:采用16S rDNA通用引物(27F:5′-AGAGTTTGATCCTGGCTCAG-3′;1492R:5′-GGTTACCTTGTTACTT-3′)进行菌落PCR扩增。PCR扩增体系:双蒸水(ddH2O)22μL,2×Mix酶25μL,上、下游引物各1μL,菌液1μL。PCR扩增条件:94℃预变性5 min;94℃变性30 s,55℃退火30 s,72℃延伸90 s,30个循环;72℃再延伸10 min。4 ℃条件下保存。PCR扩增产物利用1.0%琼脂糖凝胶电泳进行检测,使用凝胶回收试剂盒进行纯化回收。将纯化后的PCR扩增产物TA克隆后送至上海英潍捷基贸易有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中进行BLAST序列比对,并利用Mega 7.0软件中的邻接法(neighbor joining,NJ)构建系统发育树。
1.3.3 滤纸降解试验
取分离菌株接种于LB培养基中,37℃、120 r/min条件下培养12 h,作为种子液。按1%(V/V)的接种量将种子液加入含滤纸的100 mL滤纸液体培养基中,37℃、100 r/min条件下培养6~8 d,观察并记录试验现象,考察菌株是否具有降解木质纤维素的能力。
1.3.4 分离菌株生长曲线的绘制
将上述种子液按1%(V/V)的接种量接入100 mL发酵培养基中,37℃、150 r/min条件下培养60 h,于不同时期取样测定细胞生长浓度(OD600 nm值)并绘制成生长曲线。
1.3.5 纤维素酶活测定
参考文献[16]的测定方法并加以改进:将反应时间调整为20 min,利用3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)法测定纤维素酶活力。以波长540 nm处吸光度值(y)为纵坐标,葡萄糖质量浓度(x)为横坐标绘制葡萄糖标准曲线,绘得线性方程为y=11.523x-0.030 2,R2=0.990 2。由标准曲线回归方程计算得到葡萄糖质量浓度,再计算得到纤维素酶活力,其计算公式如下:
式中:M为还原糖质量,mg;D为粗酶液稀释倍数;T为酶促反应时间,min;V为粗酶液体积,mL;1 000为mg转化为μg的转化系数。
纤维素酶活单位定义:在50℃、pH 5.0条件下,1 mL酶液在1 min内催化1%的CMC-Na生成1μg葡萄糖所需的酶量为一个酶活力单位(1 U/mL)。
2 结果与分析
2.1 纤维素降解菌筛选结果
通过初筛固体培养基平板分离筛选获得3个单菌落,白色单菌落,黄色单菌落,直径相对较小的白色单菌落,分别命名为菌株BW、BY和SW。将其接种于以CMC-Na为唯一碳源的复筛液体培养基进行复筛,之后涂布于复筛固体培养基平板培养获得纯化的菌落。以1%的CMC-Na为底物测得其纤维素酶活分别为93.73 U/mL、70.02 U/mL和25.93 U/mL。其中菌株BW纤维素酶酶活较高,即以菌株BW为目标菌株。
2.2 菌株BW鉴定
2.2.1 形态观察
菌株BW的菌落形态及细胞形态结果见图1。
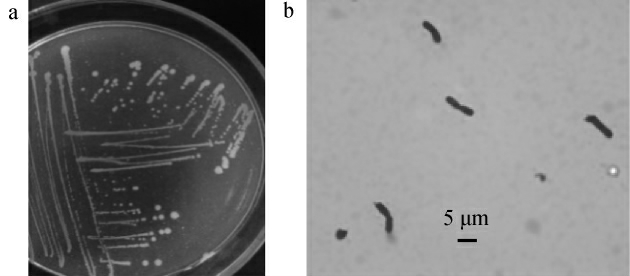
图1 菌株BW的菌落(a)及细胞(b)形态特征
Fig.1 Colony(a)and cell(b)morphology characteristics of strain BW
由图1a可以看出,菌株BW的菌落呈白色凸起,表面光滑、湿润。由图1b可以看出,菌株BW革兰氏染色呈阴性、菌体呈杆状、成对排列,通过菌体形态初步判断菌株BW为杆菌。
2.2.2 生理生化特性鉴定
菌株BW的生理生化试验结果见表1。
表1 菌株BW的生理生化特性
Table 1 Physiological and biochemical characteristics of strain BW
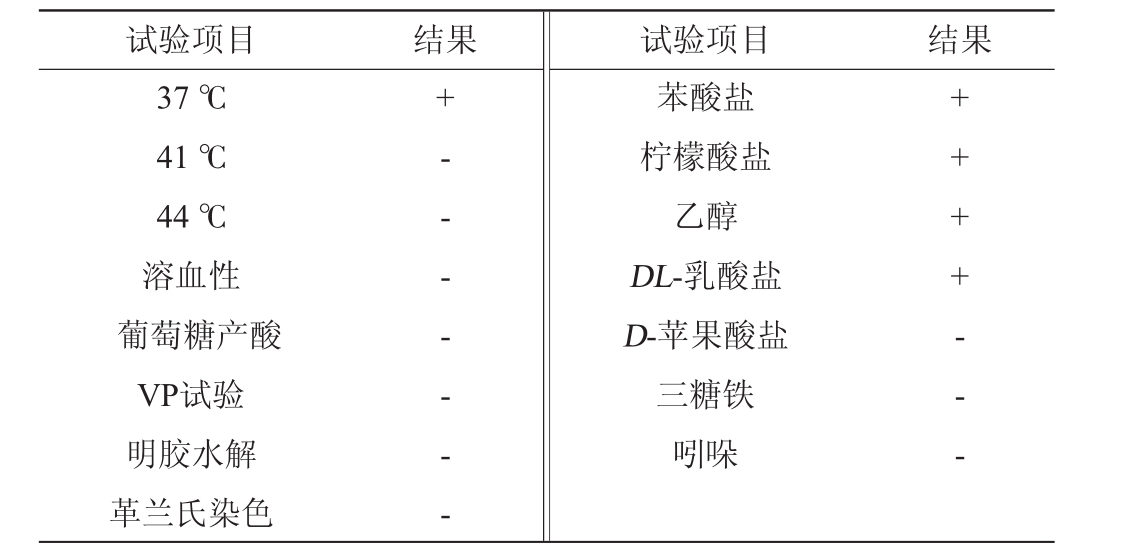
注:“-”表示结果呈阴性;“+”表示结果呈阳性。
项目 结果44℃溶血性葡萄糖产酸VP试验明胶水解革兰氏染色- - - - - -盐酸盐乙醇DL-乳酸盐D-苹果酸盐三糖铁吲哚+ + + + - - -
由表1可知,菌株BW在37℃条件下可生长,而在41℃、44℃条件下无法生长,溶血性、葡萄糖产酸、VP试验、吲哚试验、明胶水解、革兰氏染色皆为阴性,可利用苯酸盐、柠檬酸盐、乙醇、DL-乳酸盐,不能利用D-苹果酸盐、三糖铁。该试验结果与参考文献[17]约氏不动杆菌(Acinetobacter johnsonii)[18]的菌种表型特性一致。经生理生化实验结果,可初步确定菌株BW为约氏不动杆菌(Acinetobacter johnsonii)。
2.2.3 分子生物学鉴定
采用菌落PCR技术扩增菌株BW的16S rDNA序列,PCR扩增结果如图2所示。
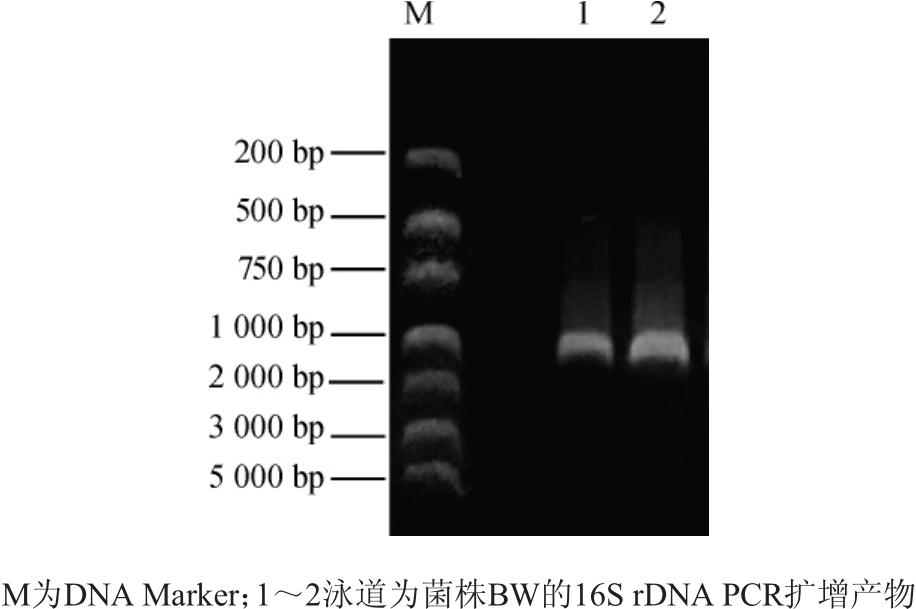
图2 菌株BW的16S rDNA PCR扩增产物电游泳图
Fig.2 Electrophoretogram of PCR amplification products of 16S rDNA of strain BW
由图2可知,扩增的目的基因片段大小约为1 500 bp,与理论一致。根据BLAST序列同源性分析比对结果,选取同源性较高的菌株,采用MEGA7.0中的邻接法构建系统发育树,结果如图3所示。
由图3可知,菌株BW菌与约氏不动杆菌(Acinetobacter johnsonii)聚于一支,亲缘性较近,同源性≥99%。结合形态观察、生理生化试验结果,鉴定菌株BW为一株约氏不动杆菌(Acinetobacter johnsonii)。
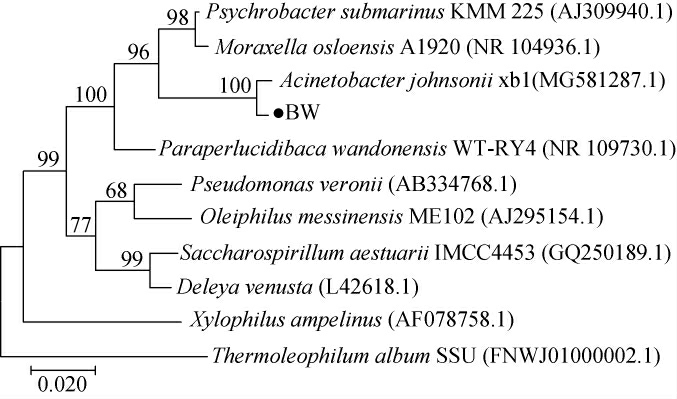
图3 基于16S rDNA序列菌株BW的系统发育树
Fig.3 Phylogenetic tree of strain BW based on 16S rDNA sequences
近几年有研究者分离出一些具有特殊降解能力的不动杆菌,如可分解马拉硫磷(硫代磷酸酯)[19]、柴油[20]、乙酰丙酮[21-22]以及在低温碱性条件下降解脂肪特性的菌株[23-24]。而已有的针对纤维素分解菌的报道中,有关不动杆菌属(Acinetobacter sp.)的纤维素分解菌的研究相对较少。SHILRK等[24]从负泥虫中分离出一株醋酸钙不动杆菌(Acinetobacter calcoaceticus),并未准确测得纤维素酶酶活大小;李静等[25]从杜鹃林的土壤中分离鉴定获得一株纤维素酶酶活力为71.75μmol/mL的不动杆菌属细菌,其只鉴定到属;EKPERIGINMM[26]从非洲大蜗牛中分离出一株无硝不动杆菌(Acinetobacter anitratus),纤维素酶活最高为0.48μmol/(mL·min)。
2.3 滤纸降解结果
菌株BW接种于滤纸液体培养基培养6~8 d后,滤纸边缘出现膨胀并有弯曲,溶液稍浑浊,有较多小絮状沉淀现象。从试验现象和结果可以判定,菌株BW可降解木质纤维素,具有一定的降解木质纤维素的潜力。
2.4 菌株BW的生长曲线及纤维素酶活测定结果
菌株BW的生长曲线及其在不同时期的纤维素酶酶活测定结果见图4。
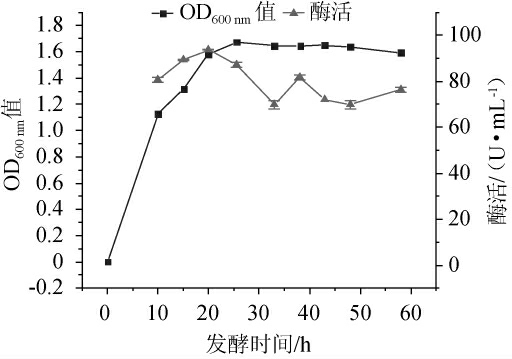
图4 菌株BW的生长曲线及纤维素酶酶活
Fig.4 Growth curve and cellulase activity of strain BW
由图4可知,菌株BW在0~10 h为迟缓期、10~20 h为对数期、20~50 h为稳定期、50~60 h为衰退期。发酵时长20 h时,纤维素酶活达最高,为(93.73±0.22)U/mL。在纤维素降解方面有较大的潜力,对其最适产酶条件以及最高酶活有待进一步探究。
3 结论
本研究从广西柳州本地的台湾乳白蚁(Coptotermes formosanus)体内分离纯化获得一株具有降解纤维素能力的菌株,编号为BW,经形态观察、生理生化试验及分子生物学鉴定为一株约氏不动杆菌(Acinetobacter johnsonii),37℃、150 r/min培养25 h后菌体生物量达到最大,而20 h左右纤维素酶酶活达到最大,为(93.73±0.22)U/mL。为不动杆菌属细菌在生物降解纤维素的研究方面提供了新的菌种资源。
[1]DEMIRBAS A.Biofuels sources,biofuel policy,biofuel economy and global biofuel projections[J].Energ Convers Manage,2008,49(8):2106-2116.
[2]LYND L R,LASER M S,BRANSBY D,et al.How biotech can transform biofuels[J].Nat Biotechnol,2008,26(2):169-172.
[3]刘振东,李贵春,杨晓梅,等.我国农业废弃物资源化利用现状与发展趋势分析[J].安徽农业科学,2012,40(26):13068-13070.
[4]WYMAN C E.Biomass ethanol:technical progress,opportunities,and commercial challenges[J].Annu Rev Energ Env,1999,24(1):189-226.
[5]孙建中,陈春润.昆虫与生物质能源利用:一个新的交叉学科前沿[J].昆虫知识,2010,47(6):1033-1042.
[6]刘冰,林景栋,宋水林,等.白蚁肠道可培养菌群及其功能初探[J].生物灾害科学,2012,35(2):172-176.
[7]CHRISTEL M,JULIEN B,CATHERINE B,et al.Identification and characterization of a new xylanase from Gram-positive bacteria isolated from termite gut(Reticulitermes santonensis)[J].Protein Expres Purif,2012,83(2):117-127.
[8]KUDO T.Termite-microbe symbiotic system and its efficient degradation of lignocellulose[J].Biosci Biotech Bioch,2009,73(12):2561-2567.
[9]王巍.白蚁肠道木质素分解菌的分离鉴定及PY12 LiP基因的克隆与序列分析[D].长春:吉林农业大学,2013.
[10]章珍.黑翅土白蚁内源性纤维素酶基因在毕赤酵母的表达[D].杭州:浙江大学,2014.
[11]刘晓静.白蚁肠道元基因组来源β-葡萄糖苷酶bgl2、bgl15和bgl17的酶学性质研究[D].镇江:江苏科技大学,2015.
[12]黄小晖,付日辉,李德,等.白蚁肠道纤维素分解菌的筛选鉴定及产酶条件的研究[J].江西农业大学学报,2009,31(6):1140-1145.
[13]李丹红,徐荣,张坤迪,等.象白蚁肠道中一个纤维素降解菌群的分离和特性研究[J].生物资源,2017,39(4):272-278.
[14]POURRANMEZAN Z,GHEZELBASH GR,ROMANIB,et al.Screening and identification of newly isolated cellulose-degrading bacteria from the gut of xylophagous termite Microcerotermes diversus(Silvestri)[J].Microbiology,2012,81(6):736-742.
[15]TEIXEIRA L M,MERQUIOR V L C.The Family Moraxellaceae[M]//The Prokaryotes:Gammaproteobacteria.Rosenberg E,DeLong E F,Lory S,(eds)..Berlin,Heidelberg:Springer,2014:443-476.
[16]GHOSE T K.Measurement of cellulase activities[J].Pure Appl Chem,1987,59(2):257-268.
[17]PHILIPPE J M B,GRIMONT P.Taxonomy of the genus Acinetobacter with the recognition of Acinetobacter baumannii sp.nov.Acinetobacter haemolyticus sp.nov.Acinetobacter johnsonii sp.nov.and Acinetobacter junii sp.nov.and emended descriptionsof Acinetobacter calcoaceticus and Acinetobacter lwofii[J].Int J Syst Bacteriol,1986,36(2):228-240.
[18]XIE S,LIUJX,LIL,et al.Biodegradation of malathion by Acinetobacter johnsonii MA19 and optimization of cometabolism substrates[J].J Environ Sci,2009,21(1):76-82.
[19]LEE M,WOO S G,TEN L N.Characterization of novel diesel-degrading strains Acinetobacter haemolyticus MJ01 and Acinetobacter johnsonii MJ4 isolated from oil-contaminated soil[J].World J Microbiol Biotechn,2012,28(5):2057-2067.
[20]STRAGANZ G D,GLIEDER A,BRECHKER L,et al.Acetylacetonecleaving enzyme Dke1:a novel C-C-bond-cleaving enzyme from Acinetobacter johnsonii[J].Biochem J,2003,369(3):573-581.
[21]HANNES H,THOMAS M,WALTER S.Diketone cleaving enzyme Dke1 production by Acinetobacter johnsonii-optimization of fermentation conditions[J].J Biotechnol,2004,107(1):73-81.
[22]WANG H K,SHAO J,WEIY J.et al.A novel low-temperature alkaline lipase from Acinetobacter johnsonii LP28 suitable for detergent formulation[J].Food Technol Biotech,2011,49(1):96-102.
[23]HAIK W,JIE Z,XIAO J W.et al.Genome shuffling improves production of the low-temperature alkalophilic lipase by Acinetobacter johnsonii[J].Biotechnol Lett,2012,34(1):145-151.
[24]SHIL R K,MOJUNMDER S,SADIDA F F.et al.Isolation and identification of cellulolytic bacteria from the gut of three phytophagus insect species[J].Braz Arch Biol Techn,2014,6(57):927-932.
[25]李静,张瀚能,赵翀.等.高效纤维素降解菌分离筛选、复合菌系构建及秸秆降解效果分析[J].应用与环境生物学报,2016,22(4):689-696.
[26]EKPERIGIN M M.Preliminary studies of cellulase production by Acinetobacter anitratus and Branhamella sp.[J].African J Biotechnol,2007,6(1):28-33.