
水平 A 青稞粉质量分数/% B 酵母菌接种量/% C 发酵温度/℃-1 0 1 4 6 8 2 3 4 25 30 35
Optimization of fermentation process of highland barley powder by response surface method and its hypoglycemic activity in vitro
青稞(Hordeum vulgare Linn),俗称裸大麦,又称元麦[1],属于禾本科大麦属农作物,主要分布在西藏、青海、四川等高原地区[2]。研究表明,青稞中含有多种人体必需氨基酸,并具有“高蛋白、高纤维素、高维生素、低脂肪、低糖”的特性[3],将其加工成为功能性食品可起到抗炎、抗癌、抗糖尿病、抗菌、抗衰老、缓解高血糖症和高血脂症的作用[4],青稞中富含的β-葡聚糖[5]具有抑制和治疗阿尔兹海默症、Ⅱ型糖尿病、癌症、冠心病等一些慢性和代谢性疾病的功能特性,且具有降低餐后血糖和胰岛素水平的效果[6],对预防心血管疾病,糖尿病等有显著作用[7]。但淀粉作为青稞中的主要营养成分,其消化速率及程度会直接影响餐后血糖反应[8],此问题限制了青稞在低糖饮食人群中的普及利用[9]。
淀粉作为人类营养物质的重要来源,是青稞中最主要成分,其消化速率及程度会直接影响餐后血糖反应,含量在64%左右,其中支链淀粉含量占70%以上[10],不同植物来源的淀粉在结构、糊化特性、淀粉老化特性等方面差异显著,而淀粉的不同特性对最终食品的品质也有所影响。依据淀粉在模拟人体消化道中的水解快慢速率可将其分为三类[11-12]:①20 min内能被α-淀粉酶和葡萄糖淀粉酶降解的淀粉称为快消化淀粉(rapidly digestible starch,RDS);②20~l20 min内能被降解的淀粉为慢消化淀粉(slowly digestible starch,SDS)[13-14];③超过120 min都未能被降解的淀粉称之为抗消化淀粉(resistant starch,RS)。ENGLYST H N等[12]研究表明,体外淀粉消化速率与血糖反应之间存在密切关系,RDS能在摄入淀粉后快速提高人体血糖水平,为人体提供必要能量以维持身体和中枢神经系统的正常生理功能。而大量的葡萄糖从RDS中快速释放会导致血糖和胰岛素水平快速升高从而引发代谢性慢性疾病,如2型糖尿病[15]。SDS消化缓慢,但可以在小肠中被完全吸收并维持人体血液中的葡萄糖浓度[16]。RS在人体消化道中无法被消化,但可以在结肠中被微生物降解发酵,有利于肠道菌群调节和预防代谢性疾病[17-18],调控淀粉消化速率对日常健康尤为重要[19]。动物试验表明,若饮食中包含SDS,会延迟胰岛素抗性的发生[20]。餐后血糖应答很大程度上取决于RDS的含量,而SDS可持续缓慢释放出能量,维持餐后血糖稳定,还可以降低餐后胰岛素分泌,提高机体对胰岛素的敏感性[21]。SDS含量高的食物还有饱腹感,可以作为肥胖人群的减肥产品,还可以作为长跑运动员的碳水化合物补充剂,对正常人群也大有裨益[22]。α-淀粉酶和α-葡萄糖苷酶可以促进肠道食物中碳水化合物如淀粉等分解成单糖,从而引起餐后血糖升高,抑制α-葡萄糖苷酶的活性可以减少单糖的生成,从而降低餐后血糖,通过体外抑制α-淀粉酶和α-葡萄糖苷酶活性试验可以评价降糖活性[23]。
酵母菌是一种单细胞真菌生物,在有氧和无氧环境下都能生存,属于兼性厌氧菌。由于酵母菌具有产淀粉酶的能力,其在发酵过程中可分泌淀粉酶使淀粉部分水解为还原糖,自然发酵后的淀粉在4 ℃环境下回生后,热流焓值明显增大,同时直链淀粉含量越高,回升过程中支链淀粉越容易成核结晶,淀粉的消化速率明显降低[24]。王唯浩等[25]研究发现,通过酵母菌发酵小米,可使小米淀粉的分子结构、糊化及老化特性发生明显变化。寇芳等[26]研究酵母菌发酵处理对小米粉物理化学性质的影响,得出酵母菌发酵可使小米粉的物理化学特性发生改变,使小米粉更有利于发展利用。张天学[27]采用热处理青稞粉,研究湿热和干热处理对青稞淀粉结构和性质的影响,结果发现,通过热处理后青稞中的快消化淀粉含量明显降低。
目前国内外很多学者对青稞淀粉的研究主要集中于与其他植物来源淀粉的理化特性分析比较[28],以及对青稞淀粉进行改性处理方面的研究,王金斌等[29]研究了青稞慢消化淀粉酶法制备技术;张倩倩[30]对青稞慢性消化淀粉的制备条件进行了优化,但鲜见以微生物发酵增加其慢消化淀粉含量方面的研究,郑子懿等[31]采用固态发酵探究慢消化淀粉含量。发芽能有效改善青稞的营养成分和抗氧化活性,能够从整体上提高青稞的营养价值[32-33]。
本研究以萌芽黑青稞粉为原材料,通过酵母菌发酵增加青稞慢消化淀粉含量。采用单因素试验及响应面试验优化其发酵工艺,并通过测定α-葡萄糖苷酶抑制率评价发酵青稞粉体外降血糖活性。旨在拓展青稞在食品上的应用,推进高原健康食品的发展,为青稞功能性食品的深度开发利用奠定理论基础,对糖尿病患者及需低糖饮食人群也有一定意义。
萌芽黑青稞粉:青海汉和生物科技股份有限公司;蔗糖(分析纯):天津市河东区红岩试剂厂;酿酒酵母(Saccharomyces cerevisiae):安琪酵母股份有限公司;猪胰α-淀粉酶(50 U/mg):合肥博美生物科技有限责任公司;糖化酶(10万U/mL):江苏锐阳生物科技有限公司;α-葡萄糖苷酶(70万U/mL):上海吉至生化科技有限公司;50 T/48 h淀粉试剂盒:北京索宝来生物科技有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)(分析纯):上海展云化工有限公司;氢氧化钠、酒石酸钾钠、乙酸(均为分析纯):天津市河东区红岩试剂厂;苯酚(分析纯):天津市致远化学试剂有限公司;无水亚硫酸钠(分析纯):天津市光复精细化工研究所;无水碳酸钠(分析纯):天津市科密欧化学试剂有限公司。
YM 50立式压力蒸汽灭菌器:上海三申医疗器械有限公司;DHG9070A电热鼓风干燥箱:上海一恒科学仪器有限公司;XW-80A漩涡振荡仪:海门市其林贝尔仪器制造有限公司;LR10M大容量冷冻离心机、H/T16MM台式高速离心机:湖南赫西仪器装备有限公司;UV-1780紫外可见分光光度计:岛津仪器(苏州)有限公司;Tissuelyser-96多样品组织研磨仪:上海净信实业发展有限公司。
1.3.1 发酵青稞粉的制备
称取一定量的萌芽黑青稞粉于锥形瓶中,于121 ℃条件下灭菌20min。灭菌结束后置于超净工作台紫外杀菌30min,将活化酵母菌(0.2 g蔗糖、8.8 mL水及1 g酵母于32 ℃活化15~20 min)、pH 5.2的缓冲溶液、无菌水加入锥形瓶中在一定温度条件下发酵一定时间。发酵结束后,将锥形瓶放入50 ℃水浴锅中10 min,进行灭酵母菌处理,于5 000 r/min离心10 min,得到的固体沉淀用蒸馏水洗涤,并按上述条件再次离心,重复操作两次,离心结束后,将沉淀移入培养皿中,于60 ℃条件下烘干处理,得到发酵青稞粉。将发酵青稞粉置于多样品组织研磨仪中以90 s、50 Hz条件下粉碎成粉,备用。
1.3.2 发酵工艺优化
(1)单因素试验
发酵时间的确定:在发酵温度为30 ℃、青稞粉质量分数为6%、酵母菌接种量为3%的条件下,分别测定发酵时间为12 h、24 h、36 h、48 h、60 h时的慢消化淀粉含量。
发酵温度的确定:在发酵时间为24 h、青稞粉质量分数为6%、酵母菌接种量为3%的条件下,分别测定发酵温度为20 ℃、25 ℃、30 ℃、35 ℃、40 ℃条件下,发酵青稞粉中慢消化淀粉含量。
青稞粉质量分数的确定:在发酵时间为24 h、发酵温度为30 ℃、酵母菌接种量为3%的条件下,分别测定青稞粉质量分数为2%、4%、6%、8%、10%条件下,发酵青稞粉中慢消化淀粉含量。
酵母菌接种量的确定:在发酵时间为24 h、发酵温度为30 ℃、青稞粉质量分数为6%的条件下,分别测定酵母菌接种量为1%、2%、3%、4%、5%条件下,发酵青稞粉中慢消化淀粉含量。
(2)响应面试验
依照单因素试验所得的结果,通过Design-Expert 8.0.6软件,根据Box-Benhnken试验设计原理,选取青稞粉质量分数(A)、酵母菌接种量(B)、发酵温度(C)作为自变量,以慢消化淀粉含量(Y)为响应值,采用3因素3水平响应面试验进行发酵工艺条件优化。Box-Benhnken试验设计因素与水平见表1。

水平 A 青稞粉质量分数/% B 酵母菌接种量/% C 发酵温度/℃-1 0 1 4 6 8 2 3 4 25 30 35
1.3.3 总淀粉含量的测定
总淀粉含量的测定采用检测试剂盒法。以0.10 mg/mL、0.05 mg/mL、0.04 mg/mL、0.03 mg/mL、0.02 mg/mL、0.01 mg/mL葡萄糖标准溶液质量浓度(x)为横坐标,以波长620 nm处测定吸光度值(y)为纵坐标,绘制葡萄糖标准曲线,得到标准曲线回归方程:y=12.192x+0.002,相关系数R2=0.999 2,总淀粉含量计算公式如下:
式中:TS为总淀粉含量,mg/g;X为测得的吸光度值对应标准曲线回归方程的葡萄糖含量,mg/mL;D为稀释倍数1 000;V为提取后总体积,mL;W为称取的改性青稞粉质量,g;1.11为换算系数。
1.3.4 慢消化淀粉含量的测定
葡萄糖标准曲线的绘制:配制1 mg/mL的葡萄糖标准溶液,分别吸取0、0.2 mL、0.4 mL、0.6 mL、0.8 mL、1.0 mL的葡萄糖标准溶液,加蒸馏水至1 mL,再分别加入2 mL DNS试剂,沸水浴加热2 min,流水冷却,用水补足到15 mL,于波长540 nm处测定吸光度值,平行测定3次。标准曲线回归方程Y=0.931 6X-0.002 4,相关系数R2=0.999 8。
慢消化淀粉含量测定采用体外模拟消化法[34]。称取发酵青稞粉0.2g,加入1 mol/LpH 5.2 的乙酸钠缓冲溶液15 mL,同时加入5颗玻璃珠,加入混酶液(猪胰α-淀粉酶300 U/mL,糖化酶15 U/mL)10 mL。立即放入37 ℃转速为150 r/min恒温振荡锅中分别反应0、20 min、120 min后,取出沸水浴灭酶10 min,放入冷水中冷却至常温,即得体外模拟消化液。取灭酶后的体外模拟消化液5 mL于离心管中,放入离心机4 500 r/min离心15 min,取上清液100 μL,加入900 μL蒸馏水后,加2 mL DNS,沸水浴反应5 min后,冷水循环冷却至室温后加入12 mL蒸馏水,混匀,使用紫外分光光度仪在波长540 nm处测定吸光度值,每个样品分别做3组平行。葡萄糖含量及慢消化淀粉含量计算公式如下:
式中:G为葡萄糖含量,mg/g;At为测试溶液的吸光度值;D为稀释倍数;W为样品的质量,g;0.002 4、0.931 6为葡萄糖标曲系数。
式中:SDS为慢消化淀粉含量,%;G120为120 min时的葡萄糖含量,mg/g;G20为20 min时的葡萄糖含量,mg/g;0.9为还原糖(以葡萄糖计)换算成淀粉的换算系数;mTS为样品中总淀粉质量,mg。
1.3.5 α-葡萄糖苷酶抑制率的测定
参照赖晓桦等[35]的方法,称取0.05 g改性青稞粉,加入0.05 mol/L(pH 6.8)磷酸盐缓冲液(phosphate buffer solution,PBS)600 μL,滴加300 μL 20 mmol/L对硝基苯基-α-D-吡喃葡萄糖苷(p-nitrophenyl-α-D-glucopyranoside,PNPG)溶液,并在37 ℃振荡水浴锅中酶解20 min,后滴加0.2 U/mL的α-葡萄糖苷酶溶液200 μL,室温反应10 min后,加入0.1 mol/L Na2CO3 2 mL终止反应,3 000 r/min离心10 min,吸取200 μL上清液于96孔板中,用酶标仪于波长405 nm处测定吸光度值。α-葡萄糖苷酶抑制率计算公式如下:
式中:a为含有α-葡萄糖苷酶溶液和待测样品的测定吸光度值;b为不含α-葡萄糖苷酶溶液含待测样品的测定吸光度值;c为含有α-葡萄糖苷酶溶液不含样品的测定吸光度值;d为不含α-葡萄糖苷酶溶液和待测样品的测定吸光度值。
1.3.6 数据处理
同一处理的样品做3组平行,使用Excel 2016、Origin 2021软件进行数据处理、分析及作图,响应面试验结果利用Design-Expert 8.0.6软件进行处理。
2.1.1 发酵时间对青稞慢消化淀粉含量的影响
由图1可知,当发酵时间在12~24 h时,慢消化淀粉含量呈现上升趋势;当发酵24 h时,慢消化淀粉含量达到最高值32.55%;当发酵时间>24 h之后,慢消化淀粉含量随着时间的延长又呈现下降趋势。原因可能是微生物生长要经过停滞期、对数生长期、稳定期和衰退期四个阶段,微生物发酵产物和含量随着发酵微生物的生长阶段而改变。一般情况下,发酵初期,随着发酵时间的延长,产品的慢消化淀粉含量逐渐升高,到了稳定期,产品的慢消化淀粉含量基本保持恒定,此时应停止发酵,进入衰退期,产品的慢消化淀粉含量会逐渐降低,因此,最佳发酵时间为24 h。
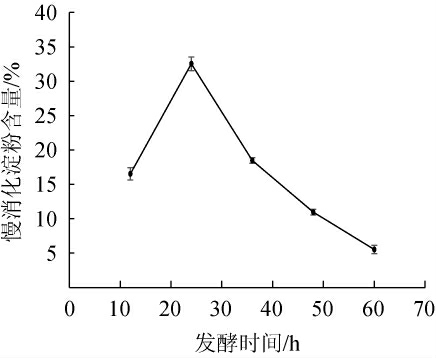
图1 发酵时间对青稞慢消化淀粉含量的影响
Fig.1 Effect of fermentation time on slow-digestible starch content of highland barley
2.1.2 发酵温度对青稞慢消化淀粉含量的影响
由图2可知,当发酵温度在20~30 ℃时,慢消化淀粉含量呈逐渐上升趋势;当发酵温度为30 ℃时,慢消化淀粉含量达到最高值34.78%;当发酵温度>30 ℃之后,慢消化淀粉含量呈下降趋势。原因可能是温度对发酵的影响是多方面的。菌体生长和代谢产物的形成是各种因素综合表现的结果。从酶反应动力学来看,温度升高,反应速度加大,生长代谢加快,产物生成提前。但是,温度愈高酶失活愈快,菌体易于衰老,影响产物的生成。因此,最佳发酵温度为30 ℃。
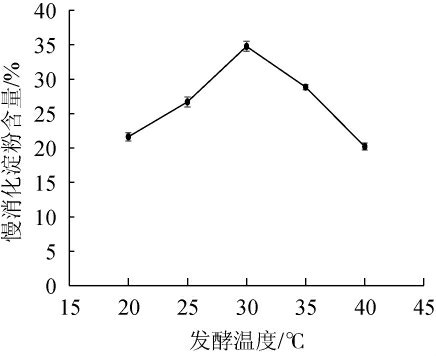
图2 发酵温度对青稞慢消化淀粉含量的影响
Fig.2 Effect of fermentation temperature on slow-digestible starch content of highland barley
2.1.3 青稞粉质量分数对青稞慢消化淀粉含量的影响
由图3可知,当青稞粉质量分数为2%~6%时,慢消化淀粉含量呈上升趋势;当青稞粉质量分数为6%时,慢消化淀粉含量达到最高值33.11%;当青稞粉质量分数为6%~10%时,慢消化淀粉含量呈下降趋势。原因可能是青稞粉质量分数过高时,不利于菌种生长繁殖,产生的淀粉酶较少,进而导致慢消化淀粉含量较少;而青稞粉质量分数过低则会抑制菌种与空气的接触,本实验所用酵母菌为兼性厌氧菌,在无氧条件下一般仅维持生存,代谢不完全,水解淀粉能力弱,产生慢消化淀粉含量少[36]。因此,最佳青稞粉质量分数为6%。
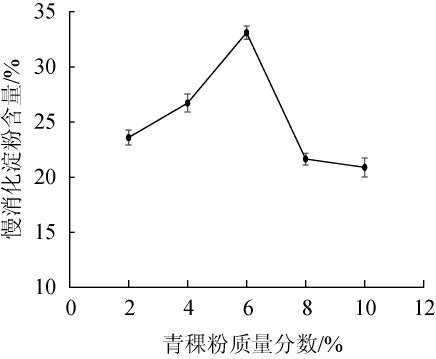
图3 青稞粉质量分数对青稞慢消化淀粉含量的影响
Fig.3 Effects of highland barley powder mass fraction on slow-digestible starch content of highland barley
2.1.4 酵母菌接种量对青稞慢消化淀粉含量的影响
由图4可知,随着酵母菌接种量的增加,慢消化淀粉的含量呈先升高后降低的趋势。当酵母接种量为1%~3%时,慢消化淀粉的含量随之增加;当酵母接种量为3%时,慢消化淀粉含量达最高值34.81%;当酵母菌的接种量>3%之后,慢消化淀粉的含量随之下降。随着接种量增加,微生物生长所需的营养物质需求更高发酵底物中的营养物质有限,不利于微生物的生长,慢消化淀粉含量又逐渐降低。因此,最佳酵母菌接种量为3%。
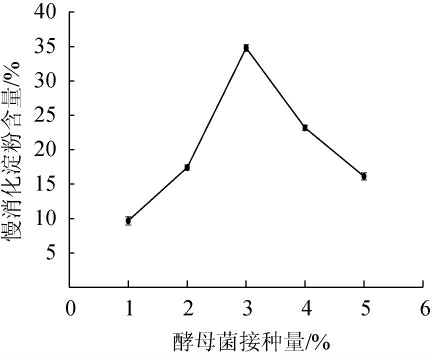
图4 酵母菌接种量对青稞慢消化淀粉含量的影响
Fig.4 Effect of yeast inoculum on slow-digestible starch content of highland barley
2.2.1 模型的建立及显著性检验
在单因素试验基础上,通过Design-Expert 8.0.6软件,根据Box-Benhnken试验设计原理,选取青稞粉质量分数(A)、酵母菌接种量(B)、发酵温度(C)作为自变量,以慢消化淀粉含量(Y)为响应值,采用Box-Benhnken试验设计出17个试验方案,测定每组试验条件下慢消化淀粉含量,Box-Benhnken试验设计及结果见表2,方差分析结果见表3。
表2 发酵工艺优化Box-Benhnken试验设计及结果
Table 2 Design and results of Box-Benhnken experiments for fermentation process optimization
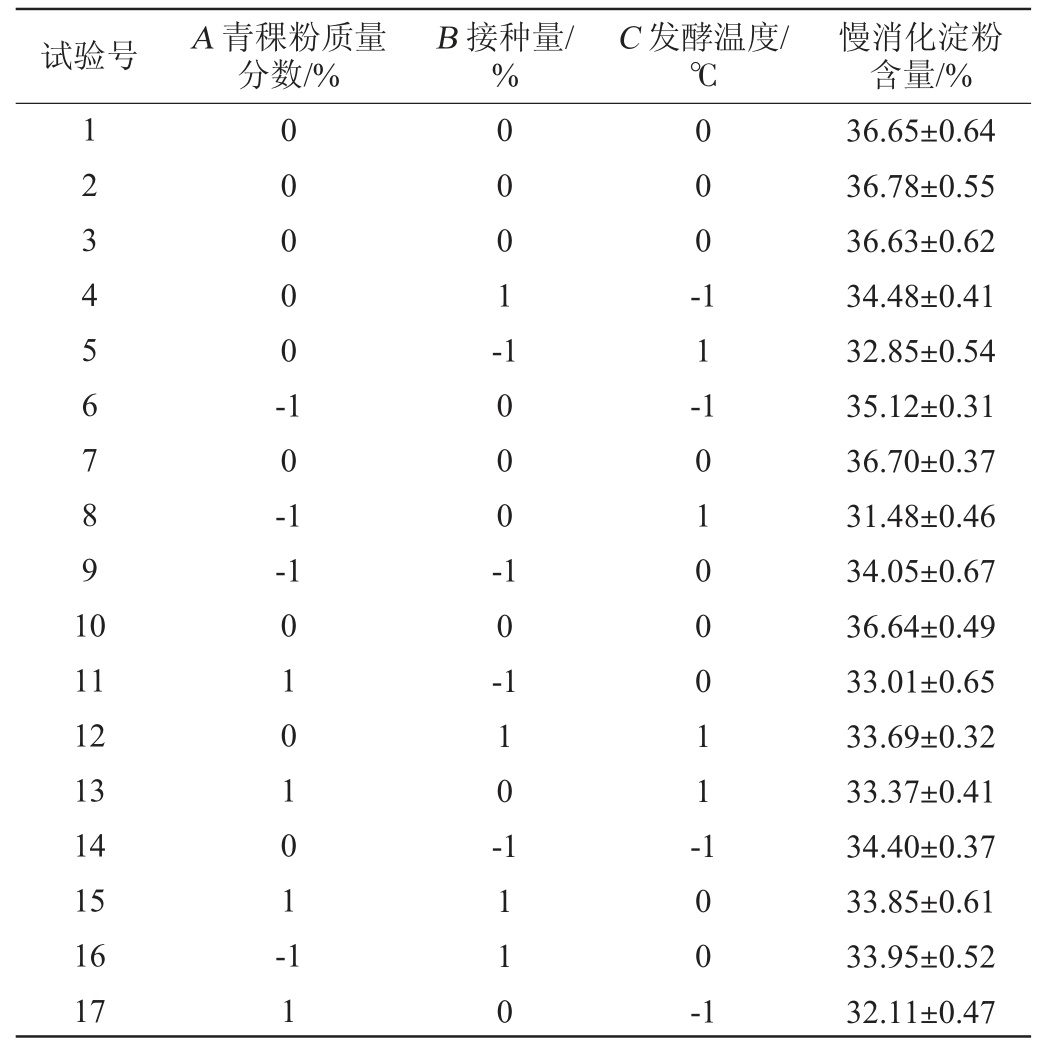
试验号 A 青稞粉质量分数/%B 接种量/%C 发酵温度/℃慢消化淀粉含量/%1234567891 0 00000-0 001-000-10-1 11--1 1000-11 12 13 14 15 16 17 010101-10-110-10100011-11 1110 100 -1 36.65±0.64 36.78±0.55 36.63±0.62 34.48±0.41 32.85±0.54 35.12±0.31 36.70±0.37 31.48±0.46 34.05±0.67 36.64±0.49 33.01±0.65 33.69±0.32 33.37±0.41 34.40±0.37 33.85±0.61 33.95±0.52 32.11±0.47
表3 回归模型方差分析
Table 3 Variance analysis of regression model
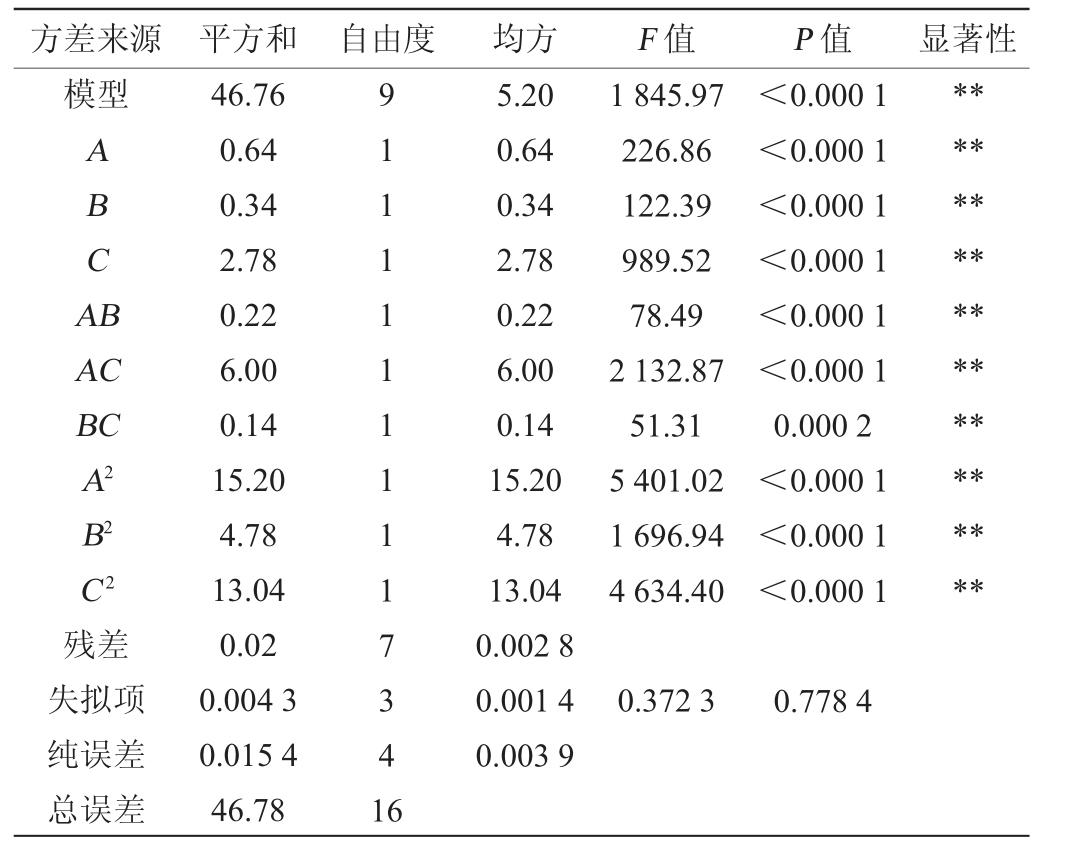
注:“**”表示对结果影响极显著(P<0.000 1)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型ABCA B AC BC A2 B2 C2残差失拟项纯误差总误差46.76 0.64 0.34 2.78 0.22 6.00 0.14 15.20 4.78 13.04 0.02 0.004 3 0.015 4 46.78 91111111117341 6 5.20 0.64 0.34 2.78 0.22 6.00 0.14 15.20 4.78 13.04 0.002 8 0.001 4 0.003 9 1 845.97 226.86 122.39 989.52 78.49 2 132.87 51.31 5 401.02 1 696.94 4 634.40<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1<0.000 1 0.000 2<0.000 1<0.000 1<0.000 1********************0.372 3 0.778 4
对表2数据采用Design-Expert 8.0.6软件进行拟合,得到慢消化淀粉含量与青稞粉质量分数(A)、酵母菌接种量(B)、发酵温度(C)的二次多项回归方程如下:
Y=36.68-0.28A+0.21B-0.59C+0.23AB+1.23AC+0.19BC-1.90A2-1.06B2-1.76C2
为检验回归方程的可靠性并确定各因素对青稞慢消化淀粉含量的影响程度,对回归方程系数进行显著性检验。由表3可知,该模型F值为1 845.97且P<0.000 1,极显著;失拟项是模型数据变异的体现,失拟项F值为0.372 3,P值为0.778 4>0.05,不显著,表明该模型预测值与实验值拟合效果较好。由P值可知,二次项A2、B2、C2、一次项A、B、C和交互项AB、AC、BC对结果影响极显著(P<0.01)。由F值可知,发酵温度对结果影响最明显,其次是青稞粉质量分数,酵母菌接种量对结果影响最小,即3个因素对慢消化淀粉含量的影响因素大小顺序为C>A>B。
2.2.2 各因素交互作用响应面分析
两因素的叠加作用可以通过响应面的立体图式直观表示出来,主效应因素通过等高线的状态能够将不同因素间叠加作用的具体强弱情况反映出来[37-38]。响应面图中曲线越弯曲、坡度越大,则表明因素对结果影响越大[39]。等高线图形状越趋近于椭圆,则两因素间交互作用越显著,等高线图越接近圆形,则交互作用越不显著。曲面坡度越陡峭,表明响应值对于操作条件的改变越敏感;反之曲面坡度越平缓,操作条件的改变对响应值的影响也就越小[41]。
通过Design-Expert 8.0.6软件,各试验因素交互作用对结果影响响应面及等高线见图5。
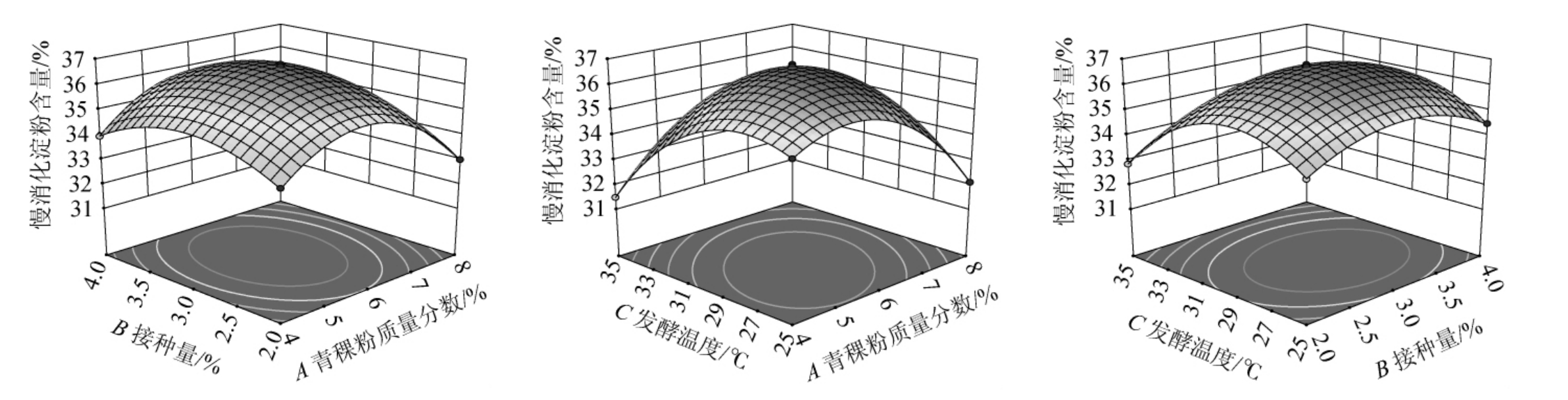
图5 各因素间交互作用对青稞慢消化淀粉含量影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on slow-digestible starch contents of highland barley
由图5a可知,青稞粉质量分数和接种量这两个因素对慢消化淀粉含量的影响极显著[2];由图5b可知,青稞粉质量分数和发酵温度交互作用等高线图接近椭圆,即这两个因素对慢消化淀粉含量的影响极显著;由图5c可知,接种量和发酵温度交互作用等高线图接近椭圆,即这两个因素对慢消化淀粉含量的影响极显著。
2.2.3 验证试验
由Design-Expert8.0.6软件分析得出最佳发酵工艺条件为:发酵温度28.94 ℃、青稞粉质量分数5.72%、酵母菌接种量3.06%,在此最佳条件下,青稞慢消化淀粉含量预测值为36.77%。考虑到实际操作的局限性,将试验条件修正为:发酵温度30 ℃,青稞粉质量分数6%、酵母菌接种量3%,在此优化条件下进行3次平行验证试验,慢消化淀粉含量实际值为35.55%。表明该回归模型可以较好地预测青稞慢消化淀粉含量。
α-葡萄糖苷酶可有效催化水解淀粉和低聚糖,引起餐后血糖升高[42],通过对响应面优化后的最佳发酵工艺下发酵青稞进行α-葡萄糖苷酶抑制率的测定,评价其体外降糖活性。结果表明,未发酵青稞粉α-葡萄糖苷酶抑制率为41.46%,通过测定以响应面优化试验所制得的发酵青稞粉为原料的α-葡萄糖苷酶抑制率为69.86%。由此可得,在最佳发酵工艺下,发酵青稞粉的α-葡萄糖苷酶抑制率明显升高,为后期研发低血糖生成指数(low glycemic index,LGI)保健食品提供理论基础。
本研究在单因素试验的基础上采用响应面法优化青稞粉发酵工艺条件,并通过测定α-葡萄糖苷酶抑制率评价发酵青稞粉体外降血糖活性。结果显示,最佳发酵工艺条件为:发酵时间24 h、发酵温度30 ℃、青稞粉质量分数6%、酵母菌接种量3%。在此优化条件下,青稞粉中慢消化淀粉含量为35.55%。与未经过发酵处理的青稞粉相比,慢消化淀粉含量增加了23.23%。在体外降糖活性试验中,测定α-葡萄糖苷酶抑制率为69.86%,比未发酵青稞粉α-葡萄糖苷酶抑制率增加了28.4%。本研究为青稞的高效利用及青稞淀粉作为功能性食品在预防心血管疾病,预防糖尿病,控制体重等方面的开发利用奠定了理论基础。
[1]谢宗万.本草纲目药物彩色图鉴[M].北京:人民卫生出版社,2001:221.
[2]陆培,安明哲,李茂,等.青稞营养成分研究进展及其应用现状[J].酿酒科技,2022(7):110-116.
[3]孙培利,车正新,焦捷,等.复合菌种发酵对青稞淀粉品质的影响[J].食品与发酵工业,2020,46(14):176-181.
[4]OBADI M,SUN J,XU B.Highland barley:Chemical composition,bioactive compounds,health effects,and applications[J].Food Res Int,2021,140:110065.
[5]冯格格,佘永新,洪思慧,等.青稞中主要功效成分最新研究进展[J].农产品质量与安全,2020(2):82-89.
[6]CAVALLERO A,EMPILLI S,BRIGHENI F,et al.High(1→3,1→4)β-Glucan barley fractions in breadmaking and their effects on human glycemic response[J].J Cereal Sci,2002,36(1):59-66.
[7]次仁央宗.浅谈青稞的成分研究进展及其开发利用现状[J].西藏科技,2020(9):11-12.
[8]吕元娣.青稞淀粉及其改性产品的性能及应用研究[D].广州:华东理工大学,2016.
[9]方圆,任欣,彭洁,等.青稞及其制品的体内外淀粉消化特性[J].食品科学技术学报,2021,39(1):144-152.
[10]BHATTY R S.Laboratory and pilot plant extraction and purification of β-glucans from hull-less barley and oat brans[J].J Cereal Sci,1995,22(2):163-170.
[11]CHUNG H J,LIU Q,HOOVER R.Impact of annealing and heat-moisture treatment on rapidly digestible,slowly digestible and resistant starch levels in native and gelatinized corn,pea and lentil starches[J].Carbohydr Polym,2009,75(3):436-447.
[12]ENGLYST H N,HUDSON G J.The classification and measurement of dietary carbohydrates[J].Food Chem,1996,57(1):15-21.
[13]胡少新,李国良,付立新,等.辐照玉米淀粉制备慢消化淀粉研究[J].黑龙江农业科学,2020(8):88-91.
[14]刘霞,黄雅萍,卢旭,等.抗性淀粉的结构性质与功能关系研究进展[J].食品与发酵工业,2020,46(18):279-286.
[15] BRENNAN C S.Dietary fibre, glycaemic response, and diabetes[J].Mol Nutr Food Res,2005,49(6):560-570.
[16]ZHANG G,HAMAKER B R.Slowly digestible starch:concept,mechanism,and proposed extended glycemic index[J].Crit Rev Food Sci Nutr,2009,49(10):852-867.
[17] KHAN A, BIBI A, ALI H, et al.Development of resistant starch film coated microparticles for an oral colon-specific drug delivery[J].Starch,2020,72(7-8):1900262.
[18] VERBEKE K, DE PRETER V, DE LOOR J, et al.Resistant starch influences the colonic ammonia metabolism but not the protein fermentation[J].Gastroenterology,2005,128(4):A282.
[19]魏芷茜,欧雨嘉,汤俊杰,等.淀粉消化的影响因素及其速率调控的研究进展[J].福建农林大学学报(自然科学版),2022,51(3):289-297.
[20] LEHMANN U, ROBIN F.Slowly digestible starch-its structure and health implications: a review[J].Trends Food Sci Tech, 2007, 18(7):346-355.
[21]PI-SUNYER F X.Glycemic index and disease[J].Am J Clin Nutr,2002,76(1):290S-298S.
[22] BRAND-MILLER J C, HOLT S H A, PAWLAK D B, et al.Glycemic index and obesity[J].Am J Clin Nutr,2002,76(1):281S-285S.
[23]张丽程,陈佳卓,彭晓赟,等.茯砖茶茶多糖乙酰化修饰及其降血糖活性研究[J].广东化工,2020,47(10):22-23.
[24]李春燕,张雯霞,张玉雪,等.小麦籽粒淀粉与面粉的理化特性差异[J].作物学报,2018,44(7):1077-1085.
[25]王唯浩,寇芳,夏天天,等.酵母菌发酵对小米淀粉分子结构及糊化特性的影响[J].食品添加剂,2017(4):119-126.
[26]寇芳,康丽君,王唯浩,等.发酵处理对小米粉物化特性的影响[J].中国生物制品学杂志,2017,30(6):600-606.
[27]张天学.热处理对青稞淀粉结构和性质的影响[D].广州:华南理工大学,2016.
[28]王晓燕,王蓉福,张昊宇,等.青稞酒曲中糖化菌的筛选鉴定及降低青稞淀粉工艺优化[J].食品与发酵工业,2020,46(5):160-165.
[29]王金斌,李文,张倩倩,等.青稞慢消化淀粉酶法制备技术研究[J].核农学报,2016,30(11):2160-2170.
[30]张倩倩.青稞慢性消化淀粉制备条件的优化及应用[D].上海:上海海洋大学,2015.
[31]郑子懿,李成武,李琳,等.比较发芽和固态发酵对糙米营养及感官品质的影响[J].食品安全质量检测学报,2021,12(11):4467-4473.
[32]苟美玲,张静.发芽对青稞的营养成分和抗氧化活性的影响[J].食品工业科技,2020,41(3):86-89,97.
[33]白术群,李学进,陈兰,等.发芽对2种青稞营养成分及抗氧化活性的影响[J].食品科技,2022,47(1):171-176.
[34]黄峻榕,任瑞珍,蒲华寅,等.慢消化淀粉的消化特性、测定及制备[J].中国粮油学报,2015,30(3):134-139.
[35]赖晓桦,邓甜,胡经飞,等.米糠发酵产物抑制α-葡萄糖苷酶的工艺优化[J].食品工业科技,2021,42(4):128-134.
[36]汤小朋.单菌及混菌固态发酵改善木薯渣品质的研究[D].雅安:四川农业大学,2014.
[37]岑忠用,苏江,高丽霞,等.响应面优化蝙蝠葛根生物碱的提取工艺[J].化学试剂,2021,43(7):986-991.
[38]张言,高定烽,李思敏,等.响应面优化超声辅助提取胭脂果色素工艺研究[J].食品研究与开发,2019,40(9):106-111.
[39]于欢,李露,王思爽,等.响应面法优化酶法提取蜜环菌多肽及其抗疲劳活性[J].食品工业科技,2017,38(23):85-91.
[40]李琪,张慧,安超,等.响应面法优化苦瓜甙的提取工艺及其HPLC测定[J].安徽农业大学学报,2022,49(1):175-180.
[41]吴现芳,赵成爱,余梅燕,等.响应面法优化八宝景天叶总黄酮的超声提取工艺[J].食品工业科技,2013,34(1):224-228.
[42] KUMARI B, SHARMA P, NATH A K.α-Amylase inhibitor in local Himalyan collections of Colocasia: isolation, purification, characterization and selectivity towards α-amylases from various sources[J].Pestic Biochem Phys,2012,103(1):49-55.