火龙果皮花青素生物转化菌株筛选及工艺优化
程水明,李露欣,刘杰凤
(广东石油化工学院 生物工程系,广东 茂名 525000)
摘 要:该研究以火龙果皮粉为发酵基质,采用20种食用真菌进行发酵,通过监测发酵后发酵液中花青素含量的变化,筛选出转化效率高的供试菌株作为火龙果皮发酵菌株,并采用响应面法优化其发酵工艺。结果表明,20种食用真菌中,经蜜环菌(Armillaria mellea)发酵的火龙果皮液中花青素含量最高,其最优发酵工艺为发酵时间5 d、接种量6%、发酵温度25 ℃、料液比1∶50(g∶mL)。在此优化条件下,发酵液中花青素含量达(2.03±0.02)mg/100 mL,是未经食用真菌转化的11.94倍,表明微生物辅助可有效转化火龙果果皮中花青素。
关键词:火龙果果皮;花青素;生物转化;食用真菌;筛选;工艺优化
中图分类号:R283;TS262.7
文章编号:0254-5071(2024)01-0197-06
doi:10.11882/j.issn.0254-5071.2024.01.031
引文格式:程水明,李露欣,刘杰凤.火龙果皮花青素生物转化菌株筛选及工艺优化[J].中国酿造,2024,43(1):197-202.
收稿日期:2023-06-13 修回日期:2023-08-10
基金项目:广东省科技专项资金目(No.mmkj2020048)
作者简介:程水明(1966-),男,教授,博士,研究方向为食品生物技术。
Screening and process optimization of strain biotransforming anthocyanidin from pitaya pericarp
CHENG Shuiming,LI Luxin,LIU Jiefeng
(Department of Bioengineering,Guangdong University of Petrochemical Technology,Maoming 525000,China)
Abstract:Pitaya pericarp powder was fermented with 20 edible fungi as the fermentation substrate.The tested fungus with the highest conversion rate was screened as the fermentation strain of pitaya pericarp by measuring the change of anthocyanin content in fermentation liquid after fermentation,and the fermentation process was optimized by response surface method.The results showed that the content of anthocyanins in pitaya pericarp liquid fermented by Armillaria mellea was the highest among the 20 tested edible fungi.The optimized fermentation conditions were obtained as follows:fermentation time 5 d,inoculum 6%,temperature 25 ℃,material-liquid ratio 1∶50(g∶ml).Under the optimized conditions,the content of anthocyanidin in the fermentation broth was(2.03±0.02)mg/100 ml,which was 11.94 times that of the blank control without fungal transformation,indicating that microbial assistance could effectively transform anthocyanin in pitaya pericarp.
Key words:pitaya pericarp;anthocyanidin;biotransformation;edible fungus;screening;process optimization
火龙果(Hylocereus undulatus Britt)属仙人掌科(Cactaceae)、量天尺属(Hylocereus Britton.&.Rose)[1],果肉颜色多样[2],原产于中美洲[3],中国于1645年引种,目前在福建、广东、海南、台湾及广西大面积种植,规模达3.33~4.00万hm2[4]。火龙果是“花果兼赏,赏食兼用”的园林绿化植物,全身是宝,果皮占火龙果总质量的25%,富含多糖、膳食纤维、天然色素及黄酮类等物质,其中,花青素含量较高。火龙果上市时间集中、量大、货架期短、不易保存;食用后的果皮当作废弃物扔掉,导致严重的资源浪费和环境污染[5]。目前,对果皮的研究利用非常有限,仅限于天然色素和膳食纤维提取[6-12],研究多认为火龙果皮色素成分为β-青苷,不含花青素[6,8]。但杨洪元等[13-14]认为火龙果红色素是由有多种结构的植物色素混合而成,既含甜菜苷,又含花色苷和花青素等。色素提取研究较多地集中于红色素方面,有关花青素、甜菜苷研究成果报道少且存在不全面、不系统、不深入等问题,值得进一步研究。
目前,花青素主要靠物理手段或化学方法从植物材料中直接提取[8-10],但存在易破坏花青素结构且工艺复杂、有机溶剂使用量大、毒性高、提取率低、产品纯度不高,大规模制备时经济成本高且操作困难等不足。如何经济有效地提高花青素提取率一直是个探索热点。与传统的物理化学提取方法相比,生物转化因其具有选择性高、可限制不需要副产物的联产、常在温和的温度及压力下进行等特点,随着生物代谢调控手段及合成生物学的迅速发展,以生长周期短、遗传背景简单、操作方便的微生物作为生物代谢反应器进行天然活性产物合成(如黄酮类物质)逐渐成为研究热点[15]。利用微生物发酵植物在《千金要方》[14]中已有记载,现代利用微生物发酵植物研究始于上个世纪八十年代,如淡豆豉、六神曲、豆黄等[16-18];其研究成果充分证明微生物转化是有效增加天然产物多效性方法之一,已在食品、医药、工业等领域广泛应用[15,18],但运用食用真菌来发酵火龙果皮提取相关活性物质则报道甚少。如何有效地提高植物材料中花青素类物质的产量,这一困惑生产实践中的问题,既需从学术理论上加以阐述,又关乎相关产业转型与持续发展,值得深入研究与探讨。
基于此,本研究选用20种食用真菌分别发酵火龙果皮,利用pH示差法测定发酵液中花青素含量,筛出适用于火龙果皮发酵的食用真菌菌株,并在单因素试验基础上,以花青素含量为响应值,通过响应面法优化菌株发酵工艺条件,为植物材料中花青素类物质的资源开发及深度利用提供科学的方法与依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
火龙果(Hylocereus undulatus Britt),品种为玉龙果,产于广东湛江,市购。
20种供试食用真菌:滑菇(Pleurotus ostreatus)、茯苓(Wolfporia cocos)、黄伞(Pholiota adiposa)、香菇(Lentinula edodes)、阿魏菇(Pleurotus ferulae)、猴头菇(Hericium erinaceus)、蛹虫草(Cordyceps militaris)、毛栓菌(Trametes hirsuta)、桑黄(Fleckedflesh polypore)、金针菇(Flammulina velutipes)、绣球菌(Sparassis crispa)、长根菇(Pleurotus ne brodensis)、黑平菇(Pleurotus ostreatus)、裂褶菌(Schizo phyllum commune)、野蘑菇(Agaricus arvensis)、蜜环菌(Armillaria mellea)、灰褐香蘑(Lepista panaeola)、白小圈齿麟伞(Pholiota albocrenulata)、玉覃离褶伞(Lyophyllum shimeji)、毛柄库恩菇(Kuehneromyces mutabilis),依次用2~21表示,所有菌株均由中国农业科学院菌种保藏中心提供。
1.1.2 试剂
醋酸(分析纯):西陇科学股份有限公司;醋酸钠、盐酸、硫酸镁、氯化钾(均为分析纯):天津市百世化工有限公司;葡萄糖(分析纯):天津市永大化学试剂有限公司;其他试剂均为国产分析纯。
1.1.3 培养基
液体培养基[19]:葡萄糖2%、酵母膏0.2%、蛋白胨0.2%、磷酸二氢钾0.046%、硫酸镁0.05%、磷酸氢二钾0.1%,pH自然,115 ℃高压蒸汽灭菌20 min。
火龙果果皮液体培养基:将火龙果果皮去除绿色部分,冷冻干燥,粉碎过100目筛,按料液比1∶45(g∶mL)加入到液体培养基中,115 ℃高压蒸汽灭菌20 min。
1.2 仪器与设备
FA2104电子分析天平:上海良平仪器仪表有限公司;V-5000型722分光光度计:上海元析仪器有限公司;DF-15高速万能粉碎机:浙江温岭市林大机械有限公司;SPX-250B人工智能生化培养箱:天津市泰斯特仪器有限公司;Super-Genie U大流量RO纯水超纯水工作站:上海乐枫生物科技有限公司;CR-080S超声波清洗器:深圳市春霖清洗设备有限公司;DHG-9073BS-Ⅲ电热鼓风干燥箱:上海新苗医疗器械有限公司;NRY-1102立式恒温摇床:上海南荣实验室设备有限公司;TG16A-WS台式高速微量离心机:上海卢湘仪离心机仪器有限公司;RE-2000A旋转蒸发仪:上海亚荣生化仪器厂;L5S紫外可见分光光度计:上海仪电科学仪器股份有限公司。
1.3 方法
1.3.1 食用真菌的筛选
将活化后的供试食用真菌分别接种到液体培养基中,100 r/min、25 ℃培养3 d得种子液;将种子液按4%的接种量接种于火龙果果皮液体培养基中,以未接种的火龙果果皮液体培养基为空白对照,100 r/min、25 ℃培养7 d,测定发酵液中的花青素含量,筛选出花青素含量最高的食用真菌作为后续工艺优化用菌株。
1.3.2 食用菌发酵火龙果果皮产花青素工艺优化
单因素试验:固定其他条件不变,考察发酵温度(22.5℃、25.0 ℃、27.5 ℃、30.0 ℃、32.5 ℃)、料液比(1∶40、1∶45、1∶50、1∶55、1∶60)(g∶mL)、发酵时间(3 d、5 d、7 d、9 d、11 d)、接种量(2%、4%、6%、8%、10%)对发酵液中花青素含量的影响。
响应面试验:以单因素试验结果为依据,以花青素含量(Y)为响应值,选择发酵时间(A)、接种量(B)、发酵温度(C)和料液比(D)4个因素为自变量,采用Design Expert 8.0.6软件设计Box-Behnken响应面试验,试验因素与水平见表1。
表1 食用菌发酵火龙果果皮产花青素工艺优化Box-Behnken响应面试验因素及水平
Table 1 Factors and levels of Box-Behnken response surface tests for anthocyanidin production process optimization from pitaya pericarp by edible fungi fermentation

水平 A 发酵时间/d B 接种量/% C 发酵温度/℃ D 料液比(g∶mL)-1 0 1 4 5 6 4 6 8 22.5 25.0 27.5 1∶45 1∶50 1∶55
1.3.3 花青素含量的测定
参照参考文献[20-21]中pH示差法测定花青素含量。
1.3.4 数据处理
每个试验重复测定3次,结果用“平均值±标准差”表示,采用Excel 2013对数据进行处理;采用Origin 2019软件绘图;通过Design Expert 8.0.6软件响应面试验结果。
2 结果与分析
2.1 食用真菌菌株的筛选结果
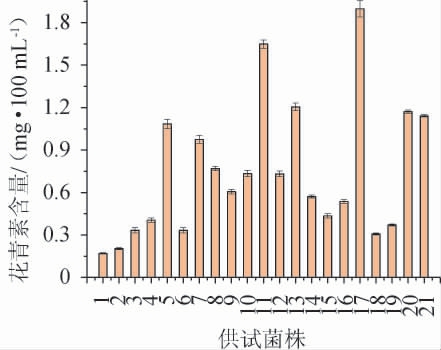
20种供试食用真菌菌株发酵火龙果果皮后,发酵液中的花青素含量见图1。
由图1可知,火龙果果皮经供试食用真菌发酵后,花青素含量(0.20~1.90mg/100mL)均比空白对照(0.17mg/100mL)有所增加,表明经微生物发酵可促进火龙果果皮中花青素的形成和释放。其中,蜜环菌(菌株17)发酵后花青素含量最高,为(1.90±0.02)mg/100 mL,显著高于空白对照及其他供试菌株,为空白对照的11.18倍,故而后续试验采用蜜环菌为供试菌株。
2.2 蜜环菌发酵火龙果果皮产花青素工艺优化单因素试验结果
2.2.1 发酵温度对花青素含量的影响
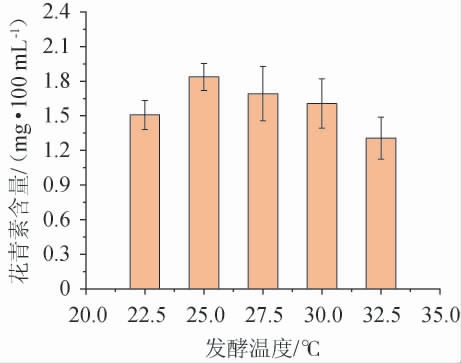
发酵温度对蜜环菌发酵火龙果果皮产花青素的影响见图2。
由图2可知,随着发酵温度的升高,发酵液中的花青素含量呈先升高后下降的趋势,当发酵温度为25 ℃时,花青素含量最高为1.84 mg/100 mL,分析原因可能是由于发酵温度过低或过高都不利于蜜环菌生长,导致发酵性能下降[22]。同时还因为花青素不能耐受高温,高温时可能引起花青素的结构变化甚至分解,从而使得花青素含量下降[22-23]。综合考虑,确定最佳发酵温度为25 ℃。
2.2.2 发酵时间对花青素含量的影响
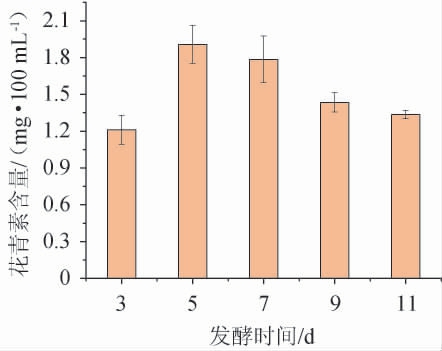
发酵时间对蜜环菌发酵火龙果果皮产花青素的影响见图3。
由图3可知,在发酵3~5d内,花青素含量随发酵延长而逐渐增加,当发酵5d时,花青素含量达最大,为1.90 mg/100 mL。发酵5 d后,随着发酵时间延长,花青素含量逐渐降低。分析原因可能是发酵时间过短,微生物群体较小,生长较为缓慢且以菌体生长为主,用于转化的酶积累较少,故而转化花青素的量也相应较少;发酵5 d时菌体生长进入快速期,次级代谢转旺,花青素转化速度加快,含量增长亦加快;发酵时间过长,因次级代谢旺盛,会产生更多代谢物质,与花青素发生复杂反应,导致花青素结构破坏,从而使花青素含量下降。综合考虑,选择最佳发酵时间为5 d。
2.2.3 料液比对花青素含量的影响
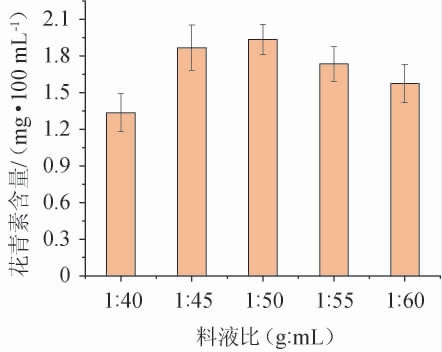
料液比对蜜环菌发酵火龙果果皮产花青素的影响见图4。
由图4可知,花青素的含量随料液比在1∶40~1∶50(g∶mL)范围减小而增加,当料液比达到1∶50时,花青素含量达最大值1.94 mg/100 mL;继续增大料液比,花青素含量略有降低但变化不大。原因可能是因随发酵液体积增加,火龙果皮粉与发酵液接触面积亦不断增加,加快了花青素类物质的溶出速度,但发酵液用量过大,会加速果皮中其他成分溶出,溶出物与花青素反应或干扰花青素稳定性,导致花青素的得率反而降低。综合考虑,选择最佳料液比为1∶50(g∶mL)。
2.2.4 接种量对花青素含量的影响
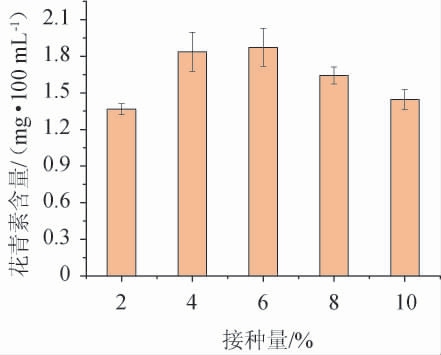
接种量对蜜环菌发酵火龙果果皮产花青素的影响见图5。
由图5可知,随着接种量不断增大,发酵液中花青素含量逐渐升高,当接种量为6.0%时,花青素含量达到最高,为1.87 mg/100 mL;继续增加接种量,花青素含量略有下降并趋于稳定,分析原因可能是接种量过大,微生物生长较快,使群体峰值较早出现,从而导致生长限制因子快速消耗,容易导致菌体衰老或自溶现象出现。综合考虑,选择最佳接种量为6.0%。
2.3 蜜环菌发酵火龙果果皮产花青素工艺优化响应面试验结果
2.3.1 响应面试验结果
根据单因素试验结果,选取发酵时间(A)、接种量(B)、发酵温度(C)和料液比(D)作为考察因素,以花青素含量(Y)为响应值,采用Design Expert 8.0.6软件设计Box-Behnken响应面试验,试验设计及结果见表2,回归模型方差分析见表3。
表2 蜜环菌发酵火龙果果皮产花青素工艺优化Box-Behnken试验设计及结果
Table 2 Design and results of Box-Behnken tests for anthocyanidin production process optimization from pitaya pericarp by Armillaria mellea
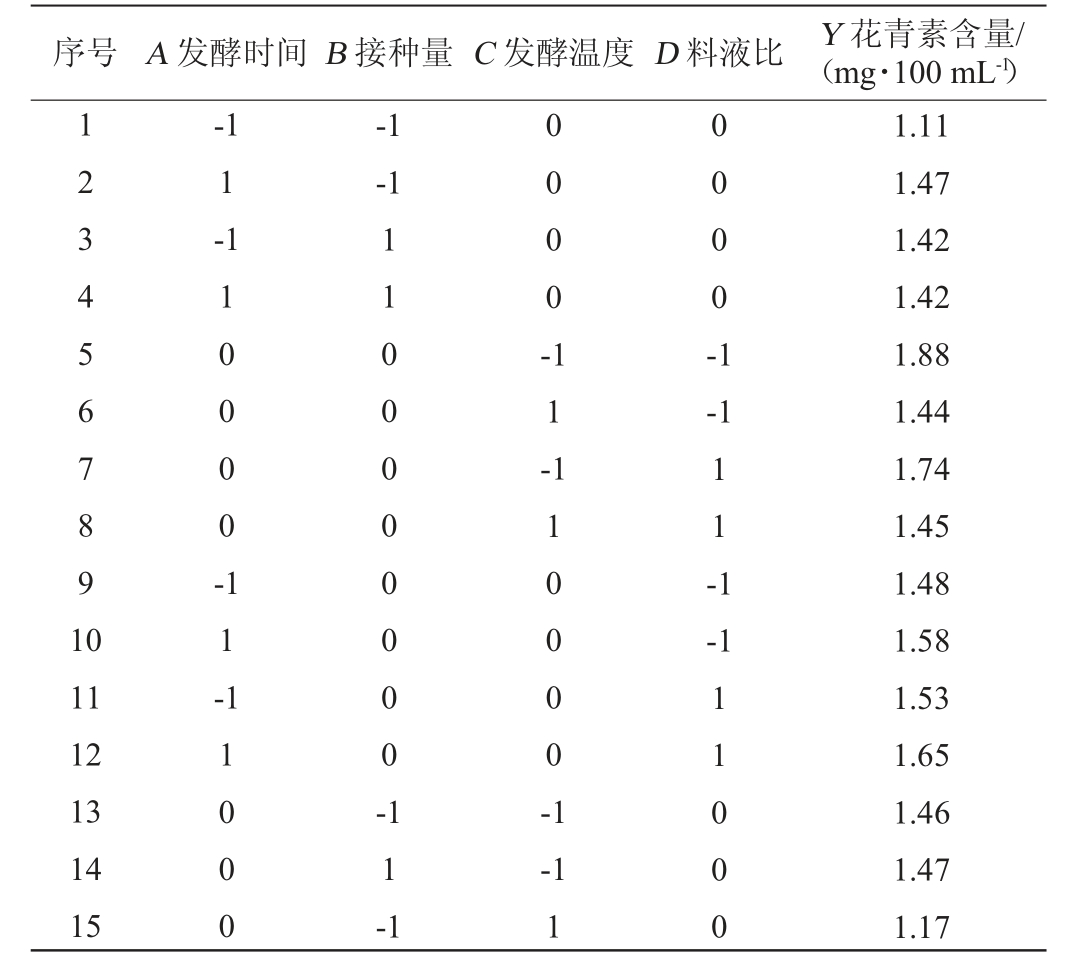
序号 A 发酵时间B 接种量C 发酵温度D 料液比 Y 花青素含量/(mg·100 mL-1)123 456 7891 0-1 1-1-1-1 1 0 0 0 0 -0 0 0 0 -1 1 -0 0 0 0 -1-1 1 1 -1-1 11 12 13 14 15 1 1 -11000 1100 0000 00-1 1 -1 1 1 0 0 0 0 -1-1 1 11000 1.11 1.47 1.42 1.42 1.88 1.44 1.74 1.45 1.48 1.58 1.53 1.65 1.46 1.47 1.17
续表
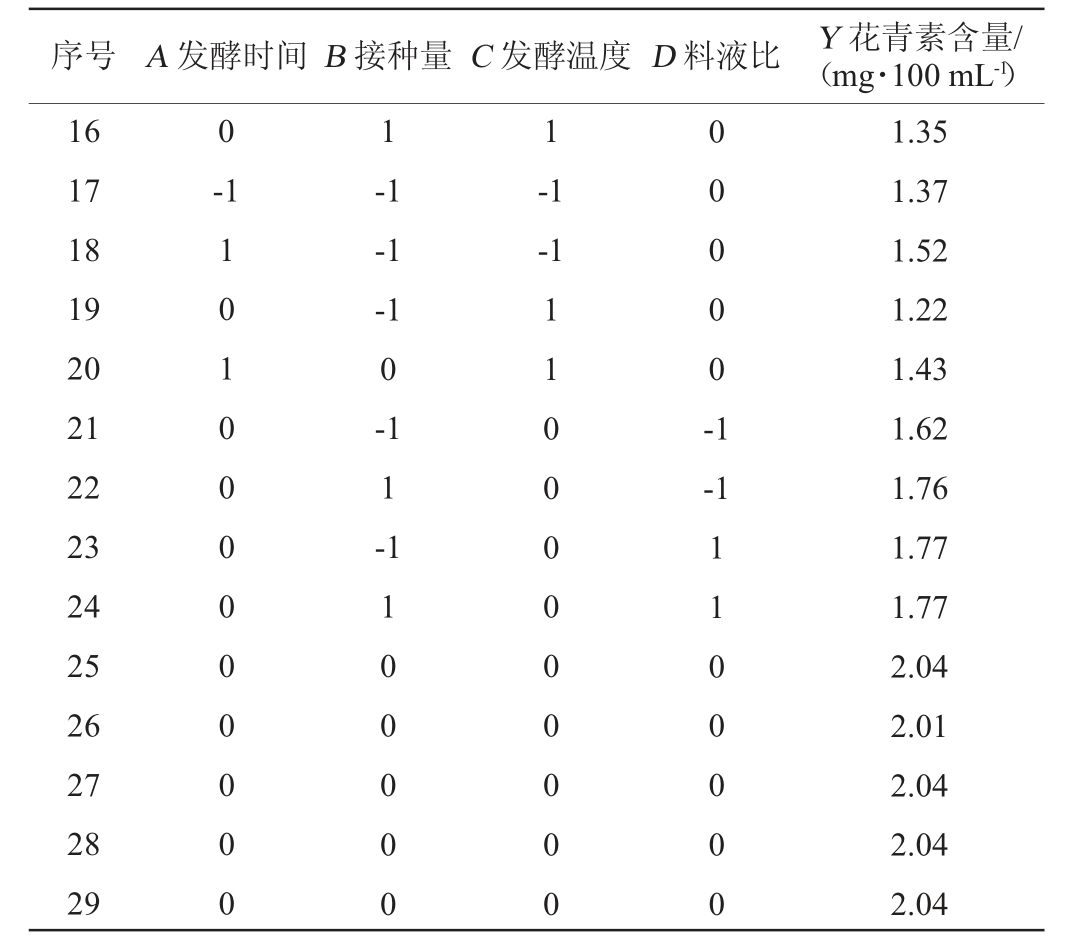
序号 A 发酵时间B 接种量C 发酵温度D 料液比 Y 花青素含量/(mg·100 mL-1)16 17 18 19 20 21 22 23 24 25 26 27 28 29 0 1 1-1 1 0 1 0 0 0 0 0 0 0 0 0-1-1-1 0-1 1-1-1-1 0 0 0 0 0 -1-1 1 0 0 0 0 0 1 1 0 0 0 0 0 0 0 0 0 1 1 0 0 0 0 0 1.35 1.37 1.52 1.22 1.43 1.62 1.76 1.77 1.77 2.04 2.01 2.04 2.04 2.04
表3 回归模型方差分析
Table 3 Variance analysis of regression model
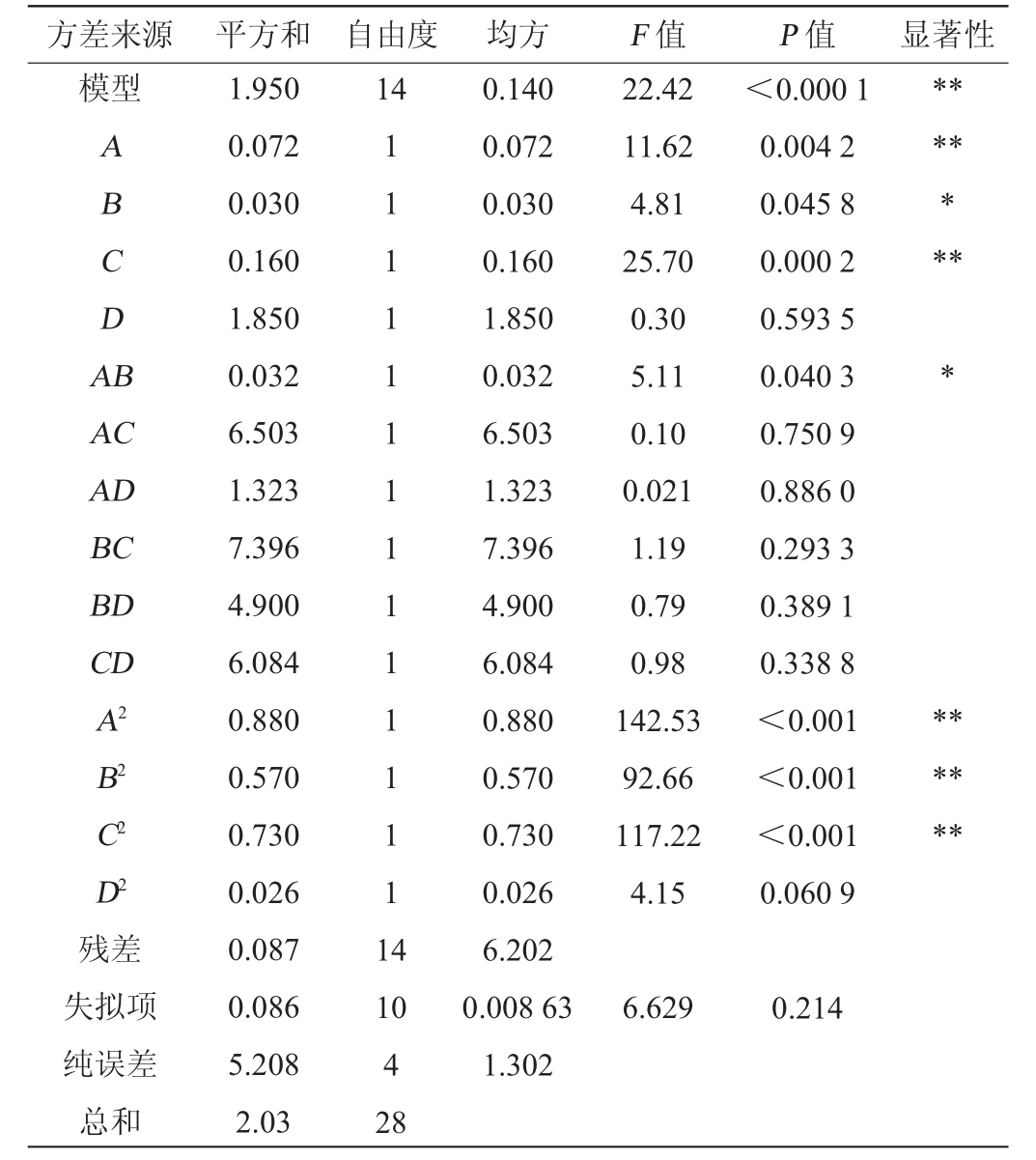
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
方差来源 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B********AC AD BC BD CD A2 B2 C2 D2 22.42 11.62 4.81 25.70 0.30 5.11 0.10 0.021 1.19 0.79 0.98 142.53 92.66 117.22 4.15<0.000 1 0.004 2 0.045 8 0.000 2 0.593 5 0.040 3 0.750 9 0.886 0 0.293 3 0.389 1 0.338 8<0.001<0.001<0.001 0.060 9******残差失拟项纯误差总和1.950 0.072 0.030 0.160 1.850 0.032 6.503 1.323 7.396 4.900 6.084 0.880 0.570 0.730 0.026 0.087 0.086 5.208 2.03 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 10 4 28 0.140 0.072 0.030 0.160 1.850 0.032 6.503 1.323 7.396 4.900 6.084 0.880 0.570 0.730 0.026 6.202 0.008 63 1.302 6.629 0.214
采用Design Expert 8.0.6对表2的数据进行多元回归拟合,得到各因素水平对花青素含量的二次多项回归模型方程:Y=2.04+0.078A+0.050B-0.12C+0.012D-0.089AB+0.013AC+5.75AD+0.043BC-5BD+0.039CD-0.37A2-0.30B2-0.33C2-0.063D2。
由表3可知,回归模型P值<0.0001,极显著,失拟项P值>0.05,不显著,表明模型高度可靠[24-27]。决定系数R2=0.957 3,说明模型能解释95.73%的响应值变化,误差小,模型F值=22.42、调整决定系数R2Adj=0.914 6,表明该模型预测值与实测值拟合度高,可以很好地解释响应值的实际变化情况。4个因素对花青素转化的影响程度为C>A>B>D,即发酵温度>发酵时间>接种量>料液比。其中,一次项A、C,二次项A2、B2、C2对花青素含量的影响极显著(P<0.01),一次项B,交互项AB对花青素含量影响显著(P<0.05),其他项对花青素含量影响不显著(P>0.05)。结果表明,该模型可较好地预测不同条件下花青素转化量的变化规律。
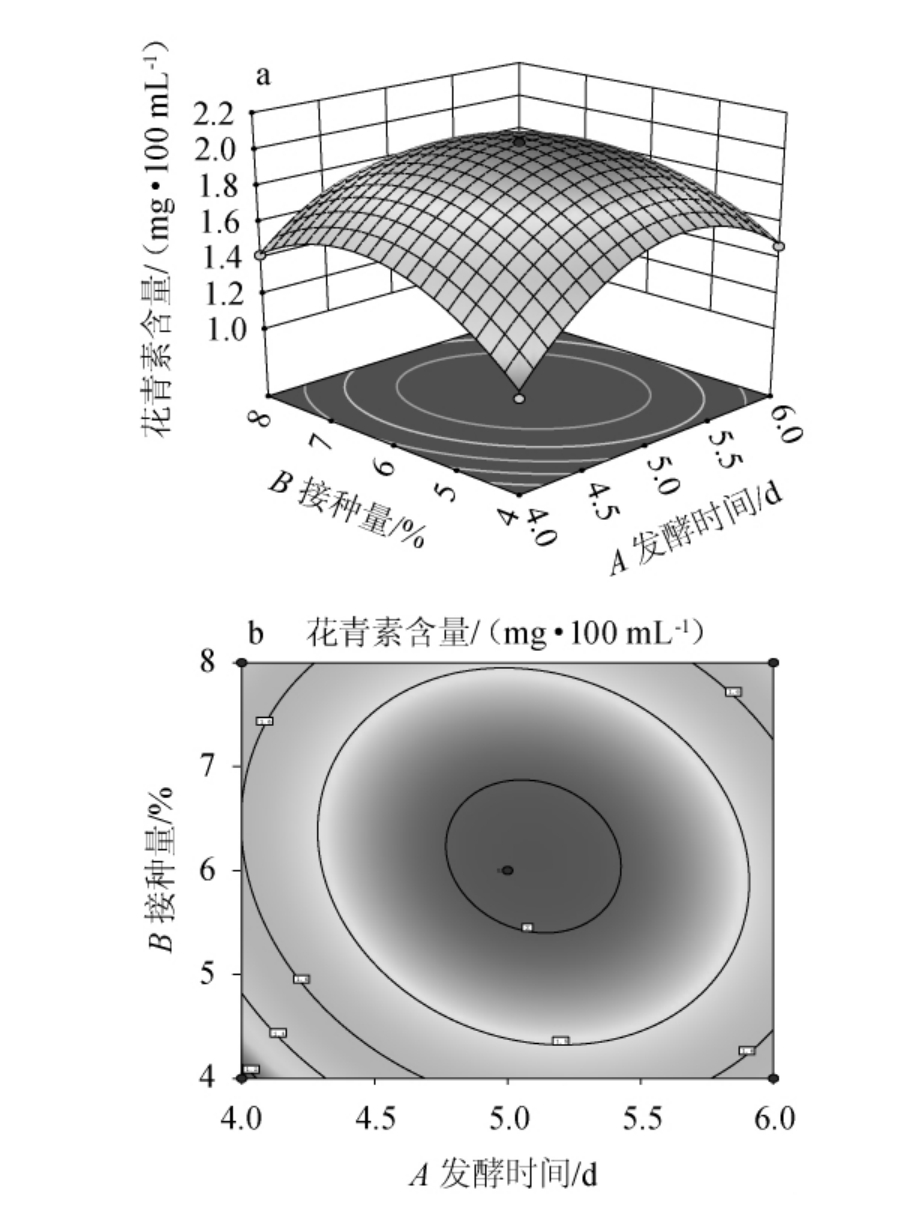
2.3.2 因素间交互作用分析
响应面和等高线图可直观表示各因素间交互作用对花青素含量的影响。三维响应面图中坡度越陡,说明该因素对响应值的影响越大,反之,走势平滑则表明影响较小[25-26]。等高线呈椭圆形代表两因素间交互作用较强,圆形则代表交互作用不显著。发酵时间与接种量间交互作用对花青素含量影响的响应面及等高线见图6。由图6可知,发酵时间与接种量间交互作用对花青素含量影响的响应面呈凸面,坡度较陡;等高线呈椭圆形,颜色变化较快,说明AB交互作用显著,与方差分析结果一致。
2.3.3 验证试验结果
通过Design Expert 8.0.6软件对二次回归方程各个自变量求极值,得到预测的最佳工艺条件:发酵时间5.17 d、接种量6.2%、发酵温度22.23 ℃、料液比1∶49.22(g∶mL),在此条件下花青素含量预测值为2.04 mg/100 mL。考虑实际操作,将最佳工艺条修正为发酵时间5 d、接种量6%、发酵温度25℃、料液比1∶50(g∶mL),在此条件下进行5次平行验证试验,得到发酵液中花青素含量实际值为(2.03±0.02)mg/100 mL。与预测值2.04 mg/100 mL接近,误差极小,说明该模型能准确反映各因素的变化与花青素含量之间的关系,模型设计可靠。
3 结论
本研究以花青素含量为评价指标,选取20种食用真菌发酵火龙果果皮,筛选得到蜜环菌转化火龙果皮中花青素的效率最高,花青素含量是空白对照的11.18倍;通过单因素试验和Box-Behnken试验设计确定蜜环菌转化花青素发酵工艺条件为:发酵时间5 d、接种量6%、发酵温度25 ℃、料液比1∶50(g∶mL),在此条件下,发酵液中花青素含量最高达到(2.03±0.02)mg/100 mL,是未经食用真菌转化的11.94倍。结果证实,微生物可有效转化火龙果皮中花青素。
参考文献:
[1]梁梦冰.乡村振兴背景下广西火龙果品牌建设路径研究[J].南方农机,2023,54(11):96-99.
[2]廖明星,吴华鑫,缪园欣.响应面法优化红心火龙果皮发酵饮料发酵工艺[J].中国酿造,2020,39(4):142-146.
[3] YEN M W.Effects of heat, pH, antioxidant, agitation and light on betacyanin stability using red-fleshed dragon fruit(Hylocereus polyrhizus)juice and concentrate as models[J].J Food Sci Tech,2015,52(5):3086-3092.
[4]翟少萍.遂溪县火龙果产业发展现状及对策[J].南方农业,2018,12(36):89-90.
[5]卓福昌,周彩霞,卢美瑛,等.基于相关性分析和变异系数法对27份火龙果种质资源果实性状的评价[J].中国热带农业,2023,20(2):21-27.
[6]李靓,朱涵彬,李长滨,等.火龙果皮红色素提取工艺研究进展[J].粮食与油脂,2023,36(1):5-7.
[7]HE J,GIUSTI M M.Anthocyanins:natural colorants with health-promoting properties[J].Annual Rev Food Sci Tech,2010,1(1):163.
[8]袁亚芳,赵珍珍,王威,等.红肉火龙果果皮色素的分离纯化和HPLC-MS分析[J].福建农林大学学报(自然科学版),2013,42(6):589-592.
[9]胡元庆,王建荟,李凤霞,等.微波辅助法提取火龙果果皮色素及其功能活性研究[J].食品工业科技,2020,41(23):182-188,202.
[10]张灵帮,邵玲,胡隼,等.两种火龙果果皮红色素提取工艺优化及其抗氧化活性[J].食品工业科技,2019,40(5):163-169,175.
[11]何玉倩,宋晓燕,刘宝林,等.干燥方式对火龙果果皮理化特性的影响[J].食品与发酵工业,2019,45(2):159-165.
[12]程水明,曾霞,周国钰,等.响应面法优化红肉火龙果果皮中花青素提取工艺[J].广东石油化工学院学报,2021,31(1):68-73.
[13]杨洪元,黄康晟.火龙果红色素提取工艺及其性质研究[J].安徽农学通报,2009,15(3):151-152.
[14]李洋,邱智东,王伟楠.中药生物转化技术研究进展[J].中国酿造,2015,34(7):15-19.
[15]WATANABE K.Effective use of heterologous hosts for characterization of biosynthetic enzymes allows production of natural products and promotes new natural product discovery[J].Chem Pharm Bull, 2014, 62(12):1153-1165.
[16]文雅,于雪荣,王泓午,等.利用微生物生物转化大黄的研究进展[J].中国酿造,2020,39(7):7-10.
[17]李宁,叶子茂,向福,等.藜蒿总黄酮生物转化菌株的筛选及转化工艺优化[J].中国酿造,2018,37(6):150-154.
[18]李秋月,林连兵,杨雪娇,等.微生物发酵中草药的研究现状[J].微生物学通报,2021,48(6):2232-2244.
[19]TAO J Y,ZHENG G H,ZHAO L,et al.The anti-hyperlipidemia activities of six herbs before and after fermentation with white rot fungi[J].J Chinese Pharm Sci,2009,18(2):136-140.
[20] ONGKOWIJOYO P, LUNA D A, ELVIRA G.Extraction techniques and analysis of anthocyanins from food sources by mass spectrometry:An update[J].Food Chem,2018,250(1):113-126.
[21]黎瑞珍,吴丽,刘美然,等.分光光度法测定火龙果中花青素的含量[J].海南热带海洋学院学报,2023,30(2):115-121.
[22]ZHAO C L,YU Y Q,CHEN Z J,et al.Stability-increasing effects of anthocyanin glycosylacylation[J].Food Chem,2017,214:119-128.
[23]CAVALCANTI R N,SANTOS D T,MEIRELES M.Non-thermal stabilization mechanisms of anthocyanins in model and food systems-An overview[J].Food Res Int,2011,44(2):499-509.
[24]谭馨.线性回归模型异方差检验方法研究[D].桂林:桂林理工大学,2020.
[25]汪秀妹,汪毅宁,胡玲芳,等.响应面法优化红枣酸奶配方及质构特性研究[J].食品研究与开发,2021,42(7):62-69.
[26]YUAN D L,ZHANG C,TANG S F,et al.Ferric ion-ascorbic acid complex catalyzed calcium peroxide for organic wastewater treatment:Optimized by response surface method[J].Chinese Chem Lett,2021,32(11):3387-3392.
[27]CLARKE H J,MANNION D T,O'SULLIVAN M G,et al.Development of a headspace solid-phase micro-extraction gas chromatography mass spectrometry method for the quantification of volatiles associated with lipid oxidation in whole milk powder using response surface methodology[J].Food Chem,2019,290(30):75-80.