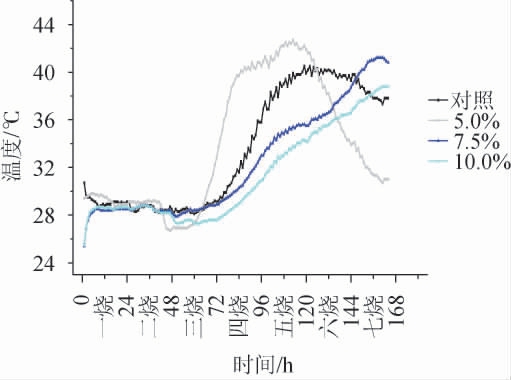
图1 不同添加量中药材酒曲培养期间温度变化趋势
Fig.1 Trend of temperature variation of Jiuqu with different addition of Chinese medicinal materials during the cultivation period
Effects of Chinese medicinal materials addition on quality of Green-covering Guanyin Tuqu and correlation analysis
“曲为酒之骨”,酒曲对白酒发酵质量具有重要的作用,一直以来科研人员对酒曲工艺开展了大量研究,旨在通过提升酒曲质量来改善酒曲在酿造过程中的作用,提升原酒品质。近年来,中药材被广泛用于酒曲生产中,中药材的添加一方面可以抑制酒曲杂菌生长;另一方面可以促进有益微生物繁殖,提高酒曲发酵性能,增强原酒中风味及活性成分含量[1-3]。韩红艳等[4]研究表明,甘草、薄荷等5种药材对金黄色葡萄球菌、大肠杆菌、黄曲霉等杂菌具有抑制作用。苏瑶等[5]研究发现,在油橄榄药曲中添加西洋参能显著提升药曲的液化酶和糖化酶活性。吴琼燕等[6]通过研究桑叶和辣蓼甜酒曲,发现桑叶和辣蓼对根霉菌丝生长具促进作用,且相应酒曲的糖化力和发酵力均有提升。吴志等[7]在制曲过程中添加3%的石菖蒲、生地黄、白术等药材的醇提液,酒曲发酵力提高了95%~108%,糖化力提高了28%~49%。李丽等[8]分别添加西洋参粉和红景天,其药曲中糖化力、蛋白酶、酸度等指标均得到提升。罗芳等[9]将21种中药材分别用于制作纯种药曲,结果表明添加一定量西洋参粉和黄芪粉,对药曲糖化力、液化力等性能指标具有明显的提升作用。因此,在制曲过程中添加一定的中药材对于提升酒曲品质具有重要的意义。
绿衣观音土曲是清香型白酒酿造中使用的酒曲之一,以其身披“绿衣”为主要特征[10-11]。在前期采用20种中药材分别对绿衣观音土曲中主要酿造微生物的生长开展探究的基础上[12],本研究选择10种对微生物增殖具有影响或对酒曲质量、原酒风味具有提升作用的中药材(当归、川芎、人参、黄芪、丹参、辣蓼、陈皮、甘草、丁香、肉桂)进行绿衣观音土曲制备,并对存放一段时间绿衣观音土曲品质指标进行检测,并探讨中药材添加量与绿衣观音土曲的品质指标的相关性,旨在探究中药材对绿衣观音土曲质量的影响,为提升绿衣观音土曲质量提供指导。
1.1.1 材料
当归、黄芪:甘肃岷县;川芎:四川都江堰;人参:吉林抚顺;丹参:湖北罗田;辣蓼:广西钦州;陈皮:广东新会;甘草:甘肃陇西;丁香:印度尼西亚;肉桂:广东肇庆;观音土:湖南临澧;米糠:当地市场;种曲:劲牌有限公司毛铺制曲车间。
1.1.2 化学试剂
3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)、葡萄糖、可溶性淀粉、浓硫酸、干酪素、碘化钾、碘、福林酚试剂(均为分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
孟加拉红培养基、营养琼脂(nutrient agar,NA)培养基、MRS培养基:深圳海博生物技术有限公司。
AL204电子分析天平、FE20 pH计:梅特勒-托利多仪器(上海)有限公司;YXQ-LS-75S蒸汽灭菌锅、SPX-100B-Z生化培养箱:上海博讯实业有限公司;BCM-1600A洁净工作台:苏州安泰空气技术有限公司;90-3磁力搅拌器:上海振荣科学仪器有限公司;QYC-2102C全温培养摇床:上海新苗医疗器械制造有限公司;RH-4C温湿度记录仪:江苏精创电气股份有限公司。
1.3.1 绿衣观音土曲的制备
根据前期研究结果及经验,选取了当归、川芎、人参、黄芪、丹参、辣蓼、陈皮、甘草、丁香、肉桂等比混合、粉碎。米糠∶种曲∶观音土按照1∶1∶3配制,以未添加中药材土曲为对照,中药材粉添加量分别为5.0%、7.5%、10.0%,充分混匀,加入适量水翻拌,翻拌均匀后捏成直径8~10 cm的球体。成型曲球放置于箱床中,选取箱床中央区域的曲球作为监测点插入温湿度记录仪,每小时自动记录温度数值。入箱20~25 h后开箱,待箱内曲坯温度自然降温至室温,将曲坯转移至曲折子上,控制培养室温度在28~32 ℃,培养室相对湿度保持在(65±10)%,培养7 d后,将曲球烘干至酒曲水分含量≤5.0%,即得绿衣观音土曲曲球,出烘房入库。
1.3.2 酒曲品质指标分析检测
酒曲的感官评价:依据劲牌有限公司毛铺制曲车间的内部标准进行判断。土曲的泡度,曲心颜色、裂口数量和大小,有无异味是绿衣观音土曲的主要感官指标。泡度以一米落地开花,曲心红色、允许少量黑心,裂口大,数量较多,无异味较佳。
酒曲温度采用记录仪进行实时记录,水分测定根据轻工业行业标准QB/T 4257—2011《酿酒大曲通用分析方法》[13]进行;酸度、氨基酸态氮:采用连续滴定法[14];糖化率的测定:采用化饭法[15];葡萄糖含量的测定:采用斐林试剂法[16];发酵率(每1 g酒曲糖化后发酵100 g大米饭3 d所生成的酒精换算成20 ℃时的酒精质量分数)的测定:将发酵醪进行蒸馏,接取前100 mL馏出液检测酒精计示值和温度。
微生物检测采用梯度稀释的方法,培养2 d后分别计数细菌、酵母、霉菌和乳酸菌的数量[17-20]。
酸性蛋白酶酶活测定:采用福林-酚法[21];糖化酶酶活测定:采用3,5-二硝基水杨酸(DNS)法[22];α-淀粉酶酶活测定:采用YOO Y T等[23]的改良法。
酸性蛋白酶酶活定义:1 g酶粉或1 mL酶液在40 ℃,pH 3.0条件下,1 min水解酪素产生1 μg酪氨酸,即为一个酶活力单位(U/g或U/mL)。糖化酶酶活定义:1 g固体酶粉(或1 mL液体酶),于40 ℃、pH值为4.6的条件下,1 h分解可溶性淀粉产生1 mg葡萄糖,即为1个酶活力单位(U/g或U/mL)。α-淀粉酶酶活定义:1 mL酶液于60 ℃,pH 6.0条件下,1 h液化可溶性淀粉1 g,即为一个酶活力单位(U/mL)。
1.3.3 数据处理
采用Excel 2019进行数据处理,Origin 9.0绘图,使用RSTUDIO利用皮尔森统计方法对样本数据进行相关性和显著性分析,差异显著水平为P<0.05。
土曲出箱后转入培养箱培养1~7 d称为一至七烧,酒曲培养期间温度变化见图1。随着微生物的繁殖,酒曲内部温度逐渐上升,从一烧开始,曲球表面逐渐覆盖霉菌外衣,即“绿衣”。随着酒曲湿度逐渐下降,表面开始出现裂口,由图1可知,随着药材添加量的增加,曲球表面裂口的时间出现延迟,对照(未添加中药材)、中药材添加量为5.0%和7.5%的曲球在第五烧开始出现裂口,药材添加比例越高,裂口越少且越细,而中药材添加量为10%的曲球则在第六烧开始出现裂口。

图1 不同添加量中药材酒曲培养期间温度变化趋势
Fig.1 Trend of temperature variation of Jiuqu with different addition of Chinese medicinal materials during the cultivation period
由图1亦可知,在一烧至二烧(出箱培养0~48 h)期间,中药材添加量为5.0%、7.5%及10.0%实验组的温度变化同对照酒曲基本一致,均在30 ℃左右开始升温。微生物的繁殖代谢是导致酒曲升温的主要原因,温度在培养末期下降至30 ℃左右,表示酒曲中微生物已增殖完成,酒曲可进行下一步的烘干。在三烧(49~72 h)期间温度开始上升,中药材添加量为5.0%的土曲温度上升较快,可能经过前期微生物与药材的相互作用,适量的中药材促进了酒曲中酵母的代谢,导致温度升高提前,缩短了酒曲的整体培养时间。对照酒曲和其他中药材添加量的土曲在四烧(73~96 h)期间温度开始上升,其中,中药材添加量7.5%和10.0%的酒曲升温较对照较缓慢,可能由于药材添加量过高,对酒曲中微生物产生了抑制作用。在五烧(97~120 h)期间,对照和中药材添加量为5.0%的酒曲开始降温,说明两者酒曲中的微生物增殖已接近饱和,温度开始出现下降,而中药材添加量为7.5%和10.0%的酒曲则仍处在温度上升期,微生物生长未饱和,酒曲培养时间延长。因此,合适的中药材添加量可促进微生物的增殖,使酒曲成熟提前,缩短制曲时间。
烘干后酒曲的感官评价结果见表1。由表1可知,中药材的添加,一定程度影响了土曲的泡度和裂口情况,在药材添加量为5.0%时,对酒曲的泡度无明显影响,药材添加量为7.5%和10.0%时,酒曲的泡度差。综上分析,中药材添加量5.0%制作的土曲泡度较好,曲心红色,有少量黑心,药材味适宜。
表1 不同添加量中药材制备酒曲感官评价
Table 1 Sensory evaluation of Jiuqu prepared with different addition of Chinese medicinal materials

中药材添加量/% 酒曲感官特征对照(未添加)5.0 7.5泡度较好,有少量黑心及红心,花皮、五烧期间出现裂口,裂口较多较大,无异味泡度较好,有少量黑心及红心,偏白、五烧期间出现裂口,裂口较多较大,药材味适宜泡度差,有少量黑心,黑皮、六烧期间出现裂口,裂口小、少,有明显药材味
续表
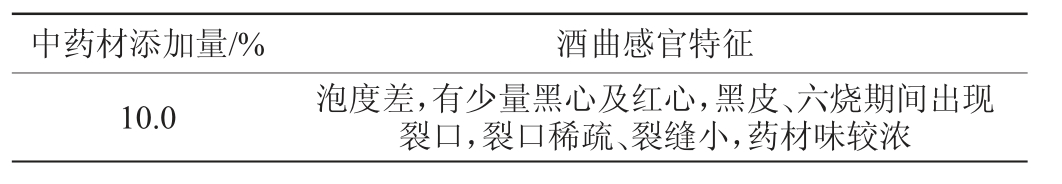
中药材添加量/% 酒曲感官特征10.0 泡度差,有少量黑心及红心,黑皮、六烧期间出现裂口,裂口稀疏、裂缝小,药材味较浓
酒曲出库后水分高、杂菌多,因此贮存是酒曲使用前的必要工序[24]。本研究分析不同添加量中药材对制备酒曲存放1~2月期间主要品质指标的影响,结果见图2。
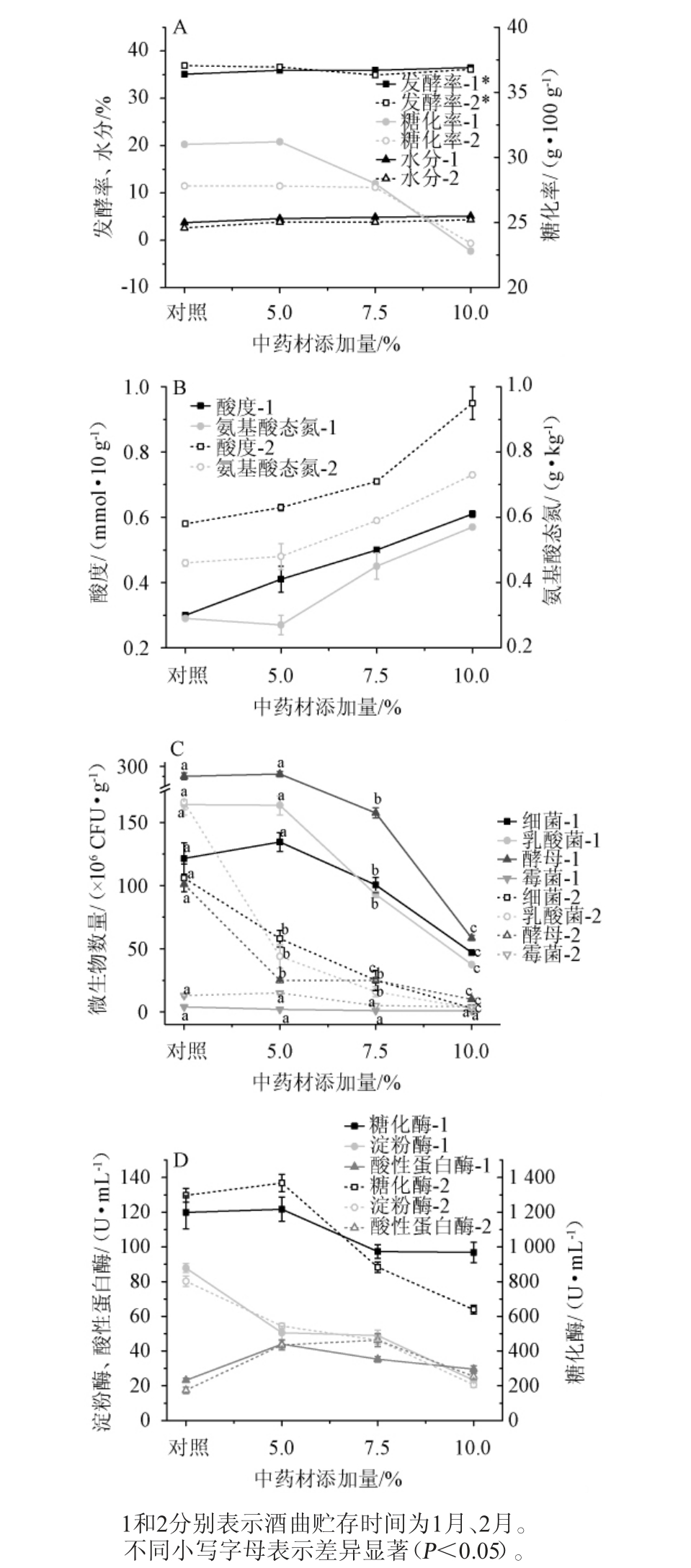
图2 不同添加量中药材制备酒曲贮存期间品质指标变化
Fig.2 Changes of quality indexes of Jiuqu prepared with different addition of Chinese medicinal materials during storage period
由图2A可知,酒曲水分随着中药材添加量增加而上升,存放2月后对应各酒曲水分稍有下降。存放1月时,糖化率随药材添加比例增加而下降,存放2月糖化率进一步下降,其中,5.0%添加量中药材与对照相当。而中药材添加量及存放时间延长对酒曲发酵率影响不大。由图2B可知,酒曲酸度和氨基酸态氮随着中药材添加量增加而上升,相比于存放1月,存放2月酒曲氨基酸态氮呈现上升趋势。
酒曲质量的优劣很大程度上取决于微生物群落组成及其代谢性能[25-26]。由图2C可知,酒曲存放一个月后,5.0%添加量中药材对酒曲微生物的生长具有一定促进作用。随着药材比例的增加,微生物生长明显受到了抑制,表现在酵母、细菌和乳酸菌数量显著降低(P<0.05)。当中药材添加量为10.0%时,酵母、细菌和乳酸菌数量分别下降了78.5%、61.5%和76.8%,霉菌数量变化较小,可见药材添加量越多,越抑制微生物的生长。相比存放1月,酒曲存放2月细菌、酵母和霉菌数量降低明显,且随着中药材添加量增加,降低趋势越明显,其中对酵母数量的抑制作用最强。结合前期单种药材对微生物生长影响实验,在制曲和存放环境下,多种中药材混合添加后,在较高的中药材添加量下对微生物容易产生抑制作用,但不同比例药材对霉菌数量影响较小,可能由于酒曲储存的开放环境,更利有于霉菌的生长,存放2月各添加中药材酒曲中霉菌数量有所上升。由图2D可知,酒曲存放1月及2月后,糖化酶在5.0%中药材添加量时有所上升,淀粉酶酶活随中药材添加量增加而下降,蛋白酶则呈现先上升后下降的趋势。存放2个月时,对淀粉酶和蛋白酶没有较大影响,糖化酶则在低添加量下出现上升,高中药材添加量下酶活呈现下降趋势。
在酒曲培养过程中,中药材添加量为5.0%的酒曲呈现出较适宜的药香,且对酒曲的泡度和裂口情况没有抑制作用。综合酒曲品质指标,表明中药材添加量在5.0%时,酒曲存放时间为1月时,对酒曲大多数品质指标表现出促进作用,如酸性蛋白酶、酸度、发酵率、糖化酶、糖化率、微生物的数量等,其中酸性蛋白酶和酸度提升幅度最高,分别达到89.7%和36.7%。尽管随着中药材添加量的增加,酸度和氨基酸态氮增长明显,然而微生物数量尤其是酵母的数量下降显著,将对酿造过程产生重要影响,如出酒率和乙酸乙酯等。而随着贮存时间延长至两个月,酒曲糖化率、微生物数量和糖化酶急剧下降,氨基酸态氮和酸度升高,而对发酵率、水分、酸性蛋白酶和淀粉酶无明显影响。因此,确定最适中药材添加量为5.0%,并且酒曲存放时间1月质量较佳,其水分为4.56%、酸度为0.41 mmol/10 g、氨基酸态氮为0.27 g/kg、糖化率为31.2 g/100 g、发酵率为35.9%,乳酸菌、酵母和霉菌数量分别为163.5×106 CFU/g、280.5×106 CFU/g、2.0×106 CFU/g,糖化酶、淀粉酶、酸性蛋白酶酶活分别为1 217.7 U/mL、50.6 U/mL、44.0 U/mL。
糖化率和发酵率是表征绿衣观音土曲质量的主要指标,而中药材添加量对多数指标具有显著影响,探究指标间的相关性可为酒曲工艺调控提供策略,中药材添加量与酒曲品质指标的相关性分析结果见图3。由图3可知,中药材添加量、水分、酸度和发酵率之间呈显著正相关(P<0.05),且这四个指标与淀粉酶活呈现显著负相关(P<0.05);霉菌数量与中药材添加量、水分呈显著负相关(P<0.05)。根据2.2中酒曲水分随着中药材添加量增加而上升,因此推断中药材添加量是影响酒曲酸度、发酵率、霉菌数量和淀粉酶酶活主要原因。
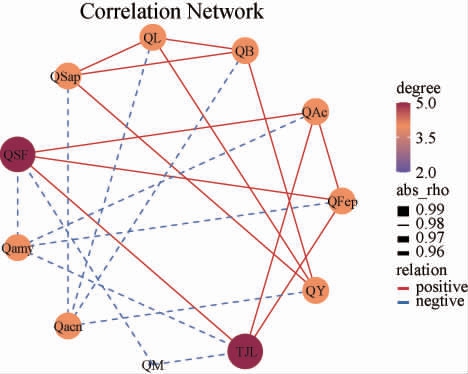
图3 中药材添加量与酒曲的品质指标相关性分析结果
Fig.3 Correlation analysis results between Chinese medicinal materials addition and quality indexes of Jiuqu
TJL:中药材添加量;QSF:水分;QB:细菌数;QL:乳酸菌数;QY:酵母菌数;QM:霉菌数;QSap:糖化率;QFep:发酵率;QAc:酸度;Qacn:氨基酸态氮;Qamy:淀粉酶。
在制曲过程中添加合适的中药材可以在一定程度提升酒曲感官和品质指标,也赋予酒曲一定的药香。结果表明,中药材添加量5.0%制作的土曲泡度较好,曲心红色,有少量黑心,药材味适宜。绿衣观音土曲存放时间1月质量较佳,其水分为4.56%、酸度为0.41 mmol/10 g、氨基酸态氮为0.27 g/kg、糖化率为31.2 g/100 g、发酵率为35.9%,乳酸菌、酵母和霉菌数量分别为163.5×106 CFU/g、280.5×106 CFU/g、2.0×106 CFU/g,糖化酶、淀粉酶、酸性蛋白酶酶活分别为1 217.7 U/mL、50.6 U/mL、44.0 U/mL。相关性分析表明,中药材添加量、水分、酸度和发酵率之间呈显著正相关(P<0.05),且这四个指标与淀粉酶活呈现显著负相关(P<0.05);霉菌数量与中药材添加量、水分呈显著负相关(P<0.05)。酒曲中添加适量中药材对于绿衣观音土曲的品质有一定的提高,而其对清香型白酒酒质的影响、中药材的加入是否在原酒中引入中药材的功效成分等方面尚有待进一步的探究。
[1]刘文玉.传统酿酒制曲应用中药材的规律及其现代意义探讨[J].酿酒,2018,45(3):116-117.
[2]张宇,吴正云,朱宇,等.制曲药材的选择及配方规律探讨[J].酿酒科技,2018(11):17-20.
[3]吴琼燕.中草药对甜酒曲微生物发酵性能及酒酿香气成分研究[D].广州:华南农业大学,2016.
[4]韩红艳,冀爱青,李洪燕.5种中药材体外抑菌活性研究[J].中兽医医药杂志,2020,39(2):63-66.
[5]苏瑶,于倩,刘宜睿,等.油橄榄西洋参药曲的研制[J].食品科技,2021,46(4):82-86.
[6]吴琼燕,林捷,简佩雯,等.甜酒药曲理化品质及糯米酒香气成分研究[J].食品工业,2016,37(12):130-134.
[7]吴志,陈晓芸.甜酒曲主要微生物的分离、筛选及其中草药制曲工艺研究[J].轻工科技,2020,36(5):18-20.
[8]李丽,张文学,罗芳,等.红曲药曲的制备工艺及药曲清酒的研究[J].食品工业科技,2014,35(18):194-198,202.
[9]罗芳,李丽,罗颂,等.多种中药材制作纯种药曲的性能比较及优化研究[J].酿酒科技,2014(2):7-9,12.
[10]李锐利,方尚玲,陈茂彬,等.绿衣观音土曲中霉菌糖化酶活力的研究[J].酿酒,2010,37(1):50-52.
[11] ZHU L P, LI L Q, YANG Q, et al.Study on microbial community of"green-covering"Tuqu and the effect of fortified autochthonous Monascus purpureus on the flavor components of light-aroma-type Baijiu[J].Front Microbiol,2022,13:973616.
[12]江威,李强,唐洁,等.中药材对清香型白酒主要酿造微生物及风味物质的影响[J].中国酿造,2023,42(2):89-94.
[13]中华人民共和国工业和信息化部.QB/T 4257—2011 酿酒大曲通用分析方法[S].北京:中国标准出版社,2011.
[14]杜亚飞,蒋英丽,何世兴,等.大曲中总酸和氨基酸态氮的连续滴定[J].中国酿造,2014,33(6):132-134.
[15]唐洁,杨强,刘源才,等.高糖化力米根霉G1培养条件优化[J].中国酿造,2022,41(7):173-178.
[16]王福荣.酿酒分析与检测[M].北京.化学工业出版社,2005:195-196.
[17]凌莉,吕敬章,陈晶,等.乳酸菌食品中污染菌的计数和MALDI-TOF MS鉴定[J].食品与发酵工业:2022,48(9):230-234.
[18]陈申习,唐洁,张龙,等.清香型小曲白酒机械化生产中微生物动态变化研究[J].中国酿造,2018,37(6):68-72.
[19]HUANG X N,FAN Y,LU T,et al.Composition and metabolic functions of the microbiome in fermented grain during light-flavor Baijiu fermentation[J].Microorganisms,2020,8(9):1281.
[20]唐洁,陈申习,张磊,等.绿衣观音土曲培养过程中微生物及酶系的动态变化[J].中国酿造,2020,39(5):97-104.
[21]郑东影,陈玮,张卫卫,等.福林酚法测定酿酒白曲酸性蛋白酶活力的条件试验[J].酿酒,2020,47(2):63-66.
[22]郝萍萍,吴发萍,张文学,等.三种米曲霉糖化酶活及其红薯酒质量指标分析[J].中国酿造,2012,31(5):35-37.
[23]YOO Y T,HONG J,HATCH R T.Comparison of α-amylase activities from different assay methods[J].Biotechnol Bioeng,1987,30(1):147-151.
[24]许必晏.川法小曲酒中药材入曲对小曲清香白酒酒质影响研究[J].酿酒,2020,47(3):97-98.
[25]吴树坤,谢军,程铁辕,等.不同地区浓香型大曲质量指标与细菌群落相关性研究[J].食品研究与开发,2019,40(4):158-164.
[26]赵金松,张良,孙啸涛,等.酱香型大曲微生物群落特征与理化指标的相关性研究[J].基因组学与应用生物学,2019,38(1):199-204.