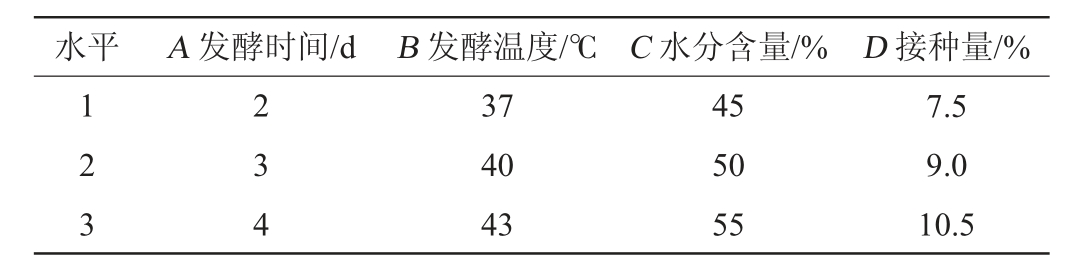
水平 A 发酵时间/d B 发酵温度/℃ C 水分含量/% D 接种量/%1 2 3 2 3 4 37 40 43 45 50 55 7.5 9.0 10.5
Research on solid-state fermentation conditions of distiller's grains by compound probiotics
白酒糟别名酒醅糟、丢糟,是白酒类生产过程中产生的主要副产物,年产量高达5 000万t[1-3],若储存不当或放置过久易导致酒糟变质,甚至造成严重环境污染[4-5]。白酒的生产是以高粱、大米、小麦等谷物为主要原料,因此白酒糟不仅氮、磷元素含量高[6],富含纤维素以及丰富的发酵产物,还有很多未能利用的淀粉、蛋白质等营养成分,营养价值较高[7-8]。目前企业对白酒糟的处理方法比较单一,主要是通过生物质燃烧或将其经过简单的干燥处理作为饲料和堆肥出售,不仅产品附加值低、经济效益较低,而且还会污染环境。无害化再利用白酒糟不仅可以实现传统白酒绿色生产,同时也能实现资源合理利用和经济循环[9],国内学者对白酒糟进行了大量的研究,主要集中在生产食醋、蛋白饲料、化工产品、食用菌栽培等方面[10-13],其中以酒糟为主要培养料接种食用菌菌种进行栽培后,菌丝满袋后未出菇菌糠的粗蛋白、粗多糖等营养成分可得到一定改善。微生物发酵处理是无害化利用白酒糟、提升酒糟品质的有效手段,在发酵过程中,微生物可以产生一些复杂的酶系,从而改善酒糟的品质,其主要有单菌种发酵[14]和复合菌种发酵[15]技术。大量研究表明,复合微生物发酵酒糟因其成本低、富含益生菌等优点逐渐受到重视,发酵工业中常用白酒糟发酵剂菌种主要包括酵母菌、霉菌、细菌、乳酸菌、放线菌等[16-18]。随着白酒产量的不断增幅,深入探索酒糟高值化、规模化和可持续处理途径具有重要的现实意义。
考虑到酒糟水分含量较高,可通过添加麸皮和洗米糠两种蛋白原料,实现降低物料水分同时提高发酵效率的效果。本试验以白酒酿造副产物酒糟、酒糟为主要培养料的未出菇菌糠、麸皮和洗米糠为发酵底物,用三种益生菌1∶1∶1(V/V)混合制备具有高生物活性的发酵剂,进行固态发酵,通过单因素试验和正交试验优化发酵条件,使酒糟的蛋白品质得到有效提升,并为发酵酒糟在酸奶、食用醋、发酵蛋白饲料等方面的应用提供理论基础,实现传统白酒升级转型为环境友好型产业。
1.1.1 菌种与材料
芽孢杆菌(Bacillus)K、酿酒酵母(Saccharomyces cerevisiae)S、屎肠球菌(Enterococcus faecium)Q:保藏于本实验室;菌糠(水分含量为59.33%,培养料为酒糟60%、棉籽壳20%、麸皮20%,菌丝满袋且未出菇):由本实验室自行栽培;酒糟(水分含量为15.35%):宜宾五粮液股份有限公司;麸皮(水分含量为11.45%)、洗米糠(水分含量为8.88%):乐山恒峰华邦生物科技有限公司;酸性蛋白酶(蛋白酶活力≥6×105 U/g):沧州夏盛酶生物技术有限公司。
1.1.2 化学试剂
硫酸铜、硫酸钾、硫酸、氢氧化钠、氢氧化钾、三氯乙酸、盐酸(均为分析纯):成都科隆化学品有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
LB培养基、酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基、MRS培养基:按照参考文献[19-21]配制。
芽孢杆菌发酵培养基:2 g/L葡萄糖,10 g/L蛋白胨,5 g/L氯化钠,4 g/L吐温-80,121 ℃灭菌15 min。
LS-75HD立式压力蒸汽灭菌锅:江阴滨江医疗设备有限公司;T-114分析天平:北京赛多利斯仪器系统有限公司;AT-710电位自动滴定计:日本京都电子制造有限公司;SH220F石墨消解仪、K9840凯氏定氮仪:山东海能科学仪器有限公司;SW-CJ-2D双人单面净化工作台:苏州净化设备有限公司;HWS-2608恒温恒湿培养箱:杭州绿博仪器有限公司。
1.3.1 高生物活性发酵剂的制备
用接种环分别刮取两环菌株K、S和Q的活化菌种,分别接种至50 mL LB培养基、50 mL YPD培养基和150 mL MRS培养基中,分别在37 ℃、200 r/min培养24 h,30 ℃、200 r/min培养20 h和37 ℃静置培养20 h,获得种子液;再按3%接种量(V/V)分别接种于芽孢杆菌发酵培养基、YPD培养基和MRS培养基中,相同条件下培养38 h、28 h和28 h后获得发酵液,其中活菌数分别为9.2×108 CFU/mL、2.3×108 CFU/mL和2.0×109 CFU/mL。
将K发酵液、S发酵液和Q发酵液以1∶1∶1(V/V)混合均匀,制得高生物活性的混合发酵剂,备用。
1.3.2 复合益生菌固态发酵酒糟
将粉碎后的酒糟、菌糠、麸皮、洗米糠分别按质量比30∶30∶20∶20(配方1)、20∶40∶20∶20(配方2)、15∶45∶20∶20(配方3)、10∶50∶20∶20(配方4)、5∶55∶20∶20(配方5)混合均匀,加入其总质量0.6%的酸性蛋白酶和7.5%(mL/g)的高生物活性混合发酵液,添加适量蒸馏水翻拌均匀,使其水分含量为45%。将最终物料分装于呼吸袋中40 ℃密闭发酵3 d。以发酵前为对照,测定发酵后的pH、粗蛋白(crude protein,CP)、酸溶蛋白(acid soluble protein,ASP)含量、ASP/CP,进而确定最优发酵配方。
1.3.3 单因素试验
选择接种量7.5%、水分含量45%、发酵时间3 d、发酵温度40 ℃作为固定初始发酵条件,依次考察接种量(4.5%、6.0%、7.5%、9.0%、10.5%)、水分含量(35%、40%、45%、50%、55%)、发酵时间(1 d、2 d、3 d、4 d、5 d)、发酵温度(34 ℃、37 ℃、40 ℃、43 ℃、46 ℃)对CP、ASP含量、ASP/CP、蛋白溶解度的影响。
1.3.4 正交试验
在单因素试验的基础上,以ASP/CP为考察指标,选择发酵时间(A)、发酵温度(B)、水分含量(C)、接种量(D)4个因素设计4因素3水平正交试验,正交试验因素与水平见表1。

水平 A 发酵时间/d B 发酵温度/℃ C 水分含量/% D 接种量/%1 2 3 2 3 4 37 40 43 45 50 55 7.5 9.0 10.5
1.3.5 检测方法
pH测定:参照刘晓明等[22]的方法,用pH计测定。
粗蛋白(CP)含量[23]:根据GB 5009.5—2016《食品安全国家标准食品中蛋白质的测定》中的凯氏定氮法测定;酸溶蛋白(ASP)含量[24]:采用三氯乙酸(trichloroacetic acid,TCA)沉淀法测定;蛋白溶解度:根据国标GB/T 19541—2017《饲料原料豆粕》[25]规定方法测定;酸溶蛋白/粗蛋白(ASP/CP)计算公式如下:
1.3.6 数据统计与分析
采用Excel 2016对数据进行统计整理,SPSS 27软件中的ANOVA程序进行单因素方差分析,并采用Duncan's法进行多重比较。结果均以“平均值±标准差”(SD)表示。
益生菌发酵不同底物配方的结果分别见表2和图1。由表2可知,随着配方中酒糟含量的不断减少,发酵前各配方的pH呈显著上升趋势(P<0.05),其中配方4和配方5发酵前pH无显著差异(P>0.05);发酵后各配方的pH与发酵前相比均有所下降,配方4和配方5发酵前后的pH值变化较大,这可能是因为此物料初始pH较高,适合微生物生长繁殖,更有利于在发酵过程中将糖类转化为乳酸、乙酸等有机酸导致酸度增加[26]。由图1可知,发酵结束后配方4的各蛋白品质提升效果均达到最好水平,CP、ASP、ASP/CP含量分别提高了9.94%、66.03%、51.29%,说明此配方碳氮源比例均衡,利于微生物生长代谢产酶。综合pH变化和蛋白品质提升效果,选取配方4进行后续条件优化试验。
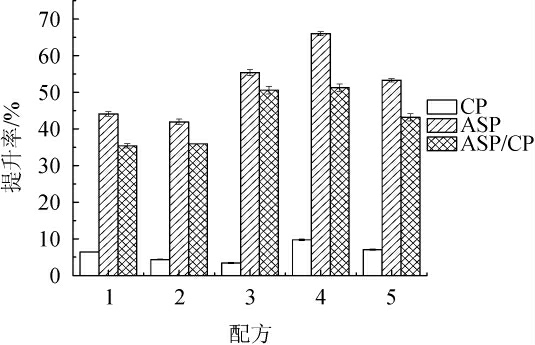
图1 不同配方原料发酵后各蛋白品质提升效果
Fig.1 Enhancing effect of protein quality in raw materials with different formulas after fermentation
表2 不同配方原料发酵前后pH的变化
Table 2 Changes of pH of raw materials with different formulas before and after fermentation
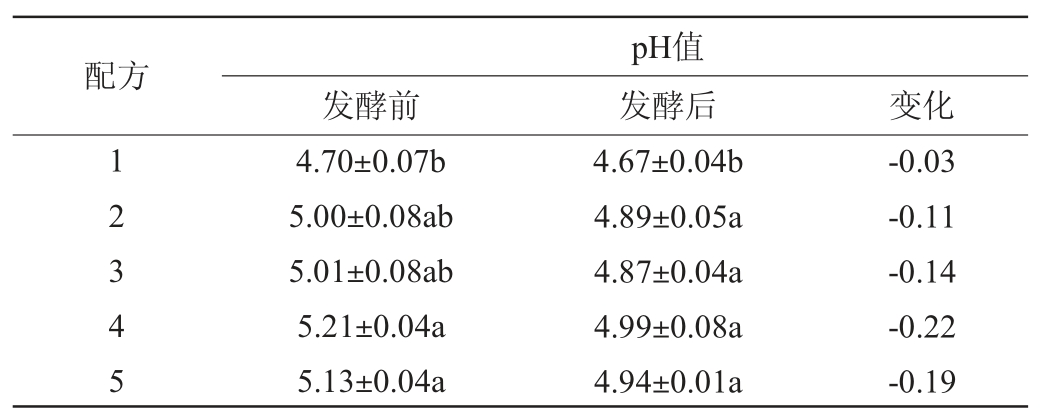
注:同列不同小写字母表示差异显著(P<0.05)。下同。
配方发酵前pH值发酵后 变化12345 4.70±0.07b 5.00±0.08ab 5.01±0.08ab 5.21±0.04a 5.13±0.04a 4.67±0.04b 4.89±0.05a 4.87±0.04a 4.99±0.08a 4.94±0.01a-0.03-0.11-0.14-0.22-0.19
2.2.1 接种量的确定
采用配方4,分别接种不同比例的混合发酵液,考察发酵底物中蛋白的变化情况,从而确定最佳的接种量,结果见图2。由图2可知,ASP/CP基本变化趋势为不断上升,在10.5%时达到最高值为54.29%,与接种量为7.5%和9.0%无显著差异(P>0.05)。原因可能是当以较低接种量接种时,固态培养基中微生物含量较低,产生的蛋白酶也相对较少,导致大量的大分子蛋白质无法被充分分解;同时菌种会先满足自身繁殖,再对物料进行发酵作用,延长固态发酵的时间[27-28]。当接种量为7.5%和10.5%相比于其他组较优,两组间各蛋白品质均不具有显著差异(P>0.05)。因此,最适接种量为9.0%。
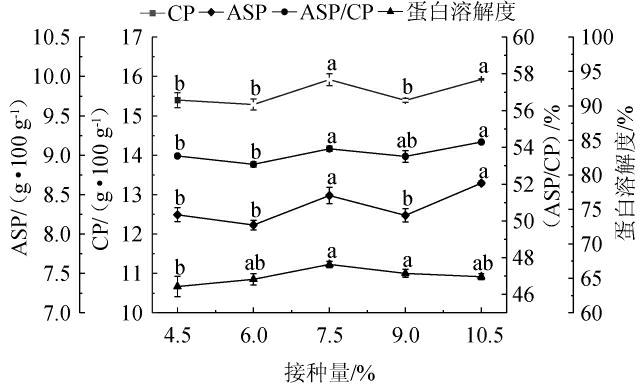
图2 接种量对蛋白品质的影响
Fig.2 Effect of inoculum on protein quality
2.2.2 水分含量对发酵酒糟的影响
不同水分含量对物料的各蛋白品质的影响见图3。在固态发酵中,水分含量对微生物的生长具有重要影响,水分过多或过少都会影响微生物生长,且随发酵的进行水分含量会随代谢强度相应发生变化,与微生物生长状况直接相关。由图3可知,随着水分含量的增加,各蛋白品质大致呈增长趋势;当水分含量为35%时,初始水分含量过低,物料不能充分的吸收水分,不利于微生物的生长,造成产酶下降,进而影响后续大分子物质的分解[29];当水分含量为50%和55%时,相比于其他组各蛋白品质较优,且两组间无显著差异(P>0.05)。当水分含量为55%时,虽然ASP/CP有最大值,但由于水分含量较高,发酵中容易导致底物粘连结块,影响感官的同时物料发酵不均匀,基质间隙率下降,影响氧气流通[30],抑制好氧菌的的代谢强度,不利于产酶或降低酶活力。因此,最适水分含量为50%。
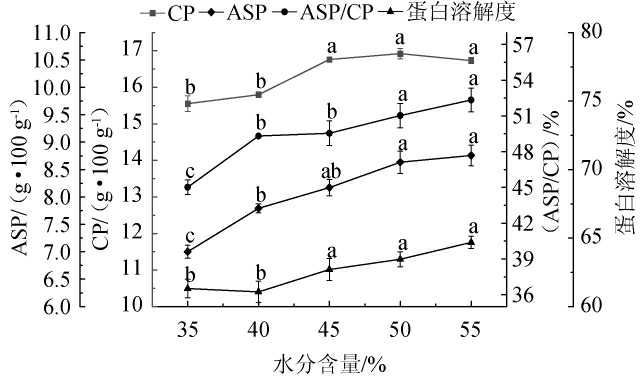
图3 水分含量对蛋白品质的影响
Fig.3 Effect of moisture on protein quality
2.2.3 发酵时间对发酵酒糟的影响
不同发酵时间对蛋白品质的影响见图4。
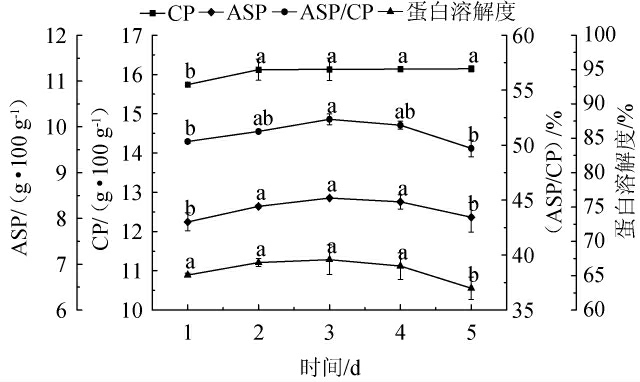
图4 发酵时间对蛋白品质的影响
Fig.4 Effect of fermentation time on protein quality
由图4可知,随着发酵天数的延长,CP和蛋白溶解度含量各组分间无显著差异,ASP含量和ASP/CP呈先上升后下降趋势,当发酵时间为第3天时,ASP、ASP/CP和蛋白溶解度均达到最大值,分别为8.45%、52.35%、67.34%。这是因为发酵前期物料中营养物质充分,微生物生长代谢旺盛,分泌的蛋白酶将蛋白大分子分解成小分子,使ASP/CP上升,随着发酵时间的延长,物料水分含量达到稳定,培养基中的营养物质不能满足微生物生长,微生物数量达到平衡状态,微生物优先利用肽或小分子蛋白合成自身蛋白,造成ASP/CP含量逐渐下降。发酵时间长短直接影响代谢产物的积累和底物的消耗,时间过短导致发酵不充分;发酵时间过长使原料被浪费[31]。因此,最适发酵时间为3 d。
2.2.4 发酵温度对发酵酒糟的影响
不同发酵温度对蛋白品质的影响见图5。
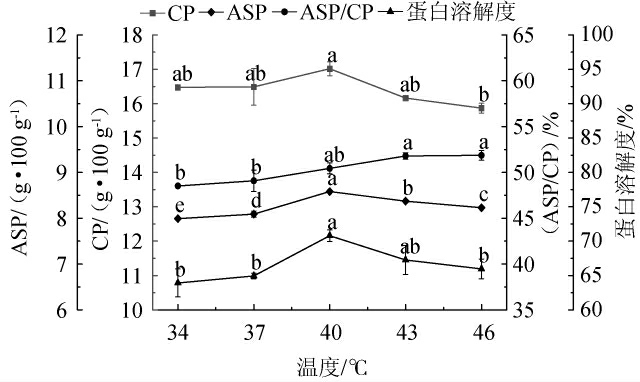
图5 发酵温度对蛋白品质的影响
Fig.5 Effect of fermentation temperature on protein quality
由图5可知,随着发酵温度的增大,物料的ASP/CP呈现逐渐上升趋势,在46 ℃时达到最大值为51.87%;CP、ASP和蛋白溶解度含量呈现先上升后下降的趋势,可能因为适度升温可以促进微生物分泌相关的酶,而温度过高则会导致某些蛋白质和酶变性[32-33]。在发酵温度40 ℃条件下,CP、ASP、蛋白溶解度三个蛋白品质均达到最大值,分别为17.02 g/100 g、8.58 g/100 g、70.80%。当发酵温度为46 ℃时,ASP/CP虽然有最大值,但与40 ℃无显著差异(P>0.05)。因此,最适发酵温度为40 ℃。
在单因素试验基础上,正交试验结果如表3所示,结果表明正交试验5号ASP/CP最高,达到52.57%。通过极差分析,可得到对ASP/CP影响的主次顺序为A>B>C>D,即影响最大的因素是发酵时间,其次是发酵温度和水分含量,影响最小的是接种量。通过比较K值,可确定最优发酵条件组合为A2B3C3D3,即发酵时间为3 d,发酵温度为43 ℃,水分含量为50%,接种量为10.5%。
表3 复合益生菌固态发酵酒糟条件优化正交试验结果与分析
Table 3 Results and analysis of orthogonal tests for solid-state fermentation conditions optimization of distiller's grains by compound probiotics
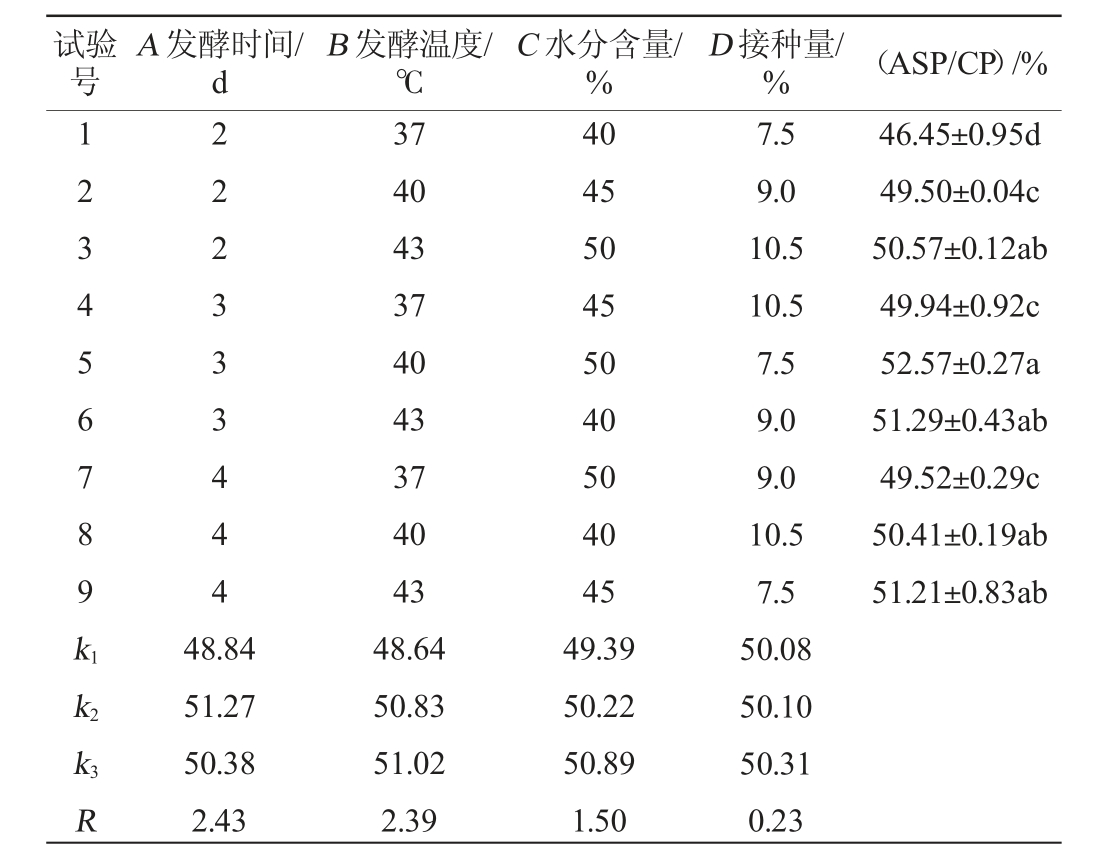
试验号A 发酵时间/d B 发酵温度/℃C 水分含量/%D 接种量/% (ASP/CP)/%12345678 9k1 222333444 46.45±0.95d 49.50±0.04c 50.57±0.12ab 49.94±0.92c 52.57±0.27a 51.29±0.43ab 49.52±0.29c 50.41±0.19ab 51.21±0.83ab k2 k3R 48.84 51.27 50.38 2.43 37 40 43 37 40 43 37 40 43 48.64 50.83 51.02 2.39 40 45 50 45 50 40 50 40 45 49.39 50.22 50.89 1.50 7.5 9.0 10.5 10.5 7.5 9.0 9.0 10.5 7.5 50.08 50.10 50.31 0.23
按最佳发酵条件组合A2B3C3D3,即水分含量为50%,接种量为10.5%,于43 ℃下固态发酵3 d,检测发酵前后的各蛋白品质,试验重复3次,结果见表4。由表4可知,在该优化条件下,CP、ASP含量、蛋白溶解度分别为16.90 g/100 g、8.95 g/100 g、70.70%,ASP/CP可达到52.95%,优于正交试验5号。
表4 固态发酵酒糟发酵前后蛋白质品质变化
Table 4 Changes of protein quality before and after solid-state fermentation of fermented grains
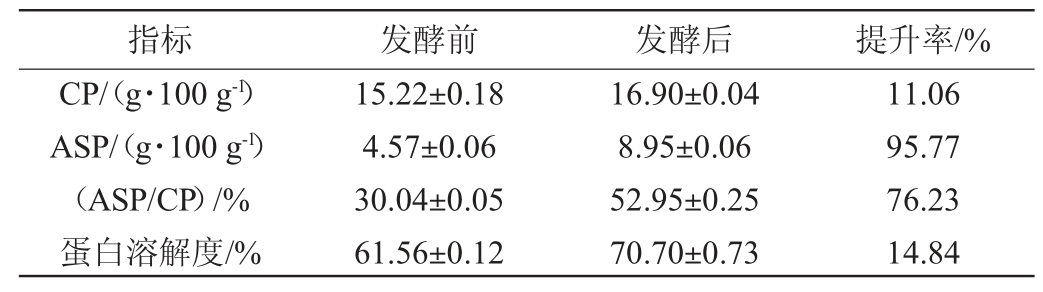
指标 发酵前 发酵后 提升率/%CP/(g·100 g-1)ASP/(g·100 g-1)(ASP/CP)/%蛋白溶解度/%15.22±0.18 4.57±0.06 30.04±0.05 61.56±0.12 16.90±0.04 8.95±0.06 52.95±0.25 70.70±0.73 11.06 95.77 76.23 14.84
通过比较不同配方发酵前后pH及蛋白品质变化筛选出一个益生菌固态发酵酒糟的较合适配方,即酒糟10%,菌糠50%,麸皮20%,洗米糠20%。通过单因素试验和正交设计试验分析得到影响益生菌固态发酵酒糟品质的影响因素次序依次为发酵时间>发酵温度>水分含量>接种量,确定最佳发酵条件组合为A2B3C3D3,即发酵时间为3 d,发酵温度为43 ℃,水分含量为50%,接种量为10.5%。在此优化发酵条件下,与发酵前相比CP含量提高了11.06%,ASP含量提高了95.77%,ASP/CP提高了76.23%,蛋白溶解度提高了14.84%。
本研究通过混合益生菌发酵酒糟,筛选出合适的发酵配方和发酵条件,使酒糟的蛋白品质得到有效提升,在一定程度上提高了酒糟的再利用价值,并为发酵酒糟在酸奶、食用醋、发酵蛋白饲料等方面的应用提供理论基础。今后还可对酶制剂添加量,益生菌发酵液比例等发酵条件进行研究,以期获得更好的发酵品质。
[1]胡志强,李存福,张国顺,等.白酒酒糟综合利用技术研究进展[J].山东化工,2019,48(15):76-78.
[2]时伟,郑红梅,何珺珺,等.白酒糟中功能因子及其提取技术的研究进展[J].中国酿造,2020,39(7):1-6.
[3]范奇高,黎露露,骆红波,等.白酒酿造副产物的资源化利用技术研究进展[J].中国酿造,2023,42(9):1-6.
[4]孔博,蔡林洋,徐健,等.浓香型白酒糟基本成分检测与酶水解[J].酿酒,2020,47(1):79-83.
[5]李红.酒糟综合利用技术研究进展[J].中国资源综合利用,2016,34(12):36-39.
[6]李建,叶翔.酒糟综合利用多元化研究[J].中国酿造,2013,32(12):121-124.
[7]FU S F,XU X H,DAI M,et al.Hydrogen and methane production from vinasse using two-stage anaerobic digestion[J].Process Saf Environ,2017,107:81-86.
[8]蔡吉,刘军,李丽,等.不同灭菌方式对酒糟培养料理化性状及平菇菌丝生长的影响[J].食用菌,2022,44(1):8-12.
[9]司维江,刘建忠,黄德利,等.白酒糟饲料化利用菌种的筛选及工艺优化[J].饲料研究,2022,45(8):67-72.
[10]任羽,王松,王涛.酒糟栽培食用菌研究现状[J].中国酿造,2017,36(3):5-9.
[11]万吉志,冷云伟,吴根江,等.综合利用黄酒糟生产食醋的研究[J].中国酿造,2016,35(1):170-173.
[12]李茂雅,陈玉连,成启明,等.酒糟饲料化利用的研究进展[J].中国饲料,2022(15):133-138.
[13] SATENIK M, AKERKE T, KAIRAT B, et al.Enhanced hydrogen gas production from mixture of beer spent grains(BSG)and distiller's grains(DG)with glycerol by Escherichia coli[J].Int J Hydrogen Energ,2020,45(35):17233-17240.
[14]裴久文,方勇,高学志,等.Ganoderma sp.X1固态发酵改善酒糟品质[J].生物学杂志,2019,36(6):64-68.
[15]胡志强,李存福,张国顺,等.复合菌种协同发酵酒糟生产饲料蛋白分析[J].生物化工,2019,5(4):64-67.
[16]于海漫.白酒糟多菌发酵制取蛋白协同效应及工艺研究[D].洛阳:河南科技大学,2017.
[17]王勇,李忠德.不同水平的益生菌发酵酒糟添加对育肥牛生长性能、屠宰性能及肉品质影响[J].中国饲料,2020(11):117-120.
[18]孙东伟,刘军,牛广杰.多菌种固态发酵酒糟生产菌体饲料蛋白的研究[J].中国饲料,2010(7):38-39,43.
[19]王宏浩,张高瑜,逯梦凡,等.芽孢杆菌KZX-11培养条件及抑菌性能研究[J].中国酿造,2022,41(7):138-143.
[20]马榕灿,李志建,李海峰.布拉迪酵母的面团发酵特性[J].食品科技,2016,41(8):126-129.
[21]雷霜江,吕青遥,王文杰,等.屎肠球菌R40产胆盐水解酶发酵动力学及底物特异性分析[J].中国酿造,2021,40(11):144-148.
[22]刘晓明,刘法孝,李兆勇,等.含水量对不同饲料原料发酵参数的影响[J].中国粮油学报,2016,31(9):100-105.
[23]中华人民共和国家卫生和计划生育委员会,国家食品药品监督管理总局.GB 5009.5—2016食品安全国家标准食品中蛋白质的测定[S].北京:中国标准出版社,2016.
[24]张苗,武俊瑞,代金月,等.响应面优化三氯乙酸沉淀测定豆酱游离氨基酸中蛋白质[J].食品科学,2013,34(10):16-20.
[25]中华人民共和国国家质量监督检验检疫总局,中国国家标准化管理委员会.GB/T 19541—2017 饲料原料豆粕[S].北京:中国标准出版社,2017.
[26]朱建军,王康,刘彦敏,等.酸马奶的微生物学及生产工艺研究现状[J].食品科技,2022,47(1):13-19.
[27]邰佳,马海英.玉米须固体发酵的工艺优化研究[J].当代化工研究,2022(15):165-167.
[28]黄威,许海宁,代春华,等.微生物固态发酵菜籽粕制备多肽的条件优化[J].中国粮油学报,2023,38(2):90-95.
[29] YAO K Y, ZHANG T Z, WANG H F, et al.Upgrading of by-product from beverage industry through solid-state fermentation with Candida utilis and Bacillus subtilis[J].Lett Appl Microbiol,2018,67(6):557-563.
[30] SADH P K, DUHAN S, DUHAN J S.Agro-industrial wastes and their utilization using solid state fermentation: a review[J].Bioresourc Bioprocess,2018,5(1):1-15.
[31]ZUO S S,NIU D Z,NING T T,et al.Protein enrichment of sweet potato beverage residues mixed with peanut shells by Aspergillus oryzae and Bacillus subtilis using central composite design[J].Waste Biomass Valorization,2018,9(5):835-844.
[32] XU X,LIN M,ZANG Q,et al.Solid state bioconversion of lignocellulosic residues by Inonotus obliquus for production of cellulolytic enzymes and saccharification[J].Bioresource Technol,2018,247:88-95.
[33]YAZID N A,BARRENA R,SANCHEZ A.Assessment of protease activity in hydrolysed extracts from SSF of hair waste by and indigenous consortium of microorganisms[J].Waste Manage,2016,49:420-426.