表1 菌株产蛋白酶条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for protease production conditions optimization of strain

水平 X1发酵温度/℃ X2接种量/% X3培养时间/h-1 01 30 35 40 345 36 40 44
Screening of acid-and protease-producing Staphylococcus from Cupei of bran vinegar and optimization of enzyme production conditions
食醋是一种由糯米、高粱、大米、玉米、小麦以及糖类发酵制成的酸味调味品,富含多种营养成分,如多酚类、黄酮类、川芎嗪等[1-2],在抗癌、心血管疾病的预防方面也有很大作用[3],可开发为功能食品,市场前景广阔。四川麸醋是我国四大名醋之一,以麦麸为主要原料,药曲为糖化发酵剂,糖化、酒精发酵和乙酸发酵同池进行,并加以9次耖糟酿制而成[4-5],其成品呈黑褐色、澄清、香味浓郁、酸味柔和[6],可长时间储存。
研究发现,有机酸是衡量食醋品质的主要指标[7],影响食醋的口感和风味。食醋中大部分有机酸来自发酵过程中的各种微生物代谢[8-10],小部分是来源于酿造原料本身所具有的风味。食醋中的有机酸有乳酸、乙酸、柠檬酸、琥珀酸等[11],不同地域酿造食醋的工艺、原料来源、地理环境以及气候不同,造成有机酸的组成和含量均存在很大的差异[12],但在各种食醋中,乳酸和乙酸始终是主要有机酸[13],乙酸是醋中主要的酸味成分,乳酸可柔和醋酸刺激性气味[14],两者含量可达到样品总有机酸含量的80%以上[15]。此外,乳酸和乙酸还可与一些醇类结合生产酯,中间代谢产物丙酮还可作为其他风味物质的前体[16],增加醋的风味。蛋白酶是水解蛋白质肽链的一类酶的总称,广泛应用于食品加工。在食醋发酵过程中,蛋白质分解不完全会产生沉淀[17],蛋白酶能水解原料中的蛋白质,促进微生物生长及风味物质的产生[18],潘佩平等[19]研究发现,蛋白酶的存在可以提高淀粉的利用率、酒精发酵力。在酒精发酵阶段或醋酸发酵阶段加入酸性蛋白酶可以明显提高醋醅中酸度和氨基酸态氮的含量[20]。
葡萄球菌(Staphylococcus)多存在于发酵制品中,在香肠发酵过程中,能促进蛋白质和脂肪的降解[21],赋予香肠好的风味,对色泽稳定也起着重要作用。已有研究显示,在镇江香醋醋醅中存在葡萄球菌,且首次从醋醅中获得了葡萄球菌纯培养物[22]。CASABURI A等[23]对不同种类的葡萄球菌进行蛋白酶活性分析,发现大多数葡萄球菌可以产蛋白酶。董杰等[24]也研究发现,大部分葡萄球菌的蛋白酶活力虽然有限,但是对蛋白质的降解作用显著。目前,对食醋微生物的研究多集中于醋酸菌和乳酸菌,葡萄球菌作为发酵香肠的主要微生物,在同为发酵产品的醋中也一定发挥了其独特的作用。
本试验旨在从麸醋醋醅中筛选得到一株可产酸、产蛋白酶的无致病性葡萄球菌。对菌株的产酸、产蛋白酶能力进行测定,并利用单因素试验及响应面设计试验对菌株产蛋白酶条件进行优化。将菌株应用于食醋固态发酵,探究菌株对食醋固态发酵的影响,这对丰富葡萄球菌在食醋酿造工艺中的应用、探究醋醅中产酸菌株、提高食醋风味均具有积极作用。
1.1.1 样品来源
醋醅:采集自宜宾市某醋厂,在一个发酵池中的上、中、下三层的四个角及中心各取醋醅500 g,并将每层样品充分混匀后的样品置于无菌袋中,-20 ℃条件下保存备用。
1.1.2 试剂
葡萄糖、酵母浸粉、蛋白胨、琼脂粉、牛肉膏(均为生化试剂):北京奥博星生物技术有限责任公司;无水乙醇、无水乙酸钠、吐温80、氯化钠、冰乙酸(均为分析纯):成都市科隆化学品有限公司;甘露醇、氯化钙、L-酪氨酸、酪蛋白、福林-酚试剂、氢氧化钠(均为分析纯):上海阿拉丁生化科技股份有限公司;磷酸(分析纯)、甲醇(色谱级)、乳酸、乙酸(均为分析纯):上海麦克林生化科技有限公司;细菌基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:生工生物工程(上海)股份有限公司。
1.1.3 培养基
富集培养基:蛋白胨10 g/L、酵母浸粉5g/L、氯化钠10 g/L。
分离培养基:蛋白胨10 g/L、酵母浸粉10 g/L、碳酸钙5 g/L、葡萄糖30 g/L、乙醇含量3.5%(V/V)、琼脂粉20 g/L。
发酵培养基:蛋白胨10 g/L、酵母浸粉10 g/L、葡萄糖30 g/L、乙醇含量3.5%(V/V),调节pH 6.5。
蛋白酶活性鉴定培养基[25]:蛋白胨10 g/L、酵母浸粉10 g/L、甘露醇10 g/L、氯化钠25 g/L、琼脂粉20 g/L。
甘露醇发酵培养基:蛋白胨10 g/L、氯化钠10 g/L、甘露醇10 g/L、酵母浸粉5 g/L、溴麝香草酚蓝0.024 g/L。
醋固态发酵培养基[26]:30 g麸皮,10 g稻壳置于500 mL锥形瓶中。
以上培养基均在121 ℃灭菌20 min。
EX20光学显微镜:奥林巴斯(中国)有限公司;V-1000可见分光光度计:翱艺仪器(上海)有限公司;PR224ZH/E电子天平:奥豪斯仪器(常州)有限公司;TC-96/G/H(b)聚合酶链式反应(polymerase chain reaction,PCR)仪:杭州博日科技股份有限公司;DYY-6D电泳仪:北京六一生物科技有限公司;LC-2030 C 3D PLUS高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;pHS-3Cb酸度计:上海越平科学仪器有限公司。
1.3.1 产酸、产蛋白酶菌株的筛选
初筛:无菌条件下称取10 g充分研磨的醋醅样品,加入90 mL无菌生理盐水中,37 ℃、180 r/min摇床培养2 h,得到菌悬液。接种2%菌悬液于富集培养基,相同条件下摇床培养12 h。将富集后的菌液用无菌生理盐水梯度稀释,取10-3、10-4、10-5梯度菌液各100 μL涂布于分离培养基,37 ℃恒温培养24 h。挑选分离平板上产生透明圈的单个菌落,在分离培养基上多次划线纯化。将经初筛得到的菌株划线于蛋白酶活性鉴定培养基,37 ℃培养24 h,观察菌落周围有无白色沉淀。
复筛:将筛选菌株接种于发酵培养基中,37 ℃恒温培养24 h后,采用HPLC法测定发酵液中乙酸、乳酸含量。
1.3.2 产酸、产蛋白酶菌株的鉴定
形态特征观察:观察平板上菌落的颜色、形状、大小、隆起、平滑程度及边缘特征,挑取处于生长对数期的菌株进行革兰氏染色和扫描电镜观察。
分子生物学鉴定:DNA提取采用细菌基因组DNA提取试剂盒(离心吸附柱型)。以通用引物16S-27f和16S-1429r进行PCR扩增,扩增完成后,取10 μL扩增产物用1.2%琼脂糖凝胶检测提取效果;将扩增后的产物送往擎科生物科技有限公司进行基因测序。将测序结果提交美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)序列比对,再利用MEGA5.0构建系统发育树。
1.3.3 安全性检测
溶血实验:参照文献[27]的方法进行测定。
甘露醇发酵实验:将菌株接种于发酵培养基,37 ℃、180 r/min摇床培养12 h进行活化,取活化后的菌液1%接种于甘露醇发酵管(以金黄色葡萄球菌为对照),37℃孵育18~24 h,每隔6 h观察发酵管颜色变化。
凝固酶实验:用接种环取活化后的菌液于滴加一滴生理盐水的载玻片上,混合均匀后观察有无自凝现象(以已知凝固酶阳性的金黄色葡萄球菌为对照),若15 s内无自凝,再加入1环兔新鲜血浆,混匀后观察结果,5~10 s内出现凝集则为阳性,反之则为阴性。
1.3.4 菌株生长特性研究
菌株生长曲线绘制:将活化后的菌液以2%的接种量接种至发酵培养基,37 ℃、180 r/min培养,每隔2 h取1 mL菌液适当稀释后,利用可见光分光光度计测定菌液在波长600 nm处的OD600 nm值[28]。以发酵时间为横坐标,OD600 nm值为纵坐标,绘制生长曲线。
菌株最适生长条件优化:将活化后的菌液以2%的接种量接种至发酵培养基中,分别在不同培养温度(22 ℃、27 ℃、32 ℃、37 ℃、42 ℃)、发酵培养基初始pH(2.5、3.5、4.5、5.5、6.5、7.5)(用1 mol/L冰乙酸溶液调节)、初始乙醇体积分数(0%、0.5%、1.5%、2.5%、3.5%、4.5%)、初始葡萄糖含量(1%、2%、3%、4%、5%、6%)条件下培养24 h,测定菌液在波长600 nm处的吸光度值,确定菌株生长的最适条件。
1.3.5 菌株产酸能力测定
样品处理:将分离得到的菌株接种到含50 mL发酵培养基的三角瓶中,37 ℃、180 r/min条件下培养72 h后,取1 mL发酵液,10 000 r/min离心2 min后取上清液,经0.22 μL滤膜过滤后进样,利用HPLC法测定乳酸、乙酸产量。
标品配制:准确称取色谱级乳酸、乙酸,以体积分数70%的乙醇为溶剂,配制成1 000 mg/L、500 mg/L、250 mg/L、100 mg/L、10 mg/L梯度标准溶液,4 ℃条件下保存。
色谱条件:色谱柱为Agilent 5 HC-C18;流动相为甲醇∶0.1%磷酸缓冲液=95∶5(V,V);流速1 mL/min;柱温30 ℃;进样量10 μL;紫外检测波长214 nm;等度洗脱。
1.3.6 菌株产蛋白酶条件优化
蛋白酶活力测定:将菌株接种于发酵培养基,37 ℃、180 r/min摇床培养12 h进行活化,取活化后的菌液1%接种于发酵培养基,最适生长条件下摇床培养24 h。1 000 r/min离心5 min,收集上清液。利用福林-酚法[29]测定酸性蛋白酶活力,以酪蛋白为底物,将40 ℃条件下每分钟水解酪蛋白产生1 μg酪氨酸,定义为1个蛋白酶活力单位(U/g)。
菌株产蛋白酶条件优化单因素试验:将活化后的菌株接种于发酵培养基,分别在不同发酵温度(20 ℃、25 ℃、30℃、35 ℃、40 ℃、45 ℃)、培养时间(8 h、16 h、24 h、32 h、40 h、48 h)和接种量(1%、2%、3%、4%、5%、6%)条件下培养,其他条件参考最适生长条件。离心收集上清液,测定菌株在不同条件下的蛋白酶活性,平行3组。
菌株产蛋白酶条件优化响应面试验:以发酵温度(X1)、接种量(X2)、培养时间(X3)为自变量,蛋白酶活性(Y)为响应值,利用Design-Expert 8.0.6进行试验设计(每组试验3组平行,结果取平均值)。响应面试验因素与水平见表1。
表1 菌株产蛋白酶条件优化响应面试验因素与水平
Table 1 Factors and levels of response surface tests for protease production conditions optimization of strain

水平 X1发酵温度/℃ X2接种量/% X3培养时间/h-1 01 30 35 40 345 36 40 44
1.3.7 葡萄球菌D-6在固态发酵中的应用
将活化后的菌液以2%的接种量接种于食醋固态发酵培养基,于最适生长条件下发酵培养5 d,测定培养基中pH、总酸和氨基酸态氮的含量[30-31],以不加发酵液的培养基作对照。同时收集发酵液,处理后按1.3.5方法测定乳酸、乙酸含量。
样品经初筛得到3株有透明圈菌落,划线于蛋白酶活性鉴定培养基,一株菌在蛋白酶活性鉴定培养基上形成白色沉淀,将其命名为D-6,后续试验中均以菌株D-6作为出发菌株。对该菌株进行形态学鉴定,结果见图1。由图1可知,菌株D-6在平板上呈圆形,白色不透明,表面光滑;为革兰氏阳性菌,菌体为球形。
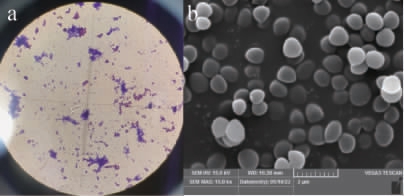
图1 菌株D-6的革兰氏染色(a)及电镜扫描(b)结果
Fig.1 Results of Gram staining (a) and electron microscope scanning(b) of strain D-6
经HPLC测定,菌株D-6发酵液中乙酸含量为157.2mg/L,乳酸含量为8 434.4 mg/L。表明菌株D-6可产乙酸、乳酸,对增加食醋中有机酸含量有积极作用。
由图2可知,菌株D-6经PCR扩增得到碱基大小在1500bp左右的亮带。测序结果用Contig Express拼接,去除两端不准的部分,将拼接好的序列在NCBI的GenBank数据库中进行比对,利用MEGA 5.0软件构建系统发育树,结果见图3。由图3可知,菌株D-6与表皮葡萄球菌(Staphylococcus epidermidis)的进化距离最近。结合菌株形态学特征和16S rRNA序列分析的结果,将菌株D-6鉴定为表皮葡萄球菌。
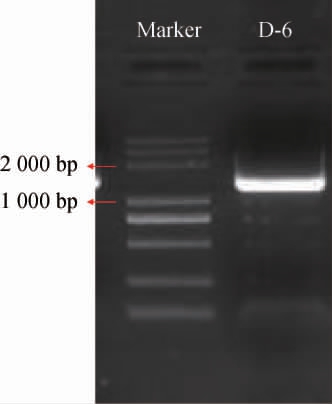
图2 菌株D-6 16S rRNA PCR扩增产物电泳图
Fig.2 Electrophoresis of 16S rRNA PCR amplification product of strain D-6
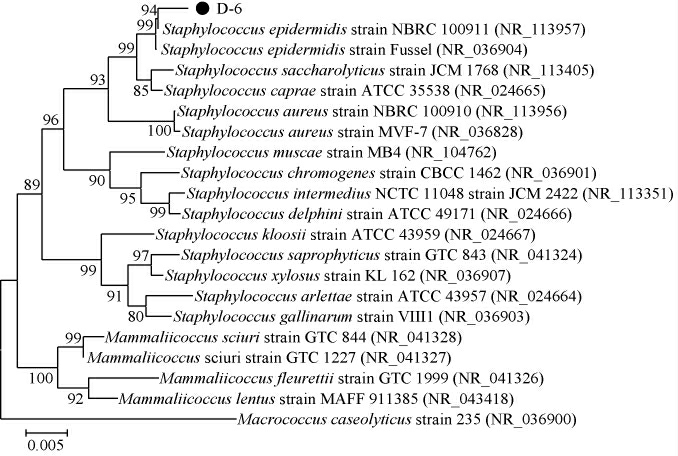
图3 基于16S rRNA基因序列菌株D-6的系统发育树
Fig.3 Phylogenetic tree of strain D-6 based on 16S rRNA gene sequence
葡萄球菌可分为致病性和非致病性两类,为保证菌株的安全性,对菌株D-6进行安全性检测,结果见表2。由表2可知,菌株D-6溶血实验、凝固酶实验、甘露醇发酵实验结果均为为阴性,说明菌株无致病性。
表2 菌株D-6安全性检测结果
Table 2 Safety test results of strain D-6
注:“--”表示结果为阴性。
项目 溶血实验 凝固酶实验 甘露醇发酵实验实验结果 —— --
2.4.1 生长曲线
由图4可知,菌株D-6在0~6 h 为生长延滞期,增长缓慢;6~20 h为对数生长期,活菌数以几何级数快速升高;22~26 h处于稳定生长期,菌群总数保持稳定;26 h 后开始进入衰亡期。因此,确定菌株D-6最适生长时间为22~26 h。
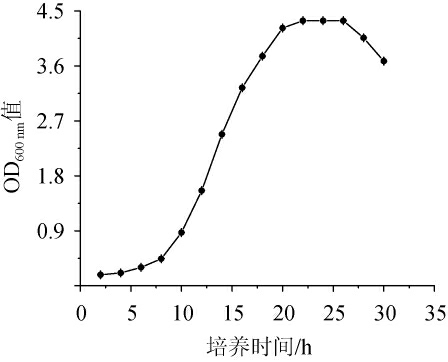
图4 菌株D-6的生长曲线
Fig.4 Growth curve of strain D-6
2.4.2 菌株D-6最适生长条件
由图5a可知,在最适培养时间内,37 ℃时菌株D-6在波长600 nm处的吸光度值最大,且基本与菌株生长曲线稳定期OD600nm值一致,因此菌株D-6生长的最适温度为37 ℃。由图5b可知,在pH 2.5~5.5的范围内,随着pH的升高,菌株D-6的OD600 nm值逐渐增大;当pH>5.5时,OD600 nm值开始下降,因此菌株D-6的最适生长pH值为5.5。由图5c可知,初始乙醇体积分数>0.5%会抑制菌株的生长,且抑制作用较为明显,适当浓度的乙醇溶液有利于菌株进行合成代谢,乙醇溶液浓度过大,会对菌株的细胞膜造成破坏,对细胞产生损伤。由图5d可知,初始葡萄糖含量为1%~3%时,菌株的OD600nm值随葡萄糖含量的升高逐渐上升,葡萄糖含量为3%时,OD600nm值达到最大值;当葡萄糖含量>3%时,OD600nm值下降缓慢,菌液的浓度逐渐降低,因此菌株的最适生长葡萄糖含量为3%。综合可知,菌株D-6的最适生长条件为培养温度37 ℃,初始pH值为5.5,乙醇体积分数0.5%,葡萄糖含量3%。
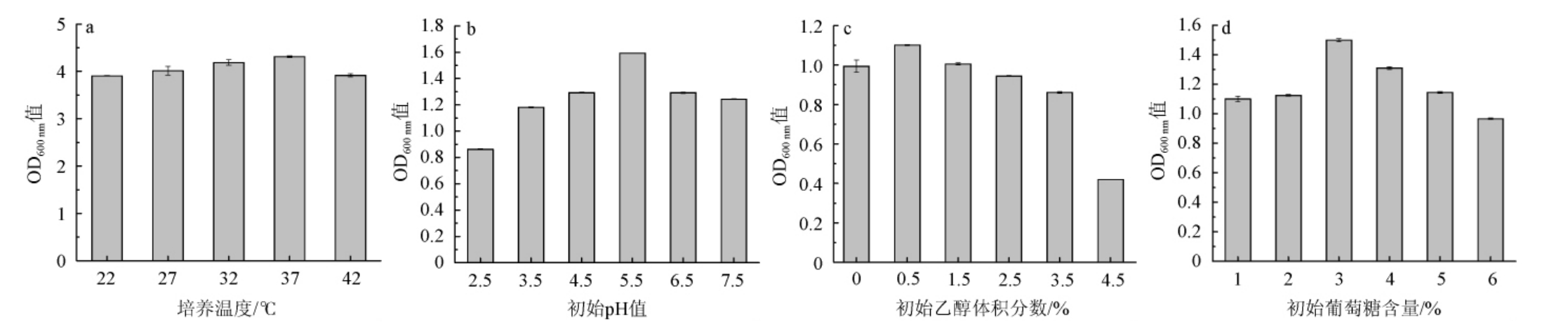
图5 培养温度(a)、初始pH值(b)、初始乙醇体积分数(c)、初始葡萄糖含量(d)对菌株D-6生长的影响
Fig.5 Effects of culture temperature (a), initial pH (b), initial ethanol volume fraction (c), initial glucose contents (d) on the growth of strain D-6
2.5.1 不同培养条件对蛋白酶活性的影响
由图6a可知,蛋白酶活力随发酵温度的升高呈先升高后降低的趋势,发酵温度为35 ℃时,蛋白酶活力达到34.88 U/g。发酵温度高于35 ℃后,由于温度过高导致蛋白酶失活,蛋白酶活力下降;因此选择发酵温度为35 ℃进行后续试验。由图6b可知,接种量1%~4%范围内时,蛋白酶活力大小随接种量的升高而增大;接种量为4%时,蛋白酶活力为33.98 U/g;当接种量>4%时,蛋白酶活力呈现下降趋势,这是由于过多的菌体导致营养物质消耗过快,且菌液的溶氧浓度有限,导致部分菌体死亡。此时再增加接种量,菌体也不会生长;由图6c可知,在0~40 h发酵时间内,随着发酵的进行,菌株蛋白酶活力逐渐升高,发酵时间到40 h时,蛋白酶活力达到最大值35.57 U/g,发酵时间>40 h后,营养物质不足导致蛋白酶活力下降。因此,选择发酵时间为40 h。
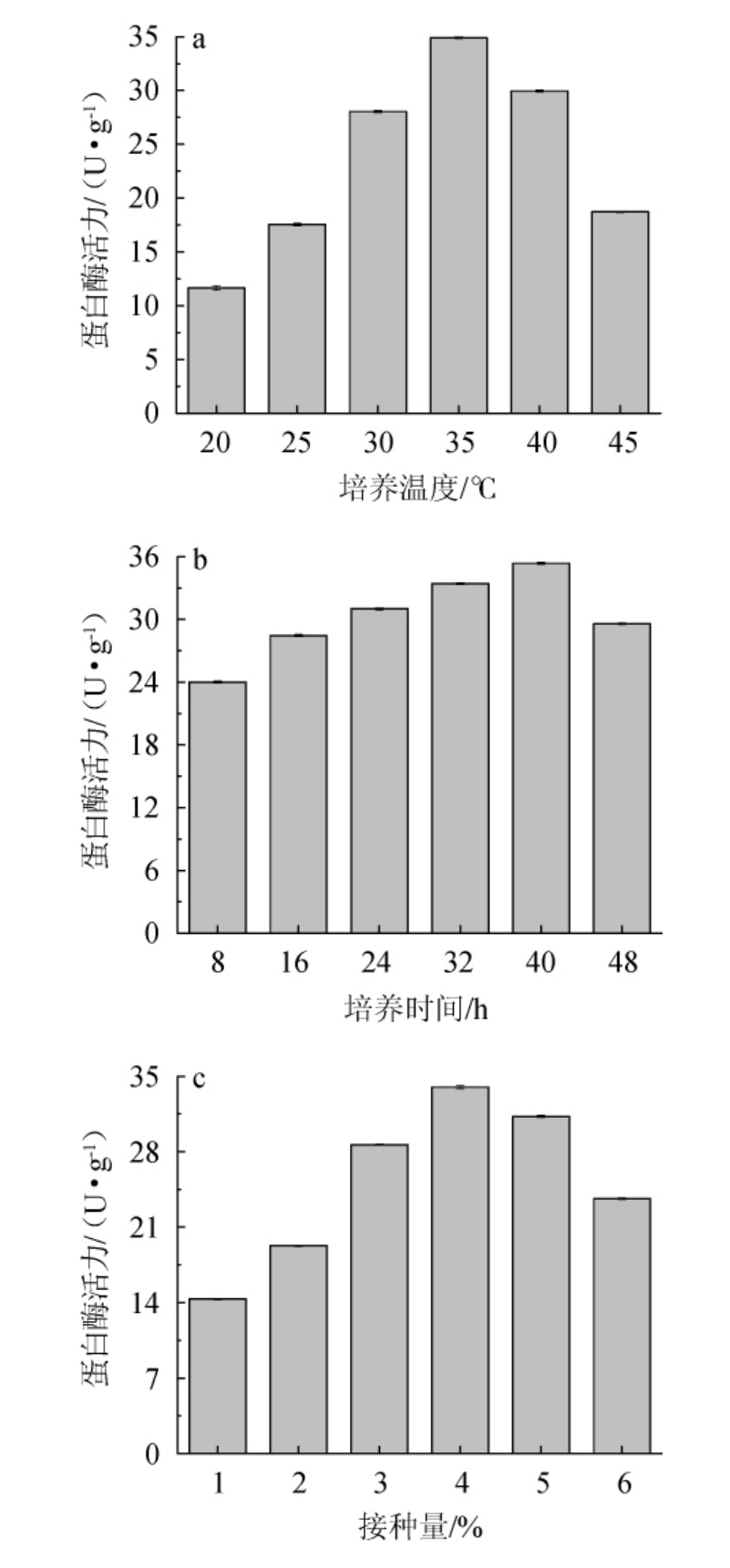
图6 不同培养条件对蛋白酶活性的影响
Fig.6 Effect of different culture conditions on protease activities
2.5.2 响应面法优化试验
响应面试验设计及结果见表3。采用Design Expert 8.0.6软件对表3试验结果进行多元回归拟合分析,得到菌株D的蛋白酶活力Y对发酵温度(X1)、接种量(X2)、培养时间(X3)的多项回归方程Y=35.45+3.05X1-1.15X2+3.88X3-1.23X1X2+1.44X1X3-1.66X2X3-9.03X12-5.21X22-6.07X32。
表3 响应面试验设计与试验结果
Table 3 Response surface test design and test results
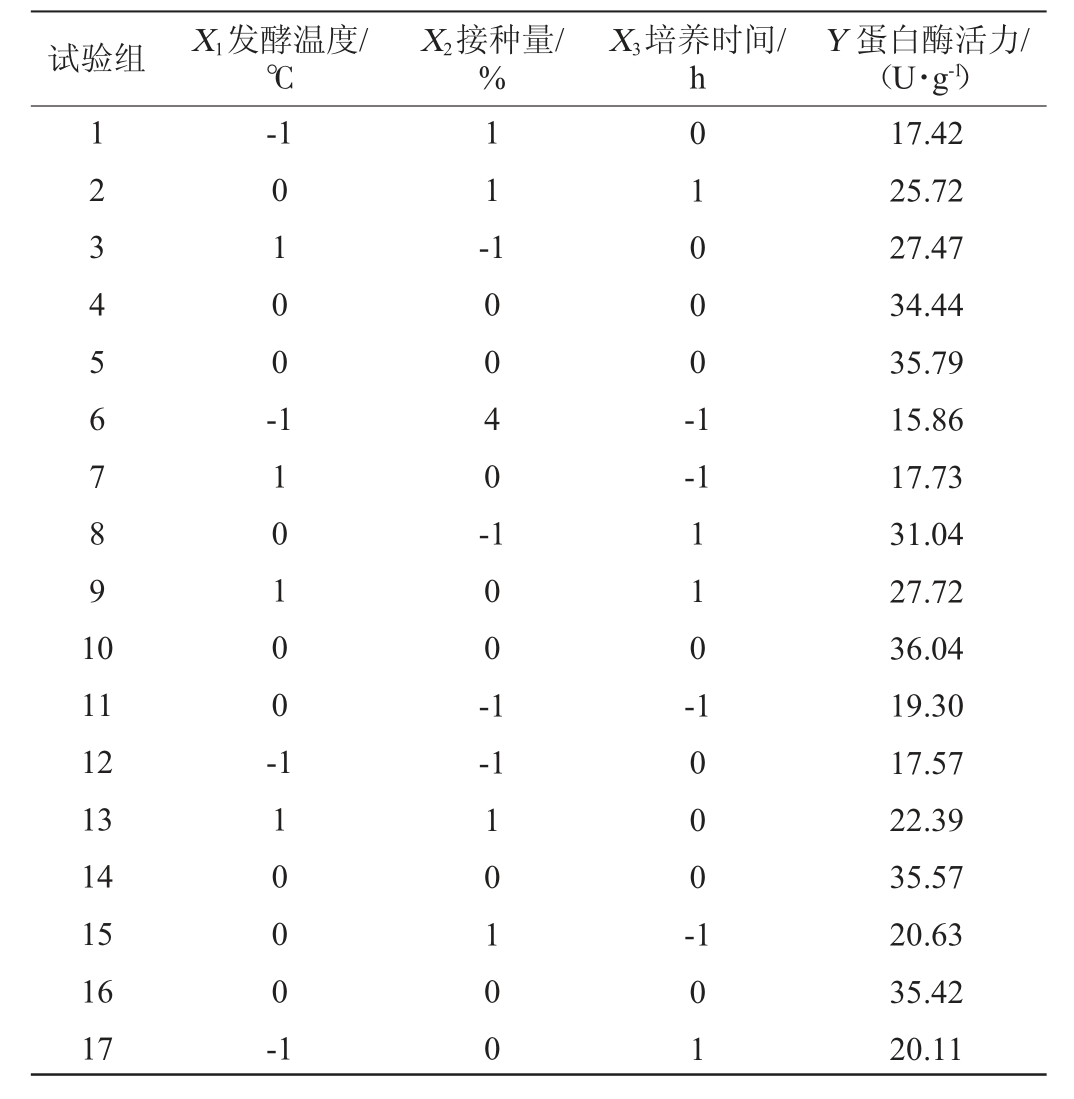
试验组 X1发酵温度/℃X2接种量/%X3培养时间/h Y 蛋白酶活力/(U·g-1)123 4567891 0-1 0 1 0 0 -1 1 -1 004 0-0 1000-1-1 11 12 13 14 15 16 17 110100-1 0 0 -1 1 1 0 -1100 0-1-1 10100 1 0 0 0 -101 17.42 25.72 27.47 34.44 35.79 15.86 17.73 31.04 27.72 36.04 19.30 17.57 22.39 35.57 20.63 35.42 20.11
中心组合试验的方差分析见表4。由表4可知,模型的F值为114.27,P<0.01,说明该模型极显著。失拟项P=0.100 5(P>0.05),表现为不显著,说明回归方程对试验拟合情况较好。模型决定系数R2=0.993 2,调整决定系数R2Adj=0.984 5,说明利用该方程来代替实际试验点进行分析具有合理性。由P值可知,一次项X1、X3对蛋白酶活性影响极显著(P<0.01),X2对蛋白酶活性影响显著(P<0.05);二次项X12、X22、X32对蛋白酶活性影响极显著(P<0.01);交互项X1X2、X1X3对蛋白酶活性影响显著(P<0.05),X2X3对蛋白酶活性影响极显著(P<0.01)。通过比较F值,3个因素对蛋白酶活性的影响大小依次为培养时间>发酵温度>接种量。
表4 回归模型方差分析
Table 4 Variance analysis of regression model
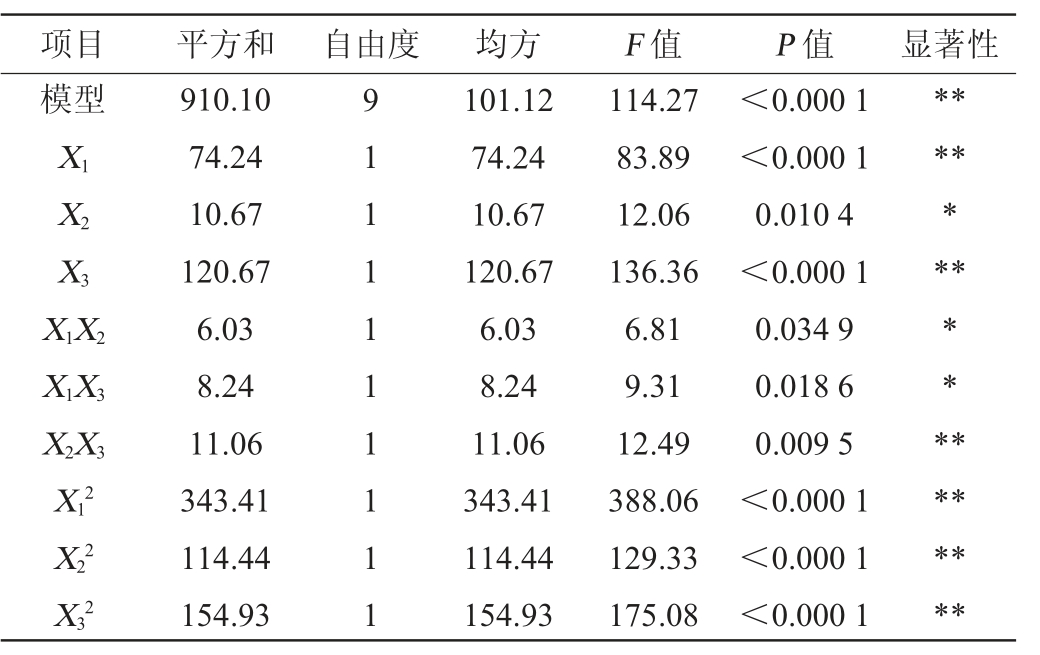
项目 平方和 自由度 均方 F 值 P 值 显著性模型X1 X2 X3 X1X2 X1X3 X2X3 X12 X22 X32 910.10 74.24 10.67 120.67 6.03 8.24 11.06 343.41 114.44 154.93 911111 1111 101.12 74.24 10.67 120.67 6.03 8.24 11.06 343.41 114.44 154.93 114.27 83.89 12.06 136.36 6.81 9.31 12.49 388.06 129.33 175.08<0.000 1<0.000 1 0.010 4<0.000 1 0.034 9 0.018 6 0.009 5<0.000 1<0.000 1<0.000 1*****************
续表
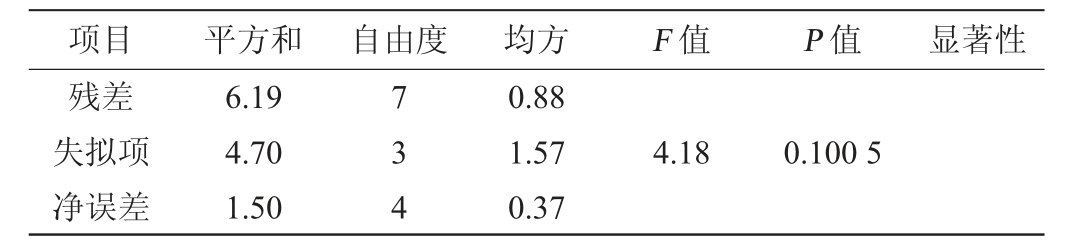
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。
项目 平方和 自由度 均方 F 值 P 值 显著性残差失拟项净误差6.19 4.70 1.50 734 0.88 1.57 0.37 4.18 0.100 5
利用Design Expert 8.0.6 软件对表3数据进行多元回归拟合,得到的两两因素间交互作用对蛋白酶活力影响的响应面及等高线,结果见图7。由图7可知,培养温度、接种量、培养时间两两间交互作用的响应面图存在最高点,说明在选定的接种量、培养时间和发酵温度范围内,蛋白酶活性存在最大值,两两因素间交互作用对蛋白酶活力影响显著,与表4方差分析结论一致。
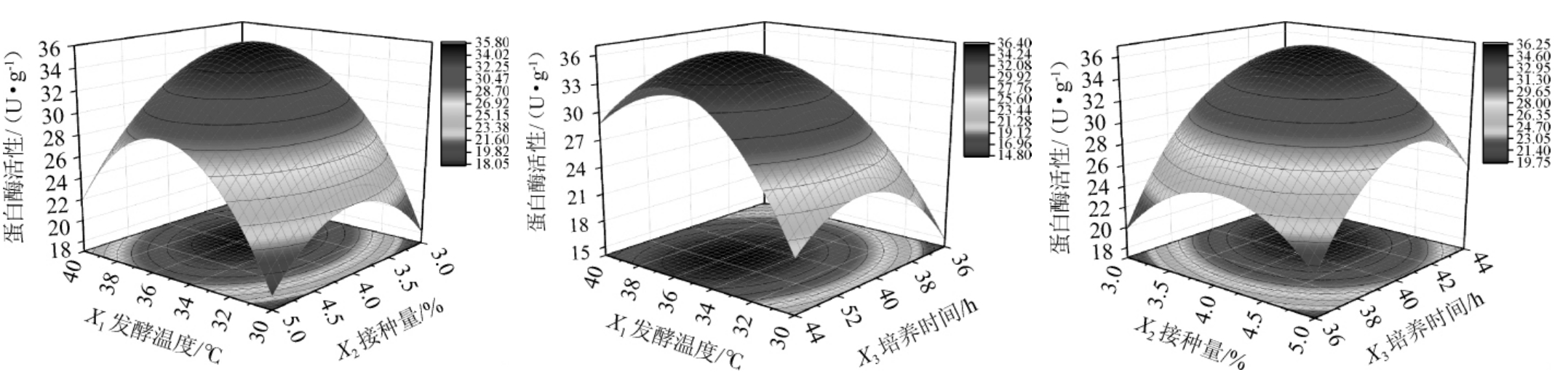
图7 两因素间交互作用对蛋白酶活性影响的响应面及等高线
Fig.7 Response surface plots and contour lines of effect of interaction between two factors on protease activity
利用Design Expert 8.0.6软件对回归方程进行求解,得出菌株D-6的最佳产酶条件为:培养温度36.18 ℃,接种量4.08%,培养时间41.16 h,此条件下菌株D-6产蛋白酶活为36.21 U/g。考虑到实际操作情况,将发酵条件修正为培养温度36 ℃,接种量4%,培养时间41 h。在此条件下进行验证,蛋白酶活性为36.12 U/g,与预测值的相对误差较小,说明该模型准确可靠。优化后相比优化前(24.20 U/g)蛋白酶活力提高了49.25%。
固态发酵后测定pH、总酸、氨基酸态氮以及有机酸含量,结果见表5。
表5 固态发酵食醋理化指标检测结果
Table 5 Determination results of physicochemical indexes of solid-state fermented vinegar
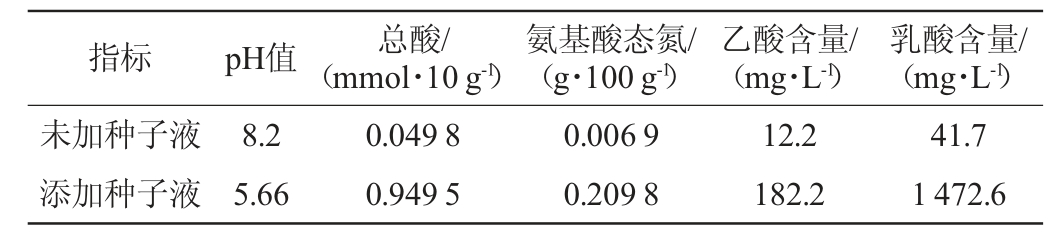
乳酸含量/(mg·L-1)未加种子液添加种子液指标 pH值 总酸/(mmol·10 g-1)氨基酸态氮/(g·100 g-1)乙酸含量/(mg·L-1)8.2 5.66 0.049 8 0.949 5 0.006 9 0.209 8 12.2 182.2 41.7 1 472.6
由表5可知,接种葡萄球菌D-6进行固态发酵后,体系中pH减小,总酸含量增大,氨基酸态氮含量增大,乙酸、乳酸含量较未加种子液均有增加。氨基酸态氮可以作为酿造醋发酵程度的特性指标[32],由此可见,葡萄球菌D-6应用于食醋固态发酵可以增加pH、总酸、氨基酸态氮及有机酸含量,对食醋生产有积极作用。
利用透明圈法和高效液相色谱法(HPLC)从麸醋醋醅中筛选得到一株产酸、产蛋白酶、无致病性的表皮葡萄球菌,最适生长条件为:培养温度37 ℃,初始pH 5.5,初始葡萄糖含量3%,初始乙醇体积分数0.5%;发酵后测定有机酸含量,乙酸含量为157.2 mg/L,乳酸含量为8 434.4 mg/L;在单因素试验基础上,利用响应面法对菌株产蛋白酶条件进行优化,结果显示,该菌株在温度36 ℃,接种量4%,培养时间41 h时蛋白酶活性最大。在此条件下进行发酵,蛋白酶活性为36.12 U/g,较优化前蛋白酶活力提高了49.25%。将其应用于食醋固态发酵,总酸、氨基酸态氮以及乳酸、乙酸含量都有所增加。本研究对探究醋醅中产酸菌株、提高食醋风味、丰富菌种资源具有积极作用,为酿醋的工业化生产提供更多菌种选择,也为之后醋的风味改良提供一个新思路。
[1]李阳,张倩,杨埔,等.生料醋醅中优势醋酸菌的筛选及其产酸特性[J].食品工业科技,2020,41(20):116-121,134.
[2]纪凤娣,魏巍,陶汇源,等.传统食醋中有机酸与人体健康[J].中国酿造,2021,40(3):11-16.
[3]SAICHANA N,MATSUSHITA K,ADACHI O,et al.Acetic acid bacteria: A group of bacteria with versatile biotechnological applications[J].Biotechnol Adv,2015,33(6):1260-1271.
[4]刘军,朱文优,杨勇.保宁醋固态发酵理化指标的动态分析[J].中国酿造,2006,25(5):45-47.
[5]杜大钊,黄静,王瑞,等.四川麸醋及其陈酿过程中挥发性风味物质解析[J].食品与发酵科技,2020,56(5):1-6.
[6]饶静,李春扬,张晓磊,等.高效液相色谱法同时测定苹果醋及原料中的17种有机酸[J].中国酿造,2018,37(4):169-173.
[7]余永建,邓晓阳,陆震鸣,等.高效液相色谱法定量分析固态发酵食醋中有机酸的方法优化[J].食品科学,2014,35(4):55-59.
[8]余永建.镇江香醋有机酸组成及乳酸合成的生物强化[D].无锡:江南大学,2014.
[9]张雅琳,刘廷锐,朱文优,等.基于Illumina MiSeq高通量测序技术解析四川麸醋发酵过程中微生物菌群结构[J].中国食品学报,2022,22(6):299-306.
[10]周楠,黄钧,周荣清,等.生物强化和中间代谢物扰动对四川麸醋微生物群落结构及代谢组分的影响[J].食品与发酵工业,2022,48(24):211-219.
[11]邝格灵,王新宇,李树,等.基于电子鼻与气相色谱-质谱联用区分不同陈酿期恒顺香醋风味物质[J].食品科学,2020,41(12):228-233.
[12] XU W, HUANG Z Y, ZHANG X J, et al.Monitoring the microbial community during solid-state acetic acid fermentation of Zhenjiang aromatic vinegar[J].Food Microbiol,2011,28(6):1175-1181.
[13]刘廷锐,张超,朱文优,等.四川不同地区的熟醋及其固态发酵过程中有机酸含量变化分析[J].食品研究与开发,2020,41(3):166-172.
[14]沈咪娜,陆震鸣,张晓娟,等.镇江香醋醋酸发酵阶段产乳酸功能细菌的物种多样性[J].应用与环境生物学报,2019,25(6):1434-1440.
[15]余宁华,陆震鸣,许伟,等.基于主成分分析的中国发酵食醋有机酸含量差异性分析[J].食品与发酵工业,2010,36(10):144-148.
[16]李雅茹.山西老陈醋源优良酵母菌和乳酸菌的筛选、互作及应用研究[D].晋中:山西农业大学,2019.
[17]毕静.酸性蛋白酶在镇江香醋生产中的应用研究[J].粮食与食品工业,2021,28(1):59-60,64.
[18]乔羽,于迪,范振宇,等.山西老陈醋发酵过程中高产蛋白酶芽孢杆菌的筛选与鉴定[J].食品与发酵科技,2017,53(6):11-16,33.
[19]潘佩平,王慕华,苏槟楠,等.酸性蛋白酶在山西老陈醋酿造中的应用[J].中国调味品,2014,39(10):33-36.
[20]毕静.镇江香醋酶解工艺的优化研究[J].中国调味品,2018,43(3):105-107,113.
[21]刘夏炜,靳志敏,罗玉龙,等.内蒙古肉制品中葡萄球菌的筛选及生产性能的研究[J].食品科技,2015,40(1):130-133.
[22]朱其瀚.镇江香醋发酵过程中微生物分离及其产酸特性[D].无锡:江南大学,2008.
[23]CASABURI A,VILLANI F,TOLDRÁ F,et al.Protease and esterase activity of Staphylococci[J].Int J Food Microbiol, 2006, 112(3): 223-229.
[24]董杰,蒋云升.肉源产蛋白酶葡萄球菌发酵剂的筛选研究[J].食品科学,2009,30(19):194-196.
[25]张琦琳,林胜利,聂小华.传统鱼制品中优良葡萄球菌的筛选与鉴定[J].食品工业科技,2012,33(13):178-180,196.
[26]赵翠梅.食醋固态发酵人工菌群构建与发酵工艺优化[D].天津:天津科技大学,2021.
[27]王曼,杨琛,覃晓玉,等.鲊肉粉中乳酸菌和葡萄球菌的筛选及鉴定[J].食品与发酵工业,2021,47(5):22-27.
[28]于华,黄丹,陈卓,等.四川麸醋醋醅中产酸芽孢杆菌的分离及发酵特性研究[J].中国食品添加剂,2017(1):83-90.
[29]郑东影,陈玮,张卫卫,等.福林酚法测定酿酒白曲酸性蛋白酶活力的条件试验[J].酿酒,2020,47(2):63-66.
[30]中华人民共和国国家卫生和计划生育委员会.GB 5009.235—2016食品安全国家标准食品中氨基酸态氮的测定[S].北京:中国标准出版社,2016.
[31]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB2719—2018 食品安全国家标准食醋[S].北京:中国标准出版社,2018.
[32]丁奇,马立利,郎爽,等.不同调味品中氨基酸态氮、总酸含量的分析及比较研究[J].分析仪器,2021(3):70-74.