Construction of Lactobacillus acidophilus expression vector and expression of mannanase
β-1,4-甘露聚糖酶(β-1,4-mannanase)EC 3.2.1.78,简称β-甘露聚糖酶或甘露聚糖酶,是一类水解甘露聚糖分子内β-1,4糖苷键的内切型水解酶[1-3]。甘露聚糖酶广泛应用于饲料添加剂、石油开采、纸浆加工、果汁澄清、生物质糖化、洗涤添加剂和甘露寡糖的制备等[4-7]。甘露聚糖酶存在于各类微生物、动物和植物中,其中微生物来源的甘露聚糖酶具有种类丰富、生产成本低、酶活性高和耐极端环境的优点[8-10]。
产甘露聚糖酶的微生物包括芽孢杆菌属(Bacillus)、假单胞菌属(Pseudomonas)、曲霉属(Asperillus)、腐质霉属(Humicola)、青霉菌属(Penicilium)和篮状菌属(Talaromyces)等[11-13],但基于生物制品安全性的风险,常用野生产酶菌株无法满足饲料和食品安全性的要求。嗜酸乳杆菌(Lactobacillus acidophilus)是乳酸菌中被广泛研究的安全菌株之一,具有调节肠道菌群平衡[14]、提高动物体免疫力[15]、促进宿主动物健康生长[16]、参与机体重要生理活动[17]、安全无毒等益生优点,是替代抗生素使用的优良微生物饲料添加剂[18]。研究表明,嗜酸乳杆菌等益生菌制剂可降低肠道有害菌的数量,改善肠道健康,有利于肉仔鸡的生长[19]。
目前报道能产酶的乳酸菌有乳杆菌属和片球菌属(Pediococcus)等,干酪乳杆菌产甘露聚糖酶酶活能达到75.8 U/mL[3]。嗜酸乳杆菌产甘露聚糖酶目前还鲜见报道。为构建产甘露聚糖酶嗜酸乳杆菌菌株,本研究将甘露聚糖酶基因与嗜酸乳杆菌表达载体连接,构建嗜酸乳杆菌分泌表达载体,以期获得含分泌表达甘露聚糖酶的嗜酸乳杆菌制剂,本研究旨在拓展产甘露聚糖酶的乳酸菌菌株,为甘露聚糖酶在饲料、食品等安全性要求高的行业进一步应用提供重要依据。
1.1.1 菌株和质粒
大肠杆菌(Escherichia coli)DH5α、嗜酸乳杆菌(Lactobacillus acidophilus)XW118、质粒pDX、质粒pDXAO3:本实验室保藏[20-21]。
1.1.2 化学试剂
T4脱氧核糖核酸连接酶、脱氧核糖核酸(deoxyribonucleic acid,DNA)限制性内切酶、Taq DNA 聚合酶、DNA Marker:大连宝生物公司;胰蛋白酶(酶活180 U/mg):生工生物工程(上海)股份有限公司;胃蛋白酶(酶活15 U/mg):阿拉丁生化科技股份有限公司;质粒小量提取试剂盒、DNA胶回收试剂盒:生工生物工程(上海)股份有限公司;甘露聚糖:美国Sigma-Aldrich公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS):国药集团化学试剂有限公司。
1.1.3 培养基
MRS液体培养基:葡萄糖20 g/L,牛肉膏5 g/L,蛋白胨10 g/L,酵母粉4 g/L,磷酸氢二钾2 g/L,乙酸钠5 g/L,柠檬酸三铵2g/L,硫酸镁七水0.2 g/L,硫酸锰一水0.05 g/L,吐温-80 1 g/L。115 ℃高压灭菌30 min。
MRS固体培养基:MRS液体培养基中加入琼脂粉18 g/L。115 ℃高压灭菌30 min。
GI54DS自动压力蒸汽灭菌器:致微(厦门)仪器有限公司;ZWY-2102C恒温摇床:上海智城分析仪器制造有限公司;SPX-250B-Z型生化培养箱:上海博讯实业有限公司;SW-CJ-1D型单人净化工作台:苏州净化设备有限公司;T100聚合酶链式反应(polymerase chain reaction,PCR)仪、Micro Pulser电穿孔仪:美国Bio-Rad公司;EPS600电泳仪:上海天能科技有限公司;ZF-288凝胶成像系统:上海嘉鹏科技有限公司;UV-6100紫外可见分光光度计:上海元析仪器有限公司;H1650-W离心机:湖南湘仪实验室仪器开发有限公司;QuantStudio实时荧光定量聚合酶链式反应(real-time fluorescent quantitative polymerase chain reaction,RT-fqPCR)仪:美国赛默飞世尔科技公司;Scientz-IID超声波细胞破碎仪:宁波新芝生物科技股份有限公司。
1.3.1 载体的构建
通过基因合成氨苄青霉素抗性基因表达盒及pMB1复制子序列,连接到嗜酸乳杆菌的内源性质粒pDX中,获得可在大肠杆菌和嗜酸乳杆菌穿梭的载体pDXA。合成与质粒pDX中的ORF3启动子相接的四环素抗性基因,并连接到载体pDXA的ORF3启动子处,构建获得载体pDXAO3。合成甘露聚糖酶基因,连入载体pDXAO3中的ORF4启动子序列的下游,获得载体pDX34M。
1.3.2 嗜酸乳杆菌的转化
将嗜酸乳杆菌在MRS固体平板上划线培养,挑取单菌落接种于MRS液体培养基中,培养24 h后取5 mL嗜酸乳杆菌培养液接种到45 mL MRS液体培养基培养90 min,收集菌体用冰水浴预冷的10%甘油溶液重悬洗涤两次,收集菌体,加入冰水浴预冷的缓冲液(0.4 mol/L蔗糖,2 mmol/L MgCl2,5 mmol/L KH2PO4),分别依次加80 μL嗜酸乳杆菌和20 μL表达载体到电击杯中,混合均匀后冰浴4 min,迅速电击(电击转化参数为1.8 kV、200 Ω、25 μF,脉冲时间4.0 ms)后转移到MRS液体培养基,29 ℃活化4 h,涂布于含50 μg/mL四环素的MRS固体平板,在29 ℃条件下培养至有嗜酸乳杆菌转化子的菌落,对嗜酸乳杆菌转化子的甘露聚糖酶基因序列进行PCR扩增,鉴定酶基因是否转入嗜酸乳杆菌。
1.3.3 嗜酸乳杆菌发酵产甘露聚糖酶及其酶活测定
挑取重组嗜酸乳杆菌单菌落接种于MRS液体培养基中,37 ℃培养30 h,按5%接种量进行扩大培养发酵,每隔4 h取样,离心弃上清,取菌体沉淀用7 g/L氯化钠溶液洗涤两次,用超纯水重悬,于冰浴条件下超声破碎细胞15 min,4 ℃、11 000 r/min条件下离心15 min,取上清酶液测定重组甘露聚糖酶活性。甘露聚糖酶活性测定方法采用DNS法[22]。甘露聚糖酶活性定义:在37 ℃和pH值5.5条件下,每分钟水解甘露聚糖释放1 μmol的还原糖所需要的酶量为1个酶活单位(U)。
1.3.4 重组甘露聚糖酶酶学性质
最适反应pH值:用适合的缓冲体系分别把底物溶液的pH值调到3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0(其中pH 3.0用甘氨酸-盐酸缓冲体系,pH 3.0、pH 4.0、pH 4.5和pH 5.0用柠檬酸-柠檬酸钠缓冲体系,其他用磷酸钠缓冲体系),分别测定样品在不同pH值条件下的重组甘露聚糖酶活力,以酶活最高酶液作为对照计算相对酶活。
pH稳定性:用适合的缓冲体系分别把酶液的pH值调到3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、7.5、8.0,37 ℃条件下保温60 min后,分别测定样品在不同pH值条件下的重组甘露聚糖酶活力,未经保温处理的酶液作为对照计算相对酶活。
最适温度:酶促反应温度分别设置为30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃、80 ℃,分别测定样品在不同温度条件下的重组甘露聚糖酶活力,以酶活最高的酶液作为对照计算相对酶活。
温度稳定性:分别在温度为30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、75 ℃、80 ℃的条件下保温60 min,然后立即用4 ℃水浴冷却,分别测定样品在不同温度条件下重组甘露聚糖酶酶活力,未经保温处理酶液作为对照计算相对酶活。
1.3.5 嗜酸乳杆菌的耐酸性研究
分别将嗜酸乳杆菌及其转化子单菌落接种到MRS液体培养基中,37 ℃液体培养24 h后收集菌体,分别在pH为2.0、2.5、3.0、3.5、4.0、4.5的缓冲液(其中pH 2.0用氯化钾-盐酸缓冲体系,pH 2.5、pH 3.0用甘氨酸-盐酸缓冲体系,pH 3.0、pH 4.0、pH 4.5用柠檬酸-柠檬酸钠缓冲体系)中孵育2 h,适当稀释后在MRS培养基平板培养计数,计算存活率,其计算公式如下:
式中:N0为孵育前菌悬液的活菌数,CFU/mL;Nx为孵育后菌悬液的活菌数,CFU/mL。
1.3.6 甘露聚糖酶抗蛋白酶水解研究
将嗜酸乳杆菌转化子发酵的甘露聚糖酶液分别与胃蛋白酶、胰蛋白酶在37 ℃水解,反应pH分别为2.5和7.6,每隔20 min取样立即置冰浴并迅速将溶液pH调节至6.5。对水解产物直接进行甘露聚糖酶活力测定。将未经过蛋白酶处理甘露聚糖酶液作为对照样品按相同条件处理,计算甘露聚糖酶液的相对酶活。
1.3.7 数据处理
所有试验均重复3次,结果取平均值。采用Excel 2019进行分析和绘图。
合成甘露聚糖酶基因,连接到质粒pDXAO3的ORF4启动子下,获得表达载体pDX34M见图1。由图1可知,载体pDX34M具有氨苄青霉素抗性基因、四环素抗性基因、pMB1复制子序列和嗜酸乳杆菌内源性质粒复制蛋白基因,可以在大肠杆菌或嗜酸乳杆菌中进行复制。
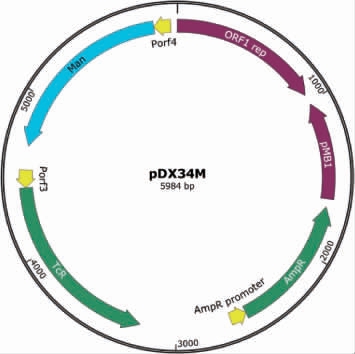
图1 甘露聚糖酶表达载体pDX34M的构建
Fig.1 Construction of mannanase expression vector pDX34M
将表达载体pDX34SM电转化嗜酸乳杆菌,在MRS液体培养基孵育活化后,涂布MRS固体抗性平板,挑选抗性菌落,获得含甘露聚糖酶基因的重组嗜酸乳杆菌,PCR扩增结果显示,重组嗜酸乳杆菌含甘露聚糖酶基因序列。重组嗜酸乳杆菌菌落形态见图2。由图2可知,重组嗜酸乳杆菌在MRS固体抗性平板上生长。
图2 表达载体转化嗜酸乳杆菌
Fig.2 Transformation of expression vector in Lactobacillus acidophilus
将重组嗜酸乳杆菌进行摇瓶发酵,测定菌体破碎后的上清酶液的甘露聚糖酶活及OD600 nm值,结果见图3。由图3可知,发酵时间为0~16 h时,重组嗜酸乳杆菌快速生长;发酵时间16~24 h时,重组嗜酸乳杆菌生长开始减缓;发酵时间>24 h之后,重组嗜酸乳杆菌生长趋于平稳。发酵时间为0~8 h时,甘露聚糖酶缓慢增加;发酵时间8~24 h时,甘露聚糖酶酶活增加较快;发酵为24 h时,甘露聚糖酶酶活最高,为353 U/mL;发酵>24 h之后,甘露聚糖酶酶活有所下降。因此,重组嗜酸乳杆菌最适培养时间为24 h。测试宿主嗜酸乳杆菌破碎后的上清液,并未测出甘露聚糖酶活性,表明重组嗜酸乳杆菌成功表达甘露聚糖酶。
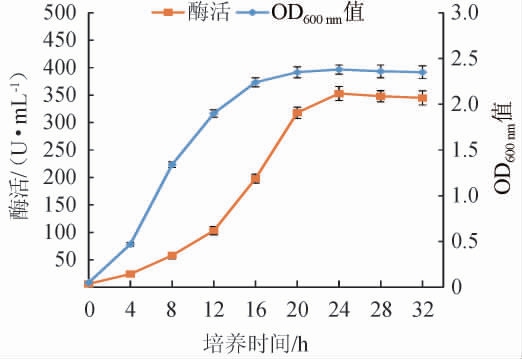
图3 重组嗜酸乳杆菌的生长曲线及产酶曲线
Fig.3 Growth curve and enzyme production curve of recombinant Lactobacillus acidophilus
分别在不同的pH缓冲体系和温度条件下测定甘露聚糖酶酶活力,结果分别见图4和图5。
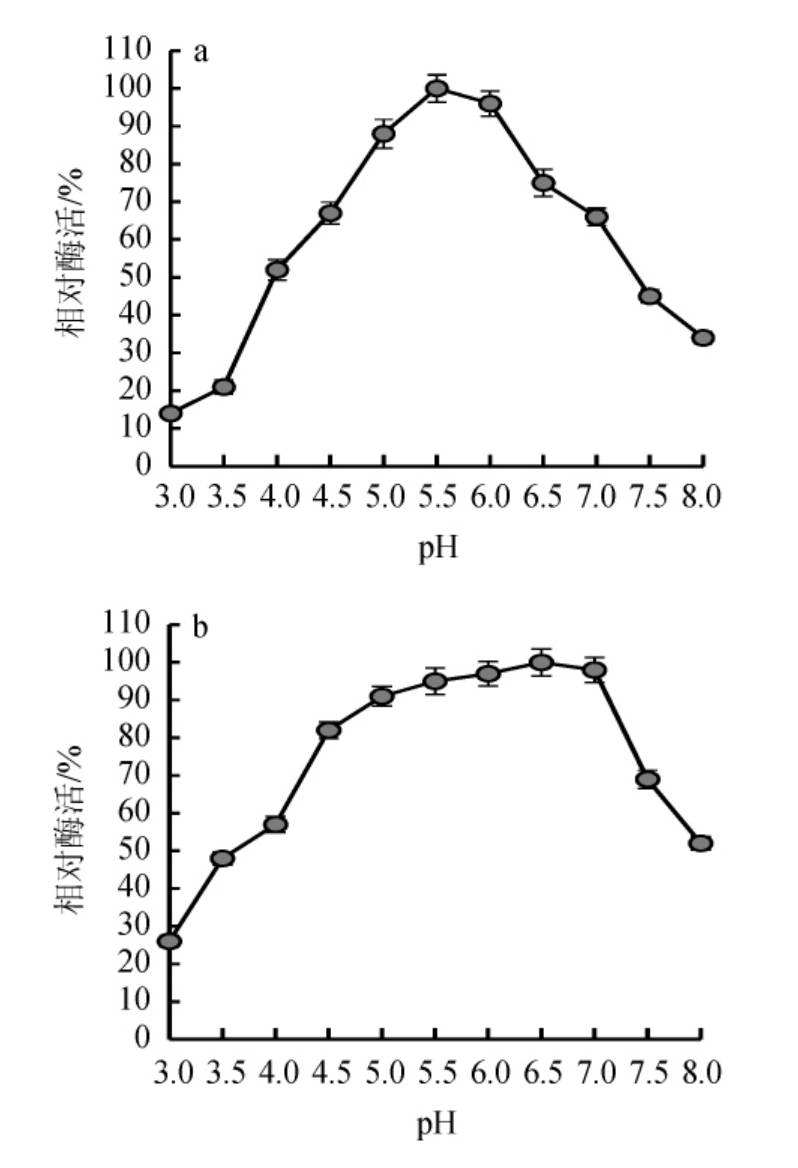
图4 重组甘露聚糖酶的最适pH(a)及pH稳定性(b)
Fig.4 Optimal pH (a) and pH stability (b) of recombinant mannanase
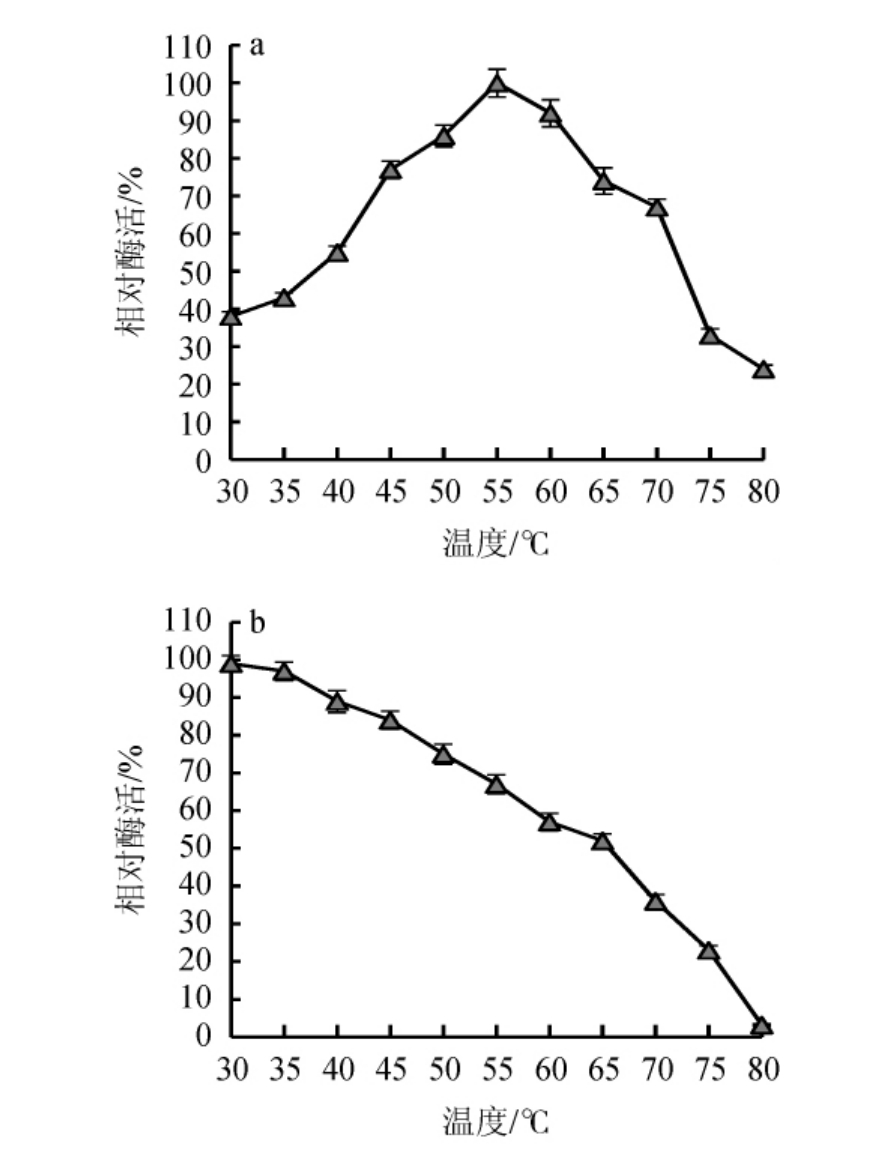
图5 重组甘露聚糖酶的最适温度(a)及温度稳定性(b)
Fig.5 Optimal temperature (a) and temperature stability (b) of recombinant mannanase
由图4a可知,重组甘露聚糖酶的最适作用pH为5.5,该酶在pH 5.0~6.0范围内催化活性保留在80%以上。由图4b可知,重组酶在pH 5.0~7.0之间稳定性较好。当pH高于7.0甘露聚糖酶稳定性随pH的升高而下降。由图5a可知,重组甘露聚糖酶的最适作用温度为55 ℃;由图5b可知,重组甘露聚糖酶在温度50~60 ℃范围内有较好的催化活性,该酶在温度<35 ℃时较为稳定,当温度>65 ℃之后,稳定性急剧下降,可能是由于甘露聚糖酶在高温下发生蛋白热变性而失活[23-25]。
研究嗜酸乳杆菌对动物胃液pH值的耐酸性,对嗜酸乳杆菌益生作用的实际发挥具有重要的意义。重组嗜酸乳杆菌耐酸性测定结果见图6。由图6可知,重组嗜酸乳杆菌在pH 2.0时的存活率为77.3%。在pH 2.0~4.5范围内重组嗜酸乳杆菌的耐酸性与出发菌无明显差异,说明转化对嗜酸乳杆菌的耐酸性无显著影响。
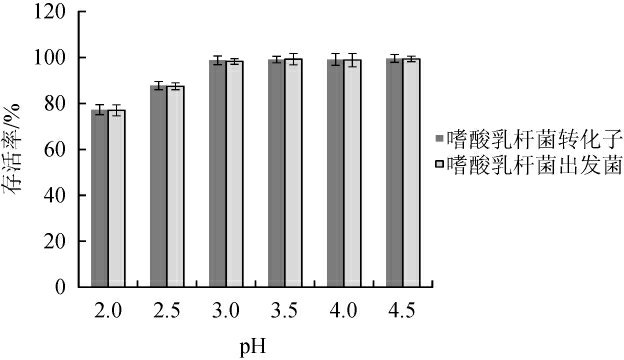
图6 重组嗜酸乳杆菌的酸耐受性
Fig.6 Acid resistance of recombinant Lactobacillus acidophilus
用胃蛋白酶和胰蛋白酶分别对重组甘露聚糖酶酶液进行耐受性研究,结果见图7。由图7可知,重组甘露聚糖酶对胃蛋白酶的耐受性比胰蛋白酶更好,胰蛋白酶处理160 min后酶液甘露聚糖剩余28%的酶活。胃蛋白酶处理160 min后甘露聚糖仍剩余65%的酶活,表明该甘露聚糖酶具有一定的抗胃蛋白酶和部分抗胰蛋白酶降解的能力。
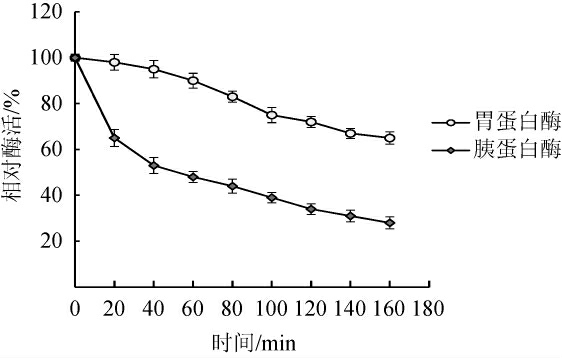
图7 重组嗜酸乳杆菌的抗胃蛋白酶和胰蛋白酶活性
Fig.7 Anti-pepsin and anti-typsin activities of recombinant Lactobacillus acidophilus
本研究构建甘露聚糖酶基因的表达载体并转化嗜酸乳杆菌,研究重组嗜酸乳杆菌产甘露聚糖酶的酶学性质,并测定重组嗜酸乳杆菌的耐酸性及甘露聚糖酶的抗蛋白酶活性。结果表明,重组嗜酸乳杆菌发酵24 h甘露聚糖酶活性为353 U/mL。甘露聚糖酶的最适催化pH值为5.5,最适催化温度为55 ℃。重组嗜酸乳杆菌在pH 2.0~4.5有一定的耐酸性,在pH 2.0条件下2 h的存活率为77.3%。甘露聚糖酶液用胃蛋白酶、胰蛋白酶处理160 min后,甘露聚糖酶剩余相对酶活分别为65%、28%。表明该甘露聚糖酶具有一定的抗胃蛋白酶和部分抗胰蛋白酶降解的能力,可作为候选益生菌株在食品和饲料方面作进一步的功能性应用研究。
[1]陈晓飞,李珊珊,刁文涛,等.高产β-甘露聚糖酶菌株的分离鉴定及酶学性质研究[J].中国酿造,2021,40(9):92-97.
[2]王佰涛,刘德海,陈晓飞,等.高产β-甘露聚糖酶黑曲霉菌株的分离与鉴定[J].中国酿造,2022,41(5):101-105.
[3]王烁,季海蕊,曹慧莹,等.干酪乳杆菌产β-甘露聚糖酶发酵条件优化及在果汁澄清中的应用[J].中国酿造,2022,41(11):144-149.
[4]LIU Z,NING C,YUAN M,et al.High-efficiency expression of a superior β-mannanase engineered by cooperative substitution method in Pichia pastoris and its application in preparation of prebiotic mannooligosaccharides[J].Bioresource Technol,2020,311(5):123482-123491.
[5] GURLER H N, YILMAZER C, ERKAN S B, et al.Applicability of recombinant Aspergillus sojae crude mannanase enzyme in carrot juice production[J].J Food Process Pres,2021,45(8):1-11.
[6]樊云雪.棕榈粕中甘露聚糖酶解的技术研究[D].南昌:南昌大学,2022.
[7]李涛,刘晓艳,王楠楠,等.β-甘露聚糖酶部分水解香豆胶对自然衰老小鼠的抗衰老作用[J].食品科学,2022,43(9):111-119.
[8]张建新,陈永艳,和子涵,等.鲤源产β-甘露聚糖酶Bacillus velezensis HF-14109的分离鉴定及其酶学和生物学特性研究[J].微生物学报,2022,62(8):3062-3078.
[9]李珊珊,刘德海,刁文涛,等.黑曲霉β-甘露聚糖酶ManA耐热突变体的筛选[J].中国酿造,2022,41(3):62-68.
[10]施鑫磊,方韵颖,尉俏女,等.一种来源于喜热梭孢壳的耐热型β-甘露聚糖酶[J].微生物学报,2021,61(9):2815-2828.
[11]DAWOOD A,MA K.Applications of microbial β-mannanases[J].Front Bioeng Biotechnol,2020,8(15):1-17.
[12]LIU W,MA C,LIU W,et al.Functional and structural investigation of a novel β-mannanase BaMan113A from Bacillus sp.N16-5[J].Int J Biol Macromol,2021,182(7):899-909.
[13]李延啸,马俊文,闫巧娟,等.米黑根毛霉甘露聚糖酶的定向进化、高效表达与应用[J].食品与生物技术学报,2022,41(7):120-129.
[14] HU C H, REN L Q, ZHOU Y, et al.Characterization of antimicrobial activity of three Lactobacillus plantarum strains isolated from Chinese traditional dairy food[J].Food Sci Nutr,2019,7(6):1997-2005.
[15] GE Q F, YANG B, LIU R, et al.Antioxidant activity of Lactobacillus plantarum NJAU-01 in an animal model of aging[J].BMC Microbiol,2021,21(1):182-190.
[16]田立立,刘家鼎,孙龙生,等.饲料中添加乳酸菌和三丁酸甘油酯对克氏原螯虾生长、氨基酸沉积率及消化酶活性的影响[J].饲料工业,2021,42(24):50-54.
[17]MARIYA I P,GREGOR R,JESSICA A H.Lacticaseibacillus rhamnosus GR-1,a.k.a.Lactobacillus rhamnosus GR-1:Past and future perspectives[J].Trends Microbiol,2021,29(8):747-761.
[18] WAN I I, ALI M H, TECK L, et al.Dietary postbiotic Lactobacillus plantarum improves serum and ruminal antioxidant activity and upregulates hepatic antioxidant enzymes and ruminal barrier function in postweaning lambs[J].Antioxidants,2020,9(3):250-259.
[19]傅予彤,房勇,曲绍军,等.复合益生菌制剂对肉仔鸡生长性能、肠道屏障功能及肠道菌群的影响[J].饲料工业,2022,43(14):19-23.
[20]袁林,曾静,郭建军,等.粪肠球菌内源性质粒的序列分析及其穿梭载体的构建[J].食品工业科技,2021,42(23):141-149.
[21]顾斌涛,郭建军,曾静,等.嗜酸乳杆菌质粒的分析和穿梭载体的构建[J].食品工业科技,2023,44(13):127-133.
[22]孔海洋,蒋肖,王苑,等.β-甘露聚糖酶Man5A和木聚糖酶Tlxyn11B的融合表达[J].生物工程学报,2020,36(9):1849-1858.
[23]李梦娜.H+对溶菌酶热变性过程的促进机制[J].中国科学技术大学学报,2020,50(5):637-644.
[24]高伟强,陈赟,梁琪,等.两株产耐高温β-甘露聚糖酶的枯草芽孢杆菌分离鉴定及其酶学性质研究[J].饲料研究,2021,44(8):73-77.
[25]田庚,高伟强,陈晓波,等.热稳定性高β-甘露聚糖酶产生菌的筛选、鉴定及酶学性质研究[J].食品工业科技,2020,41(19):127-131.