传统发酵乳品中产广谱细菌素乳酸菌选育
刘彩云1,麻和平1,张文齐1,王 洁1,彭章普2,邵建宁1*
(1.甘肃省科学院生物研究所 甘肃省微生物资源开发利用重点实验室,甘肃 兰州 730000;2.甘肃省科学院,甘肃 兰州 730000)
摘 要:为选育产广谱细菌素乳酸菌,采用琼脂扩散法对甘肃牧区传统发酵乳品中分离纯化的96株乳酸菌进行了筛选,并确定产细菌素菌株,具有最佳抑菌效果的菌株经重离子束12C6+辐照诱变,再采用培养皿分区法进行6种指示菌广谱抑菌性能比较。结果表明,琼脂扩散法筛选出抑菌效果最佳的产细菌素菌株Lp1,经辐照诱变得到98株突变菌,选育出对大肠埃希氏菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、单核细胞增生李斯特氏菌(Listeria monocytogenes)、沙门氏菌(Salmonella)、志贺氏菌(Shigella)和克罗诺杆菌(Cronobacter)抑菌性能均明显优于出发菌株Lp1的5株突变株L088、L087、L063、L049、L010进行广谱抑菌试验,其中菌株L088和L063为广谱抑菌性能较好菌株,突变株L088对上述6种指示菌的抑菌扇环半径比出发菌株Lp1抑菌扇环半径分别提高47.81%、33.28%、22.97%、45.25%、21.39%、40.21%,突变株L063对上述6种指示菌的抑菌扇环半径比出发菌株Lp1抑菌扇环半径分别提高54.27%、29.18%、25.37%、58.03%、17.85%、42.13%。采用培养皿分区法可同时在1个培养皿中完成检测6种指示菌的抑菌试验,可高效筛选产广谱细菌素乳酸菌。
关键词:乳酸菌;细菌素;广谱抑菌;抑菌试验
中图分类号:Q939.97
文章编号:0254-5071(2024)01-0131-05
doi:10.11882/j.issn.0254-5071.2024.01.020
引文格式:刘彩云,麻和平,张文齐,等.传统发酵乳品中产广谱细菌素乳酸菌选育[J].中国酿造,2024,43(1):131-135.
收稿日期:2023-07-25 修回日期:2023-11-03
基金项目:甘肃省科学院应用研究与开发项目(2020JK-01);甘肃省科技计划项目(22YF7WA065);甘肃省自然科学基金项目(21JR1RA347)
作者简介:刘彩云(1977-),女,副研究员,硕士,研究方向为食品微生物。
*通讯作者:邵建宁(1971-),男,教授级高级工程师,本科,研究方向为应用微生物与食品生物技术。
Breeding of broad-spectrum bacteriocin-producing lactic acid bacteria in traditional fermented dairy products
LIU Caiyun1,MA Heping1,ZHANG Wenqi1,WANG Jie1,PENG Zhangpu2,SHAO Jianning1*
(1.Key Laboratory of Microbial Resources Exploitation and Application of Gansu Province,Institute of Biology,Gansu Academy of Sciences,Lanzhou 730000,China;2.Gansu Academy of Sciences,Lanzhou 730000,China)
Abstract:To breed broad-spectrum bacteriocin-producing lactic acid bacteria,96 strains of lactic acid bacteria isolated and purified from tradition fermented dairy products in Gansu province were screened by agar diffusion assay, and the bacteriocin-producing strains were determined.The strains with the optimal antibacterial effect were mutated by heavy ion beam 12C6+irradiation,and the broad-spectrum antibacterial performance on six indicator bacteria was compared by culture dish partition method.The results showed that the bactericin-producing strain Lp1 with the optimal bacteriostatic effect was selected, and 98 mutant strains were obtained by irradiation mutation.Five mutant strains (L088, L087, L063, L049, L010) with significantly better antibacterial performance against Escherichia coli, Staphylococcus aureus, Listeria monocytogenes, Salmonella, Shigella and Cronobacter were screened for broad-spectrum antibacterial performance,and were significantly better than those of the original strain Lp1.Among them, strains L088 and L063 had better broad-spectrum antibacterial performance, the radius of inhibition annular sector of the mutant strain L088 against 6 indicator bacteria increased by 47.81%,33.28%,22.97%,45.25%,21.39%,and 40.21%than that of the original strain Lp1 respectively,and the radius of inhibition annular sector of the mutant strain L063 against 6 indicator bacteria increased 54.27%, 29.18%, 25.37%, 58.03%, 17.85%,and 42.13%, respectively.The inhibition tests of 6 indicator bacteria could be completed in one Petri dish simultaneously, which could screen the broad-spectrum bacteriocin-producing lactic acid bacteria efficiently.
Key words:lactic acid bacteria;bacteriocin;broad-spectrum bacteriostasis;bacteriostatic test
乳酸菌是世界上公认安全的食品级微生物,广泛应用于食品、医药、工业、农业等与人类生活密切相关的领域[1]。乳酸菌能抑制食品中腐败菌的生长繁殖,抑菌物质主要是其代谢产物如细菌素、过氧化氢、有机酸等[2-4]。其中细菌素是乳酸菌代谢过程中合成并分泌到环境中的具有杀菌作用的多肽类物质,具有安全、高效、无抗药性、无残留等优点[5-8]。由于细菌素具有潜在的可作为食品生物防腐剂的开发前景,因此成为生物防腐剂研究领域中的研究热点[9-11]。乳酸链球菌素(Nisin)是目前已商品化且被用于食品防腐的细菌素[12],但由于乳酸链球菌素的抑菌谱较窄,其应用受到了一定的限制[13-15],因此选育产广谱细菌素乳酸菌菌株对乳酸菌细菌素的研究开发和应用具有重要意义。
琼脂扩散法操作简单易行、结果直观准确可靠,是抑菌试验的经典方法,被广泛应用于抗生素效价测定以及抑菌物质的广谱抑菌性能检测[16-18]。但是,传统琼脂扩散法在进行抑菌试验时,每个培养皿中仅能检测待检品对一种指示菌的抑菌性能,导致对待检品进行广谱抑菌试验时,检测工作量大、效率低,因此亟需进行广谱抑菌试验方法改进的研究。
本研究以甘肃牧区传统发酵乳品中分离纯化的96株乳酸菌为研究对象[19],采用琼脂扩散法进行了产细菌素乳酸菌筛选[20],并以筛选的1株产细菌素乳杆菌Lp1为出发菌株,经重离子束12C6+辐照诱变[21-22],采用培养皿分区法筛选广谱抑菌性能优于出发菌株的突变株。本研究采用的培养皿分区法是作者采用自主设计制作的培养皿分区器[23],在琼脂扩散法基础上进行改良的一种广谱抑菌试验方法,以期为产广谱细菌素乳酸菌高效筛选提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
乳酸菌:96株乳酸菌分离自甘肃牧区传统发酵乳品采集样品。
指示菌:大肠埃希氏菌(Escherichia coli)ATCC25922、金黄色葡萄球菌(Staphylococcus aureus)CMCC26003、单核细胞增生李斯特氏菌(Listeria monocytogenes)CMCC54004、沙门氏菌(Salmonella)ATCC14028、志贺氏菌(Shigella)CICC10865、克罗诺杆菌(Cronobacter)ATCC29544,由甘肃省微生物菌种保藏中心提供。
1.1.2 培养基
MRS肉汤培养基、MRS琼脂培养基、M17肉汤培养基、M17琼脂培养基、营养肉汤(nutrient broth,NB)培养基、营养琼脂(nutrient agar,NA)培养基:青岛海博生物技术有限公司;素琼脂培养基:1 g琼脂粉溶于100 mL蒸馏水中。
1.2 仪器与设备
DELTA 320 pH计:梅特勒-托利多集团;JA2003N电子天平:上海精密仪器有限公司;LDZF-75L-II立式高压蒸汽灭菌器:上海申安医疗器械厂;DG-1多功能培养箱:上海医疗器械修造厂;BH-2显微镜:日本奥林巴斯(中国)有限公司;SW-CJ-2D超净工作台:苏州净化设备有限公司;电子数显卡尺-II型:哈尔滨量具刃具集团有限责任公司;牛津杯:上海兢翀电子科技发展有限公司;一次性使用培养皿:江苏新康医疗器械有限公司;6区分区器(分区圈直径85mm,高度8 mm,6个分区板):自制。
1.3 实验方法
1.3.1 乳酸菌培养上清液制备
将受试乳酸菌菌株按5%接种量,接入盛有10 mL MRS或M17肉汤培养基的试管中,37 ℃恒温静置培养24 h后,培养液在4 ℃、8 000 r/min条件下离心10 min,收集上清液,立即做抑菌检测或4 ℃保存备用。
1.3.2 含指示菌营养琼脂制备
大肠埃希氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、沙门氏菌、志贺氏菌、克罗诺杆菌按5%接种量分别接种于营养肉汤培养基中,37 ℃恒温培养20 h。抑菌检测时,指示菌培养菌液按照1%的添加量加入50 ℃左右营养琼脂培养基,混合均匀,50 ℃保温待用,营养琼脂中指示菌活菌数保持在106~107 CFU/mL。
1.3.3 抑菌试验
琼脂扩散法:在无菌培养皿中先加入10 mL灭菌后冷却至50 ℃左右的素琼脂培养基,平铺于皿底中,置于水平台面上待其自然凝固,作为底层;垂直均匀放置无菌牛津杯3个,再加入10 mL含指示菌营养琼脂,均匀平铺于底层之上,作为菌层。待菌层完全凝固后取出牛津杯,在形成的3个琼脂孔洞中分别入100 μL乳酸菌培养上清液,将培养皿水平正置,37 ℃恒温培养20 h后,观察有无抑菌圈出现,以抑菌圈直径大小表示乳酸菌菌株抑制指示菌能力的强弱。
培养皿分区法:在无菌培养皿中先放入培养皿分区器的分区圈,再加入灭菌后冷却至50 ℃左右的素琼脂培养基,平铺于皿底中,置于水平台面上待其自然凝固,作为底层;在分区圈中心放入牛津杯后,在培养皿的各个分区中分别加入1 mL含指示菌营养琼脂,平铺于培养皿分区底层上,待培养皿各个分区中含不同指示菌营养琼脂完全凝固后,取出牛津杯,在形成的中心琼脂孔洞中加入100 μL乳酸菌培养上清液,将培养皿水平正置,37 ℃恒温培养20 h后,采用电子数显卡尺测量各个分区出现的抑菌扇环的半径,抑菌扇环半径为从中心琼脂孔洞边缘到指示菌生长边缘的径向长度,以抑菌扇环半径大小表示产细菌素乳酸菌株抑制指示菌能力的强弱。
1.3.4 产细菌素乳酸菌筛选
(1)琼脂扩散法筛选菌株
将受试乳酸菌菌株培养上清液,分别以大肠埃希氏菌、金黄色葡萄球菌为指示菌,采用琼脂扩散法进行抑菌试验,筛选出对大肠埃希氏菌、金黄色葡萄球菌均有抑菌性能的乳酸菌菌株。
(2)有机酸和过氧化氢排除试验
将初筛乳酸菌菌株培养上清液,用1 mol/L NaOH调pH值至5.0,排除有机酸干扰;再在80 ℃条件下加热10 min,排除过氧化氢干扰[24];上清液再经0.22 μm滤膜过滤后,分别以大肠埃希氏菌、金黄色葡萄球菌为指示菌,采用琼脂扩散法进行抑菌试验,筛选出对大肠埃希氏菌、金黄色葡萄球菌有较好抑菌效果的乳酸菌菌株。
(3)蛋白酶敏感试验
将复筛乳酸菌菌株培养上清液分别用胰蛋白酶、胃蛋白酶、木瓜蛋白酶、蛋白酶K在各自作用的最适pH值下处理,各种酶的最终质量浓度为1 g/L,37 ℃水浴3 h后,再调回pH值5.0,以原培养上清液为对照,采用琼脂扩散法进行抑菌试验,比较抑菌圈直径变化,判断复筛乳酸菌培养上清液对蛋白酶敏感性[25]。
1.3.5 产广谱细菌素乳酸菌诱变育种
将出发菌株接种于MRS肉汤培养基中,37 ℃恒温静置培养24 h后,在无菌条件下,将1.5 mL待辐照菌悬液置于35 mm无菌平皿中,利用中科院近物所重离子加速器浅层辐照终端提供的80 MeV/u,剂量率20 Gy/min的12C6+重离子束进行辐照处理,辐照剂量300 Gy[26]。将辐照后的菌悬液10倍系列稀释后,选择适宜稀释度的稀释液涂布平板,在MRS琼脂平板37 ℃恒温倒置培养24~48 h,挑选所有单菌落,分别接入盛有10 mL MRS肉汤培养基的试管中,37 ℃恒温静置培养24 h后,收集上清液(见1.3.1),以大肠埃希氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、沙门氏菌、志贺氏菌和克罗诺杆菌为指示菌采用培养皿分区法进行抑菌试验,测量抑菌扇环半径,选出对上述6种指示菌均大于出发菌株抑菌扇环半径的突变株。
1.3.6 数据处理
试验数据采用Microsoft Excel 2019软件进行整理和分析,结果用“平均值±标准偏差”表示。P<0.05表示差异有统计学意义。
2 结果与分析
2.1 产细菌素乳酸菌筛选
将甘肃牧区传统发酵乳品采集样品中分离得到的革兰氏染色阳性、过氧化氢酶阴性96株乳酸菌菌株,杆菌转接到MRS液体培养基试管中,球菌转接到M17液体培养基试管中,37 ℃条件下培养24 h,采用琼脂扩散法,以大肠埃希氏菌、金黄色葡萄球菌为指示菌进行抑菌试验,初步筛选出对大肠埃希氏菌、金黄色葡萄球菌均具有抑制作用的菌株12株,结果见表1。
表1 筛选的产细菌素乳酸菌的抑菌试验结果
Table 1 Results of bacteriostatic test on screened bacteriocinproducing lactic acid bacteria
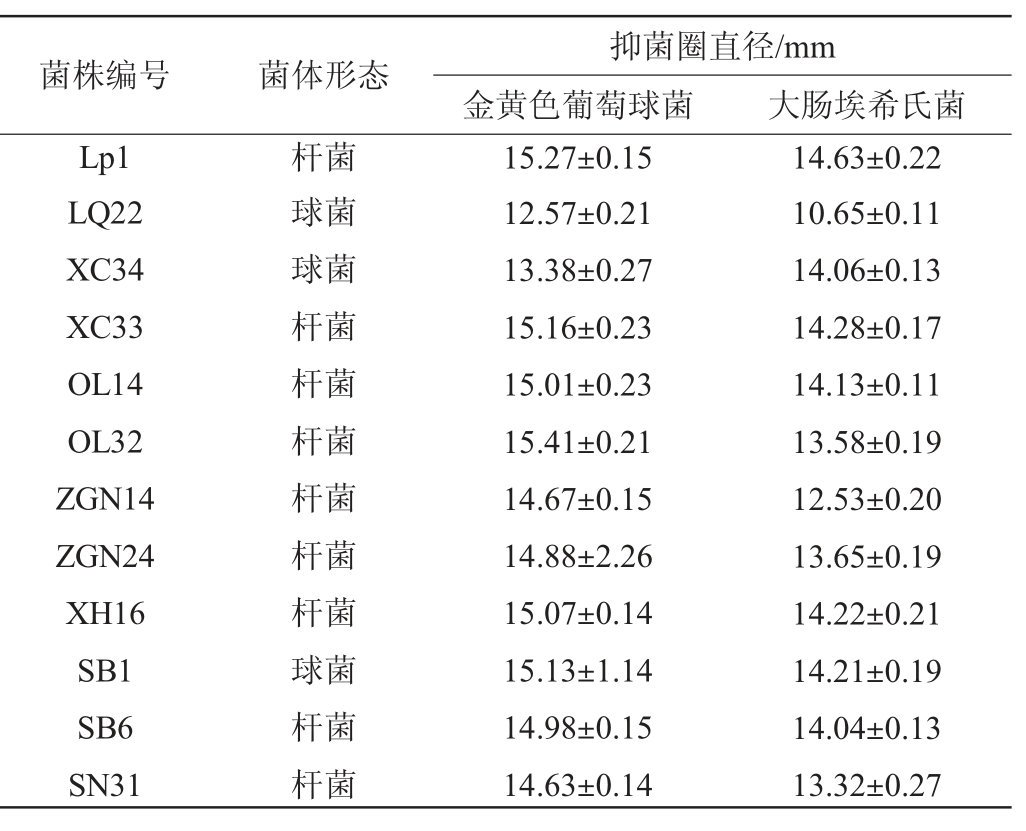
菌株编号 菌体形态Lp1 LQ22 XC34 XC33 OL14 OL32 ZGN14 ZGN24 XH16 SB1 SB6 SN31抑菌圈直径/mm金黄色葡萄球菌 大肠埃希氏菌杆菌球菌球菌杆菌杆菌杆菌杆菌杆菌杆菌球菌杆菌杆菌15.27±0.15 12.57±0.21 13.38±0.27 15.16±0.23 15.01±0.23 15.41±0.21 14.67±0.15 14.88±2.26 15.07±0.14 15.13±1.14 14.98±0.15 14.63±0.14 14.63±0.22 10.65±0.11 14.06±0.13 14.28±0.17 14.13±0.11 13.58±0.19 12.53±0.20 13.65±0.19 14.22±0.21 14.21±0.19 14.04±0.13 13.32±0.27
2.2 产细菌素菌株的确定
2.2.1 有机酸和过氧化氢排除试验
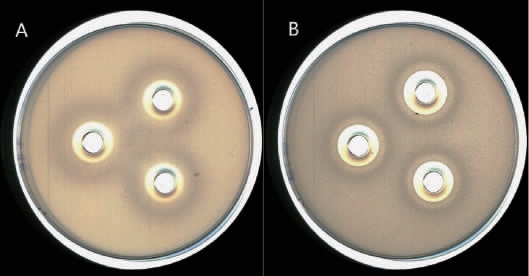
对筛选出的12株菌株培养上清液进行排除有机酸、过氧化氢干扰,再采用琼脂扩散法,以大肠埃希氏菌、金黄色葡萄球菌为指示菌进行抑菌试验,结果见表2。由表2可知,排除有机酸、过氧化氢干扰,12株菌株培养上清液对大肠埃希氏菌、金黄色葡萄球菌2种指示菌均有抑制作用,由此可以说明,筛选出的菌株培养上清液中有其他抑菌物质对指示菌起抑制作用。菌株Lp1抑菌效果最好,因此选择该菌株作进一步研究,菌株Lp1对大肠埃希氏菌、金黄色葡萄球菌的抑菌效果见图1,其培养上清液对2种指示菌均产生了清晰的抑菌圈。
表2 经过排除试验的12株菌株对金黄色葡萄球菌和大肠杆菌的抑菌试验结果
Table 2 Results of bacteriostatic test on Staphylococcus aureus and Escherichia coli of 12 strains after exclusion test
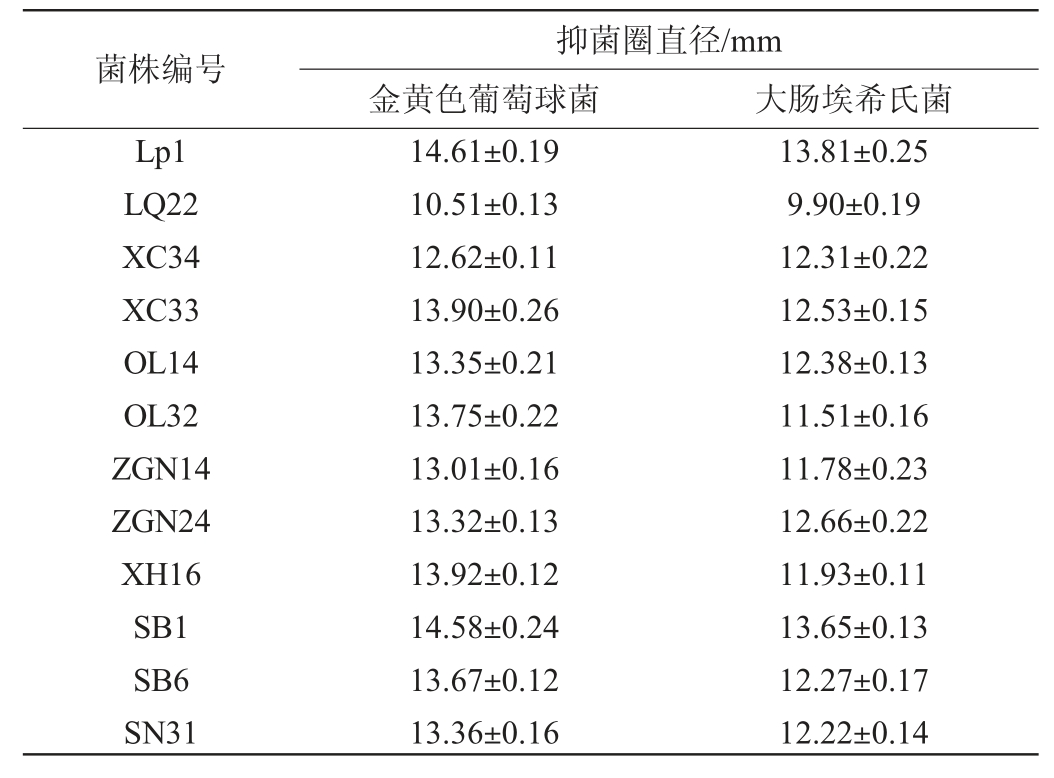
菌株编号Lp1 LQ22 XC34 XC33 OL14 OL32 ZGN14 ZGN24 XH16 SB1 SB6 SN31抑菌圈直径/mm金黄色葡萄球菌 大肠埃希氏菌14.61±0.19 10.51±0.13 12.62±0.11 13.90±0.26 13.35±0.21 13.75±0.22 13.01±0.16 13.32±0.13 13.92±0.12 14.58±0.24 13.67±0.12 13.36±0.16 13.81±0.25 9.90±0.19 12.31±0.22 12.53±0.15 12.38±0.13 11.51±0.16 11.78±0.23 12.66±0.22 11.93±0.11 13.65±0.13 12.27±0.17 12.22±0.14
2.2.2 蛋白酶敏感试验
菌株Lp1培养上清液排除有机酸和过氧化氢干扰后,经1 g/L的胰蛋白酶、胃蛋白酶、木瓜蛋白酶、蛋白酶K分别处理,其抑菌结果见表3。由表3可知,经胰蛋白酶处理后菌株对大肠埃希氏菌、金黄色葡萄球菌指示菌的抑菌圈直径均减小,抑菌能力出现降低趋势,木瓜蛋白酶、胃蛋白酶和蛋白酶K处理后抑菌活性全部丧失,说明抑菌物质对蛋白酶敏感,结合有机酸和过氧化氢排除试验,可以确定菌株Lp1培养上清液中主要抑菌活性物质为细菌素类物质。
表3 菌株Lp1的蛋白酶敏感性试验
Table 3 Protease sensitivity tests of strain LP1

注:“-”表示无抑菌圈产生。
蛋白酶处理对照胰蛋白酶胃蛋白酶木瓜蛋白酶蛋白酶K抑菌圈直径/mm金黄色葡萄球菌 大肠埃希氏菌14.61±0.19 11.29±0.09 13.81±0.25 9.65±0.27-- --- -
2.3 产广谱细菌素乳酸菌诱变育种
将菌株Lp1作为出发菌株,应用重离子束辐照微生物育种技术,选育产广谱产细菌素乳酸菌。对重离子束12C6+300 Gy剂量辐照菌株Lp1诱变得到98株突变菌株,采用培养皿分区法测定这些菌株对6种指示菌的抑菌性能,筛选出5株突变株L088、L087、L063、L049、L010对6种指示菌的抑菌效果都优于出发菌株Lp1,5株突变菌株与出发菌株Lp1对6种指示菌抑菌效果见图2,抑菌扇环半径测定结果见表4。
表4 广谱抑菌突变株抑菌试验结果
Table 4 Antibacterial tests results of broad-spectrum antimicrobial mutants

注:同一列不同的字母表示具有显著性差异(P<0.05)。下同。
菌株编号Lp1 L088 L087 L063 L049 L010抑菌扇环半径/mm大肠埃希氏菌 金黄色葡萄球菌 李斯特氏菌 沙门氏菌 志贺氏菌 克罗诺杆菌5.27±0.26c 7.79±0.23ab 5.95±0.10c 8.13±0.13a 6.26±0.07bc 5.86±0.29c 6.34±0.14a 8.45±0.21a 7.20±0.08a 8.19±0.37a 8.30±0.04a 6.85±0.23a 7.53±0.08a 9.26±0.12a 9.15±0.25a 9.44±0.18a 8.62±0.31a 9.47±0.20a 4.42±0.50b 6.42±0.17ac 6.23±0.23ab 6.98±0.34a 5.98±0.17ab 4.93±0.13bc 8.46±0.35a 10.27±0.07a 9.62±0.13a 9.97±0.15a 9.17±0.13a 9.12±0.16a 5.72±0.03b 8.02±0.19a 6.61±0.36ab 8.13±0.29a 6.61±0.04ab 6.77±0.31ab
由图2可知,围绕平皿中心琼脂孔洞各分区都产生了大小不一的抑菌扇环,菌株L088、L087、L063、L049、L010对6种指示菌的抑菌扇环半径均大于出发菌株Lp1对6种指示菌的抑菌扇环半径。由表4可知,筛选的5株广谱抑菌乳酸菌对6种指示菌的抑制作用均优于出发菌株Lp1,其中,对大肠埃希氏菌抑菌性能提高了11.20%~54.27%,金黄色葡萄球菌提高了8.04%~33.28%,单核细胞增生李斯特氏菌提高了14.48%~25.76%,沙门氏菌提高了11.54%~57.92%,志贺氏菌提高了7.80%~21.39%,克罗诺杆菌提高了15.56%~42.13%。其中,菌株L088对大肠埃希氏菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、沙门氏菌、志贺氏菌、克罗诺杆菌6种指示菌的抑菌扇环半径比出发菌株Lp1抑菌扇环半径分别提高了47.81%、33.28%、22.97%、45.25%、21.39%、40.21%;L063对6种指示菌的抑菌扇环半径比出发菌株Lp1抑菌扇环半径分别提高了54.27%、29.18%、25.37%、58.03%、17.85%、42.13%,因此菌株L088和L063为广谱抑菌性能较好菌株。
2.4 抑制特定指示菌性能优良突变株筛选
采用培养皿分区法对重离子束辐照Lp1菌株的98株突变菌株进行广谱抑菌试验时,发现有些突变菌株针对6种指示菌中某一种指示菌有良好的抑菌性能,与出发菌株Lp1的抑菌能力相比有明显提高,从98株突变菌株中筛选出了分别对6种指示菌抑菌效果最强的5株菌株,试验结果见表5。
表5 抑制特定指示菌突变株抑菌试验结果
Table 5 Antibacterial tests results for specific indicator bacterial mutant strains

菌株编号Lp1 L092抑菌扇环半径/mm大肠埃希氏菌 金黄色葡萄球菌 李斯特氏菌 沙门氏菌 志贺氏菌 克罗诺杆菌4.16±0.14b 6.68±0.30a 7.48±0.37b 8.01±0.42b 9.52±0.21bc 8.93±0.48c 3.77±0.53b 4.07±0.17b 3.87±0.35b 4.45±0.56b 5.73±0.43a 6.32±0.40a
续表

菌株编号L084 L043 L002 L072抑菌扇环半径/mm大肠埃希氏菌 金黄色葡萄球菌 李斯特氏菌 沙门氏菌 志贺氏菌 克罗诺杆菌5.78±0.29ab 4.34±0.51b 5.01±0.27ab 4.96±0.39ab 11.26±0.08a 8.54±0.22b 8.83±0.43ab 9.13±0.51ab 9.75±0.33bc 14.64±0.35a 11.62±0.40b 7.98±0.27c 4.96±0.48b 9.14±0.17a 5.02±0.47b 4.68±0.24b 4.16±0.19b 5.07±0.17b 9.61±0.28a 4.15±0.51b 5.99±0.30a 6.14±0.36a 6.37±0.41a 7.67±0.19a
由表5可知,与出发菌株Lp1相比,菌株L092对大肠埃希氏菌抑菌扇环半径提高了60.58%,菌株L084对金黄色葡萄球菌抑菌扇环半径提高了50.53%,菌株L043对李斯特氏菌和沙门氏菌的抑菌扇环半径分别提高了53.78%和42.44%,菌株L002对志贺氏菌抑菌扇环半径提高了148.32%,菌株L072 对克罗诺杆菌抑菌扇环半径提高了67.47%。
3 结论
本研究先采用琼脂扩散法对甘肃牧区传统发酵乳品中分离纯化的96株乳酸菌进行了产细菌素菌株筛选,在排除有机酸、过氧化氢干扰和蛋白酶敏感性试验后,初步判断筛选的菌株Lp1培养上清液中有细菌素类抑菌物质。采用培养皿分区法,对筛选出的菌株Lp1重离子束12C6+辐照诱变后获得的98株突变菌株,进行了6种指示菌广谱抑菌性能比选,选育出对6种指示菌的抑制性能均明显优于出发菌株Lp1的5株突变菌株,其中L088、L063在5株广谱抑菌突变菌株中具有较好的广谱抑菌性。相较于传统琼脂扩散法,培养皿分区法通过在培养皿各分区中加入不同指示菌,可以比较在相同条件下对不同指示菌的抑菌性能,抑菌扇环半径大小可以直观反映对不同指示菌抑菌能力,在1个培养皿中可同时完成检测6种指示菌的抑菌试验,可用于产广谱细菌素乳酸菌高效筛选。
参考文献:
[1] MORADI M, KOUSHEHS, ALMASI H, et al.Postbiotics produced by lactic acid bacteria:the next frontier in food safety[J].Compr Rev Food Sci Food Safety,2020,19(6):3390-3415.
[2]JIANG H,LI P,GU Q.Heterologous expression and purification of plantaricin NC8,a two-peptide bacteriocin against Salmonella spp.from Lactobacillus plantarum ZJ316[J].Prot Express Purificat, 2016, 127(11):28-34.
[3]YU H J,CHEN Y F,YANG H J,et al.Screening for Lactobacillus plantarum with potential inhibitory activity against enteric pathogens[J].Ann Microbiol,2015,65(3):1257-1265.
[4]REUBEN R C,ROY P C,SARKAR S L,et al.Characterization and evaluation of lactic acid bacteria from indigenous raw milk for potential probiotic properties[J].J Dairy Sci,2020,103(2):1223-1237.
[5]刘树昕,吴爱娟,甄妮,等.广谱抑菌乳酸菌的筛选及其细菌素相关基因分析[J].食品科学,2020,41(6):101-107.
[6]ANACARSO L,GIGLI L,BONDI M,et al.Isolation of two lactobacilli,produces of two new bacteriocin-like substances(BLS)for potential foodpreservative use[J].Eur Food Res Technol,2017,5:1-8.
[7]CHIKINDAS M L,WEEKS R,DRIDER D,et al.Functions and emerging applications of bacteriocins[J].Curr Opin Biotechnol,2018,49:23-28.
[8]孙群,易华西,张冬,等.潜在益生菌的筛选及抑菌功能特性评价[J].食品科技,2019,44(12):1-5.
[9]杨珍珠,潘秭琪,迟海,等.羊奶源产细菌素乳酸菌筛选、鉴定及益生特性研究[J].中国食品学报,2021,21(11):71-77.
[10] SHIN J M, GWAK J W, KAMARAJAN P, et al.Biomedical applications of nisin[J].J Appl Microbiol,2016,120(6):1449-1465.
[11]HWANHLEM N,IVANOVA T,HAERTLE T,et al.Inhibition of foodspoilage and foodborne pathogenic bacteria by a nisin Z-producing Lactococcus lactis subsp.lactis KT2W2L[J].LWT-Food Sci Technol,2017,82(9):170-175.
[12]LE BLAY G,LACROIX C,ZIHLER A,et al.In vitro inhibition activity of nisin A, nisin Z, pediocin PA-1 and antibiotics against common intestinal bacteria[J].Lett Appl Microbiol,2007,45(3):252-257.
[13]王佳宇,胡文,管玉格,等.乳酸链球菌素抑菌机理及在食品保鲜中的研究进展[J].食品工业科技,2021,42(3):346-350.
[14] MEENU C, PAWAN K, MANJU B N, et al.Surfactant assisted nisin loaded chitosan-carageenan nanocapsule synthesis for controlling food pathogens[J].Food Control,2014,37(1):158-164.
[15]ANWER M K,JAMIL S,IBNOUF E O,et al.Enhanced antibacterial effects of clove essential oil by nanoemulsion[J].J Oleo Sci,2014,63(4):347-354.
[16]刘树昕,吴爱娟,甄妮,等.广谱抑菌乳酸菌的筛选及其细菌素相关基因分析[J].食品科学,2020,41(6):101-107.
[17]孔令誉,夏超然,沈淇元,等.乳酸菌合成细菌素的细胞通讯机制研究进展[J].中国食品学报,2022,22(12):360-372.
[18]胡美丽,王俊钢,李宇辉.产细菌素乳酸菌在食品中的应用[J].食品安全质量检测学报,2022,13(14):4657-4664.
[19]邵建宁,张文齐,麻和平,等.甘肃牧区传统发酵乳制品中优良乳酸菌的分离筛选[J].中国酿造,2017,36(3):75-79.
[20] YANG E, FAN L, JIANG Y, et al.Antimicrobial activity of bacteriocin-producing lactic acid bacteria isolated from cheeses and yogurts[J].AMB Express,2012,2(1):48.
[21]LI R M,WANG J F,LI W J.Application of heavy ion beams to microbial mutation breeding and exploitation of biological energy[J].Nuclear Phys Rev,2007,24(3):234-237.
[22]缪建顺,曹国珍,张苗苗,等.重离子束诱变选育谷氨酸高产菌株[J].辐射研究与辐射工艺学报,2015,33(5):39-45.
[23]邵建宁,麻和平,张文齐,等.一种用于广谱抑菌试验的培养皿分区器:CN202022804820.X[P].2021-12-14.
[24]任世英,丁沈利,王玲,等.产蛋白质类抑菌物质乳酸菌的分离鉴定与抑菌特性研究[J].生物学杂志,2018,35(3):34-38.
[25]马国涵,马欢欢,吕欣然,等.大菱鲆肠道中广谱拮抗活性乳酸菌的筛选及其细菌素鉴定[J].食品科学,2019,40(6):159-165.
[26]麻和平,彭章普,张文齐,等.重离子束辐照选育高产细菌素植物乳杆菌[J].食品工业科技,2021,42(15):139-143.