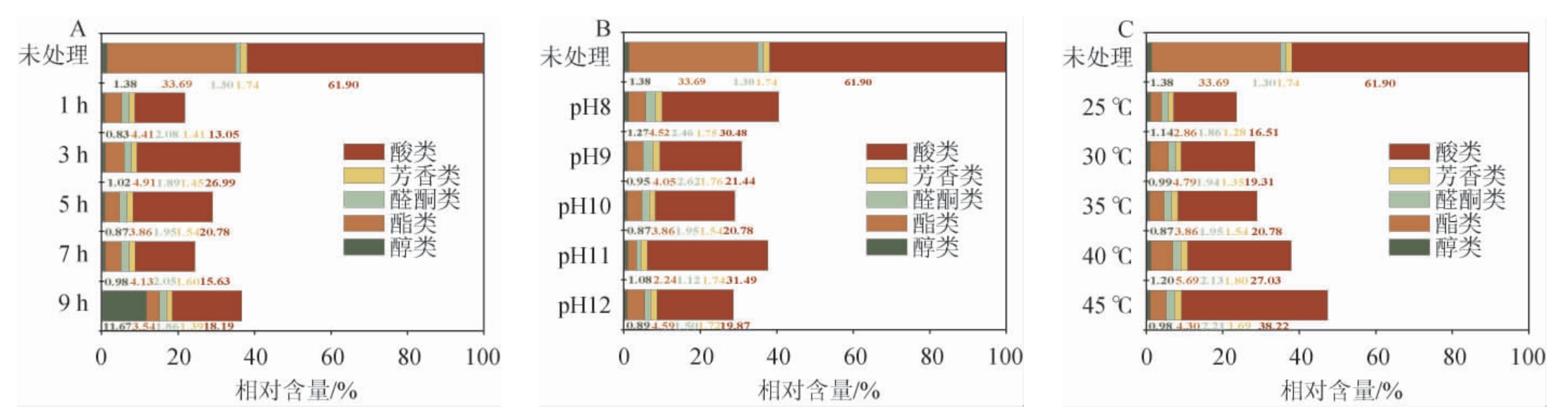
图1 不同Ca(OH)2脱毒条件对酒糟水解液成分种类及相对含量的影响
Fig.1 Effects of different Ca(OH)2 detoxification conditions on types and relative contents of composition of distillers'grain hydrolysate
以未处理的酒糟水解液中的化合物含量设为100%。
Screening of inhibitors from hydrolysate of distiller's grains and its effect on butanol fermentation
随着化石燃料的持续消耗和储量的不断下降,寻找绿色可持续的生物质能源成为一大热点。生物丁醇与生物乙醇相比具有蒸汽压低、腐蚀性小、热值高、疏水性强、以及便于管道运输的优点;同时丁醇能够部分或全部取代汽油,不需要对现有发动机进行修改,是极具潜力的生物质能源[1-3]。丁醇在工业上的生产方法主要包括化学合成法和生物发酵法,与化学合成法相比,生物发酵法具有原料选择广、生产设备投资少以及生产条件温和等特点,因此受到了广泛的关注[4-5]。生物发酵法主要通过微生物代谢,将底物转换为丙酮-丁醇-乙醇(acetone-butanol-ethanol,ABE)等溶剂,又称为ABE发酵[6]。玉米、小麦和薯类等粮食原料作为ABE发酵的第一代原料,尽管可发酵性糖含量丰富且前处理简单,但原料成本较高,达到总生产成本的60%[7]。第二代与第三代原料主要包括木质纤维素和粗甘油、亚硫酸盐废液等工农业废弃物,这些原料相对廉价,但预处理复杂并且处理过程中会产生多种抑制物影响丁醇发酵,如弱酸类、呋喃类以及酚类等[8-9],不利于大规模的工业化应用。
近年来,食品废弃物作为ABE发酵原料受到了广泛关注[10-12],白酒糟是其中的优良选择之一。白酒糟是白酒生产过程中的主要固体废弃物,平均生产1 t白酒会产生2~4 t的酒糟[13],2021年白酒糟产量约为1 432~2 864万t[14]。研究表明,白酒糟中含有大量的淀粉、蛋白质、脂肪和水溶性维生素等营养成分,能够满足微生物发酵所需的营养条件,将其作为发酵原料不仅可以生产高附加值的产品,还能够拓展酒糟的综合利用途径。然而,白酒糟中积累了酒曲微生物产生的大量代谢副产物,具有酸度高和微量成分复杂等特点,这些潜在物质严重阻碍着白酒糟资源的再利用[15-16]。选择合适的脱毒方法从而提高丁醇产量至关重要,Ca(OH)2脱毒法、活性炭吸附法、离子交换树脂处理以及溶剂萃取等[17]方法是常见的生物质水解液抑制物去除方法。本实验室前期利用Ca(OH)2处理白酒糟酶解液后用于丁醇发酵,丁醇产量达到(9.02±0.18)g/L,远高于未处理的丁醇发酵产量(0.51±0.03)g/L,这表明Ca(OH)2处理有效去除了酒糟水解液(distillers'grain hydrolysate,DGH)中抑制物质对丁醇生产的负面影响[18]。但Ca(OH)2处理成本较高,不利于大规模的工业化应用。解析酒糟中的主要抑制物种类,筛选高效、经济的脱毒方法,对于降低丁醇生产成本,实现白酒糟的高值化利用具有重要意义。
本研究利用Ca(OH)2对酒糟水解液进行脱毒处理,通过气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪检测脱毒前后酒糟水解液中的物质种类和含量变化,并结合主成分分析(principal component analysis,PCA)和偏最小二乘分析(partial least squares,PLS)等多元统计分析方法筛选酒糟水解液中的潜在抑制物,以期提高丁醇发酵产量,为白酒糟综合利用生产燃料丁醇奠定基础。
1.1.1 材料与菌株
浓香型白酒糟:湖北某酒厂;拜氏梭菌(Clostridium beijerinckii)LY-5:实验室菌种库保藏。
1.1.2 培养基
种子培养基:10 g酵母浸膏,20 g葡萄糖,20 g蛋白胨,加入1 000 mL蒸馏水,搅拌溶解。
合成培养基:2 g酵母膏,2 g牛肉膏,85 g葡萄糖,4.3 g蛋白胨,0.5 g KH2PO4,0.5 g L-半胱氨酸,0.02 g FeSO4·7H2O,3 g CH3COONH4,0.18 g MgSO4·7H2O,加入1 000 mL蒸馏水,搅拌溶解,调节pH到5.5。
1.1.3 试剂
糖化酶(酶活力100 000 U/g):阿拉丁试剂有限公司;液化酶(酶活力20 000 U/mL):上海源叶生物科技有限公司;试验所用其他试剂均为国产分析纯。
WD-9405B恒温摇床:沃德生物医学仪器公司;PHS-3C pH计:上海雷磁仪器有限公司;YXQ-LS-75立式压力蒸汽灭菌锅:上海博讯实验有限公司医疗设备;ZHJH-1214B超净工作台:上海智诚分析仪器制造公司;HWS-250P恒温恒湿培养箱:天津市泰斯特仪器有限公司;7820A气相色谱仪、5977B-7890B气相色谱-质谱联用仪:美国安捷伦公司。
1.3.1 酒糟水解液的制备
酒糟55 ℃烘干磨粉,过40目筛。取300 g酒糟置于1 000 mL蒸馏水中,充分搅匀,置于60 ℃水浴锅预糊化120 min。取出冷却至室温,利用2 mol/L NaOH调节pH到6.0,添加50 U/g α-高温淀粉酶,沸水浴120 min。取出冷却至室温调节pH到4.0,添加250 U/g糖化酶在60 ℃水浴120 min。水解结束后,8 000 r/min高速离心5 min,制得酒糟水解液,经脱毒处理后用于酒糟发酵。
1.3.2 白酒糟水解液的Ca(OH)2脱毒条件
利用Ca(OH)2对酒糟水解液进行脱毒处理,设置基础条件为处理时间5 h,脱毒pH10,温度35 ℃,恒温摇床180 r/min,改变单一变量,分别考察不同处理时间(1 h、3 h、5 h、7 h、9 h)、脱毒pH(8、9、10、11、12)、脱毒温度(25 ℃、30 ℃、35 ℃、40 ℃、45 ℃)对酒糟水解液中的物质成分的影响。未经Ca(OH)2脱毒处理的酒糟水解液为对照组,所有试验重复三次。
1.3.3 潜在抑制物发酵验证
单因素试验:分别配制单一潜在抑制物质量浓度为50 mg/L、100 mg/L、200 mg/L、400 mg/L、800 mg/L于合成培养基,115 ℃灭菌20 min,CaCO3添加量0.3%,接种量10%,34 ℃恒温培养96 h进行发酵验证实验[19]。
混合抑制物发酵:分别加入等质量浓度的各种潜在抑制物(50 mg/L、100 mg/L、200 mg/L、400 mg/L、800 mg/L)于合成培养基,进行发酵验证,发酵条件同上。
1.3.4 酒糟水解液物质成分的测定
内标配制方法:称取乙酸正戊酯0.084 7 g,叔戊醇0.0777g,2-乙基丁酸0.0898g于10mL容量瓶,二氯甲烷定容。
样品前处理:分别取4 mL对照组和经过Ca(OH)2脱毒处理后的酒糟水解液,加入10 μL内标,2 mL二氯甲烷,混匀振荡10 s后静置分层,吸取上清液加入无水硫酸钠,-80 ℃冰箱冷冻4 h,用0.22 μm尼龙滤膜过滤,进行GC-MS分析。
气相色谱条件:色谱柱DB-WAX 122-7032(30 m×0.25 mm×0.25 μm),进样口温度260 ℃,载气为高纯氦气(He)(99.999%),分流比10∶1,色谱柱流量0.7 mL/min。程序升温设置:第一阶段45 ℃保持1.5 min;第二阶段6 ℃/min上升至85 ℃;第三阶段4 ℃/min上升至225 ℃,保持6 min。
质谱条件:四极杆温度150 ℃,传输线温度250 ℃,离子源温度230 ℃。电子能量70 eV,质量扫描范围50~550 m/z。
1.3.5 丁醇含量的测定
丁醇含量的测定采用气相色谱法。色谱柱:DB-WAX 122-7032(30 m×0.25 mm×0.25 μm);氢火焰离子化检测器(flame ionization detector,FID)检测器(220 ℃);进样温度220 ℃;进样量为0.6 μL;分流比60∶1;分流流量为48 mL/min。柱箱升温过程如下:起始35 ℃维持5 min,然后以4 ℃/min升至60℃,再以6℃/min升至78℃,最后以20℃/min升至220 ℃,维持10 min。内标物为4%乙酸正戊酯,以保留时间定性,内标法定量。
1.3.6 数据处理
采用美国国家标准与技术研究所(national institute of standards and technology,NIST)MS Search 2.3软件对原始的峰谱图进行积分处理,根据已知内标的浓度和峰面积比较,得到各类物质的含量。本实验采用SIMCA 14.1、Originpro 2021b、GraphPad Prism 8.0.2、R 4.2.3软件以及Hiplot科研绘图平台进行绘图,采用SPSS 22.0软件的单因素方差分析进行数据分析,P<0.05为显著。
采用GC-MS对不同处理条件下酒糟水解液中的成分进行分析,结果见表1。经过Ca(OH)2处理后,酒糟水解液中的化学成分呈现出不同的变化情况。Ca(OH)2脱毒对酒糟水解液组成的影响结果见图1。

图1 不同Ca(OH)2脱毒条件对酒糟水解液成分种类及相对含量的影响
Fig.1 Effects of different Ca(OH)2 detoxification conditions on types and relative contents of composition of distillers'grain hydrolysate
以未处理的酒糟水解液中的化合物含量设为100%。
表1 不同Ca(OH)2脱毒条件对白酒糟水解液成分的影响
Table 1 Effects of different Ca(OH)2 detoxification conditions on composition of distillers'grain hydrolysate
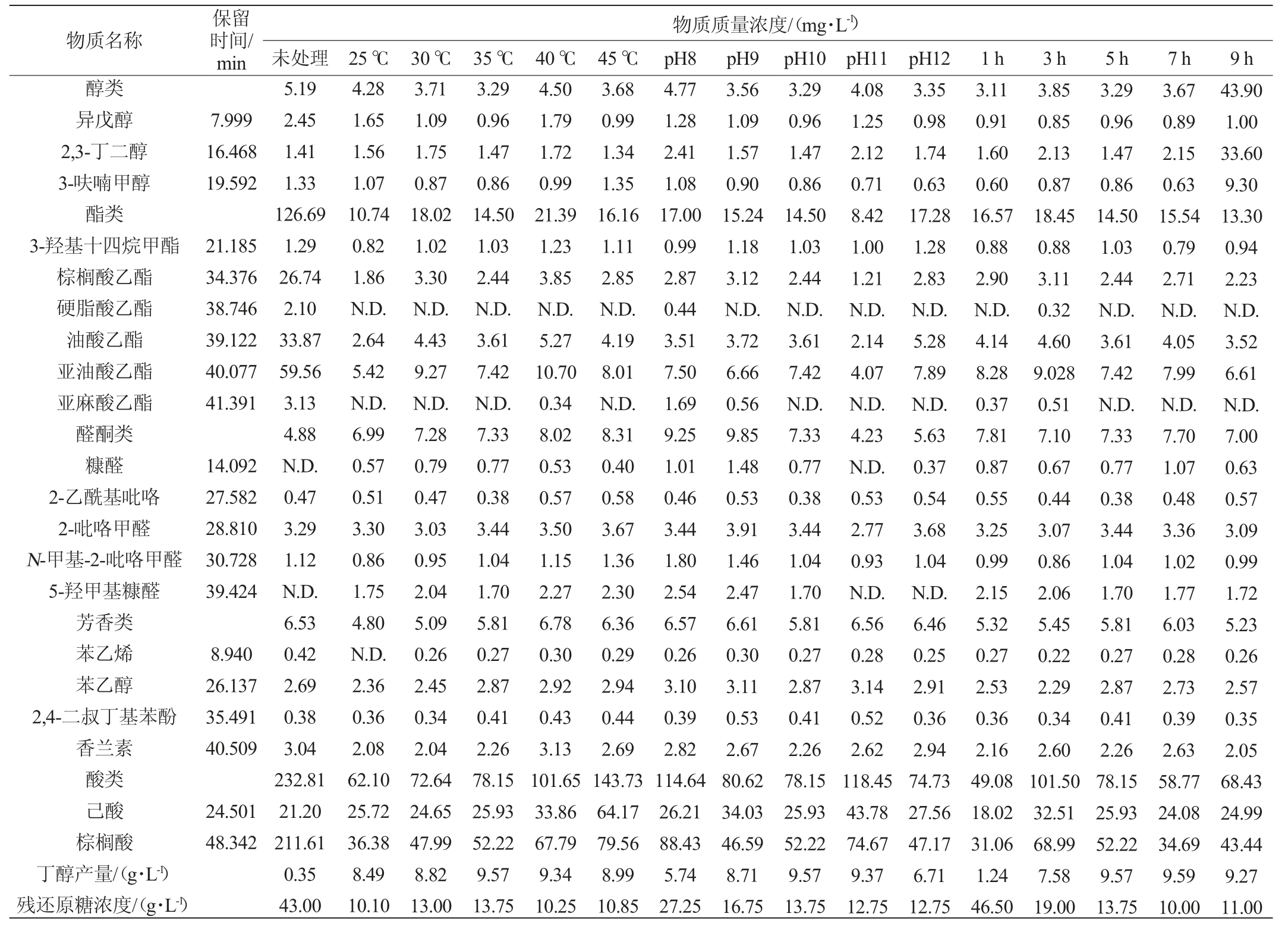
注:“N.D.”表示未检出。
物质名称醇类异戊醇2,3-丁二醇3-呋喃甲醇酯类3-羟基十四烷甲酯棕榈酸乙酯硬脂酸乙酯油酸乙酯亚油酸乙酯亚麻酸乙酯醛酮类糠醛2-乙酰基吡咯2-吡咯甲醛N-甲基-2-吡咯甲醛5-羟甲基糠醛芳香类苯乙烯苯乙醇2,4-二叔丁基苯酚香兰素酸类己酸棕榈酸丁醇产量/(g·L-1)残还原糖浓度/(g·L-1)保留时间/min 7.999 16.468 19.592 21.185 34.376 38.746 39.122 40.077 41.391 14.092 27.582 28.810 30.728 39.424 8.940 26.137 35.491 40.509 24.501 48.342物质质量浓度/(mg·L-1)未处理 25 ℃ 30 ℃ 35 ℃ 40 ℃ 45 ℃ pH8 pH9 pH10 pH11 pH12 1 h 3 h 5 h 7 h 9 h 5.19 2.45 1.41 1.33 126.69 1.29 26.74 2.10 33.87 59.56 3.13 4.88 N.D.0.47 3.29 1.12 N.D.6.53 0.42 2.69 0.38 3.04 232.81 21.20 211.61 0.35 43.00 4.28 1.65 1.56 1.07 10.74 0.82 1.86 N.D.2.64 5.42 N.D.6.99 0.57 0.51 3.30 0.86 1.75 4.80 N.D.2.36 0.36 2.08 62.10 25.72 36.38 8.49 10.10 3.71 1.09 1.75 0.87 18.02 1.02 3.30 N.D.4.43 9.27 N.D.7.28 0.79 0.47 3.03 0.95 2.04 5.09 0.26 2.45 0.34 2.04 72.64 24.65 47.99 8.82 13.00 3.29 0.96 1.47 0.86 14.50 1.03 2.44 N.D.3.61 7.42 N.D.7.33 0.77 0.38 3.44 1.04 1.70 5.81 0.27 2.87 0.41 2.26 78.15 25.93 52.22 9.57 13.75 4.50 1.79 1.72 0.99 21.39 1.23 3.85 N.D.5.27 10.70 0.34 8.02 0.53 0.57 3.50 1.15 2.27 6.78 0.30 2.92 0.43 3.13 101.65 33.86 67.79 9.34 10.25 3.68 0.99 1.34 1.35 16.16 1.11 2.85 N.D.4.19 8.01 N.D.8.31 0.40 0.58 3.67 1.36 2.30 6.36 0.29 2.94 0.44 2.69 143.73 64.17 79.56 8.99 10.85 4.77 1.28 2.41 1.08 17.00 0.99 2.87 0.44 3.51 7.50 1.69 9.25 1.01 0.46 3.44 1.80 2.54 6.57 0.26 3.10 0.39 2.82 114.64 26.21 88.43 5.74 27.25 3.56 1.09 1.57 0.90 15.24 1.18 3.12 N.D.3.72 6.66 0.56 9.85 1.48 0.53 3.91 1.46 2.47 6.61 0.30 3.11 0.53 2.67 80.62 34.03 46.59 8.71 16.75 3.29 0.96 1.47 0.86 14.50 1.03 2.44 N.D.3.61 7.42 N.D.7.33 0.77 0.38 3.44 1.04 1.70 5.81 0.27 2.87 0.41 2.26 78.15 25.93 52.22 9.57 13.75 4.08 1.25 2.12 0.71 8.42 1.00 1.21 N.D.2.14 4.07 N.D.4.23 N.D.0.53 2.77 0.93 N.D.6.56 0.28 3.14 0.52 2.62 118.45 43.78 74.67 9.37 12.75 3.35 0.98 1.74 0.63 17.28 1.28 2.83 N.D.5.28 7.89 N.D.5.63 0.37 0.54 3.68 1.04 N.D.6.46 0.25 2.91 0.36 2.94 74.73 27.56 47.17 6.71 12.75 3.11 0.91 1.60 0.60 16.57 0.88 2.90 N.D.4.14 8.28 0.37 7.81 0.87 0.55 3.25 0.99 2.15 5.32 0.27 2.53 0.36 2.16 49.08 18.02 31.06 1.24 46.50 3.85 0.85 2.13 0.87 18.45 0.88 3.11 0.32 4.60 9.028 0.51 7.10 0.67 0.44 3.07 0.86 2.06 5.45 0.22 2.29 0.34 2.60 101.50 32.51 68.99 7.58 19.00 3.29 0.96 1.47 0.86 14.50 1.03 2.44 N.D.3.61 7.42 N.D.7.33 0.77 0.38 3.44 1.04 1.70 5.81 0.27 2.87 0.41 2.26 78.15 25.93 52.22 9.57 13.75 3.67 0.89 2.15 0.63 15.54 0.79 2.71 N.D.4.05 7.99 N.D.7.70 1.07 0.48 3.36 1.02 1.77 6.03 0.28 2.73 0.39 2.63 58.77 24.08 34.69 9.59 10.00 43.90 1.00 33.60 9.30 13.30 0.94 2.23 N.D.3.52 6.61 N.D.7.00 0.63 0.57 3.09 0.99 1.72 5.23 0.26 2.57 0.35 2.05 68.43 24.99 43.44 9.27 11.00
由表1可知,未处理的酒糟水解液中共检测出18种化合物,包括3种醇类、6种酯类、3种醛酮类、4种芳香类和2种酸类化合物。大部分物质都是浓香型白酒中的重要香味成分,如己酸、异戊醇、2,3-丁二醇等[20]。其中,酸类物质含量最高,达到232.81 mg/L,其次是酯类(126.69 mg/L),醇类、醛酮类和芳香类物质含量相对较低,分别为5.19 mg/L、4.88 mg/L和6.53 mg/L。
由图1可知,Ca(OH)2处理对酸类物质和酯类物质的去除较为显著,去除率范围分别为38.2%~78.9%和83.1%~93.3%,其次是醇类、芳香烃类和醛酮类物质。据文献报道,碱处理对醛酮类和芳香类化合物具有显著脱除效果,它能促进醛酮之间发生羟醛缩合反应,从而降低水解液的毒性[21]。本研究中,醛酮类和芳香类物质的去除效果不佳,可能是因为酒糟水解液中两大类化合物含量较少;此外,处理条件的改变会影响此类化合物的存在形式和稳定性,并且酒糟水解液成分复杂,会相互影响物质的去除效果[22-23]。由图1A可知,脱毒时间对酸类物质的影响最大,尤其是棕榈酸的去除率达到58.2%~85.3%,可能是因为氢氧化钙属于碱性物质,棕榈酸与氢氧化钙发生酸碱中和作用后生成了棕榈酸钙沉淀,从而达到去除的效果。尚嘉毅等[24]报道棕榈酸与氢氧化钙的反应时间过长,会破坏棕榈酸钙的结构。这与本实验中Ca(OH)2处理1 h时酸类物质的去除效果最好,随着时间的继续延长其去除效率出现下降的现象相一致。由图1B可知,pH对酯类物质脱除影响最大,随着pH升高其脱除效果越好,当pH为10时酯类物质的去除率达93.3%,去除效果最佳。这与文献报道的相一致。IWASAKI F等[25]通过添加Ca(OH)2改变原料甘蔗汁中的pH,发现pH的变化影响了甘蔗汁中挥发性物质的形成,如乙酸异戊酯、乙酸乙酯等酯类物质。同时,Ca(OH)2处理的高pH条件,会影响部分酯类物质的稳定性,酯类物质发生水解反应从而造成浓度降低[26]。由图1C可知,温度对芳香类物质的影响最为显著,随着处理温度的升高,芳香类物质的去除效果变差,25 ℃时芳香类物质的脱除效果最好,达到了26.5%。综上所述,不同的Ca(OH)2处理条件对酒糟水解液中的化合物有不同程度的去除效果,最佳脱毒条件为pH 10,25 ℃处理1 h,其中对酸类和酯类物质的去除效果最佳。
2.2.1 不同碱处理条件下酒糟水解液成分变化的聚类分析将酒糟水解液中的成分进行聚类分析,通过纵向聚类反映不同成分在不同处理条件下的含量差异,结果见图2。
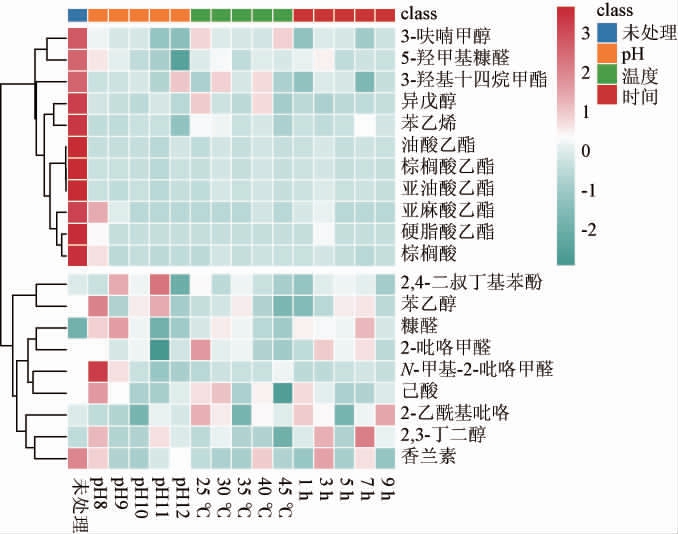
图2 白酒糟水解液成分聚类分析结果
Fig.2 Cluster analysis results of composition of distillers'grain hydrolysate
由图2可知,水解液中检出的物质根据浓度差异被聚类为两类,第一类含有大量的酯类物质,第二类主要包含醛酮类和芳香类物质。未处理的酒糟水解液所对应的第一类物质浓度比第二类高,第一类物质经碱处理后含量减少,第二类因条件变化出现了含量升高或降低的不规律现象,并且其经Ca(OH)2处理后含量变化比第二类物质明显。第二类物质中糠醛和香草醛是丁醇发酵中常见抑制物,文献报道两者的最低抑制浓度分别为2.0 g/L、1.0 g/L[27]。本研究中,未处理样品及经碱处理后的酒糟水解液中的糠醛和香草醛最高不超过1.48 mg/L和3.13 mg/L,不足以影响丁醇发酵。第一类物质经碱处理后比第二类呈现出的去除性规律性更为明显,同时第二类物质中未处理样品含量明显低于第一类,酯类和酸类作为酒糟水解液中含量最高的两大类物质,大部分物质都聚类在第一类中,结合2.1的结果推测这两类物质可能是酒糟水解液中的潜在抑制物。
2.2.2 不同碱处理条件下酒糟水解液成分变化的主成分分析
将上述数据进行主成分分析,研究不同条件下Ca(OH)2处理对酒糟水解液中化合物的影响,结果见图3。由图3可知,PC1的方差贡献率为49.7%,PC2的方差贡献率为13.8%,PC3的方差贡献率为9.7%,PCA中的前两个主成分解释了63.5%的数据,PC1和PC2具有代表总体的特征,并能够分析Ca(OH)2处理酒糟水解液物质变化的数据差异[28]。酒糟水解液样本根据距离远近分为4个区域,未处理为一类,45 ℃处理条件为一类,pH 8处理条件为一类,其余处理条件为一类。Ca(OH)2处理的酒糟水解液与未处理相比未被分为一类,说明Ca(OH)2处理对酒糟水解液具有一定的影响,并且未处理的酒糟水解液明显偏离经过Ca(OH)2处理的酒糟水解液样品,同时pH条件的改变相比于另外两个处理条件分离的更为明显。主成分分析中的载荷因子可反映重要变量的贡献程度,载荷因子绝对值越大对酒糟水解液的影响程度越大。选取PC1和PC2中载荷因子绝对值>0.9的物质为指标,确定对丁醇发酵有明显影响的物质。PC1中主要影响物质有棕榈酸、硬脂酸乙酯、棕榈酸乙酯、亚油酸乙酯、油酸乙酯、亚麻酸乙酯,PC2对应的物质为己酸,说明以上几种物质在前两个主成分中起主导作用。
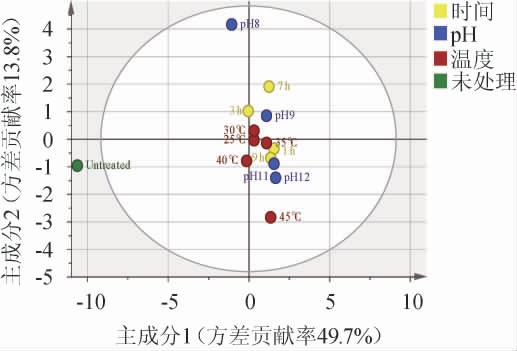
图3 白酒糟水解液成分主成分分析结果
Fig.3 Principal component analysis results of composition of distillers'grain hydrolysate
2.2.3 不同碱处理条件下酒糟水解液成分变化的偏最小二乘分析
PLS与无监督的PCA相比,解决了原始数据相关性小,降维后的主成分无法直观表现样本间关系的问题,PLS是系统优化的有力工具,能够有效提取对因变量解释最强的综合变量[29]。因此,本研究在PCA基础上,结合PLS筛选水解液中的潜在抑制物。PLS中主因子个数为5时,模型X轴累积解释率R2X=0.974,Y轴累积解释率Q2Y=0.901,模型判定系数(R2)和预测能力参数(Q2)超过0.5,表示该模型有较好的拟合解释能力。Ca(OH)2脱毒白酒糟水解液样本的PLS载荷图和变量重要度(variable importance for projection,VIP)值结果见图4。
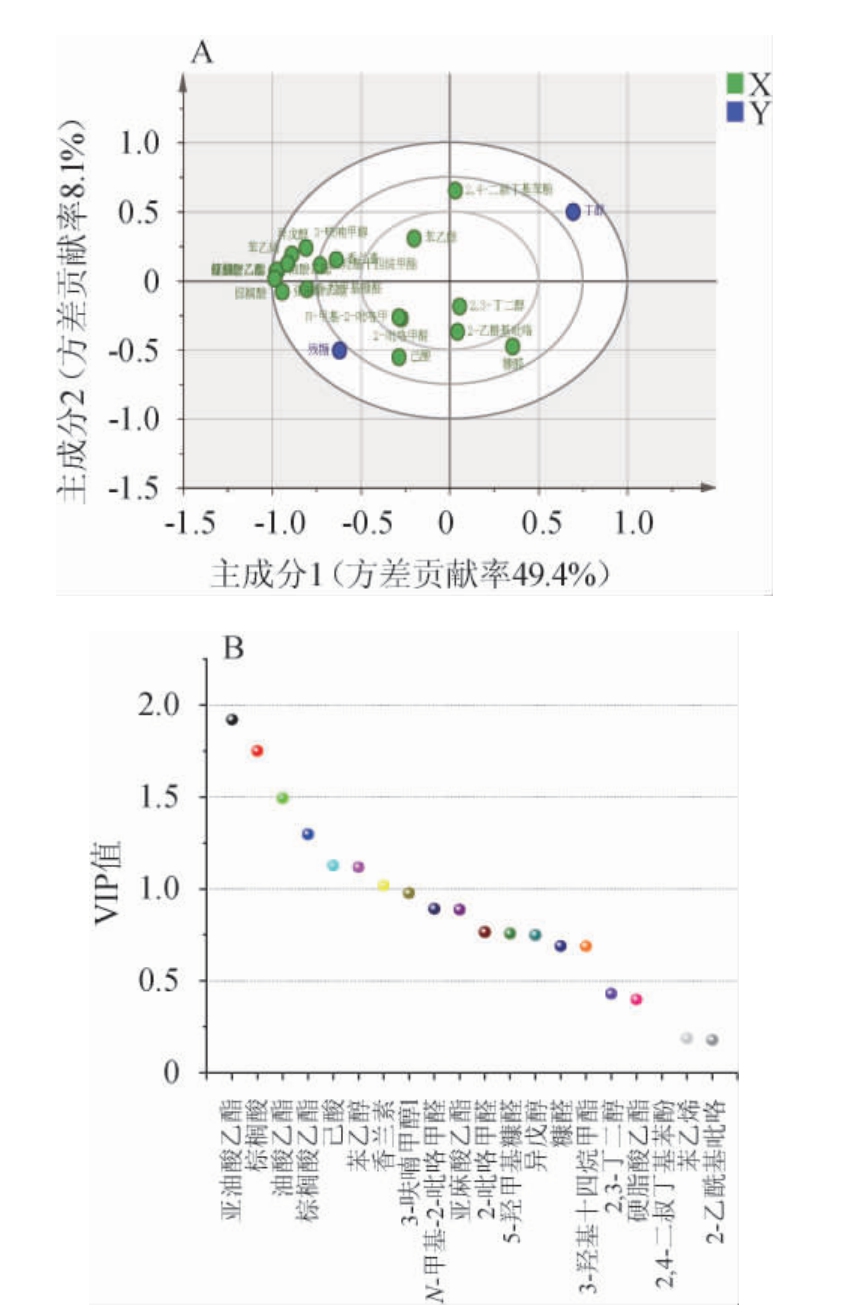
图4 白酒糟水解液成分偏最小二乘分析(A)及变量重要性投影值(B)
Fig.4 Partial least squares (A) and variable importance in projection values (B) of composition of distillers'grain hydrolysate
由图4A可知,残糖和丁醇属于负相关关系,符合丁醇含量越高,剩余还原糖含量越低的预期。集中分布于椭圆最左侧的点与丁醇质量浓度具有较强的负相关性,主要有亚麻酸乙酯、棕榈酸、硬脂酸乙酯、油酸乙酯、亚油酸乙酯、棕榈酸乙酯,这些物质载荷因子绝对值大于0.9。投影值的VIP值可以反应物质对模型分类的贡献度,可将VIP>1的物质作为筛选潜在抑制物的标准之一[30]。将载荷因子>0.9且VIP>1的物质确定为对丁醇发酵影响显著的潜在性抑制物,包括亚油酸乙酯、棕榈酸、油酸乙酯、棕榈酸乙酯、己酸(图4B),因此需要对上述五种潜在抑制物的抑制作用进行探究。
采用梯度发酵试验确定酒糟水解液中抑制物,考察五种潜在抑制物单独添加及混合添加对丁醇含量的影响,结果见图5。
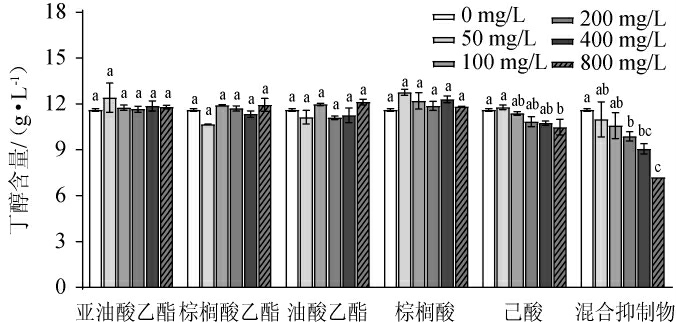
图5 不同亚油酸乙酯、棕榈酸乙酯、油酸乙酯、棕榈酸、己酸和混合抑制物添加量对丁醇发酵的影响
Fig.5 Effects of different addition of ethyl linoleic acid, ethyl palmitic acid, ethyl oleic acid, palmitic acid, hexanoic acid and mixed inhibitor on butanol fermentation
同一潜在抑制物不同添加量间字母不同代表差异显著(P<0.05)。
由图5可知,单独添加潜在抑制物时,亚油酸乙酯、棕榈酸乙酯、油酸乙酯、棕榈酸四种物质的质量浓度在800 mg/L以内时对丁醇发酵无显著影响(P>0.05)。但当己酸的质量浓度达到800 mg/L时,其丁醇产量为(10.35±0.33)g/L,其产量相比于空白对照组减少了12.0%,有显著性差异(P<0.05)。这可能是因为中链脂肪酸进入细菌细胞壁内,发生β-氧化产生过氧化氢,当过氧化氢酶无法清除过多的过氧化氢,积累到细胞无法排除时导致了细胞死亡[31]。
虽然酯类物质单独添加时未对丁醇发酵产生抑制,但水解液中存在多种酯类物质,它们之间可能存在协同抑制作用。对上述潜在抑制物的协同抑制作用进行了研究,结果表明,当酯类物质和脂肪酸混合共同发酵时,随着混合抑制物添加量的提高,丁醇产量逐渐降低。当添加量从0增加至200 mg/L时,丁醇产量从(11.70±0.34)g/L降低到(9.90±0.30)g/L,降低了15.4%;当添加量达到400 mg/L和800 mg/L时,丁醇含量分别减少了29.1%和38.5%。混合抑制物浓度大于400 mg/L时,其丁醇产量与己酸单独添加时相比有显著差异(P<0.05)。这表明随着混合抑制物浓度的升高,它们的协同抑制作用会更加明显,对丁醇发酵的抑制效果更显著。PLAZA P E等[32]利用啤酒糟生产丁醇时发现,啤酒糟水解液中存在多种抑制物,而不是单一物质抑制发酵。HUANG C B等[33]指出中链和长链脂肪酸都具有极强的抗菌性,此类脂肪酸及其酯类对革兰氏阳性菌的抑制效果更强。本实验中,多种脂肪酸及其酯类物质共同影响拜氏梭菌LY-5的丁醇发酵过程,并且混合抑制物的毒性作用强于单一抑制物。
综上所述,己酸对丁醇发酵有一定的抑制作用,与亚油酸乙酯、棕榈酸乙酯、油酸乙酯、棕榈酸等量混合且添加量超过400 mg/L时,会与其有协同抑制作用。
研究了不同条件下Ca(OH)2处理对酒糟水解液中化合物种类和含量的影响,并结合多元统计分析方法,对其中的潜在抑制物进行鉴定。结果表明,未经Ca(OH)2处理的酒糟水解液中共检测出18种物质,酯类和酸类含量最多,且经过Ca(OH)2处理后去除率最高,分别为93.3%和78.9%。己酸、油酸乙酯、亚油酸乙酯、棕榈酸乙酯、棕榈酸是潜在的抑制物种类,其协同抑制作用会显著降低丁醇发酵产量(P<0.05)。这为之后的白酒糟综合利用生产丁醇奠定了基础。
[1]BHARATHIRAJA B,JAYAMUTHUNAGAI J,SUDHARSANAA T,et al.Biobutanol-An impending biofuel for future: A review on upstream and downstream processing tecniques[J].Renew Sust Energ Rev,2017,68:788-807.
[2]汪江波,孔博,蔡林洋,等.新型燃料生物丁醇研究进展[J].中国酿造,2020,39(10):15-20.
[3]周智友,李志,张庆华,等.利用木质纤维素生产丁醇的研究进展[J].微生物学通报,2019,46(12):3461-3468.
[4] ZHANG J, AMARTEY S, LIN C, et al.A brief review of some current improvements in ABE production: New development of raw materials,strain improvement,fermentation systems,and end product extraction[J].J Biobased Mater Bioenergy,2018,12(5):405-414.
[5]崔兆然.正丁醇的合成进展简述[J].中国石油和化工标准与质量,2019,39(7):136-137.
[6]JONES D T.Acetone-butanol fermentation revisited[J].Microbiol Rev,1986,50(4):484-524.
[7]GUO Y,LIU Y,GUAN M,et al.Production of butanol from lignocellulosic biomass: recent advances, challenges, and prospects[J].Rsc Adv,2022,12(29):18848-18863.
[8]LIN X,LIU Y,ZHENG X,et al.High-efficient cellulosic butanol production from deep eutectic solvent pretreated corn stover without detoxification[J].Ind Crops Prod,2021,162:113258.
[9]VEZA I,SAID M F M,LATIFF Z A.Recent advances in butanol production by acetone-butanol-ethanol(ABE)fermentation[J].Biomass Bioenergy,2021,144:105919.
[10] ABEDINI A, AMIRI H, KARIMI K.Efficient biobutanol production from potato peel wastes by separate and simultaneous inhibitors removal and pretreatment[J].Renew Energ,2020,160:269-277.
[11] PROCENTESE A, RAGANATI F, OLIVIERI G, et al.Pre-treatment and enzymatic hydrolysis of lettuce residues as feedstock for bio-butanol production[J].Biomass Bioenergy,2017,96:172-179.
[12]QIN Z,DUNS G J,PAN T,et al.Consolidated processing of biobutanol production from food wastes by solventogenic Clostridium sp.strain HN4[J].Bioresour Technol,2018,264:148-153.
[13] MING C Y, DILOKPIMOL A, ZOU C G, et al.The quest for fungal strains and their co-culture potential to improve enzymatic degradation of Chinese distillers' grain and other agricultural wastes[J].Int Biodet Biodegrad,2019,144:104765.
[14]王鹏晓,肖进彬,刘晓杰,等.白酒酒糟资源化利用现状及展望[J].现代食品,2022,28(17):1-4.
[15]蔡凤娇,蔡林洋,孔博,等.白酒糟的多元化利用研究进展[J].酿酒,2020,47(2):11-15.
[16]高铭坤,温广宇,钱芳.微生物对白酒酒糟的转化利用研究进展[J].食品与机械,2018,34(2):191-194.
[17]孙彦平,靳艳玲,李新波,等.木质纤维素生产燃料丁醇工艺的研究进展[J].中国酿造,2010(11):17-22.
[18]WANG J B,KONG B,WANG H,et al.Production of butanol from distillers'grain waste by a new aerotolerant strain of Clostridium beijerinckii LY-5[J].Bioprocess Biosyst Eng,2021,44(10):2167-2179.
[19]蔡林洋.耐氧型丁醇生产菌的筛选及高效转化白酒糟生产丁醇的研究[D].武汉:湖北工业大学,2020.
[20]张杰,程伟,潘天全,等.浓香型白酒风味成分研究现状及展望[J].酿酒,2019,46(1):29-32.
[21]ZHANG Y,XIA C,LU M,et al.Effect of overliming and activated carbon detoxification on inhibitors removal and butanol fermentation of poplar prehydrolysates[J].Biotechnol Biofuels,2018,11(1):1-14.
[22]刘鹏,徐烨,郭静.分散液相微萃取-气相色谱法测定水样中六种芳香胺[J].分析科学学报,2011,27(4):451-454.
[23]潘晓倩,张顺亮,李素,等.吹扫/捕集-热脱附-气相色谱-质谱联用法分析不同解冻温度对牛肉风味品质的影响[J].肉类研究,2019,33(1):60-65.
[24]尚嘉毅,刘孟涛,初柏君,等.饲用泌乳剂脂肪酸钙的制备工艺优化研究[J].粮食与食品工业,2018,25(5):8-12.
[25] IWASAKI F, SUNAO M, OKUTSU K, et al.Effects of liming on the flavor of kokuto-shochu,a spirit made from non-centrifugal sugar[J].J Biosci Bioeng,2020,130(4):360-366.
[26] PALMQVIST E, HAHN-HÄGERDAL B.Fermentation of lignocellulosic hydrolysates.I: inhibition and detoxification[J].Bioresour Technol,2000,74(1):17-24.
[27]MAITI S,GALLASTEGUI G,SARMA S J,et al.A re-look at the biochemical strategies to enhance butanol production[J].Biomass Bioenergy,2016,94(1):187-200.
[28]邵淑贤,徐梦婷,林燕萍,等.基于电子鼻与HS-SPME-GC-MS技术对不同产地黄观音乌龙茶香气差异分析[J].食品科学,2023,44(4):232-239.
[29]尹燕,王淼,阳志强,等.化学模式识别在中药炮制中的应用[J].中草药,2021,52(17):5369-5377.
[30] WANG Y F, TIAN J, JI Z H, et al.Intracellular metabolic changes of Clostridium acetobutylicum and promotion to butanol tolerance during biobutanol fermentation[J].Int J Biochem Cell Biol,2016,78:297-306.
[31]BORRULL A,LOPEZ-MARTINEZ G,POBLET M,et al.New insights into the toxicity mechanism of octanoic and decanoic acids on Saccharomyces cerevisiae[J].Yeast,2015,32(5):451-460.
[32]PLAZA P E,COCA M,LUCAS S,et al.Efficient use of brewer's spent grain hydrolysates in ABE fermentation by Clostridium beijerinkii.Effect of high solid loads in the enzymatic hydrolysis[J].J Chem Technol Biotechnol,2020,95(9):2393-2402.
[33] HUANG C B, GEORGE B, EBERSOLE J L.Antimicrobial activity of n-6,n-7 and n-9 fatty acids and their esters for oral microorganisms[J].Arch Oral Biol,2010,55(8):555-560.