桑果中非酿酒酵母的分离鉴定及混菌发酵果酒研究
王香君1,蒲 军1,夏文银1,吴劲轩1,夏川林1,殷 浩1*,张 帆2,张 涛3
(1.四川省农业科学院 蚕业研究所,四川 南充 637000;2.四川上嘉农业科技有限公司,四川 南充 637000;3.南充市绿盛农业科技有限公司,四川 南充 637978)
摘 要:为提高桑果酒风味,采用分离培养方法,从桑果中筛选非酿酒酵母并对其进行鉴定,同时对筛选菌株耐受性进行测定,并利用筛选菌株制备桑果酒,对其发酵特性进行研究。结果表明,从桑果表面筛选获得5株产香非酿酒酵母(编号为S006-01、S006-02及S007-01~S007-03),经形态学和分子生物学鉴定,确定菌株S006-01、S006-02为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),菌株S007-01、S007-02、S007-03为克鲁维毕赤酵母(Pichia kluyveri)。耐受性研究表明,菌株S007-03能在酒精度5%vol的培养液中旺盛生长,其余菌株随着酒精度的增加生长受到抑制;菌株S006-02耐SO2、耐酸能力较好。发酵特性研究表明,菌株S006-02、S007-03与酿酒酵母(Saccharomyces cerevisiae)按105∶105∶107 CFU/mL的混菌组合接种到含330 g/L葡萄糖的桑果汁中,发酵的酒液酒精度比接种单一酿酒酵母发酵的高2%vol;在模拟桑果汁中,混菌发酵(HJ)产生更多香气成分,桑果酒中酯类和醇类物质更丰富,主要为辛酸乙酯、癸酸乙酯、苯乙醇等花果香风味物质。可得出葡萄汁有孢汉逊酵母S006-02、克鲁维毕赤酵母S007-03与酿酒酵母混菌发酵性能较优,能增加桑果酒酯类和醇类物质,使香气更浓郁饱满。
关键词:非酿酒酵母;分离鉴定;耐受性;风味;桑果酒
中图分类号:TS261.4
文章编号:0254-5071(2024)01-0091-08
doi:10.11882/j.issn.0254-5071.2024.01.014
引文格式:王香君,蒲军,夏文银,等.桑果中非酿酒酵母的分离鉴定及混菌发酵果酒研究[J].中国酿造,2024,43(1):91-98.
收稿日期:2023-05-04 修回日期:2023-08-10
基金项目:四川省自然科学基金资助(2022NSFSC1653);四川省财政自主创新专项(2022ZZCX089);财政部和农业农村部:国家现代农业产业技术体系资助(CARS-18-SYZ19);四川省农业科学院“1+9”揭榜挂帅科技攻关任务(Sichuan Academy of Agricultural Sciences(1+9KJGG007));四川省科技计划资助(2021YFN0097)
作者简介:王香君(1988-),女,助理研究员,硕士,研究方向为蚕桑资源综合利用。
*通讯作者:殷 浩(1980-),男,研究员,硕士,研究方向为蚕桑资源综合利用。
Isolation,identification and mixed fermentation of non-Saccharomyces from mulberry fruit
WANG Xiangjun1,PU Jun1,XIA Wenyin1,WU Jinxuan1,XIA Chuanlin1,YIN Hao1*,ZHANG Fan2,ZHANG Tao3
(1.The Sericultural Research Institute,Sichuan Academy of Agricultural Sciences,Nanchong 637000,China;2.Sichuan Shangjia Agricultural Science and Technology Co.,Ltd.,Nanchong 637000,China;3.Nanchong Lvsheng Agricultural Science and Technology Co.,Ltd.,Nanchong 637978,China)
Abstract:In order to improve the flavor of mulberry wine, the non-Saccharomyces with better aroma components from mulberry was screened and identified using the isolation and culture method,as well as to determine the tolerance of the screened strains,and the fermentation characteristics of mulberry wine were carried out.Results showed that a total of five strains (numbered as S006-01, S006-02, S007-01-S007-03) of yeast with better aroma-producing performance were obtained by morphology and molecular biology, strains S006-01, S006-02 were identified as Hanseniaspora uvarum,and strains S007-01,S007-02,S007-03 were identified as Pichia kluyveri.The tolerance resistance experiments showed that strain S007-03 was able to grow vigorously in a culture solution of 5%vol, while the growth of the remaining strains was inhibited with the increase of alcohol content,strain S006-02 had good resistance to SO2 and acid.Mixed strains of S006-02, S007-03 and Saccharomyces cerevisiae (105∶105∶107 cfu/ml)were inoculated into the fruit juice containing 330 g/L glucose,the alcohol content of the fermented liquor was 2%vol higher than that of the fermented liquor inoculated with single strain fermentation of S.cerevisiae.In the simulated mulberry juice,mixed fermentation(HJ)produced more volatile compounds with richer esters and alcohols, which mainly distributed in ethyl octanoate, ethyl decanoate, phenylethyl alcohol.The fermentation performance of H.uvarum S006-02,P.kluyveri S007-03 mixed with S.cerevisiae was better,which could increase the esters and alcohols,made the flavor and aroma of mulberry wine richer and fuller.
Key words:non-Saccharomyces;isolation and identification;tolerance;flavor;mulberry wine
桑果(Morus spp.)是卫生部公布的首批“药食同源”农产品之一,富含花青素、矿物质等营养功能成分,具有抗氧化、抗炎等作用[1-2]。《本草纲目》曾记载“桑椹捣汁饮,解酒中毒;酿酒服,利水气,消肿”,桑果酒具有桑果和生物发酵的双重营养成分[3]。
新鲜桑果转化为桑果酒是一个复杂的生态和生化过程,其涉及酵母菌、细菌、霉菌等多种微生物,它们对果酒风味的复杂性起着重要作用[4]。国外研究认为由酵母菌引起的酒精发酵是酿酒的关键,多年来一直集中分离、选择本地传统和非传统酵母来提高葡萄酒质量[5]。目前我国果酒发酵多数仍使用商业葡萄酒活性干酵母,但桑果与葡萄在营养成分上差异较大,仅使用活性干酵母严重抑制桑果中非酿酒酵母的活性,导致不同类型果酒产品同质化,不能有效突出桑果特有风味[6]。
大量研究表明,葡萄酒酿制过程中非酿酒酵母通过与酿酒酵母共同发酵来控制酒体不理想的风味或者降低酒精度来赋予葡萄酒复杂的香气,并在发酵过程中产生高级醇、低级脂肪酸和酯类等芳香化合物,突出果酒酒体的典型性[7]。ZHAO Y等[8]分析了葡萄酒自然发酵过程中非酿酒酵母的多样性,发现地区独有7种非酿酒酵母,它们可能在区域葡萄酒特征中发挥重要作用。BINATI R L等[9-10]用杆状世达梅乐酵母(Starmerella bacillaris)、发酵毕赤酵母(Pichia fermentans)等非酿酒酵母纯种发酵葡萄汁,得出非酿酒酵母不能进行完整的酒精发酵,需要与酿酒酵母(Saccharomyces cerevisiae)混合发酵。研究也得出接种多种非酿酒酵母有助于提高工业葡萄酒的香气多样性和品质[11]。因此,多位学者在葡萄自然发酵过程中筛选优质非酿酒酵母,并运用非酿酒酵母和酿酒酵母混合发酵改善葡萄酒感官特性[12-16]。VARELA C等[17]用美极梅奇酵母(Metschnikowia pulcherrima)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)与酿酒酵母混菌发酵生产低酒精度的葡萄酒(比单一酿酒酵母发酵的低1.7%vol)。LEE S B等[18]将酿酒酵母和非酿酒酵母通过鼓风干燥制作成复合发酵剂。越来越多的本地非酿酒酵母用于增加葡萄酒的复杂性和地域性。针对桑果酒中的酵母菌也开展了多项研究,孙时光等[19]从桑果中分离出一株产高级醇的酿酒酵母,产高级醇312.41 mg/L;赵祥杰等[20]从桑果、桑叶及桑果园土壤中筛选出一株优良酿酒酵母,但鲜有从本地桑果资源中分离野生非酿酒酵母的研究。
本研究从桑果资源中分离产香优良的野生非酿酒酵母,采用嗅觉识别、形态学观察,结合18S rRNA基因序列分析和构建系统发育树对菌株进行鉴定,并对菌株进行耐受性和桑果酒发酵性能分析,以期为本地酵母在桑果酒发酵中应用提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与培养基
新鲜桑果(品种“嘉陵30”、“粤椹大十”):四川省南充市嘉陵区新庙乡;酿酒酵母(Saccharomyces cerevisiae):烟台帝伯仕自酿机有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)培养基、YPD液体培养基:杭州百思生物技术有限公司。
1.1.3 试剂
细菌/真菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:ZYMO RESEARCH生物科技公司:果胶酶(>22 500 AJDU/g):烟台帝伯仕自酿机有限公司;乳酸标准品(色谱纯):上海联迈生物工程有限公司;叔戊醇标准品(色谱纯):西格玛奥德里奇(上海)贸易有限公司;甲醇(色谱纯):德国Merck公司;磷酸(分析纯):茂名市雄大化工有限公司。
1.2 仪器与设备
LZ-0.5螺旋榨汁机:温州扬名机械有限公司;BSA224S电子分析天平:德国赛多利斯公司;上海雷磁PHS-25台式精密酸度计:上海仪电科学仪器股份有限公司;SW-CJ-1D型单人净化工作台:上海苏净实业有限公司;Verity 96well聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;FR-980A凝胶成像仪:上海复日科技有限公司;UV-2550紫外可见分光光度计:日本岛津公司。
1.3 方法
1.3.1 培养液与模拟桑果汁的制备
菌种培养液:新鲜桑果(品种“粤椹大十”)破碎后去渣留汁,分别分装200 mL汁于250 mL三角瓶中,121 ℃灭菌15 min。
模拟桑果汁:新鲜桑果(品种“粤椹大十”)破碎,加二氧化硫(90 mg/L)混匀,2 h后添加果胶酶(20 mg/L)混匀,6 h后过滤得桑果汁,用白砂糖调节桑果汁的葡萄糖质量浓度至220 g/L,再分别分装2 L汁于3 L于发酵瓶中,100 ℃灭菌10 min,冷却至室温备用。高糖桑果汁调整葡萄糖质量浓度至330 g/L。
1.3.2 非酿酒酵母的筛选
课题组前期已采用内转录间隔区(internal transcribed spacer,ITS)测序技术得出不同处理桑果表面的真菌群落结构,得出-1 ℃贮藏4 d、常温贮藏4 d的桑果样品中非酿酒酵母的相对丰度较高。因此,分别取-1 ℃贮藏4 d、常温贮藏4 d的桑果样品10 g置于YPD液体培养基中24 ℃培养,分别取发酵0 d、2 d的菌种培养液及发酵6 d菌种培养液的酒泥作为各非酿酒酵母菌属的筛选样品。将-1 ℃贮藏4 d的菌种培养液各阶段取样进行10-4、10-5、10-6、10-7梯度稀释;将常温贮藏4 d的菌种培养液各阶段取样进行10-8、10-9、10-10、10-11梯度稀释。涂布于YPD固体培养基(含10%葡萄糖)上,28 ℃培养48 h。挑取具有酵母菌菌落形态特征的菌落经2~3次分离纯化,直至镜检为纯种并编号。
1.3.3 菌株的鉴定
(1)形态学鉴定:通过形态学观察进行菌株的鉴定[21-22]。挑取单菌落进行制片和草酸铵结晶紫染色,显微镜镜检观察。
(2)生化鉴定:选择具有各酵母菌细胞形态和生殖方式的单菌落接种于YPD液体培养基28 ℃培养48 h,通过嗅闻法[23-24]判断培养基产气和气味情况,筛选产气、有较浓酯香气或特殊果香气的菌株。
(3)分子生物学鉴定:用细菌/真菌DNA提取试剂盒提取菌株DNA,-18 ℃储藏备用。用通用引物NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS6(5'-GCATCACAGACCTGTTATTGCCTC-3')对菌株的18S rDNA基因序列进行PCR扩增并测序。PCR扩增体系和扩增条件参考马文锦等[25]的方法,再电泳检测扩增结果,合格后,由生工生物工程(上海)股份有限公司完成测序。将测序结果在NCBI上的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,用MEGA7.0软件采用邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.4 筛选菌株的耐受性研究
对筛选菌株进行糖度、SO2、酸度、酒精度及温度耐受性试验。分别制备不同葡萄糖质量浓度(150 g/L、200 g/L、250 g/L、300 g/L、350 g/L、400 g/L),SO2质量浓度(50 mg/L、100mg/L、150mg/L、200mg/L),pH(2、3、4、5),酒精度(5%vol、10%vol、15%vol、20%vol)的灭菌YPD液体培养基,分别接种筛选菌株,使培养基中各菌株生物量达106CFU/mL,再分别置于10℃、20℃、30℃、40℃条件下静置培养4d,在波长600nm处测定菌悬液的吸光度值,平行重复3次,并做空白对照。
1.3.5 高糖条件菌株的发酵性能
研究筛选菌株在葡萄糖质量浓度330 g/L(参考市面自然发酵果酒的最高酒精度换算得出)的桑果汁中的发酵性能。菌株按照葡萄汁有孢汉逊酵母∶酿酒酵母=105∶107CFU/mL(发酵液2),克鲁维毕赤酵母∶酿酒酵母=105∶107 CFU/mL(发酵液3),葡萄汁有孢汉逊酵母∶克鲁维毕赤酵母∶酿酒酵母=105∶105∶107 CFU/mL(发酵液4)接种于葡萄糖质量浓度330 g/L的桑果汁中,24 ℃发酵6 d分离酒脚,取上清液测定理化指标,以接种107 CFU/mL酿酒酵母(发酵液1)为空白对照[26]。
1.3.6 桑果酒的制备
将葡萄汁有孢汉逊酵母∶克鲁维毕赤酵母∶酿酒酵母=105∶105∶107 CFU/mL(HJ)接种于模拟桑果汁中,24 ℃发酵6 d分离酒脚,过滤得桑果酒,测定桑果酒理化指标,以酿酒酵母接种量107 CFU/mL(DY)为空白对照。
1.3.7 分析检测
(1)理化指标
pH值的测定采用pH计法;干浸出物、总糖(以葡萄糖计)、总酸(以酒石酸计)、挥发酸、酒精度的测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;总酯的测定参照GB/T 27588—2011《露酒》。
(2)甲醇及乳酸含量
甲醇含量的测定:参照GB/T 5009.266—2016《食品中甲醇的测定》中气相色谱法;乳酸含量的测定:参照GB/T 5009.157—2016《食品中有机酸的测定》中高效液相色谱法。
(3)挥发性风味成分
采用固相微萃取(solid-phase micro extraction,SPME)结合气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法。准确称取样品5 g于顶空进样瓶中。将SPME针管插入样品瓶中进行萃取,萃取温度50 ℃、萃取时间30 min,后取出萃取头,立即插入色谱仪进样口,250 ℃热解吸3 min后进行色谱和质谱分析。
气相色谱条件:HP-5MS毛细管柱(30 m×250 μm×0.25 μm);进样口温度230 ℃。升温程序:起始温度60 ℃,保持2min,以5℃/min上升至110℃,保持2min,再以10 ℃/min升至220 ℃,保持10 min;载气为高纯氦气(He),流速1.0 mL/min,不分流。
质谱条件:5975C型四极杆质谱仪,采用电子轰击离子源(electron impact ionization,EI),电子能量为70 eV;离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围:45~550 m/z。
定性定量方法:将采集的质谱图利用美国国家标准与技术研究院(national institute of standards and technology,NIST)14.L谱库进行检索定性,用气相色谱峰面积归一法计算各挥发性成分的相对含量。
1.3.8 数据处理
测定和分析结果采Excel 2007和SPSS 20.0进行数据处理,结果采取“平均值±标准差”形式,P<0.05认为具有显著差异。采用MEGA7.0软件绘制系统发育树。
2 结果与分析
2.1 菌株筛选结果
从-1℃贮藏4d桑果样品中筛选菌株2株,编号为S006-01、S006-02;从常温贮藏4 d桑果样品中筛选菌株3株,编号为S007-01、S007-02、S007-03。
2.2 菌株鉴定结果
2.2.1 形态学鉴定及生化鉴定
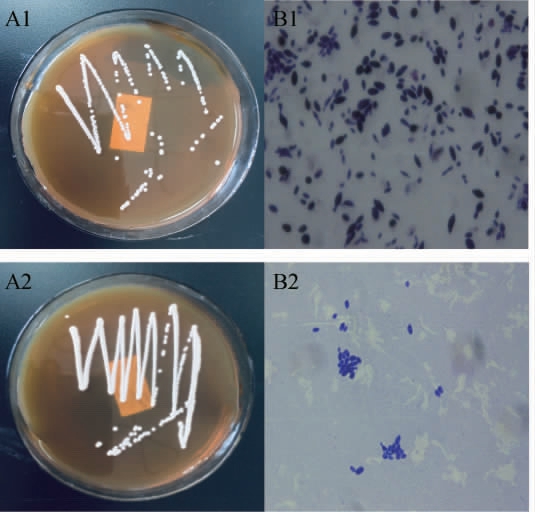
筛选菌株中代表菌株的菌落形态及细胞形态结果见图1,嗅闻结果见表1。
表1 筛选菌株的嗅闻结果
Table 1 Sniffing results of the screened strains

注:“+”表示香气浓烈程度,“+”越多表示香气越浓,“-”表示没有发酵香味。
编号 发酵液嗅觉分析 香味浓烈程度空白酿酒酵母菌株S006-01菌株S006-02菌株S007-01菌株S007-02菌株S007-03--菌落均匀分布,酒味浓,有酵母味菌落均匀分布,酒味浅、有香味菌落均匀分布,酒味浅、无特殊香味表面有层白色浮膜,有香味、香味清新表面有层白色浮膜,香味浓表面有层白色浮膜,香味浓,香味甜++++++++++++++++++
菌株S006-01、S006-02在YPD固体培养基上菌落均为乳白色、有光泽、边缘整齐、凸起、表面湿润;染色均显示细胞呈柠檬形,无性繁殖,细胞两极性出芽(见图1 A1、B1)。菌株S007-01、S007-02、S007-03在YPD固体培养基上菌落白色、表面不光滑无光泽、菌落圆形但边缘不整齐有小齿状(见图1 A2),染色显示细胞均为卵圆形或椭圆形,有性生殖,产生子囊,每个子囊内含1~4枚形状不一的子囊孢子(见图1 B2)。由表1嗅闻鉴定结果可知,5株菌均产气,有酒味,其中菌株S007-01、S007-02、S007-03在培养液表面形成一层白色浮膜,有较浓酯香;而菌株S006-01、S006-02酯香味较淡。通过菌落形态和嗅闻法初步得出,筛选菌株具有酵母菌的细胞形态和生理生化特性,均能产生酒香,且多数菌株能产生特征香气成分。
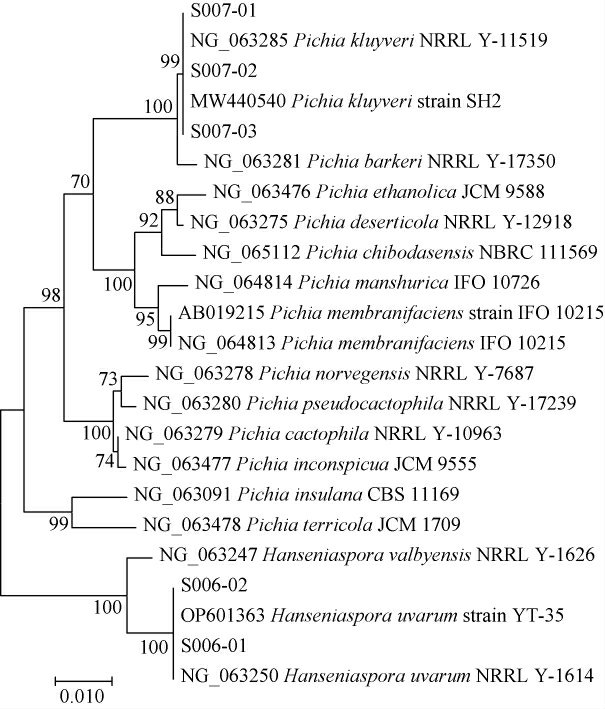
2.2.2 分子生物学鉴定
筛选菌株的系统发育树见图2。由图2分子生物学鉴定结果显示,菌株S006-01、S006-02与葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)在同一分支上,菌株S007-01、S007-02、S007-03与克鲁维毕赤酵母(Pichia kluyveri)在同一分支上。结合形态学、嗅闻、分子生物学鉴定结果,可鉴定S006-01、S006-02为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),S007-01、S007-02、S007-03为克鲁维毕赤酵母(Pichia kluyveri)。
2.3 筛选菌株的耐受性研究
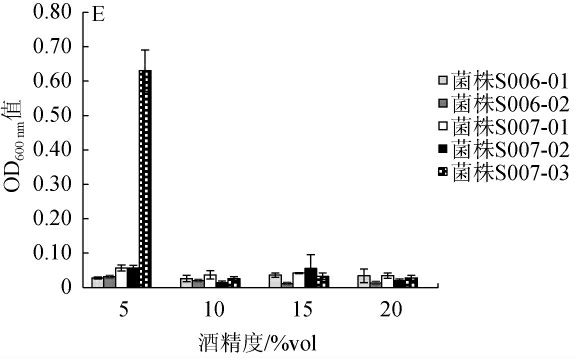
对筛选的5株菌进行温度、糖度、SO2、pH、酒精度耐受性试验,结果见图3。
由图3A可知,温度对菌株S006-01、S006-02影响较大,高低温均会抑制其生长,其在30 ℃生长较好;菌株S007-01、S007-02可耐40 ℃高温,但不耐10 ℃低温,而S007-03耐高低温,3株菌在20~30 ℃均生长旺盛。由图3B可知,5株菌在400g/L的葡萄糖质量浓度下仍能生长,随着葡萄糖质量浓度增加,菌株的OD600nm值与其呈负相关,高糖对菌株S006-01、S006-02的影响较大。由图3C可知,5株菌在含50~200 mg/L SO2的培养基中均能生长,其中菌株S007-01、S007-02、S007-03耐SO2的能力较强,而菌株S006-01、S006-02耐SO2的能力较弱,以S006-01的耐受性最弱。由图3D可知,5株菌均能在低pH值环境下生长,其中菌株S007-01、S007-02、S007-03耐低pH的能力较强,而菌株S006-01、S006-02不耐低酸,以菌株S006-01在低酸环境中生长最弱。由图3E可知,菌株S007-03耐酒精能力最强,能在酒精度5%vol的培养液中旺盛生长,其余4株菌对酒精具有不耐受性,这充分说明多数非酿酒酵母对酒精敏感,只存在于发酵的早期阶段[27]。因此如果在桑果酒发酵过程中采用葡萄酒用活性干酵母快速提升桑果汁的酒精度,会大量抑制桑果资源中非酿酒酵母的生长。
综上所述,菌株S007-03能在酒精度5%vol的培养液中旺盛生长,且对温度、糖、SO2、酸具有很好的耐受性,而菌株S007-01、S007-02随着酒精度的增加,其生长受到抑制;菌株S006-02耐SO2、耐酸能力显著高于菌株S006-01,故菌株S006-01不适合桑果酒酸性、含SO2的发酵环境。因此选择菌株S006-02、S007-03作为优良酵母菌进行下一步试验。
2.4 不同组合菌株在高糖桑果汁中发酵性能研究
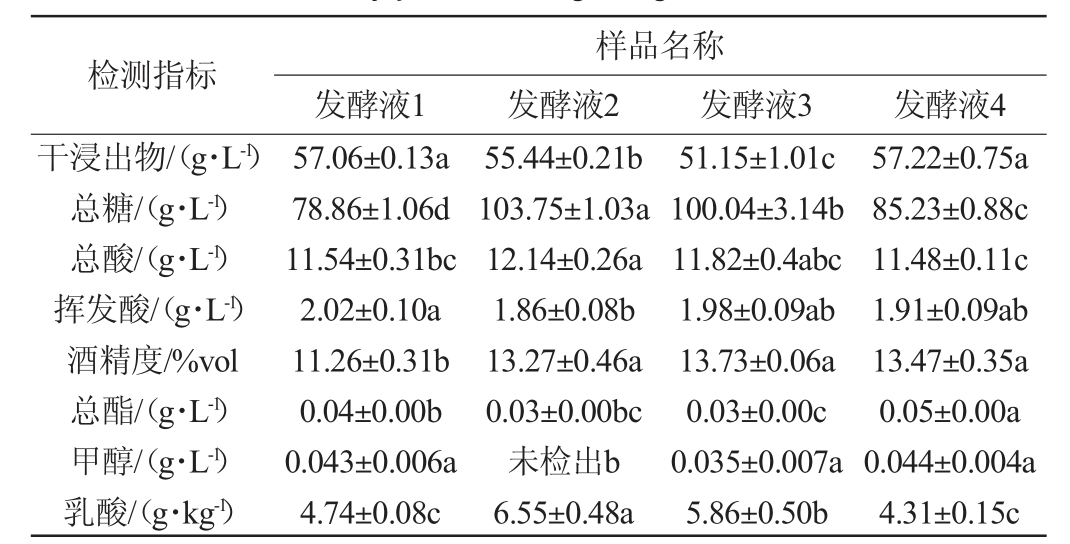
在高糖桑果汁中接种菌株S006-02、S007-03,研究其是否促进桑果酒的发酵,结果见表2。由表2可知,菌株S006-02、S007-03能在葡萄糖质量浓度330 g/L的桑果汁中生长发酵,且其均能促进桑果酒乙醇的生成,果酒酒精度均在13%vol以上,比单一酿酒酵母发酵(发酵液1)的高2%vol。经方差分析得出,相较发酵液1,发酵液4在酒精度、总酯增加方面有显著差异(P<0.05),相较发酵液2和发酵液3,发酵液4在干浸出物、总酯增加方面有显著差异(P<0.05),而发酵液2、发酵液3中总糖、乳酸含量显著高于其他样品(P<0.05),可推测菌株S006-02与S007-03具有协同发酵作用。WEI J P等[28]得出不同非酿酒酵母混合发酵时,克鲁维毕赤酵母和葡萄园有孢汉逊酵母的生长相互影响,葡萄园有孢汉逊酵母比克鲁维毕赤酵母消耗更多糖分,LIU S X等[29]也得出混菌发酵生产的越桔葡萄酒酒精度更高,与本研究结果一致。因此该研究表明,在高糖含量下,S006-02、S007-03可与酿酒酵母混菌发酵促进果酒发酵,且在降低挥发酸和生成酒精方面优于S006-02单一非酿酒酵母与酵母混菌发酵以及酿酒酵母单独发酵。
表2 高糖桑果汁中筛选菌株的发酵性能分析
Table 2 Analysis of fermentation performance of selected strains from mulberry juice with high sugar content
注:不同字母表示结果差异显著(P<0.05)。下同。
检测指标干浸出物/(g·L-1)总糖/(g·L-1)总酸/(g·L-1)挥发酸/(g·L-1)酒精度/%vol总酯/(g·L-1)甲醇/(g·L-1)乳酸/(g·kg-1)样品名称发酵液1 发酵液2 发酵液3 发酵液4 57.06±0.13a 78.86±1.06d 11.54±0.31bc 2.02±0.10a 11.26±0.31b 0.04±0.00b 0.043±0.006a 4.74±0.08c 55.44±0.21b 103.75±1.03a 12.14±0.26a 1.86±0.08b 13.27±0.46a 0.03±0.00bc未检出b 6.55±0.48a 51.15±1.01c 100.04±3.14b 11.82±0.4abc 1.98±0.09ab 13.73±0.06a 0.03±0.00c 0.035±0.007a 5.86±0.50b 57.22±0.75a 85.23±0.88c 11.48±0.11c 1.91±0.09ab 13.47±0.35a 0.05±0.00a 0.044±0.004a 4.31±0.15c
2.5 桑果酒指标的测定
2.5.1 理化指标测定
在模拟桑果汁中接种菌株S006-02、S007-03和酿酒酵母,与单一酿酒酵母发酵的酒样进行对比,分析非酿酒酵母发酵对桑果酒成分的影响,结果见表3。
表3 模拟桑果汁接种发酵后各成分变化
Table 3 Changes of components of simulated mulberry juice after inoculation and fermentation
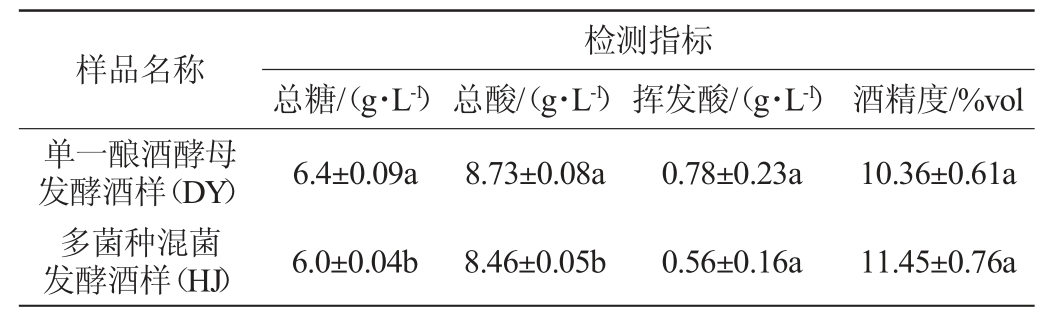
样品名称 检测指标总糖/(g·L-1)总酸/(g·L-1)挥发酸/(g·L-1) 酒精度/%vol单一酿酒酵母发酵酒样(DY)多菌种混菌发酵酒样(HJ)6.4±0.09a 6.0±0.04b 8.73±0.08a 8.46±0.05b 0.78±0.23a 0.56±0.16a 10.36±0.61a 11.45±0.76a
由表3可知,单一酿酒酵母发酵酒样(DY)中总糖、总酸显著高于接种S006-02、S007-03和酿酒酵母混菌发酵酒样(HJ)(P<0.05),而酒精度低于HJ,但不显著(P>0.05),可知多种非酿酒酵母发酵利于总酸的降低和乙醇的生成。HJ酒样中挥发酸<1 g/L,总酸<8.85 g/L,远低于表2中各发酵液的挥发酸和总酸,可知高糖会促使酿酒酵母产生高质量浓度的总酸和挥发酸,推测可能是酵母为适应高糖浓度引起的高渗透压环境,细胞内酶外溢发生反应,导致果酒总酸和挥发酸增加。
2.5.2 桑果酒挥发性成分测定
对筛选菌株发酵的酒样中挥发性成分进行分析,结果见表4。
表4 酵母菌株发酵桑果酒挥发性成分GC-MS分析结果
Table 4 Results of volatile components of mulberry fruit wine fermented by yeast strain analyzed by GC-MS
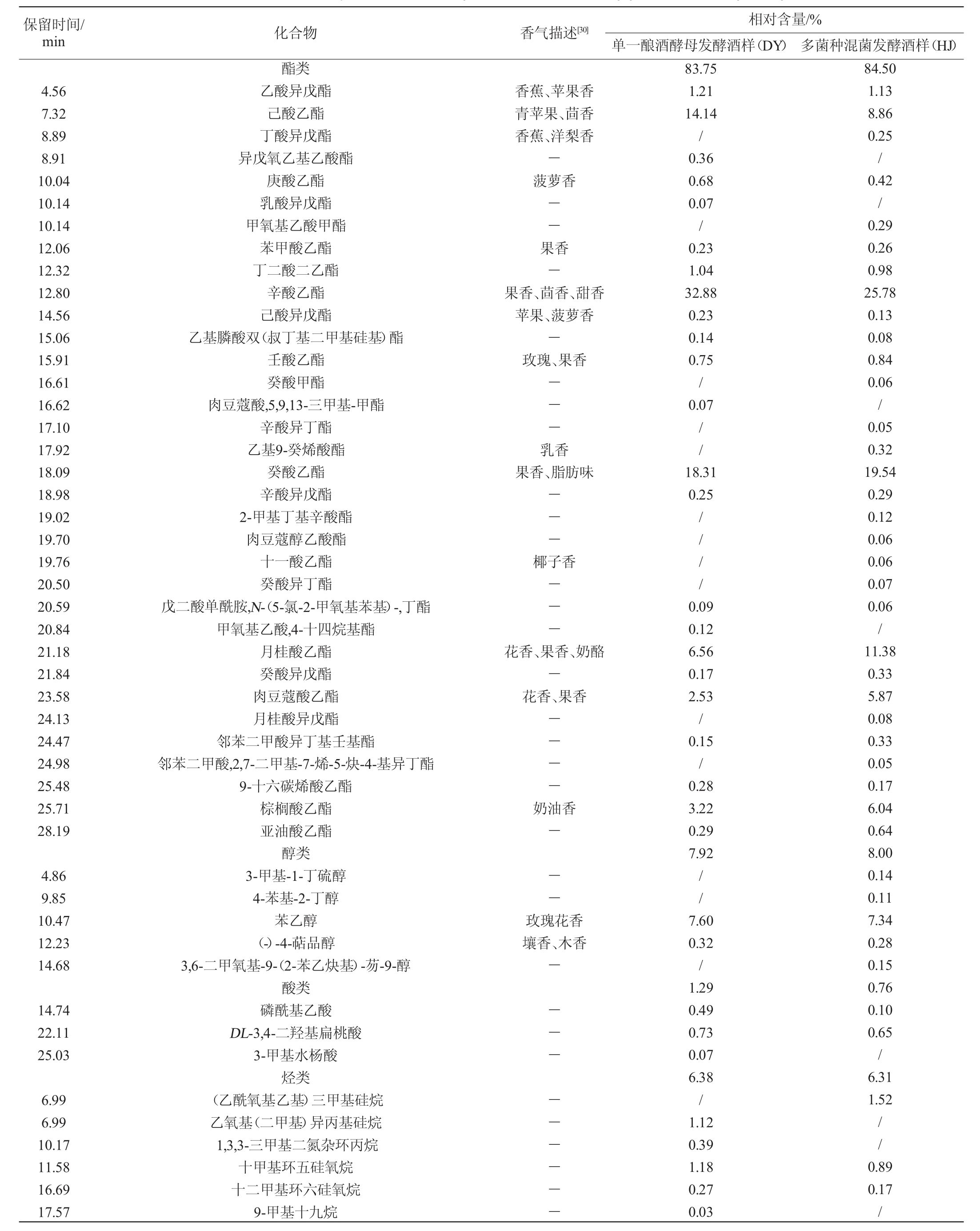
保留时间/min 化合物 香气描述[30]相对含量/%单一酿酒酵母发酵酒样(DY) 多菌种混菌发酵酒样(HJ)4.56 7.32 8.89 8.91 10.04 10.14 10.14 12.06 12.32 12.80 14.56 15.06 15.91 16.61 16.62 17.10 17.92 18.09 18.98 19.02 19.70 19.76 20.50 20.59 20.84 21.18 21.84 23.58 24.13 24.47 24.98 25.48 25.71 28.19 4.86 9.85 10.47 12.23 14.68 14.74 22.11 25.03 6.99 6.99 10.17 11.58 16.69 17.57酯类乙酸异戊酯己酸乙酯丁酸异戊酯异戊氧乙基乙酸酯庚酸乙酯乳酸异戊酯甲氧基乙酸甲酯苯甲酸乙酯丁二酸二乙酯辛酸乙酯己酸异戊酯乙基膦酸双(叔丁基二甲基硅基)酯壬酸乙酯癸酸甲酯肉豆蔻酸,5,9,13-三甲基-甲酯辛酸异丁酯乙基9-癸烯酸酯癸酸乙酯辛酸异戊酯2-甲基丁基辛酸酯肉豆蔻醇乙酸酯十一酸乙酯癸酸异丁酯戊二酸单酰胺,N-(5-氯-2-甲氧基苯基)-,丁酯甲氧基乙酸,4-十四烷基酯月桂酸乙酯癸酸异戊酯肉豆蔻酸乙酯月桂酸异戊酯邻苯二甲酸异丁基壬基酯邻苯二甲酸,2,7-二甲基-7-烯-5-炔-4-基异丁酯9-十六碳烯酸乙酯棕榈酸乙酯亚油酸乙酯醇类3-甲基-1-丁硫醇4-苯基-2-丁醇苯乙醇(-)-4-萜品醇3,6-二甲氧基-9-(2-苯乙炔基)-芴-9-醇酸类磷酰基乙酸DL-3,4-二羟基扁桃酸3-甲基水杨酸烃类(乙酰氧基乙基)三甲基硅烷乙氧基(二甲基)异丙基硅烷1,3,3-三甲基二氮杂环丙烷十甲基环五硅氧烷十二甲基环六硅氧烷9-甲基十九烷香蕉、苹果香青苹果、茴香香蕉、洋梨香-菠萝香--果香-果香、茴香、甜香苹果、菠萝香-玫瑰、果香---乳香果香、脂肪味---椰子香---花香、果香、奶酪-花香、果香----奶油香---玫瑰花香壤香、木香----------83.75 1.21 14.14/0.36 0.68 0.07/0.23 1.04 32.88 0.23 0.14 0.75/0.07//18.31 0.25// / /0.09 0.12 6.56 0.17 2.53/0.15/0.28 3.22 0.29 7.92//7.60 0.32/1.29 0.49 0.73 0.07 6.38/1.12 0.39 1.18 0.27 0.03 84.50 1.13 8.86 0.25/0.42/0.29 0.26 0.98 25.78 0.13 0.08 0.84 0.06/0.05 0.32 19.54 0.29 0.12 0.06 0.06 0.07 0.06/11.38 0.33 5.87 0.08 0.33 0.05 0.17 6.04 0.64 8.00 0.14 0.11 7.34 0.28 0.15 0.76 0.10 0.65/6.31 1.52//0.89 0.17/
续表

注:“-”表示未查询到该物质香气描述;“/”表示未检测到该化合物。
保留时间/min 化合物 香气描述[30]相对含量/%单一酿酒酵母发酵酒样(DY) 多菌种混菌发酵酒样(HJ)19.82 20.84 22.48 22.55 23.01 23.35 23.73 23.93 24.61 24.69 25.54 4.94 17.23 18.60 19.02 19.56 19.62 19.92 20.02 20.28 20.50 22.37 22.37 6.66 25.03 9.85 18.34 22.74十四甲基环七硅氧烷3-甲基十五烷十七烷姥鲛烷三十一烷十六烷基七硅氧烷植烷十八甲基环九硅氧烷正二十一烷正二十烷二十甲基环十硅氧烷苯乙烯2,6-二甲基-2,6-辛二烯石竹烯A-姜黄烯γ-衣兰油烯芳姜黄烯α-衣兰油烯β-红没药烯反-菖蒲烯Α-杜松烯1,2,3-三甲基-4-丙烯基,(E)-萘6-异丙基-1,4-二甲基萘醛类苯甲醛酮类1-(4-甲氧基苯基)-5,5-二氧六氢-5,6-噻吩并[3,4-b]吡咯-2-酮其他三(叔丁基二甲基硅氧基)砷16-甲基十七烷-1,2-二醇,三甲基硅基醚2,2',5,5'-四甲基联苯----------------------------0.33/0.06 0.15//0.85 0.52/0.04 0.13/0.12 0.16 0.14 0.06 0.09 0.11 0.06 0.35 0.08/0.14 0.28 0.28 0.00/0.34 0.17 0.18/0.31 0.09 0.12 0.28 0.04 0.07 1.31 0.46 0.13 0.04 0.09 0.24 0.08///0.06/0.06 0.17/0.19/0.33 0.33 0.06 0.06 0.04//0.04
由表4可知,经GC-MS分析和鉴定,2个酒样中共检出挥发性成分76种,接种菌株S006-02、S007-03和酿酒酵母混菌发酵酒样(HJ)中有挥发性成分60种,而单一酿酒酵母发酵酒样(DY)中仅有53种。酯类、醇类是2个酒样中最主要的挥发性组分,酯类的相对含量最高,达83%以上。2个酒样共有酯类19种,HJ中酯类比DY多7种,相对含量提高0.75%;共有醇类2种,HJ中醇类比DY多3种,相对含量提高0.08%;共有酸类2种,相对含量降低0.53%;其他共有烃类13种,醛类1种。可见,多种非酿酒酵母和酿酒酵母混菌发酵可增加桑果酒酯类、醇类物质种类和相对含量。
酯类物质是果酒的重要香气成分,大多数酯类具有花果香气,对酒体风味贡献最大[30]。2个酒样中酯类物质中相对含量较高的是辛酸乙酯、癸酸乙酯、己酸乙酯、月桂酸乙酯、棕榈酸乙酯、肉豆蔻酸乙酯,HJ酒样中酯类物质相对含量分布较均匀,月桂酸乙酯、棕榈酸乙酯、肉豆蔻酸乙酯相对含量比DY的高,这些酯类感官表现为酯香、果香、奶油香,使桑果酒香气更浓郁饱满[31]。新增酯类主要是乙基9-癸烯酸酯、丁酸异戊酯等呈果香、乳香的酯类。
2个酒样中醇类物质主要集中在苯乙醇,苯乙醇具有玫瑰花香。HJ酒样中新增醇类主要是(-)-4-萜品醇等带有壤香、木香的高级醇,少量的高级醇可增加果酒香气复杂性,有协调平衡作用,以构成酒的不同风格[32]。
虽然2个酒样中检出的烃类物质种类较多(共检出烃类物质29种),但每种烃类的相对含量均较低,相对含量>1%的烃类物质主要集中在烷烃类,其中HJ酒样中独有(乙酰氧基乙基)三甲基硅烷、植烷,植烷被认为是构成茅台酱香型酒糟香气的主要成分之一[33]。酸类、醛类、酮类物质的相对含量较低,仅HJ酒样中检测出酮类物质。可得出HJ酒样中香气丰富度优于DY。
3 结论
本研究从本土桑果资源中筛选出产香优良的非酿酒酵母5株,编号为S006-01、S006-02、S007-01、S007-02、S007-03,通过形态学和分子生物学鉴定,确定菌株S006-01、S006-02为有葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),菌株S007-01、S007-02、S007-03为克鲁维毕赤酵母(Pichiakluyveri)。菌株耐受性研究表明,2株葡萄汁有孢汉逊酵母中,菌株S006-01对SO2、酸具有不耐受性,而3株克鲁维毕赤酵母对温度、糖度、SO2、酸具有耐受性,其中菌株S007-03在耐酒精方面较突出,其能在酒精度5%vol的培养液中旺盛生长,其余菌株对酒精具有不耐受性。葡萄糖质量浓度330 g/L的桑果汁中,菌株S006-02、S007-03与酿酒酵母按照105∶105∶107 CFU/mL混菌发酵能促进桑果酒的发酵,显著提高桑果酒酒精度(P<0.05)。模拟桑果汁中,酯类和醇类是其最主要的两类挥发性组分,菌株S006-02、S007-03与酿酒酵母混菌发酵能促进酯类、醇类相对含量和种类的提高。因此,筛选菌株葡萄汁有孢汉逊酵母S006-02、克鲁维毕赤酵母S007-03与酿酒酵母混菌发酵能丰富果酒香气,使桑果酒香气更浓郁饱满。
参考文献:
[1]CHEN Y,ZHANG W J,ZHAO T,et al.Adsorption properties of macroporous adsorbent resins for separation of anthocyanins from mulberry[J].Food Chem,2016,194:712-722.
[2] LIANG L H, WU X Y, ZHU M M, et al.Chemical composition, nutritional value, and antioxidant activities of eight mulberry cultivars from China[J].Pharmacognosy Magazine,2012,8(31):215-224.
[3]李时珍.本草纲目:校点本.上册[M].北京:人民卫生出版社,1982:2066-2067.
[4]ANDORRA I,MIRO G,ESPLIGARES N,et al.Wild yeast and lactic acid bacteria of wine[M].Yeasts in Biotechnology,2019.
[5]MONACO S,CURILEN Y,MATURANO R,et al.The use of indigenous yeast to develop high-quality patagonian wines[J].Grape and wine biotechnology,2016.DOI:10.5772/64750.
[6]李双石,李浡,吴志明,等.不同酵母发酵对葡萄酒香气成分的影响[J].食品研究与开发,2012,33(11):14-18.
[7]剧柠,赵梅梅,柯媛,等.枸杞果酒用非酿酒酵母的分离筛选及香气成分分析[J].食品与发酵工业,2017,43(11):125-131.
[8]ZHAO Y,SUN Q Y,ZHU S S,et al.Biodiversity of non-Saccharomyces yeasts associated with spontaneous fermentation of Cabernet Sauvignon wines from Shangri-La wine region,China[J].Scientif Report,2021,11(1):5150.
[9]BINATI R L,INNOCENTE G,GATTO V,et al.Exploring the diversity of a collection of native non-Saccharomyces yeasts to develop co-starter cultures for winemaking[J].Food Res Int,2019,122:432-442.
[10]FERRANDO N,ARAQUE I,ORTIS A,et al.Evaluating the effect of using non-Saccharomyces on Oenococcus oeni and wine malolactic fermentation[J].Food Res Int,2020,138(pb):109779.
[11]LIU P T,LU L,DUAN C Q,et al.The contribution of indigenous non-Saccharomyces wine yeast to improved aromatic quality of Cabernet Sauvignon wines by spontaneous fermentation[J].LWT-Food Sci Technol,2016,71:356-363.
[12]ZHANG W,WENG P,WU Z.Interaction profile of a mixed-culture fermentation of Issatchenkia orientalis and Saccharomyces cerevisiae by transcriptome sequencing[J].British Food J,2023,125(6):1985-2001.
[13]李艺凡,薛逸轩,赵璐,等.一株非酿酒酵母分离鉴定及多菌种混菌发酵对葡萄酒香气的影响研究[J].食品工业科技,2018,39(11):113-120.
[14]于洋,粟春燕,陈晶瑜.3株葡萄酒非酿酒酵母的生长与发酵特性[J].食品科学,2015,36(19):106-111.
[15]WEI J P,WANG S,ZHANG Y X,et al.Characterization and screening of non-Saccharomyces yeasts used to produce fragrant cider[J].LWTFood Sci Technol,2019,107:191-198.
[16] ZHANG B Q,TANG C,YANG D Q,et al.Effects of three indigenous non-Saccharomyces yeasts and their pairwise combinations in co-fermentation with Saccharomyces cerevisiae on volatile compounds of Petit Manseng wines[J].Food Chem,2021,368:130807.
[17]VARELA C,SENGLER F,SOLOMON M,et al.Volatile flavour profile of reduced alcohol wines fermented with the non-conventional yeast species Metschnikowia pulcherrima and Saccharomyces uvarum[J].Food Chem,2016,209:57-64.
[18]LEE S B,CHOI W S,JO H J,et al.Optimization of air-blast drying process for manufacturing Saccharomyces cerevisiae and non-Saccharomyces yeast as industrial wine starters[J].Amb Express,2016,6(1):105.
[19]孙时光,左勇,张晶,等.一株低产高级醇桑椹果酒酵母的分离,鉴定[J].食品工业科技,2019,40(1):121-126.
[20]赵祥杰,杨荣玲,肖更生,等.桑椹果酒专用酵母的筛选及鉴定[J].中国食品学报,2008,8(1):60-66.
[21]魏景超.真菌鉴定手册[M].上海:上海科学技术出版社,1979.
[22]BARNETT J A,PAYNE R W,YARROW D,et al.Yeasts:Characteristics and Identification[M].Amsterdam:Elsevier,1983.
[23]赵湖冰,黎华,田野,等.一株刺梨非酿酒酵母的分离鉴定,生理特性及混菌发酵研究[J].食品工业科技,2020,41(16):120-126.
[24] GUTIERREZ A, BOEKHOUT T, GOJKOVIC Z, et al.Evaluation of non-Saccharomyces yeasts in the fermentation of wine, beer and cider for the development of new beverages[J].J I Brewing, 2018, 124(4):389-402.
[25]马文锦,李梅林,王博,等.胶红酵母Rhodotorula mucilaginosa CM-1菌株的鉴定及胞外多糖的分离纯化[J].食品与发酵工业,2021,47(21):46-52.
[26]HONG M N,LI J,CHEN Y W,et al.Impact of mixed non-Saccharomyces yeast during fermentation on volatile aroma compounds of Vidal blanc icewine[J].LWT- Food Sci Technol,2021,145(11):111342.
[27] ROCIO E V, LUCIA G A, JAVIER P, et al.Wine aroma evolution throughout alcoholic fermentation sequentially inoculated with non-Saccharomyces/Saccharomyces yeasts[J].Food Res Int,2018,112:17-24.
[28] WEI J P, ZHANG Y X, WANG Y, W et al.Assessment of chemical composition and sensorial properties of ciders fermented with different non-Saccharomyces yeasts in pure and mixed fermentations[J].Int J Food Microbiol,2019,318(C):108471.
[29]LIU S X,LAAKSONNEN O,KORTESNIEMI M,et al.Chemical composition of bilberry wine fermented with non-Saccharomyces yeasts(Torulaspora delbrueckii and Schizosaccharomyces pombe)and Saccharomyces cerevisiae in pure,sequential and mixed fermentations[J].Food Chem,2018,266(15):262-274.
[30]张秀玲,汲润,李凤凤,等.发酵工艺对蓝靛果酒功能性及香气成分的影响[J].食品科学,2022,43(10):189-198.
[31]毕静莹.柑橘酒苦味物质及其控制技术研究[D].杨凌:西北农林科技大学,2019.
[32] ANANTHAKUMAR A, VARIYAR P S, SHARMA A.Estimation of aroma glycosides of nutmeg and their changes during radiation processing[J].J Chromatogr A,2006,1108(2):252-257.
[33]张世仙,金茜,曾启华,等.茅台酱香型酒糟香气成分分析[J].中国酿造,2012,31(1):188-189.