产蛋白酶芽孢杆菌的筛选、耐酸性驯化及蛋白酶酶学性质分析
张 璋,赵腾飞,李红霞,宋露露
(茅台学院 酿酒工程系,贵州 遵义 564507)
摘 要:该研究利用透明圈法及蛋白酶活力测定从高温大曲中筛选高产蛋白酶的菌株,通过形态学观察和分子生物学技术对其进行菌种鉴定。进一步对筛选菌株的耐酸性进行驯化,并对其耐受性及所产蛋白酶酶学性质进行研究。结果表明,分离筛选到一株高产蛋白酶活力的菌株Cy3,经鉴定为蜡样芽孢杆菌(Bacillus cereus),其在最适生长pH 6条件下所产蛋白酶活性为505.0 U/mL。通过对菌株Cy3进行耐酸性驯化后,得到菌株Cy3-驯,成功将其生长pH驯化至5,培养15 h时OD600 nm值提高2.54倍。菌株Cy3-驯所产蛋白酶的最适反应温度从60 ℃提高至70 ℃,最适反应pH值为6,但活性及稳定性略有下降。菌株Cy3-驯具有较好的NaCl和葡萄糖耐受性,最高耐受含量分别为15%和60%,同时在乙醇体积分数8%以及乳酸体积分数3%时仍能生长。
关键词:蛋白酶;芽孢杆菌;分离鉴定;耐酸性驯化;酶学性质
中图分类号:TS261.1
文章编号:0254-5071(2024)01-0084-07
doi:10.11882/j.issn.0254-5071.2024.01.013
引文格式:张璋,赵腾飞,李红霞,等.产蛋白酶芽孢杆菌的筛选、耐酸性驯化及蛋白酶酶学性质分析[J].中国酿造,2024,43(1):84-90.
收稿日期:2023-05-29 修回日期:2023-07-10
基金项目:遵义市科技计划项目(遵市科合HZ字〔2021〕314号);茅台学院高层次人才科研启动经费项目(mygccrc[2022]003);遵义市科技计划项目(遵市科合HZ字〔2020〕318号);国家自然科学基金地区科学基金项目(32260229)
作者简介:张 璋(1986-),女,副教授,博士,研究方向为微生物筛选、酶学研究及蛋白质改造。
Screening and acid resistance acclimatization of protease-producing Bacillus and enzymatic characteristics analysis
ZHANG Zhang,ZHAO Tengfei,LI Hongxia,SONG Lulu
(Department of Brewing Engineering,Moutai Institute,Zunyi 564507,China)
Abstract:A high protease-producing strain was screened from high-temperature Daqu by transparent circle method and protease activity determination,and identified by morphological observation and molecular biological technique.The acid tolerance of the screened strain was further acclimated,the tolerance was analyzed,and theenzymatic characteristics of protease produced by the screened strain were studied.The results showed that thestrain Cy3 with high protease activity was isolated and screened,and identified as Bacillus cereus,and the protease activity was 505.0 U/ml under the optimal growth condition of pH 6.The strain Cy3-acclimation was obtained after acid tolerance acclimatization for strain Cy3,and its growth pH was successfully acclimated to 5,and the OD600 nm value increased by 2.54 times after culture for 15 h.The optimum reaction temperature of protease produced by strain Cy-3-acclimation was promoted from 60 ℃to 70 ℃,and the optimum reaction pH was 6.However,the protease activity and stability were slightly decreased.The strain Cy3-acclimation had high tolerance to NaCl and glucose,with the maximum tolerance mass fraction of 15%and 60%,respectively,and could still grow when the volume fraction of ethanol and lactic acid was 8%and 3%,respectively.
Key words:protease;Bacillus;isolation and identification;acid tolerance acclimation;enzymatic characteristics
白酒是我国特有的蒸馏酒,具有悠久的历史和独有的特点,在世界蒸馏酒中别树一帜。白酒酿造原料中的蛋白质经过蛋白酶降解可以形成氨基酸和多肽类物质。这些水解产物为酿酒功能微生物提供有机氮源促进生长繁殖及代谢,有益于发酵进程;同时,也是形成白酒风味的重要前体物质[1-2],白酒生产中蛋白酶的存在对白酒的产量和风味有着重要意义。蛋白酶在自然界中广泛存在,因其在食品、化学品、农业和医药等不同行业领域的普遍应用而得到广泛认可[3]。据估计,至2020年全球工业酶市场总额达到近62亿美元[4],其中蛋白酶占全球工业酶市场的60%以上[5]。
芽孢杆菌属(Bacillus sp.)属于便于培养的革兰氏阳性菌,易于进行基因操作和表达性质各异的多种酶类,适合于实验室研究及工业生产中多个方面的应用[5]。参与蛋白酶生产的芽孢杆菌包括蜡状芽孢杆菌(Bacillus cereus)、嗜热芽孢杆菌(Bacillus stearothermophilus)、莫哈韦芽孢杆菌(Bacillus mojavensis)、巨大芽孢杆菌(Bacillus megaterium)和枯草芽孢杆菌(Bacillus subtilis)等[5-6],它们具有丰富的水解酶系统,可分泌大量淀粉酶和蛋白酶,在白酒酿造中有着举足轻重的地位,也是不同香型大曲中共有的优势细菌种[7-8]。有研究表明,酒醅中的枯草芽孢杆菌产淀粉酶的能力最强,巨大芽孢杆菌产蛋白酶的能力最强[9]。芽孢杆菌在白酒发酵过程中主要的优势代谢产物是乙偶姻(3-羟基-2-丁酮)、2,3-丁二醇和酯类等芳香化合物,为酱香型白酒的复杂风味体系提供了前体物质,对白酒质量的稳定起到关键的作用[10]。
酱香型白酒传统窖池发酵过程中,窖池内的酸性物质随发酵的进行不断产生和积累,使pH值呈现不断下降的趋势。在窖池酸度下降到一定程度后,微生物的生理活动会受到严重抑制,发酵能力逐渐下降,从而对原料转化利用的效率显著降低,乃至停止[11-12]。因此,针对白酒发酵后期高酸度环境下、仍有旺盛的生理代谢活动及较高的原料转化利用率的典型功能微生物的深入研究,不仅对提升白酒的质与量有关的工艺优化有着至关重要的意义,也是对此类酿造功能微生物后续深度开发和利用的必要环节。
本研究采用福林酚-酪蛋白透明圈法对贵州仁怀茅台镇当地的酱香型白酒大曲中的芽孢杆菌进行分离筛选,结合菌株形态学观察以及16S rDNA序列测定对菌株进行鉴定,对所得菌株进行耐酸性驯化,并以蛋白酶活力为评价指标,针对耐酸性驯化前后菌株所产蛋白酶的酶学性质进行探讨,同时探索了驯化后菌种对乙醇、葡萄糖、NaCl和乳酸的耐受性,以研究耐酸性驯化对菌株所产蛋白酶的影响以及在白酒发酵酒糟降解中的应用潜能。
1 材料与方法
1.1 材料与试剂
1.1.1 样品
酱香型白酒大曲样品:贵州省仁怀市茅台镇某酒厂。
1.1.2 试剂
酵母提取物、胰蛋白胨、干酪素:北京奥博星生物技术有限责任公司;聚合酶链式反应(polymerase chain reaction,PCR)引物、PCR预混液:生工生物工程(上海)股份有限公司;氢氧化钠、碳酸钠、三氯乙酸、盐酸、乳酸、L-酪氨酸、福林酚、氯化钠、磷酸二氢钠、磷酸氢二钠、无水乙醇等试剂(均为分析纯):国药集团药业股份有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
LB固体培养基:酵母浸粉0.5 g、蛋白胨1 g、氯化钠1 g、琼脂2 g,加入100 mL超纯水后混匀,121 ℃高压蒸汽灭菌20 min。
LB奶粉培养基[13]:酵母浸粉0.5 g、蛋白胨1 g、氯化钠1 g、琼脂2 g、奶粉1 g,加入100 mL超纯水后混匀,121 ℃高压蒸汽灭菌20 min。
液体发酵培养基[14]:葡萄糖1 g,硫酸铵0.15 g,磷酸氢二钾0.15 g、磷酸二氢钾0.5 g,硫酸镁0.02 g,氯化钠0.05 g,脱脂奶粉1 g,加入100 mL超纯水后充分溶解,115 ℃高压蒸汽灭菌30 min。
1.2 仪器与设备
SW-CJ-2FD型双人单面净化工作台:浙江孚夏医疗科技有限公司;DHP-9402型恒温培养箱:上海森信实验仪器有限公司;BSD-YX3200型立式智能精密摇床、YXQ-100A型立式压力蒸汽灭菌锅:上海博讯实业有限公司;DHG-9140A型电热恒温鼓风干燥箱:常州润华电器有限公司;JNOEC XS-212-202型电子显微镜:上海圆派科学仪器有限公司;HH-2型恒温水浴锅:上海力辰邦西仪器科技公司;FA2004N型电子天平:上海菁海仪器有限公司;UV-5100型紫外可见分光光度计:上海棱光技术有限公司;PHS-3E型pH校对仪:上海仪电科学仪器股份有限公司;SIGMA-1-14型低温离心机:美国Sigma-Aldrich公司;DYY-6C型琼脂糖凝胶电泳仪:北京六一生物科技有限公司;S1000TM型PCR扩增仪:美国Bio-Rad公司。
1.3 试验方法
1.3.1 产蛋白酶菌株的分离及初筛[15]
称取1 g曲样置于15 mL离心管中,加入10 mL生理盐水混匀,然后将其置于80 ℃恒温水浴锅中水浴10 min,期间每隔2 min振荡混匀。水浴结束后取上清液用生理盐水进行梯度稀释。选取稀释度分别为10-5、10-6、10-7、10-8的上清液,以四区划线法接种至LB奶粉培养基上,30 ℃倒置培养24 h。观察筛选平板上单菌落的透明水解圈,并比较透明圈(D)和菌落(d)直径之间的比值(D/d),挑取比值大的菌落进行复筛。
1.3.2 高产蛋白酶芽孢杆菌的复筛
将挑取的菌落接种于液体发酵培养基,30 ℃、200 r/min条件下振荡培养16 h,作为种子液。将种子液稀释到OD600nm值为0.6,按照2%(V/V)的接种量转接至含有100 mL液体发酵培养基的摇瓶中,30 ℃、200 r/min条件下振荡培养24 h。发酵结束后12 000 r/min离心10 min,收集发酵上清液。测定发酵上清液中蛋白酶的活力,对产高活性蛋白酶菌株进行筛选。
1.3.3 蛋白酶活力测定
采用福林酚法测定蛋白酶活性[16]。蛋白酶活定义:1 mL蛋白酶液在40 ℃、pH 7.2的条件下,1 min水解酪蛋白产生1 μg酪氨酸所需的酶量为1个蛋白酶活力单位(U/mL)。
1.3.4 高产蛋白酶芽孢杆菌菌株的鉴定
形态观察:将产蛋白酶菌株接种至LB固体培养基上,在30 ℃条件下培养2 d后,挑取单菌落观察菌落形态,并将其接种至液体发酵培养基中,30 ℃、200 r/min条件下培养16 h后进行革兰氏染色,显微镜观察细胞形态特征。
分子生物学鉴定:采用苯酚氯仿抽提法[17]对目标菌株的基因组脱氧核糖核酸(deoxyribonucleic acid,DNA)进行提取,以其为模板,采用通用引物27F(5'-AGAGTTTGATCMTGGCTCAG-3')和1492(5'-GGTTACCTTGTTACGACTT-3')进行16S rDNA的PCR扩增。PCR扩增体系:DNA 0.5 μL,rTaq聚合酶0.5 μL,10×buffer 5 μL,脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTP)4 μL,引物27F和1492各2 μL,双蒸水(ddH2O)补足50 μL。PCR扩增条件:95 ℃预变性3 min;95 ℃变性30 s,55 ℃退火10 s,72 ℃延伸30 s,共循环35次;72 ℃再延伸7 min。PCR扩增产物经1%琼脂糖凝胶电泳检测合格后送至生工生物工程(上海)股份有限公司进行测序,测序结果提交至美国国家生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,比对结果使用MEGA 11.0生物学软件中的邻接(neighborjoining,NJ)法构建系统发育树[18-19],确定菌株的种属。
1.3.5 高产蛋白酶芽孢杆菌耐酸性驯化
驯化点的确定:将筛选得到的高产蛋白酶芽孢杆菌菌株接种至液体发酵培养基中,在30 ℃、200 r/min条件下振荡培养16 h进行活化,以2%(V/V)的接种量转接于pH值分别为7.0、6.0、5.0、4.0、3.0、2.0、1.0的液体发酵培养基扩大培养,在发酵3 h、6 h、9 h、12 h、15 h、18 h、26 h、40 h、48 h、60 h、72 h时取样,使用紫外分光光度计在波长600 nm处测定菌液的OD600 nm值,并测定蛋白酶活力,每个时间点测定三次,绘制生长曲线及酶活力曲线。
耐酸性驯化:确定驯化点pH后,将筛选菌株从驯化点pH的液体培养基内培养至OD600nm值达到0.6时,以2%(V/V)的接种量转接入低于驯化点pH 0.5的100 mL液体发酵培养基中,30 ℃、200 r/min条件下培养至OD600nm值达到0.6时,再以2%(V/V)的接种量转接入低于驯化点pH 1.0的100 mL液体发酵培养基中,30 ℃、200 r/min条件下培养,使用紫外分光光度计测定培养3 h、6 h、9 h、12 h、15 h、18 h、26 h、40 h、48 h、60 h、72 h时菌液的OD600 nm值,并测定蛋白酶活力,每个时间点测定三次,绘制生长曲线及蛋白酶酶活力曲线。
1.3.6 耐酸性驯化菌株的耐受性分析
参照文献[20-21]对驯化后的菌株进行乙醇耐受性、葡萄糖耐受性、NaCl耐受性和乳酸耐受性的测定。
1.3.7 蛋白酶粗酶的酶学性质研究[22-25]
pH对蛋白酶活力的影响:将底物用不同pH值(5.0、6.0、7.0、8.0、9.0、10.0、11.0、12.0、13.0)的缓冲液溶解配制,测定蛋白酶活力,考察pH对蛋白酶活力的影响。
蛋白酶的pH稳定性:将酶液用最适pH值缓冲液稀释后,在不同的时间点进行取样,然后在最适反应pH条件下测定残余酶活。
温度对酶活力的影响:分别在30 ℃、40 ℃、50 ℃、60 ℃、70 ℃、80 ℃条件下测蛋白酶的活力,考察温度对蛋白酶活力的影响。
蛋白酶的温度稳定性:将酶液在最适温度条件下保温,在不同的时间点进行取样,然后在最适反应温度条件下测定残余酶活。
2 结果与分析
2.1 高产蛋白酶菌株的分离及筛选
从酱香型白酒大曲中共分离得到纯培养菌株350株,以菌落的透明圈为依据进行初筛,结果筛选到160株产蛋白酶水解透明圈的菌株,其中D/d较大的17株菌株见表1。由表1可知,17株菌株的D/d为1.39~2.13,其中菌株3#的D/d最高,为2.13,其次为5#和17#,D/d分别为1.90、1.86。因此,将菌株3#、5#及17#作为初筛菌株。
表1 产蛋白酶菌株的透明圈及菌落直径比值
Table 1 Transparent circle and colony diameter ratio of proteaseproducing strains
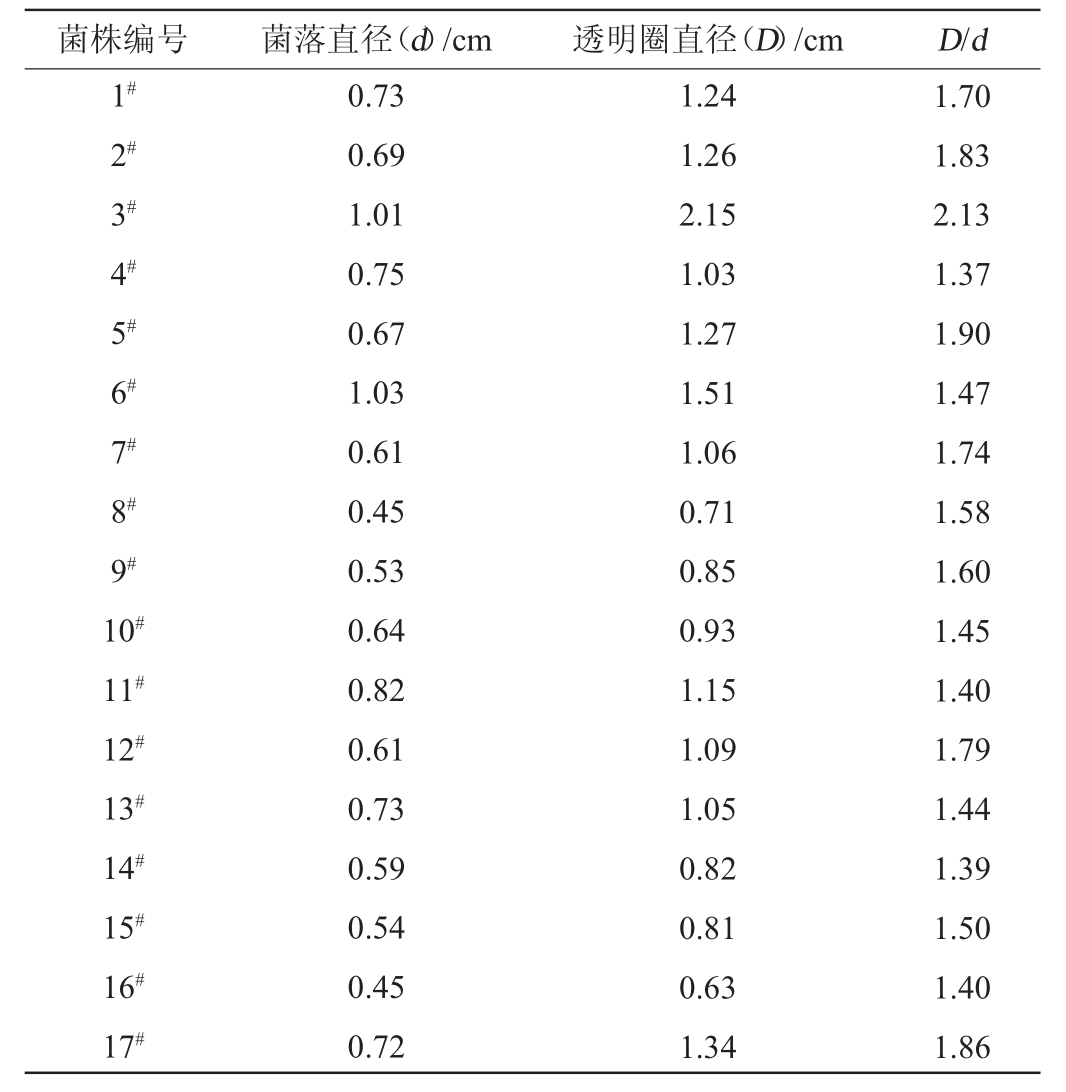
菌株编号 菌落直径(d)/cm 透明圈直径(D)/cm D/d 1#2#3#4#5#6#7#0.611.061.74 8#0.450.711.58 9#0.530.851.60 10#0.640.931.45 11#0.821.151.40 12#13#14#15#16#17#0.73 0.69 1.01 0.75 0.67 1.03 0.61 0.73 0.59 0.54 0.45 0.72 1.24 1.26 2.15 1.03 1.27 1.51 1.09 1.05 0.82 0.81 0.63 1.34 1.70 1.83 2.13 1.37 1.90 1.47 1.79 1.44 1.39 1.50 1.40 1.86
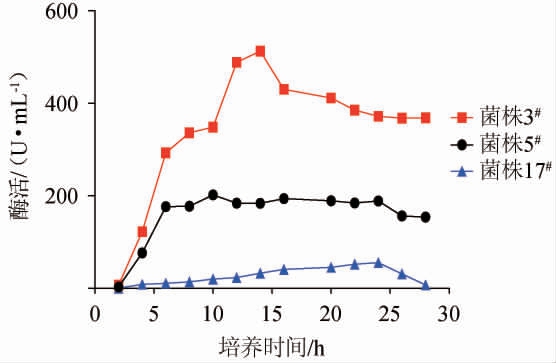
进一步对3株初筛菌株的产蛋白酶活力进行测定,筛选高产蛋白酶活力菌株,结果见图1。
由图1可知,菌株3#的的蛋白酶活力较高,其次为菌株5#,与初筛结果一致。菌株3#在培养前6 h时蛋白酶活力上升较为迅速,在培养6~10 h时酶活力上升变得平缓,在培养14 h时具有最高酶活力,达到516.0 U/mL。菌株5#在培养前6 h活性有明显上升,之后活性变化趋于平缓,在培养10 h时达到最高酶活,为201.8 U/mL。菌株17#在培养过程中蛋白酶活性总体较低,在培养24 h时达到峰值,为55.6 U/mL。因此,选菌株3#为高产蛋白酶活力的目标菌株进行研究,并命名为菌株Cy3。
2.2 菌株Cy3的鉴定
2.2.1 形态观察
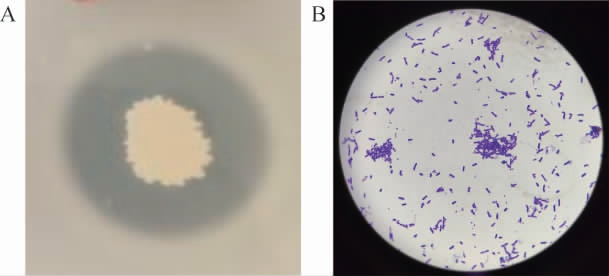
菌株Cy3的菌落及细胞形态特征见图2。由图2可知,菌株Cy3在LB奶粉培养基上的菌落呈现白色至乳白色的不透明状态,表面有褶皱,边缘无规则不平滑,菌落内部湿润且不易被挑起。菌株Cy3经革兰氏染色后结果呈阳性,细胞形态为杆状,单细胞或多细胞,可形成椭圆形或两端钝圆的芽孢。根据菌株Cy3的菌落形态和细胞形态,初步判定菌株Cy3为芽孢杆菌属(Bacillus sp.)。
2.2.2 分子生物学鉴定
基于16S rDNA基因序列构建菌株Cy3的系统发育树,结果见图3。由图3可知,菌株Cy3与蜡样芽孢杆菌(Bacillus cereus)YHNG19聚于同一分支,具有最高的序列同源性。结合形态特征,最终鉴定菌株Cy3为蜡样芽孢杆菌(Bacillus cereus)。
2.3 菌株Cy3的耐酸性驯化
2.3.1 菌株Cy3在不同pH环境下的生长情况及蛋白酶活力变化
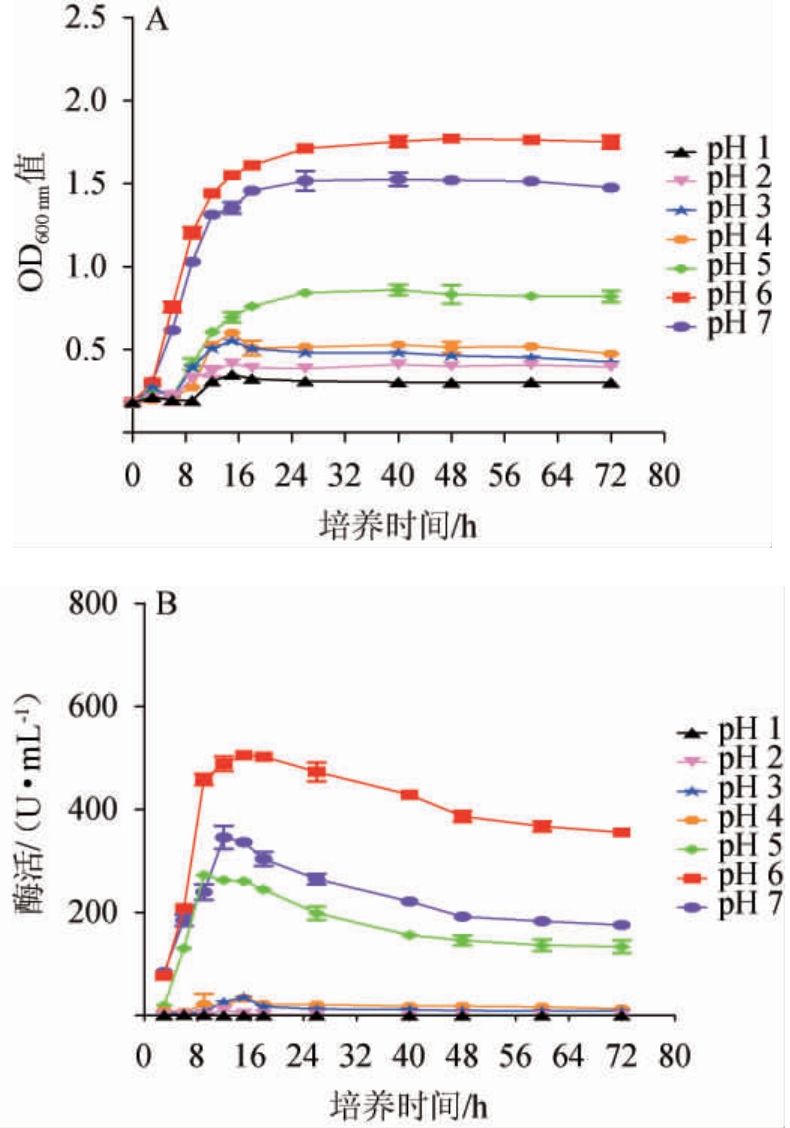
环境pH值对菌株的生长代谢有较大的影响[26],在白酒发酵过程中,由于原料在分解过程中产生酸性的代谢产物,导致酿造环境随着发酵的进行pH趋于下降的趋势,这就要求菌株具有一定的耐酸性,从而适应发酵过程中pH的不断降低[27]。菌株Cy3在不同pH条件下的生长曲线及酶活力曲线见图4。由图4A可知,菌株Cy3在pH 1~4范围内生长困难,在pH值为5时,生长活力有一定的提高,在pH值为6时具有最高的生长活力,而在pH为7时,OD600nm值又有所下降,但下降幅度不大。菌株Cy3所产蛋白酶酶活力和其生长活力具有相同的趋势,由图4B可知,在pH为1~4时,菌株Cy3所产蛋白酶酶活力极低,在pH值为5时,酶活力有一定的提升,在pH值为6时酶活力有显著的提升,在培养至15 h时可达到最高酶活505.0 U/mL。因此,选择将菌株Cy3的最适生长pH从pH 6驯化至pH 5,以期获得在较低pH环境下具有较高生长活力的驯化菌株。
2.3.2 菌株Cy3耐酸性驯化后的生长情况及蛋白酶活力变化
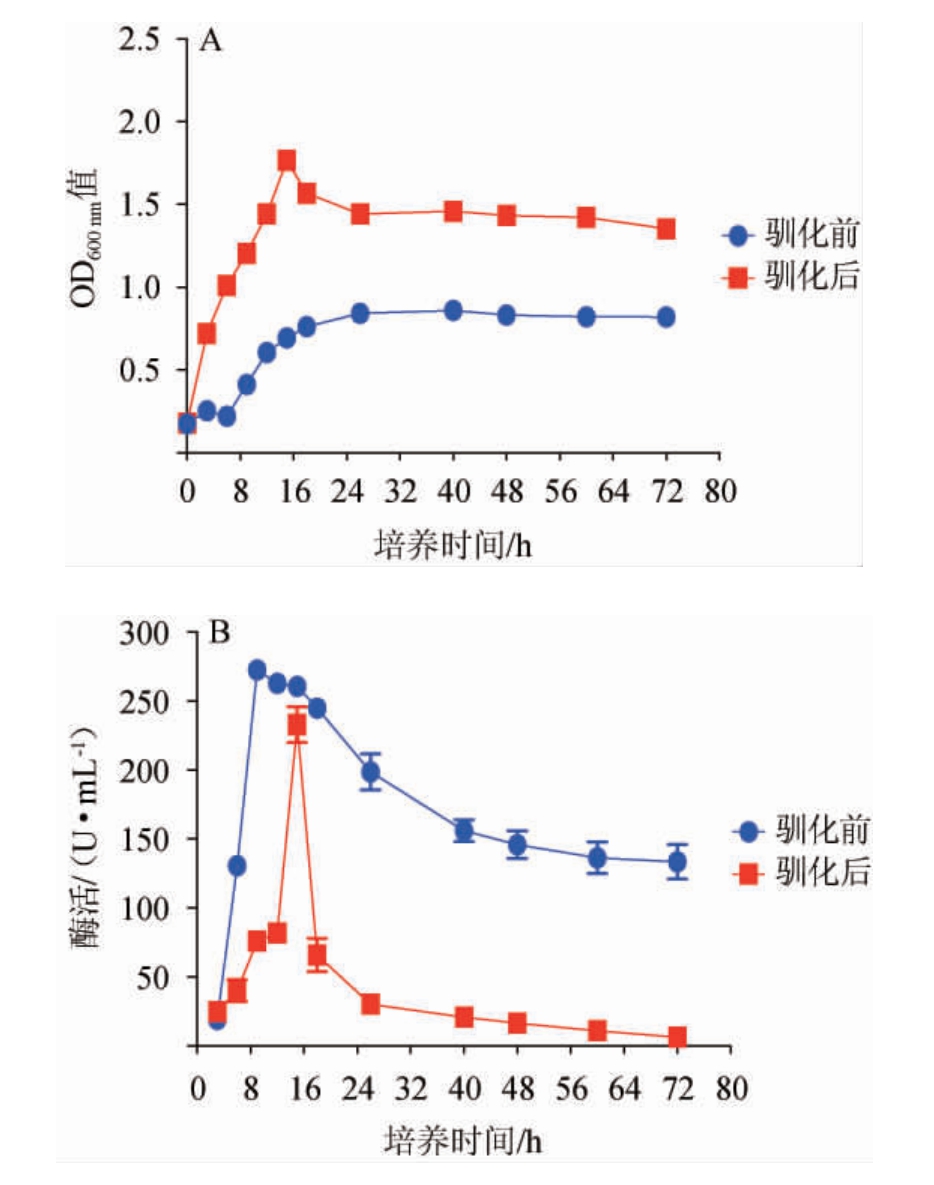
微生物的生长离不开合适的pH环境,pH会严重影响微生物生长过程中机体内发生的酶促反应。培养环境pH的急剧改变,容易引起菌种的快速死亡。因此,可使用pH缓慢改变的策略,帮助微生物逐渐适应新的生长环境。利用梯度pH降低的逐步驯化方式,将菌株Cy3从pH 6培养环境驯化至pH 5培养环境,其在驯化前后的生长曲线及酶活力曲线见图5。
由图5可知,经过驯化,成功提高了菌株Cy3在pH 5环境下的生长活性,生物量有了显著的增加。在培养15 h时达到最大生物量,OD600nm值为1.764±0.042,是驯化前的2.54倍。然而,所产蛋白酶活力有一定程度的降低,在15 h出现最大酶活,为232.9 U/mL,是驯化前最高酶活的85.5%。酶促反应的效率和pH条件有极大的关系,较低的pH环境不仅可能导致酶促反应的速率降低,甚至可能导致酶这一蛋白质类物质发生不可逆转的变性从而完全丧失活性。驯化后菌株Cy3所产蛋白酶酶活相比驯化前有所降低,极有可能是由于长期处于较低的pH环境所引起的。生长量的显著增加虽然导致酶活力微略下降,但对于促进低pH环境下菌种对原料的利用和转化,仍旧具有一定的积极意义。将驯化后的菌株Cy3命名为菌株Cy3-驯。
2.4 菌株Cy3及Cy3-驯产蛋白酶粗酶液的酶学性质分析
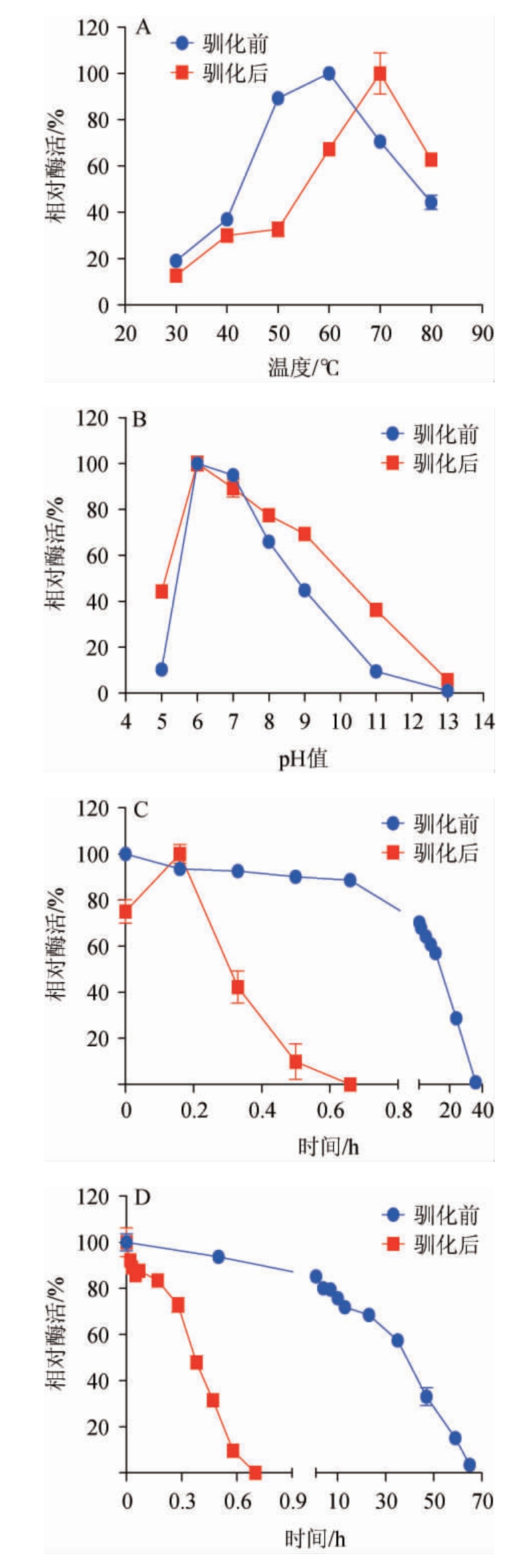
在白酒发酵过程,尤其是酱香型白酒发酵工艺中,高温制曲、高温堆积、高温发酵是整个工艺中的独特点及关键点[28]。而温度、pH等环境因素的改变对于酶的酶学性质也起着决定性的影响[29-30]。菌株Cy3、Cy3-驯产蛋白酶粗酶液的酶学性质见图6。
由图6A可知,菌株Cy3-驯所产蛋白酶的最适反应温度从60 ℃提高至70 ℃,在60~80 ℃范围内仍保留有60%以上的活性。由图6B可知,菌株Cy3-驯所产蛋白酶为中性蛋白酶,且所产蛋白酶的最适反应pH在驯化前后没有发生明显改变,但在较低pH(pH 5)下的酶活提高了约4倍。有研究表明,pH能够驱动蛋白在不同状态之间切换[31]。因此可能是因为较低的培养pH在一定程度上导致Cy3-驯菌株所产蛋白酶在酸性环境培养条件下酶的构象上产生微弱的改变,从而导致酶活性有较为明显的提高。由图6C和图6D可知,虽然菌株Cy3-驯所产蛋白酶的最适反应温度有一定的提高,但是该酶的温度稳定性及pH稳定性都有一定的下降。菌株Cy3所产蛋白酶在60 ℃保温20 h仍保留60%左右的活性,但菌株Cy3-驯在1 h内活性就基本丧失,可能是因为在70 ℃的最适温度下长时间的保温后,较高的温度对酶的空间结构有较严重的破坏,从而导致活性快速的丧失。pH稳定性也出现了同样的趋势,菌株Cy3-驯所产蛋白酶在pH 7条件下保温1 h内活性基本丧失,与pH 6条件下保温60 h仍能保留20%以上活性相比,有了明显的差异。造成这种现象的原因可能是长时间的低pH培养条件,对蛋白酶产生了不可逆转的损伤[31]。但是结合菌株Cy3-驯在较低pH下能够有较高的生长活力来看,虽然损失了部分稳定性,但较高的生长活性对原料的利用,乃至后期在酸性较大的酒糟的降解应用上,仍旧具有一定的价值。
2.5 菌株Cy3-驯的生物学特性分析
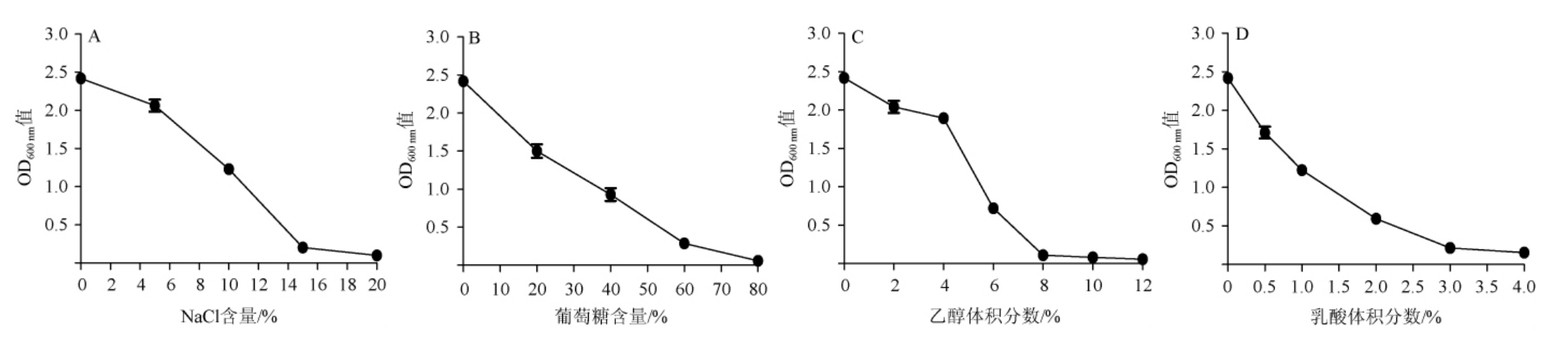
在白酒发酵过程中,菌株对于渗透压、乙醇、有机酸和葡萄糖的耐受性,直接影响了菌株对原料的利用和转化。盐浓度越高,对细胞产生的渗透压越大,越容易引起细胞水分甚至结构的变化,从而影响菌株的生物活性[32]。淀粉质原料在发酵过程中,经过淀粉酶的水解会生成较高浓度的糖,而过高的糖类也会产生较高的渗透压,从而对菌株产生危害[32]。乙醇是白酒发酵过程中非常重要的代谢产物,过高的乙醇体积分数会抑制细胞活性,甚至导致菌株的死亡[33]。同时,在白酒发酵过程中,有机酸类物质会大量累积。有机酸是酯类等风味物质的前体物质,但是有机酸含量过高又会对细胞产生严重毒害[34]。因此,白酒发酵过程中菌株对于渗透压、乙醇以及有机酸的耐受性,对发酵的效率和质量有着直接的影响。而且有研究发现,酱香型白酒酒糟中乳酸的含量高达1.84%[35]。因此以乳酸为代表考查菌株Cy3-驯对有机酸的耐受性,更有利于拓展其后期在酒糟降解中的应用。菌株Cy3-驯对NaCl、葡萄糖、乙醇及乳酸的耐受性见图7。
由图7A可知,随着NaCl含量的逐渐增大,菌株Cy3-驯生长所受到的抑制也逐渐增加,但其可耐受的NaCl含量可达15%,说明菌株Cy3-驯具有较好的耐盐性。由图7B可知,随着葡萄糖含量的不断增大,菌株Cy3-驯的生长受到一定的抑制,说明高渗透压对其生物活性产生了负面的影响,但其在葡萄糖含量达到60%~80%时,仍具有一定的生命活动,说明菌株Cy3-驯具有良好的葡萄糖耐受性,可耐受60%的葡萄糖,有利于快速适应白酒酿造复杂的酿造环境,具有良好的应用前景。由图7C可知,随着乙醇体积分数的增加,菌株Cy3-驯的生长速度逐渐下降,尤其在乙醇体积分数达到4%以后,下降的速率明显增加,但菌株Cy3-驯在乙醇体积分数12%内能够生长,在乙醇体积分数8%内具有较好的生长,这说明该菌株具有较好的乙醇耐受性,可耐受乙醇体积分数8%,能够在酿造环境中发挥较好的作用。由图7D可知,菌株Cy3-驯在乳酸体积分数4%以内,随着乳酸体积分数的增加,生长速率呈下降趋势,但在乳酸体积分数3%之内具有较好的生命活力,在3%~4%仍能生长,可见该菌株具有一定的乳酸耐受性,可耐受3%的乳酸,在白酒酿造及副产物降解利用中具有潜在的应用价值。
3 结论
该研究利用透明圈法及蛋白酶活力测定从酱香型高温大曲中分离筛选到一株高产蛋白酶活力的菌株Cy3,通过形态学观察以及分子生物学鉴定,确定该菌株为蜡样芽孢杆菌(Bacillus cereus)。菌株Cy3的最适生长pH为6,在此条件下所产蛋白酶活性为505.0 U/mL。通过对菌株Cy3进行耐酸性驯化后,得到菌株Cy3-驯,其在pH 5环境下生长活力相比驯化前有了较大幅度的提升,培养15 h时OD600 nm值提高了2.54倍;其所产蛋白酶最适反应pH为pH 6,最适反应温度从60 ℃提高至70 ℃,但酶活及稳定性受到酸性培养环境的影响有一定的降低。菌株Cy3-驯具有较好的NaCl耐受性及葡萄糖耐受性,最高耐受含量分别为15%和60%,同时在乙醇体积分数8%及乳酸体积分数3%下仍能生长。本研究对挖掘该菌株在白酒发酵乃至酒糟降解等工业应用方面奠定了一定的科学依据及理论基础。
参考文献:
[1]聂士昊,张志伟,汪俊卿,等.芽孢杆菌加强菌对酱香型白酒酒醅微生物群落及蛋白酶活力的影响[J].中国酿造,2022,41(8):137-142.
[2]刘晶晶.大曲酶系和代谢物组分析及其中产复合酶菌株的应用研究[D].北京:中国农业大学,2018.
[3]樊烂.麦芽糖α-淀粉酶和中性蛋白酶协同处理对发酵米糕食用品质的影响[D].无锡:江南大学,2023.
[4]THAKUR N,KUMAR A,SHARMA A,et al.Purification and characterization of alkaline,thermostable and organic solvent stable protease from a mutant of Bacillus sp.[J].Biocatal Agr Biotechnol,2018,16:217-224.
[5] ALNAHDI H S.Isolation and screening of extracellular proteases produced by new isolated Bacillus sp.[J].J Appl Pharm Sci, 2012, 2(9):71-74.
[6]黄晓宁,刘晶晶,韩北忠,等.基于酶学特性筛选大曲来源芽孢杆菌用于强化酿酒[J].食品科学,2021,42(10):218-224.
[7]赵才贤.酱香型白酒大曲和酒醅的微物群落结构特征及其变化规律研究[D].贵阳:贵州大学,2021.
[8]何猛超,罗家顺,罗轲,等.基于高通量技术对比分析南洲大曲与茅台大曲的细菌多样性[J].酿酒科技,2022(10):17-21.
[9]钟姝霞,邓杰,汪文鹏,等.酱香型酒醅产香芽孢杆菌的分离鉴定及其代谢产物分析[J].现代食品科技,2017,33(4):89-95,88.
[10]林群,肖之陶,付秋香,等.产香风味地衣芽孢杆菌(Bacillus licheniformis)的分离及发酵代谢产物分析[J].酿酒科技,2013(12):49-52.
[11]罗惠波,李光辉.耐酸酵母菌的筛选研究[J].四川理工学院学报(自然科学版),2004(Z1):151-154.
[12]陈剑,蒋英丽,程伟,等.酱香型白酒酒糟中耐酸产酯香细菌的筛选[J].酿酒科技,2016(2):61-64.
[13]李巧玲,李爱博,黄志远,等.一株枯草芽孢杆菌的水解酶特性及其对盐胁迫的响应[J].生态学杂志,2023,42(8):2032-2039.
[14]贾仲昕,赵佳男,季芳,等.高产中性蛋白酶芽孢杆菌的筛选鉴定及酶学性质研究[J].黑龙江畜牧兽医,2023(1):106-112,132.
[15]辛国芹,汪祥燕,曹斌,等.一株产酸凝结芽孢杆菌的筛选及耐受特性研究[J].中国酿造,2022,41(4):111-115.
[16]郑东影,陈玮,张卫卫,等.福林酚法测定酿酒白曲酸性蛋白酶活力的条件试验[J].酿酒,2020,47(2):63-66.
[17] SINGH S.DNA extraction by the utilization of phenol chloroform[J].Adv Tech Biol Med,2021,9(9):1.
[18] TAMURA K, STECHER G, KUMAR S.MEGA11: molecular evolutionarygenetics analysis version 11[J].Mol Biol Evol,2021,38(7):3022-3027.
[19] JAFFE A, AMSEL N, AIZENBUD Y, et al.Spectral neighbor joining for reconstruction of latent tree models[J].SIAM J Math Data Sci,2021,3(1):113-141.
[20] MA J, CHENG L, ZHANG Y, et al.Screening of yeasts isolated from Baijiu environments for producing 3-methylthio-1-propanol and optimizing production conditions[J].Foods,2022,11(3616):1-23.
[21]秦立芹,马景浩,李二浩,等.一株源于北派酱香白酒酿造环境中产淀粉酶细菌的筛选,鉴定及其特性研究[J].中国酿造,2021,40(11):154-160.
[22]冯菲,权淑静,刘丽,等.高产蛋白酶菌株的分离、鉴定及酶学性质研究[J].中国酿造,2021,40(7):148-152.
[23]佘新松,邵建扬,孙春巧,等.一株产耐高温蛋白酶蜡样芽胞杆菌的分子鉴定和酶学性质研究[J].核农学报,2020,34(8):1698-1704.
[24]石慧,莫晨阳,金喆昊.低温碱性蛋白酶芽孢杆菌的筛选鉴定及酶学性质研究[J].粮食科技与经济,2020,45(1):76-79.
[25]桑鹏,王肇衿,陈贵元,等.耐热蛋白酶产生菌的筛选鉴定及其酶学性质研究[J].中国饲料,2019,23:41-45.
[26]付肖蒙,王鹏飞,郝爱丽,等.高耐性酿酒酵母的筛选及其耐受性研究[J].中国酿造,2017,36(10):23-26.
[27]贾丽艳,郭晋田,刘帅,等.清香型白酒发酵过程中微生物及理化指标的变化规律[J].中国食品学报,2020,20(8):162-167.
[28]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:357-368.
[29] DANIEL R M, PETERSON M E, DANSON M J, et al.The molecular basis of the effect of temperature on enzyme activity[J].Biochem J,2010,425(2):353-360.
[30]BISSWANGER H.Enzyme assays[J].Perspect Sci,2014,1(1-6):41-55.
[31] BOYKEN S E, BENHAIM M A, BUSCH F, et al.De novo design of tunable,pH-driven conformational changes[J].Science,2019,364(6441):658-664.
[32]杨雄州,姚国强,于洁,等.工业微生物在渗透胁迫下的应激反应及保护措施[J].微生物学报,2022,62(11):4176-4187.
[33]雷毅,蒋丽娟,陈宝宝,等.不同浓度乙醇溶液杀菌效果观察[J].中国消毒学杂志,2020,37(9):656-658.
[34]谢军,孙晓红,潘迎捷,等.电解水和有机酸对虾的杀菌效果及感官品质影响[J].食品与发酵工业,2010,36(5):57-63.
[35]江思瑶,宋昊,陈晨,等.白酒酒糟中有机酸的分离提取及香气成分分析[J].食品工业科技,2019,40(17):206-211.