地皮菜不同极性萃取部位活性成分及生物活性研究
陈富章1,院珍珍1,2*,金苏宇1,李雅倩1,宋晓凡1,孙康娜1,韩丽娟1,叶 英1
(1.青海大学 农牧学院,青海 西宁 810016;2.青海大学 省部共建三江源生态与高原农牧业国家重点实验室,青海 西宁 810016)
摘 要:为研究地皮菜不同极性萃取部位活性成分含量及其抗氧化与体外抑菌作用,采用超声辅助提取法提取后得到石油醚相、乙酸乙酯相、正丁醇相和水相4个极性萃取部位。测定4个不同极性萃取部位总三萜、总黄酮和总多酚得率,以维生素C(VC)为对照,测定不同极性萃取部位对ABTS、DPPH、O2-自由基的清除能力和还原能力;用滤纸片法测定其抑菌圈大小并分析其抑菌活性。结果表明,地皮菜乙酸乙酯相总三萜、总黄酮和总多酚得率分别为0.33%、2.40%、0.67%。各极性萃取部位均有一定的抗氧化能力及抑菌活性,其中乙酸乙酯相提取物的抗氧化能力及抑菌活性最好。这为今后利用地皮菜中生物活性物质和开发地皮菜抗氧化产品提供一定的理论依据。
关键词:地皮菜;不同极性萃取物;抗氧化活性;抑菌活性
中图分类号:TS201.1
文章编号:0254-5071(2024)01-0063-06
doi:10.11882/j.issn.0254-5071.2024.01.010
引文格式:陈富章,院珍珍,金苏宇,等.地皮菜不同极性萃取部位活性成分及生物活性研究[J].中国酿造,2024,43(1):63-68.
收稿日期:2023-05-24 修回日期:2023-10-15
基金项目:省部共建三江源生态与高原农牧业国家重点实验室自主课题(2019-ZZ-03)
作者简介:陈富章(1998-),男,硕士研究生,研究方向为食品加工与安全。
*通讯作者:院珍珍(1988-),女,副教授,博士,研究方向为天然产物与功能性食品研究。
Research on active composition and biological activity in different polar extracts of Nostoc commune
CHEN Fuzhang1,YUAN Zhenzhen1,2*,JIN Suyu1,LI Yaqian1,SONG Xiaofan1, SUN Kangna1,HAN Lijuan1,YE Ying1
(1.College of Agriculture and Animal Husbandry,Qinghai University,Xining 810016,China;2.State Key Laboratory of Plateau Ecology and Agriculture,Qinghai University,Xining 810016,China)
Abstract:In order to study the active components contents in different polar extracts of Nostoc commune and their antioxidant and antibacterial effects in vitro,4 polar extracts including petroleum ether phase,ethyl acetate phase,n-butanol phase and water phase were obtained by ultrasonic-assisted extraction method.The contents of total triterpenes,total flavonoids,and total polyphenols in 4 different polar extracts were determined.Using vitamin C(VC)as the control,the radical scavenging of different polar extracts on ABTS+,DPPH,O2-free radical,and reducing power were determined.The inhibition zone size and its antibacterial activity were measured by filter paper method.The results showed that the contents of total triterpenes,total flavonoids and total polyphenols in ethyl acetate phase of N.commune were 0.33%,2.40%and 0.67%,respectively.All polar extracts had certain antioxidant activity and antibacterial activity.Among them,the extract of ethyl acetate phase had the optimal antioxidant capacity and antibacterial activity.The study provided a theoretical basis for the utilization of bioactive substances in N.commune and the development of antioxidant products of N.commune.
Key words:Nostoc commune;different polar extracts;antioxidant activity;bacteriostatic activity
地皮菜(Nostoc commune)为念珠藻属[1],又名地衣,呈现蓝墨色;通常在雨后大量出现,喜欢潮湿的环境,全国各地均有分布[2]。且其抗干旱能力较强,干旱情况下可以长期休眠[3]。地皮菜维生素、膳食纤维、矿物质元素含量丰富[4],氨基酸种类较多,易于被人体吸收利用。其不仅能为人体提供日常所需能量,还有清热明目、通便润肠[5]、降血糖[6]、抗肿瘤[7]、抑菌[8]、抗氧化[9]等作用,可作为一种潜在的天然功能性食品资源[4]。地皮菜属于固氮蓝藻,不仅能进行光合作用,还能将大气中的氮固定,为其他生物提供肥料,疏松土质,促进植物生长[10]。地皮菜在环境修复、污水处理方面也有良好的应用,可以用来吸收重金属和放射性元素[11],改善被破坏的土壤[12]。
由于外界及自身因素,人体内不断产生自由基,这对人体造成很大危害,而且可能会引发许多并发症,研究抗氧化可以有效克服其所带来的危害[13-14]。地皮菜中含有多糖[15]、黄酮[16]、多酚[17]、三萜[18]等生物活性物质,具有一定的抗氧化功效。王迎进等[19]研究表明,地皮菜提取液具有抗氧化和抑菌作用。目前,对于抑菌活性的检测主要是通过滤纸片法[20]来实现的,如赵雷等[21]通过滤纸片法得出,藜麦麸皮的正丁醇萃取层的抑菌活性最高,并得出其最低抑菌浓度和最低杀菌浓度;蔡依等[22]通过滤纸片法得出阳荷的不同极性部位萃取物对于大肠杆菌、肺炎克雷伯菌、粪肠球菌、铜绿假单胞菌和鲍曼不动杆菌的抑菌能力,分析得出了阳荷对革兰氏阳性菌和革兰氏阴性菌具有广谱抑菌活性;廖金梅等[23]通过滤纸片法研究了黄皮等23种植物的甲醇提取物对8种植物病原真菌和9种动物病原细菌的抑制作用,得出黄皮叶在植物源抑菌剂方面具有较好的开发应用价值的结论。本研究对地皮菜不同极性部位活性成分含量及抗氧化活性进行测定和比较,为进一步研究地皮菜活性成分提供参考,并为开发利用地皮菜提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 材料和菌株
地皮菜:青海海东市绿品源商贸有限公司。大肠埃希式菌(Escherichia coli)、金黄色葡萄球菌(Staphylococcus aureus)、枯草芽孢杆菌(Bacillus subtilis):广东环凯微生物科技有限公司。
1.1.2 试剂
无水乙醇、石油醚、乙酸乙酯、正丁醇(均为分析纯):天津市富宇精细化工有限公司;没食子酸、维生素C(vitamin C,VC)(纯度均>98%):上海展云化工有限公司;2,2'-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)、Na2HPO4、NaH2PO4、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、三氯乙酸、三氯化铁(均为分析纯)、芦丁、齐墩果酸标准品(纯度均>95%):上海阿拉丁生物科技股份有限公司;体积分数30%过氧化氢(分析纯):国药集团化学试剂有限公司。
1.1.3 培养基
LB液体培养基:北京奥博星生物技术有限公司:LB固体培养基:LB液体培养基中加入15 g/L琼脂。培养基灭菌条件均为121 ℃灭菌30 min。
固体培养基制备:与液体培养基相似,取LB肉汤2.0 g溶于100 mL水中,加入1.5 g的琼脂,混匀后放入灭菌锅中121 ℃下灭菌30 min,取出放在无菌台中备用。
1.2 仪器与设备
200T多功能粉碎机:永康市铂欧五金制品有限公司;HH6数显恒温水浴锅:常州市金坦友联仪器研究所;KQ-300E超声波清洗机:东莞市科桥超声波清洗器;FA2004B电子天平:上海佑科仪器仪表有限公司;SHB-Ⅲ循环水式多用真空泵、R-1001VN旋转蒸发仪:郑州长城科工贸有限公司;UV1780紫外可见分光光度计:岛精仪器有限公司;H/T16MM台式高速离心机:湖南赫西仪器装备有限公司;FSP120-AAAN2光吸收酶标仪:全汉企业股份有限公司;SW-CJ-2FD超净工作台:苏州安泰空气技术有限公司;YM50立式压力蒸汽灭菌器:上海三申医疗器械有限公司。
1.3 方法
1.3.1 地皮菜不同极性部位样品
将地皮菜于45 ℃烘箱中干燥至恒质量,研磨成粉,过60目筛,装入纱布袋中,在温度60 ℃、料液比1∶25(g∶mL)条件下,用3种不同体积分数的乙醇(95%、80%、65%)在超声功率320 W状态下超声提取2次,每次提取时间为1 h。将2次提取液用旋转蒸发仪合并浓缩至浸膏状,分别用石油醚、乙酸乙酯、正丁醇常温下进行萃取,萃取时间为0.5 h,得到不同极性部位萃取样品,剩余为水相样品。
1.3.2 活性成分含量的测定
(1)总三萜
按照宋晓凡等[24]的方法绘制齐墩果酸标准曲线。以吸光度值(Y)与齐墩果酸标准品质量浓度(X,mg/mL)进行线性回归,得回归方程Y=75.26X+0.007 9,相关系数R2=0.998 7。按照标准曲线回归方程计算样品中总三萜含量。
总三萜得率=总三萜含量/样品质量×100%。
(2)总黄酮
按照宋晓凡[16]等的方法绘制芦丁标准曲线。以吸光度值(Y)与芦丁标准品质量浓度(X,mg/mL)进行线性回归,得线性回归方程Y=12.39X+0.000 8,相关系数R2=0.999 6。按照标准曲线回归方程计算总黄酮含量。
总黄酮得率=总黄酮含量/样品质量×100%。
(3)总多酚
参考景炳年等[25]的方法绘制标准曲线,以没食子酸标准品的吸光度值(Y)与质量浓度(X,mg/mL)进行线性回归,得回归方程Y=249.64X+0.043 4,相关系数R2=0.997 8。按照标准曲线回归方程计算总多酚含量。
总多酚得率=总多酚含量/样品质量×100%。
1.3.3 体外抗氧化活性测定方法
ABTS+、DPPH自由基清除能力、还原能力:按宋晓凡等[16]的方法测定;超氧阴离子自由基清除率按尼格尔热依·亚迪卡尔等[26]的方法测定。
1.3.4 体外抑菌活性测定方法
(1)菌种活化及菌悬液制备
用体积分数75%的酒精擦拭存放大肠埃希式菌、金黄色葡萄球菌、枯草芽孢杆菌的试剂瓶,从中取出少量干燥菌种于LB液体培养基中,振荡混匀后取少量菌液涂布于LB固体培养基,37 ℃培养24 h。
取3个100 mL用超净台紫外灯灭菌30 min的锥形瓶,装入30 mL无菌的LB液体培养基,分别用接菌环在LB固体培养基均匀刮取一环已经活化的大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌置于锥形瓶中,封口放入摇床,160 r/min振荡培养,制成1×108 CFU/mL的菌悬液。培养完成后,放在4 ℃冰箱中备用。
(2)滤纸片制备
取四个极性萃取部位的浸膏于试管中,用无菌蒸馏水配制成质量浓度64 mg/mL的溶液,再利用二倍稀释法[21]将地皮菜的不同极性部位配制为8个质量浓度。将已灭菌的6 mm药敏片分别放入8个质量浓度梯度的地皮菜不同极性部位样液中浸泡1 h,备用。
(3)抑菌试验
移液枪取100 μL上述制备的菌悬液均匀涂布在琼脂平板表面,制成大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌含菌平板。取浸泡过地皮菜不同极性部位样液的6 mm药敏片贴在含菌平板上,每个培养皿各3片浸过同一种浓度样液的滤纸片。以无菌蒸馏水为空白对照组。将处理过的含菌平板置于恒温培养箱中,37 ℃恒温培养24 h后,测量并记录抑菌圈的直径;再将培养皿放入37 ℃恒温培养箱中培养24 h后,测量并记录抑菌圈直径。
1.3.5 数据处理
所有实验均重复3次,采用SPSS 26软件对实验数据进行分析,以“平均值±标准差”表示;作图采用Origin 9.9.0软件绘制。
2 结果与分析
2.1 不同极性萃取部位活性成分总含量
地皮菜不同极性萃取部位总三萜、总黄酮、总多酚得率如表1所示。
表1 地皮菜不同极性萃取部位总三萜、总黄酮及总多酚得率比较
Table 1 Total triterpenes, total flavonoids, and total polyphenols yields of different polar extracts of Nostoc commune
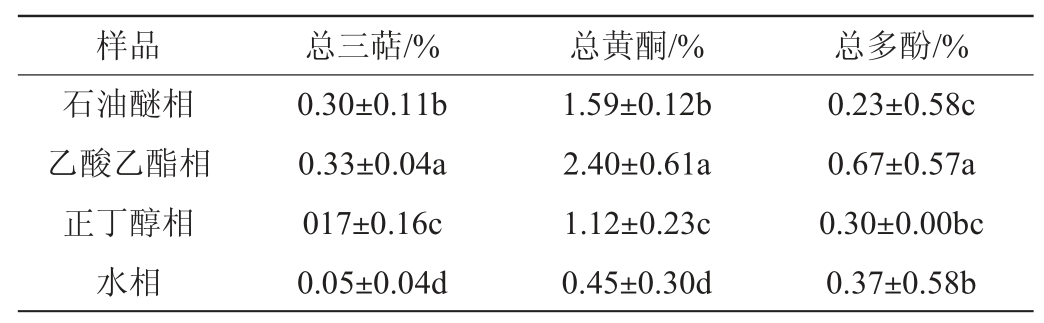
注:同列小写字母不同,表示差异显著(P<0.05)。
样品 总三萜/% 总黄酮/% 总多酚/%石油醚相乙酸乙酯相正丁醇相水相0.30±0.11b 0.33±0.04a 017±0.16c 0.05±0.04d 1.59±0.12b 2.40±0.61a 1.12±0.23c 0.45±0.30d 0.23±0.58c 0.67±0.57a 0.30±0.00bc 0.37±0.58b
由表1可知,地皮菜提取物各极性萃取部位均含有三萜、黄酮和多酚,其中乙酸乙酯相的总三萜、总黄酮、总多酚含量最高,分别为0.33%、2.40%、0.67%。总三萜和总黄酮含量在不同极性萃取部位从高到低依次均为乙酸乙酯相>石油醚相>正丁醇相>水相;乙酸乙酯相和石油醚相总三萜含量之间差异显著(P<0.05),总多酚含量在不同极性萃取部位从高到低依次为乙酸乙酯相>水相>正丁醇相>石油醚相。朱萱萱等[27-28]的研究也表明,乙酸乙酯相提取得到的活性成分含量最高,总三萜、总黄酮在水相中的含量最低;石油醚相中总多酚含量最少,为0.24%。李芳龙等[29]的研究中,总多酚石油醚相含量同样最低。利用不同极性部位提取不同原材料中活性成分时,乙酸乙酯相活性成分含量最高,这可能是乙酸乙酯相的极性大小最适合用于提取活性成分;而活性成分含量最低的萃取相不同原材料是不一样的。
2.2 不同极性萃取部位活性成分抗氧化能力
2.2.1 地皮菜不同极性萃取部位提取物对ABTS+·的清除能力
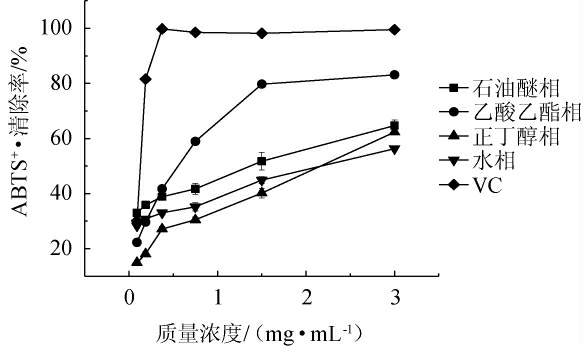
由图1可知,当地皮菜不同极性萃取部位提取物质量浓度为0.09~3.00 mg/mL时,对ABTS+·清除能力随着提取质量浓度的增大而增大。当提取物质量浓度为3.00 mg/mL时,石油醚相清除率为64.66%,乙酸乙酯相清除率为83.08%,正丁醇相清除率为62.31%,水相清除率为56.28%。地皮菜不同极性萃取部位提取物不同质量浓度范围内的抗氧化活性也具有较大差别,在0.09~0.188 mg/mL时,乙酸乙酯相的ABTS+·清除率低于石油醚相和水相,VC清除率由30.15%增加至81.57%;在0.188~0.38 mg/mL时,正丁醇相和乙酸乙酯相ABTS+·清除率快速增加,石油醚相和水相清除率增速较为缓慢,VC的ABTS+·清除率达到99.77%;提取物质量浓度在0.38~3.00 mg/mL时,乙酸乙酯相清除ABTS+·的能力逐渐增大,超过石油醚相和水相,表现出较强的清除能力,VC的清除率也保持在98%以上,这与黄小凤等[30]的研究相似。在质量浓度为0.09~1.50 mg/mL时,正丁醇相的ABTS+·清除率较石油醚相、乙酸乙酯相、水相均低,表明在此浓度范围内,正丁醇相较其他三种极性萃取部位ABTS+·清除能力最弱。综上所述,表明地皮菜对ABTS+·有一定的清除能力。不同极性萃取部位对ABTS+·的清除能力总体从强到弱依次为乙酸乙酯相>石油醚相>水相>正丁醇相。
2.2.2 地皮菜不同极性萃取部位提取物对DPPH·的清除能力
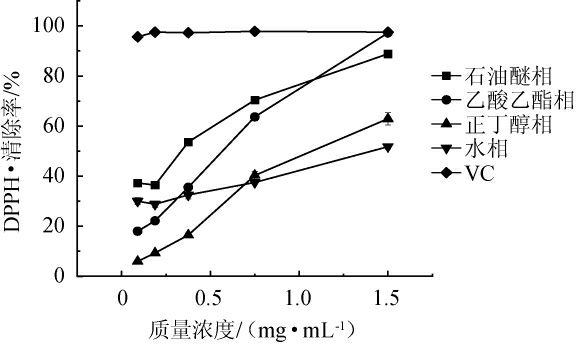
由图2可知,当提取物质量浓度为1.50 mg/mL时,石油醚相DPPH·清除率为88.82%,乙酸乙酯相的清除率为97.22%,正丁醇相的清除率为62.9%,水相的清除率为51.76%。提取物质量浓度在0.09~0.375 mg/mL,石油醚相的DPPH·清除率高于其他三相的清除率;提取物质量浓度在0.375~1.50 mg/mL时,随着质量浓度逐渐增大,石油醚相、乙酸乙酯相、正丁醇相、水相的样品对DPPH·的清除能力也大幅增强,其中乙酸乙酯相增幅最为明显,当提取物质量浓度达到1.50 mg/mL时,其清除率与VC基本相似,表明此时乙酸乙酯相的样品有极强的DPPH·的清除能力。提取物质量浓度在0.09~1.50 mg/mL时,VC的DPPH·清除率均在95%以上。陈石梅等[31]的研究中关于DPPH·的清除率,除石油醚相清除率较低,其他萃取相结果与本研究相似。
2.2.3 地皮菜不同极性萃取部位提取物还原能力
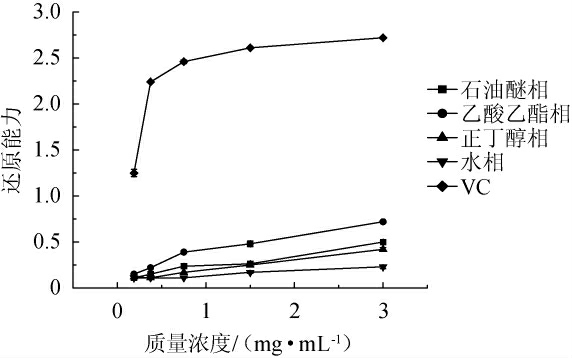
由图3可知,地皮菜石油醚相、乙酸乙酯相、正丁醇相、水相4种不同极性萃取部位的样品在质量浓度为0.19~3.00 mg/mL范围内,还原能力较弱,远远低于对照组VC的还原能力,与李莎莉等[32]研究中的还原能力相似,整体偏低。在样品质量浓度为0.188~0.75 mg/mL时,随着质量浓度的增大,4个极性萃取部位样品的还原能力都有不同程度的增大,VC的还原能力由1.25增加至2.46;在0.75~3 mg/mL浓度范围内,乙酸乙酯相还原能力远大于其他三相,VC的还原能力都在2.46以上。在质量浓度为3.00 mg/mL时,石油醚相还原能力为0.50,乙酸乙酯相还原能力为0.72,正丁醇相还原能力为0.42,水相还原能力为0.23。还原能力总体效果不太显著,但是不同萃取相之间,还是乙酸乙酯相还原能力最强。各极性部位样品还原能力的强弱依次为:乙酸乙酯相>石油醚相>正丁醇相>水相。
2.2.4 地皮菜不同极性萃取部位提取物对O2-·的清除能力
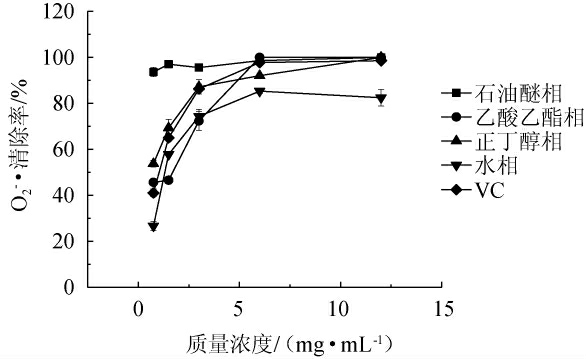
由图4可知,当提取物质量浓度为12 mg/mL时,地皮菜石油醚相、乙酸乙酯相、正丁醇相的O2-·清除率均为100%,水相清除率为82.45%。当质量浓度为0.75~3.00 mg/mL时,石油醚相清除率高于其他三相,正丁醇相清除率高于VC;质量浓度为3.00~12.00 mg/mL时,对O2-·有较强的清除作用,其清除率均>55%,其中石油醚相最为突出,始终保持在96%左右,VC与乙酸乙酯相清除率与石油醚相近。随着不同极性部位样品浓度逐渐增大,各极性部位样品的清除率也有不同程度的升高,水相的清除率变化幅度最大,乙酸乙酯相、正丁醇相次之,石油醚相变化幅度最小。
2.3 地皮菜不同极性萃取部位活性成分抑菌作用
2.3.1 地皮菜不同极性萃取部位提取物对大肠杆菌的抑制作用
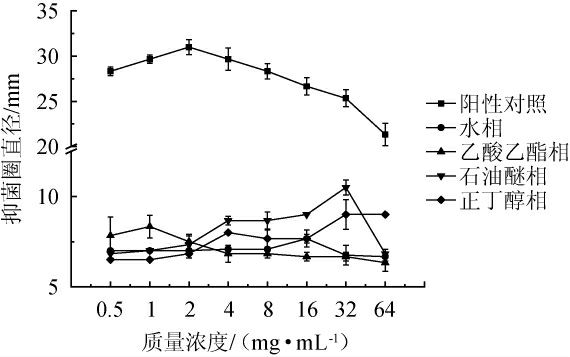
由图5可知,地皮菜不同极性萃取部位提取物对于大肠杆菌均有抑菌作用。样品质量浓度为0.5~2.0 mg/mL时,乙酸乙酯相有较高的抑菌活性,这与郭菡等[33]的研究相似;而在质量浓度为2.0~32.0 mg/mL时,石油醚相有较高的抑菌活性;在质量浓度为32.0~64.0 mg/mL时,石油醚相抑菌活性降低,正丁醇相抑菌活性没有发生变化。与阳性对照组相比,地皮菜不同极性部位提取物的抑菌活性相对较弱。地皮菜乙酸乙酯相、正丁醇相、石油醚相、水相提取物质量浓度分别为1 mg/mL、4 mg/mL、32 mg/mL、16 mg/mL时对大肠杆菌的抑制效果最好。
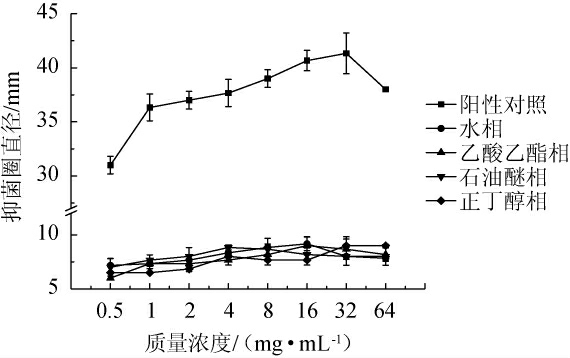
2.3.2 地皮菜不同极性萃取部位提取物对枯草芽孢杆菌的抑制作用
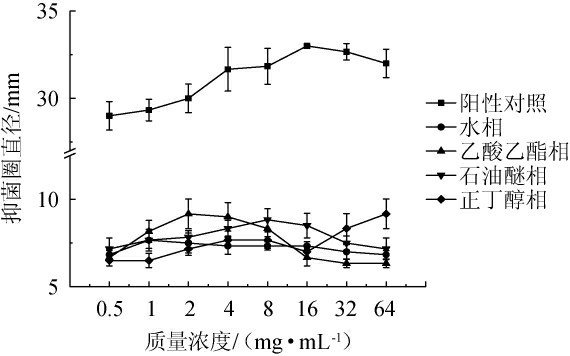
由图6可知,四种极性萃取部位对于枯草芽孢杆菌均有抑菌作用,质量浓度为0.5~4 mg/mL时,四个极性部位对于枯草芽孢杆菌的抑制作用相对较弱,当质量浓度为4~16 mg/mL时,除正丁醇相外,其他三相对于枯草芽孢杆菌的抑制作用均达到最高;在质量浓度为16.0~64.0 mg/mL时,正丁醇相抑菌活性增加,其他三相都有所降低。同时,与阳性对照组相比地皮菜不同极性部位的抑菌活性相对较弱。由图6亦可知,乙酸乙酯相对于枯草芽孢杆菌的抑制效果最好的质量浓度为16 mg/mL,正丁醇相对于枯草芽孢杆菌抑制效果最好的质量浓度为8 mg/mL,石油醚相对于枯草芽孢杆菌抑制效果最好的质量浓度为4 mg/mL,水相对于枯草芽孢杆菌抑制效果最好的质量浓度为8 mg/mL。
2.3.3 地皮菜不同极性萃取部位提取物对金黄色葡萄球菌的抑制作用
由图7可知,四种极性萃取部位对于金黄色葡萄球菌均有抑菌作用,且在质量浓度为0.5~1.0 mg/mL时,四种极性萃取部位对于金黄色葡萄球菌的抑制效果均较差,相较于其他两相来说,乙酸乙酯相和水相的抑菌效果对于浓度的变化更加敏感;在质量浓度为1.0~4.0mg/mL时,乙酸乙酯相抑菌活性大于其他三相;在质量浓度为4.0~64.0 mg/mL时,乙酸乙酯相抑菌活性逐渐降低。同时,与阳性对照组相比地皮菜不同极性萃取部位的抑菌活性相对较弱。由图7亦可知,乙酸乙酯相对于金黄色葡萄球菌的抑制效果最好的质量浓度为2 mg/mL,正丁醇相对于金黄色葡萄球菌抑制效果最好的质量浓度为4 mg/mL,石油醚相对于金黄色葡萄球菌抑制效果最好的质量浓度为8 mg/mL,水相对于金黄色葡萄球菌抑制效果最好的质量浓度为1 mg/mL。
3 结论
地皮菜石油醚相、乙酸乙酯相、正丁醇相、水相的样品中都含有活性物质成分,且活性成分含量与抗氧化活性具有一定差异。且乙酸乙酯相较其他三个极性萃取部位活性物质含量最高,说明乙酸乙酯相是地皮菜抗氧化主要的极性部位。通过对抗氧化活性的测定可知地皮菜石油醚相、乙酸乙酯相、正丁醇相、水相的样品对ABTS+·、DPPH·、O2-·均具有较好的清除能力和一定的还原能力,在一定的浓度范围内呈现线性增长,且乙酸乙酯相抗氧化能力高于其他相。乙酸乙酯相总黄酮含量较高,而且每个极性部位总黄酮含量普遍高于总三萜和总多酚,推断由于乙酸乙酯相总黄酮含量高,从而导致乙酸乙酯相抗氧化活性也均高于其他相。
通过地皮菜不同极性萃取部位对同一菌种抑菌效果比较发现,石油醚相对于大肠杆菌的抑制效果最好,乙酸乙酯相对于金黄色葡萄球菌的抑制效果最好,而四种极性部位对于枯草芽孢杆菌抑制作用相当,且在较低浓度时,乙酸乙酯相对于三种菌的抑制作用均比其极性部位要好。综上所述,乙酸乙酯相提取物的抗氧化活性和抑菌活性都较好,可以用乙酸乙酯相作为地皮菜相关功能性产品研发的主要成分。同时也为以后地皮菜相关方面的研究奠定基础。
参考文献:
[1]刘梦.地皮菜中抗溃疡性结肠炎活性成分的开发及应用[D].桂林:桂林医学院,2021.
[2]东方,王鑫,张梦媛,等.地皮菜糖蛋白-硒复合物的制备、结构表征及抗氧化性研究[J].食品科技,2021,46(11):244-251.
[3]郭敏.地皮菜活性多糖的制备及其抗大肠癌效应研究[D].太原:山西大学,2019.
[4]王瑶.地皮菜的人工液体培养及其藻蓝蛋白的分离纯化[D].西安:西北大学,2012.
[5]赵秀玲,刘永杰.地皮菜挥发油的化学成分及抗氧化性研究[J].云南大学学报(自然科学版),2017,39(3):454-462.
[6]LI Z Y,GUO M.Healthy efficacy of Nostoc commune Vaucher[J].Oncotarget,2018,9(18):14669-14679.
[7]樊妙珍,罗珍华,王慧登,等.地皮菜抗三阴性乳腺癌作用活性成分的发现与靶点验证[J].中国现代应用药学,2023,40(18):2484-2491.
[8] WANG H B, WU S J, LIU D.Preparation of polysaccharides from cyanobacteria Nostoc commune and their antioxidant activities[J].Carbohydr Polym,2014,99:553-555.
[9]DIAO Y,ZHANG Y L,HAN H B.In vitro antimicrobial activities of Nostoc commune extracts[J].Environ Earth Sci Res J,2015,2(4):1-4.
[10]HIROSHI K,JUN F,KAORI T Y,et al.Isolation and purification of an axenic diazotrophic drought-tolerant cyanobacterium, Nostoc commune,from natural cyanobacterial crusts and its utilization for field research on soils polluted with radioisotopes[J].BBA-Bioenergetics,2012,1817(8):1499-1505.
[11]ATOKU D I,OJEKUNLE O Z,TAIWO A M,et al.Evaluating the efficiency of Nostoc commune,Oscillatorialimosa and Chlorella vulgarisin a phycoremediation of heavy metals contaminated industrial wastewater[J].Scie Afr,2021,12:e00817.
[12] LEONG Y K, CHANG J S.Bioremediation of heavy metals using microalgae: Recent advances and mechanisms[J].Bioresource Technol,2020,303:122886.
[13] SHON M Y, KIM T H, SUNG N J.Antioxidant and free radical scavenging activity of Phellinus baumii (Phellinus Hymenochaetaceae) extracts[J].Food Chem,2003,82(4):593-597.
[14]郭新颖,史玉坤,陈峰,等.5种中药提取物清除自由基的体外抗氧化活性研究[J].化学工程师,2019,33(9):74-77.
[15]GUO M, DING G B, GUO S J, et al.Isolation and antitumor efficacy evaluation of a polysaccharide from Nostoc commune Vauch[J].Food Funct,2015,6(9):3035-3044.
[16]宋晓凡,李岩,张一茹,等.地皮菜总黄酮提取工艺优化及抗氧化活性评价[J].食品科技,2021,46(12):201-216,223.
[17] NINOMIYA M, SATOH H, YAMAGUCHI Y, et al.Antioxidative activity and chemical constituents of edible terrestrial alga Nostoc commune Vauch[J].Biosci Biotech Biochem,2011,75(11):2175-2177.
[18]包海鹰,刘丹,图力古尔,等.地衣的化学成分及药理活性研究进展[J].吉林农业大学学报,2015,37(4):379-389.
[19]王迎进,解晶晶,孙幸,等.地皮菜提取液的抗氧化性及抑菌作用研究[J].食品研究与开发,2020,41(4):58-62.
[20]张笮晦,钱信怡,黄广智,等.肉桂和同源根皮不同极性部位的成分分析及其抑菌效果[J].林产化学与工业,2019,39(3):115-122.
[21]赵雷,丁葵英,郑星,等.藜麦麸皮不同极性部位的抑菌及酪氨酸酶抑制活性研究[J].食品工业科技,2019,40(6):82-88,94.
[22]蔡依,郭百臻,徐津林,等.阳荷不同极性部位体外抑菌活性研究[J].食品研究与开发,2018,39(19):36-39,103.
[23]廖金梅,邓业成,邓志勇,等.黄皮等23种植物提取物的抑菌活性研究[J].河南农业科学,2022,51(5):84-95.
[24]宋晓凡,李岩,院珍珍,等.响应面法优化地皮菜总三萜提取工艺及其抗氧化活性[J].食品研究与开发,2023,44(4):86-91,106.
[25]景炳年,魏磊,王伟,等.响应面优化亚麻荠饼粕多酚提取工艺及其抑菌和抗氧化活性研究[J].中国食品添加剂,2022,33(6):37-44.
[26]尼格尔热依·亚迪卡尔,邓淑萍,白玉,等.超声辅助提取薰衣草总三萜的工艺优化及体外抗氧化活性研究[J].食品工业科技,2022,43(3):172-179.
[27]朱萱萱,刘晓谦,梁曜华,等.金樱根提取物不同极性部位的体外抗氧化活性考察及其化学成分分析[J].中国实验方剂学杂志,2021,27(8):117-125.
[28]林秋生,陈莹,于海宁,等.三种菱壳不同极性部位提取物的生物活性[J].食品工业科技,2013,34(2):139-142,146.
[29]李芳龙,阿呷尔布,李家东,等.水柏枝乙醇提取物不同极性部位体外抗氧化活性研究[J].四川农业大学学报,2021,39(4):512-517.
[30]黄小凤,刘泽干,雷攀,等.柴胡不同极性部位的体外抗氧化活性研究[J].中南药学,2021,19(2):203-208.
[31]陈石梅,黄比翼,黄锁义.草果醇提物不同极性部位的体外抗氧化活性研究[J].中国药房,2020,31(8):953-956.
[32]李莎莉,徐帅,聂进卓,等.韭菜不同极性部位抗氧化活性研究[J].食品科技,2019,44(1):286-290.
[33]郭菡,徐溶蔓,原梦,等.杜仲叶乙醇提取物抑菌试验[J].河南科技大学学报(自然科学版),2023,44(4):91-98,9-10.