高温大曲中葡萄球菌多样性解析及其分离株鉴定
程驰新笑1,2,贺子豪1,2,郭 壮1,2,田龙新2,3,周加平2,3,刘菊珍2,3,王玉荣1,2*
(1.湖北文理学院 湖北省食品配料工程技术研究中心,湖北 襄阳 441053;2.襄阳市酱香型白酒固态发酵企校联合创新中心,湖北 襄阳 441053;3.酱香型白酒固态发酵襄阳市重点实验室,湖北 襄阳 441614)
摘 要:为探究湖北襄阳地区不同颜色高温大曲中葡萄球菌(Staphylococcus)多样性,该研究通过下载并筛选葡萄球菌属相对含量>10%的样品序列,采用Illumina MiSeq高通量测序技术和传统纯培养技术相结合的方法对大曲中葡萄球菌多样性进行解析。结果表明,高温大曲中葡萄球菌相对含量>10%的样品共有13份,包括7份黑色大曲、4份黄色大曲和2份白色大曲,葡萄球菌基因序列相对丰度占所有原核生物的14.33%~74.19%。多样性分析表明,黑色大曲中葡萄球菌丰富度和多样性均显著偏高(P<0.05),且不同颜色高温大曲中葡萄球菌群落结构差异显著(P<0.05)。操作分类单元(OTU)分析表明,高温大曲中共有OTU 5个,累积平均相对含量达到91.38%。传统纯培养技术表明,腐生葡萄球菌(Staphylococcus saprophyticus)是黑色、黄色和白色大曲中共有的可培养菌种,亦是高温大曲中葡萄球菌的主要可培养菌种。由此表明,黑色大曲中葡萄球菌丰富度和多样性更高,且腐生葡萄球菌为高温大曲中葡萄球菌的主要可培养菌种。
关键词:高温大曲;葡萄球菌;高通量测序;操作分类单元;传统培养技术
中图分类号:TS261.1
文章编号:0254-5071(2024)01-0057-06
doi:10.11882/j.issn.0254-5071.2024.01.009
引文格式:程驰新笑,贺子豪,郭壮,等.高温大曲中葡萄球菌多样性解析及其分离株鉴定[J].中国酿造,2024,43(1):57-62.
收稿日期:2023-06-04 修回日期:2023-07-12
基金项目:襄阳市重大科技计划项目(2021AAS003037);湖北文理学院教师科研能力培育基金“科技创新团队”(2020kypytd009)
作者简介:程驰新笑(2003-),男,本科生,研究方向为食品生物技术。
*通讯作者:王玉荣(1993-),女,讲师,博士,研究方向为食品生物技术。
Diversity analysis and isolation strains identification of Staphylococcus in high-temperature Daqu
CHENG Chixinxiao1,2,HE Zihao1,2,GUO Zhuang1,2,TIAN Longxin2,3,ZHOU Jiaping2,3,LIU Juzhen2,3,WANG Yurong1,2*
(1.Hubei Provincial Engineering and Technology Research Center for Food Ingredients,Hubei University of Arts and Science,Xiangyang 441053,China;2.Xiangyang Jiangxiang Baijiu Solid State Fermentation Enterprise-School Joint Innovation Center,Xiangyang 441053,China;3.Xiangyang Key Laboratory of Solid State Fermentation of Jiangxiang Baijiu,Xiangyang 441614,China)
Abstract:In order to further explore the diversity of Staphylococcus in high-temperature Daqu of different colors in Xiangyang,Hubei Province, the sample sequences with the relative content of Staphylococcus>10% were downloaded and screened, and the diversity of Staphylococcus in Daqu was analyzed by using Illumina MiSeq high-throughput sequencing technology and combining with traditional pure culture techniques.The results showed that there were 13 samples with a relative content of Staphylococcus>10% in high-temperature Daqu, including 7 black Daqu, 4 yellow Daqu,and 2 white Daqu.The relative abundance of Staphylococcus gene sequence accounted for 14.33%-74.19%of all prokaryotes.Diversity analysis showed that the abundance and diversity of Staphylococcus in black Daqu were significantly higher (P<0.05), and the community structure of Staphylococcus in high-temperature Daqu with different colors showed significant differences(P<0.05).Operational taxonomic unit(OTU)analysis showed that there were 5 OTU in high-temperature Daqu,with a cumulative average relative content of 91.38%.Traditional pure culture techniques indicated that Staphylococcus saprophyticus was a common cultivable strain in black,yellow,and white Daqu,and was also the main cultivable strain of Staphylococcus in high-temperature Daqu.The results indicated that the abundance and diversity of Staphylococcus were higher in black Daqu,and S.saprophyticus was the main cultivable strain of Staphylococcus in high-temperature Daqu.
Key words:high-temperature Daqu;Staphylococcus;high throughput sequencing;operational taxonomic unit;traditional pure culture techniques
高温大曲又称为酱香大曲或茅台大曲,是以茅台为代表的酱香型白酒酿造过程中重要的糖化剂和发酵剂[1]。传统高温大曲以纯小麦作为主要原料,采用人工踩曲的方式完成曲胚的制作,并在相对开放的环境中进行固态发酵,富集了制曲环境、原料和曲母来源的微生物以及制曲工具和踩曲工人携带的微生物,经过较长时间的堆积发酵形成独特的菌群结构[2]。高温大曲堆积发酵过程中,曲心温度最高可达到65 ℃,且由于不同曲块在曲房中的位置不同,各个曲块所处的温度、湿度、氧含量等微环境有所不同,从而导致成品曲块的颜色存在差异[3]。其中,分布于上层和边层的曲块,与空气接触较多且水分散发快,主要呈现白色,位于中层的曲块,可利用氧浓度较低、温度较高且湿度较大,主要呈现黑色,位于下层的曲块则多呈现为黄色。SHI W等[3]对同一车间黑色、黄色和白色高温大曲微生物菌群进行分析发现,葡萄球菌属(Staphylococcus)在所有大曲中均存在,且与大多数含量丰富的挥发物呈现正相关。SHANG C H等[4]对高温大曲和酒醅中细菌多样性进行分析亦发现,Staphylococcus是高温大曲和酒醅样品的优势细菌属之一。由此可知,Staphylococcus在高温大曲中分布较为广泛,进一步探究不同颜色高温大曲中Staphylococcus群落结构是很有必要的。
Staphylococcus大多数为非致病菌,少数为致病菌,在自然界中分布广泛,尤其适宜在家禽动物的体表、肠道黏膜以及饲养加工环境中生长繁殖[5]。因此,Staphylococcus是大多数传统发酵食品中较为常见的细菌微生物之一,且对食品的色泽、风味和滋味品质以及安全性具有不可忽视的作用[6-7]。胡传旺等[8]从日式酱油发酵的酱醪体系中分离出耐盐的Staphylococcus sp.,其在高盐条件下代谢产生更多的挥发性物质。龙强等[9]通过调查研究发现,Staphylococcus不仅可以作为肉制品产良好风味的发酵剂,而且还具有降低生物胺含量、促进肉制品安全发酵的特性。生物胺广泛存在于葡萄酒、啤酒和白酒等发酵酒中,其含量过高会导致摄入者产生呼吸紊乱、头痛心悸等一系列不良应激反应,严重情况下可能引起大脑出血,甚至呼吸骤停[10]。因此,进一步探究高温大曲中Staphylococcus群落结构及其物种分布,对白酒的风味品质及其安全性可能具有一定的积极作用。
本研究团队前期对采集自湖北襄阳地区的黑色、黄色和白色高温大曲细菌多样性进行分析发现,Staphylococcus在不同颜色高温大曲中分布广泛,且是其优势细菌属之一。基于此,本研究筛选出葡萄球菌相对含量>10%的大曲样品,对黑色、黄色和白色大曲中Staphylococcus群落结构进行比较分析,并采用传统纯培养技术对高温大曲中可培养Staphylococcus进行分离鉴定,以期为襄阳地区高温大曲核心微生物的解析以及白酒风味品质的提升提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
高温大曲(黑色、黄色和白色大曲各10份):采自湖北省襄阳市某酱香型白酒厂。从中筛选出优势细菌属Staphylococcus相对含量>10%的样品,共获得13份高温大曲样品。其中,黑色高温大曲7份,编号为H1、H3、H4、H6、H7、H8和H10,黄色高温大曲4份,编号为Y2、Y4、Y5和Y7,白色高温大曲2份,编号为B1和B7。
1.1.2 化学试剂
脱氧核糖核酸(deoxyribonucleic acid,DNA)基因组提取试剂盒:德国QIAGEN公司;引物27F/1495R和M13F/M14R:天一辉远(武汉)生物科技有限公司;10×聚合酶链式反应(polymerase chain reaction,PCR)Buffer、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphates,dNTPs)Mix、DNA聚合酶:北京全式金生物技术有限公司;Axygen清洁试剂盒:康宁生命科学(吴江)有限公司;2×PCR Buffer、rTaq酶和克隆载体pMDR18-T Vecto:宝生物工程大连有限公司。
1.1.3 培养基
LB培养基:青岛海博生物技术有限公司。
1.2 仪器与设备
800Y粉碎机:永康市铂欧五金制品有限公司;Veriti FAST梯度PCR仪:美国ABI公司;DYCP-31DN型琼脂糖凝胶电泳仪:北京六一生物科技有限公司;Power Edge R930架式服务器:美国DELL公司;Illumina MiSeq高通量测序平台:美国Illumina公司。
1.3 试验方法
1.3.1 生物信息学分析
采用实验室自编脚本,将纳入本研究的13份高温大曲样品中隶属于Staphylococcus的测序序列提取出来,经过合并处理后使用QIIME(v1.9.1)平台对测序数据进行分析,主要流程包括序列校准与质控、操作分类单元(operational taxonomic units,OTU)划分与物种注释以及Staphylococcus群落α多样性与β多样性分析[11-13]。
1.3.2 高温大曲中葡萄球菌的分离鉴定
参考QI N S等[14]的方法并略做修改,称取10 g高温大曲样品于装有90 mL无菌生理盐水的锥形瓶中,充分混匀后进行倍比稀释。取梯度(10-5、10-6和10-7)稀释液100 μL涂布于LB固体平板上,37 ℃恒温培养48 h观察其菌落形态,挑取疑似葡萄球菌的单菌落进行2~3次纯化,使用30%甘油于-80 ℃条件下冻存。
参考ZHANG Z D等[15]的方法,对分离株进行DNA提取和16SrDNAPCR扩增。PCR扩增体系(25μL):DNA模板1μL,rTaq酶0.5 μL,2.5 mmol/L dNTPs Mix 2 μL,5 μmol/L 27F和1495R各0.5 μL,10×PCR buffer 2.5 μL,用双蒸水(ddH2O)将体系补充到25 μL;PCR扩增条件:94 ℃预变性4 min;94 ℃变性1 min,55 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃延伸10 min,4 ℃结束。通过琼脂糖凝胶电泳检测PCR扩增产物,对扩增合格的PCR产物进行清洁、连接和转化,之后挑选阳性克隆子送往上海桑尼生物科技有限公司进行鉴定,将测序返回的有效序列上传至美国国家生物技术信息中心(national center for biotechnology information,NCBI)网站的GenBank数据库中进行同源性比对。
1.3.3 数据处理与可视化分析
使用Excel2016进行数据整理,应用Past3软件中Kruskal-Wallis检验对不同颜色高温大曲之间的α多样性指数进行分析,应用多元方差分析(multivariate analysis of variance,MANOVA)对不同颜色高温大曲中的Staphylococcus群落结构进行分析,使用R(v4.1.0)软件和Origin 2017进行数据可视化分析,使用BioEdit7.2和MEGA7.0软件构建系统发育树。
2 结果与分析
2.1 不同高温大曲样品的葡萄球菌多样性分析
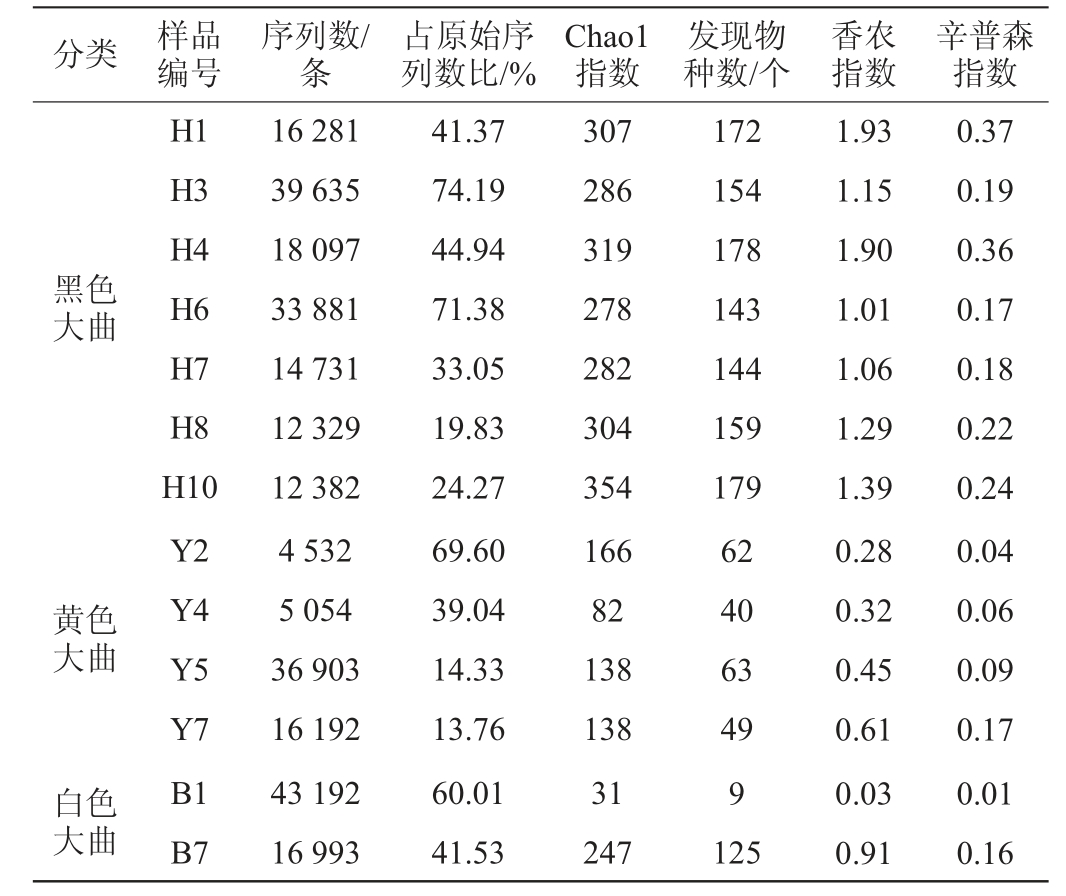
本研究首先利用UPARSE算法按照97%相似度阈值对高温大曲样品中所有Staphylococcus序列进行OTU划分,并使用QIIME软件对大曲中Staphylococcus的α多样性指数进行分析,包括Chao1指数、发现物种数、香农指数和辛普森指数。其中,Chao1指数和发现物种数常用于样品中群落丰富度的评估,香农指数和辛普森指数常用于样品中群落多样性的评估,数值越大表明群落丰富度或多样性越高[16]。13份高温大曲样品中Staphylococcus的序列统计和α多样性指数见表1。
表1 高温大曲样品中Staphylococcus的序列统计和α多样性指数分析
Table 1 Sequence statistics and α diversity index analysis of Staphylococcus in high-temperature Daqu samples
分类 样品编号序列数/条占原始序列数比/%Chao1指数发现物种数/个香农指数辛普森指数黑色大曲黄色大曲白色大曲H1 H3 H4 H6 H7 H8 H10 Y2 Y4 Y5 Y7 B1 B7 16 281 39 635 18 097 33 881 14 731 12 329 12 382 4 532 5 054 36 903 16 192 43 192 16 993 41.37 74.19 44.94 71.38 33.05 19.83 24.27 69.60 39.04 14.33 13.76 60.01 41.53 307 286 319 278 282 304 354 166 82 138 138 31 247 172 154 178 143 144 159 179 62 40 63 49 9 125 1.93 1.15 1.90 1.01 1.06 1.29 1.39 0.28 0.32 0.45 0.61 0.03 0.91 0.37 0.19 0.36 0.17 0.18 0.22 0.24 0.04 0.06 0.09 0.17 0.01 0.16
由表1可知,13份高温大曲样品中Staphylococcus基因序列相对丰度占所有原核生物的13.76%~74.19%,可用于后续Staphylococcus多样性分析。由表1亦可知,当测序量为4 010条序列时,黑色大曲中Staphylococcus的Chao1指数、发现物种数、香农指数和辛普森指数均明显偏高,其次是黄色大曲和白色大曲。经过Kruskal-Wallis检验发现,3种颜色高温大曲中Chao1指数、发现物种数、香农指数和辛普森指数差异均显著(P<0.05)。由此表明,黑色大曲样品中Staphylococcus丰富度和多样性均显著偏高(P<0.05)。
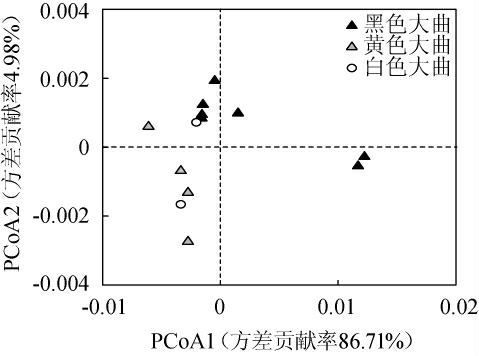
为探究不同颜色高温大曲中Staphylococcus的分布情况,本研究基于OTU加权UniFrac距离的主坐标分析(principal co-ordinates analysis,PCoA),进一步对黑色、黄色和白色大曲样品进行了空间排布,结果见图1。
由图1可知,基于加权UniFrac距离PCoA1和PCoA2的方差贡献率分别为86.71%和4.98%,累计方差贡献率高达91.69%,可有效解释样品之间的差异。由图1亦可知,黑色大曲和黄色大曲样品之间具有明显的分离趋势,而白色大曲与其他两组样品之间均具有重叠。经过多元方差分析发现,三种颜色高温大曲中Staphylococcus群落结构差异显著(P<0.05)。由此表明,与上述α多样性分析结果一致,不同颜色高温大曲中Staphylococcus群落结构存在明显差异。
本研究团队前期通过对黑色、黄色和白色大曲中细菌类群进行分析发现,Staphylococcus在不同颜色高温大曲中平均相对含量均>10%,是高温大曲中具有绝对优势的细菌属,且Staphylococcus亦是黑色大曲中细菌群落的生物标志物[17]。周志立[18]通过对绍兴黄酒生麦曲的群落结构进行解析发现,较之机制曲,手工曲在发酵初期Staphylococcus丰度更高,这主要与手工曲制作过程中踩曲工人脚部携带的细菌相关,这可能也是导致纳入本研究的不同颜色高温大曲中富含Staphylococcus群落结构的重要原因。此外,Staphylococcus作为一类需氧型或兼性厌氧型革兰氏阳性球菌,具有较强的抵抗力和耐受性[19],而曲房中间层的温度更高且氧气含量更低,对大部分不耐高温和需氧型微生物的生长繁殖具有一定的抑制作用,从而可能对分布于曲房中间层黑色大曲中Staphylococcus的含量产生影响。
2.2 不同颜色高温大曲中葡萄球菌的OTU分析
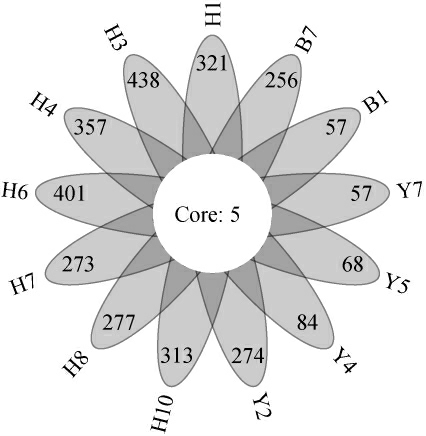
通过选取OTU中具有代表性的基因序列与数据库进行同源性分析,从而实现OTU水平的物种分类。若某一个OTU在所有样品中均存在,则将其定义为核心OTU[20]。黑色、黄色和白色大曲样品中隶属于Staphylococcus的OTU分布情况见图2,高温大曲中核心OTU及其平均相对含量见图3。
由图2可知,黑色大曲样品中OTU数最高,在273~438个之间,黄色大曲中OTU数在57~274个之间,白色大曲中OTU数分别为57个和256个。经过Kruskal-Wallis检验发现,三种颜色高温大曲中OTU数差异显著(P<0.05)。已有研究显示,OTU数目可以用来评估样品中群落物种丰富度,OTU数目越多,表明群落物种丰富度越高[21]。由此表明,与表1分析结果一致,黑色大曲中Staphylococcus丰富度显著偏高(P<0.05)。由图2亦可知,13份高温大曲中共有5个核心OTU。
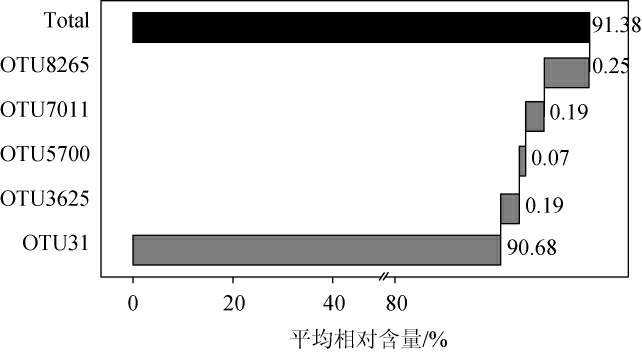
由图3可知,高温大曲中隶属于Staphylococcus的5个核心OTU分别为OTU31、OTU3625、OTU5700、OTU7011和OTU8265,平均相对含量分别为90.68%、0.19%、0.07%、0.19%和0.25%,累计平均相对含量达到91.38%。其中,OTU31可被鉴定到种水平,隶属于腐生葡萄球菌(Staphylococcus saprophyticus)。通常情况下,生物学分类系统包括界、门、纲、目、科、属和种共7个分类水平,且分类细致程度逐渐提高。然而,基于16S rRNA基因序列仅能够精确分类到属水平,对于种水平的分类却不够可信[22]。由此表明,15份高温大曲中存在大量共有的Staphylococcus群落结构,推测其可能主要隶属于S.saprophyticus。
值得一提的是,本研究发现有2个OTU仅存在于黑色大曲中,包含的序列数仅占总序列数的0.02%,亦发现2个OTU仅存在于白色大曲中,包含的序列数不到总序列数的0.01%,未发现仅在黄色大曲中出现的OTU。由此表明,黑色和白色大曲中亦存在少量特有的Staphylococcus群落结构。这与上述α多样性分析结果一致,不同颜色高温大曲中Staphylococcus多样性差异明显,且黑色和白色大曲中Staphylococcus多样性明显高于黄色大曲。
2.3 不同颜色高温大曲中葡萄球菌的分离鉴定
2.3.1 形态学鉴定
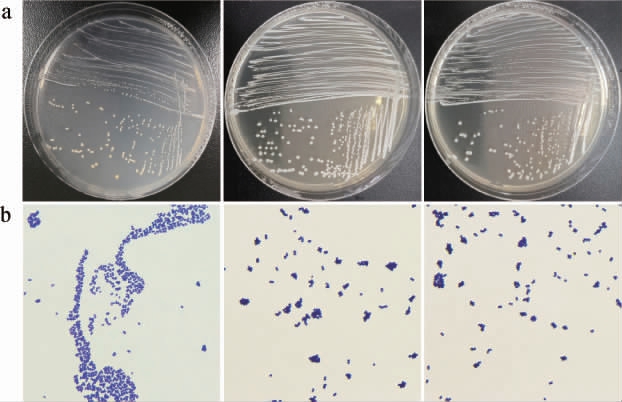
为进一步明确高温大曲中可培养Staphylococcus的构成,本研究采用传统纯培养技术对高温大曲中Staphylococcus进行了分离鉴定。通过对分离株的菌落形态和显微镜形态进行观察,将已纯化菌株中革兰氏染色为阳性且镜检形态为球形或椭圆形的分离株初步判定为Staphylococcus。13份高温大曲样品中共分离出14株疑似Staphylococcus的分离株,部分菌株菌落形态和细胞形态见图4。
由图4可知,分离株的菌落形态单一,大多呈现为白色,表面光滑、凸起且圆润,细胞形态均呈圆形,如葡萄状排列,基本符合Staphylococcus的形态特征。
2.3.2 分子生物学鉴定
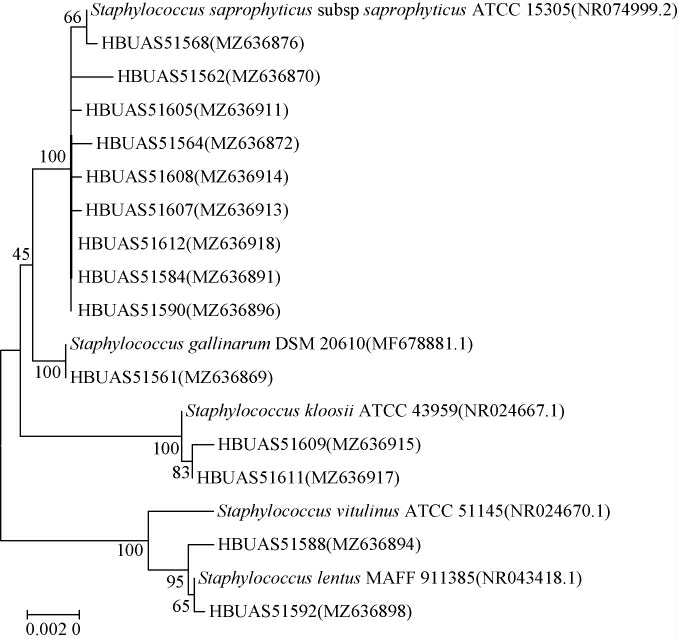
本研究进一步对14株疑似Staphylococcus的分离株进行分子生物学鉴定,将PCR扩增产物送至美国国家生物技术信息中心(NCBI),通过将各分离株的测序数据与GenBank数据库进行基本局部比对搜索工具(basic local alignment search tool,BLAST)同源性比对,将分离株鉴定到种水平,并下载与分离株同源性不小于99%的标准菌株参比序列,基于邻接(neighbor-joining,NJ)法构建分离株与标准菌株之间的系统发育树,结果见图5。
由图5可知,从所有高温大曲中共分离出的14株Staphylococcus 中 分 离 株HBUAS51562、HBUAS51564 和HBUAS51568等共9株菌与标准菌株Staphylococcus sapro-phyticus subsp.saprophyticus ATCC 15305聚在同一分支,故将其鉴定为腐生葡萄球菌(S.saprophyticus),同理,分离株HBUAS51561被鉴定为鸡葡萄球菌(Staphylococcus gallinarum),分离株HBUAS51609和HBUAS51611被鉴定为克氏葡萄球菌(Staphylococcus kloosii),分离株HBUAS51588被鉴定为小牛葡萄球菌(Staphylococcus vitulinus),分离株HBUAS51592 被鉴定为缓慢葡萄球菌(Staphylococcus lentus),其中S.saprophyticus占分离株总数的64.29%,表明S.saprophyticus为高温大曲中Staphylococcus的主要可培养菌种,进一步验证了上述OTU种水平分析结果。
由图5亦可知,从黑色大曲中分离出8株Staphylococcus,分别为S.saprophyticus(75%)、S.gallinarum(12.5%)和S.kloosii(12.5%),从黄色大曲中分离出4株Staphylococcus,分别为S.saprophyticus(50%)、S.kloosii(25%)和S.vitulinus(25%),从白色大曲中分离出2株Staphylococcus,分别为S.saprophyticus(50%)和S.lentus(50%)。由此表明,S.saprophyticus是三种颜色高温大曲中共有的优势可培养Staphylococcus,S.gallinarum、S.vitulinus和S.lentus分别是黑色、黄色和白色大曲中特有的可培养Staphylococcus,且相对含量较高的S.saprophyticus在不同颜色高温大曲中具有明显差异,与上述PCoA分析结果一致。
已有研究报道,Staphylococcus在传统发酵食品中具有重要作用。S.saprophyticus可以显著提升白腐乳氨基酸态氮含量,加快产香速度[23]。Staphylococcus是中国传统酸肉中重要的微生物类群之一[24],木糖葡萄球菌(Staphylococ-cus xylosus)可以根据其生物胺氧化酶活性降低发酵香肠中生物胺含量[25],S.xylosus、肉葡萄球菌(Staphylococcus carnosus)和马胃葡萄球菌(Staphylococcus equorum)在发酵肉制品中可以产生多种香气化合物[26]。S.saprophyticus可以产生脲酶,从而能够降低了酒醅中尿素含量,对控制或减少白酒中氨基甲酸乙酯的含量具有重要作用[27]。由此可知,Staphylococcus对白酒风味品质以及酒体安全性方面可能具有一定的积极作用。
3 结论
不同颜色高温大曲样品Staphylococcus群落结构存在明显差异,较之黄色和白色大曲,黑色大曲中Staphylococcus丰富度和多样性更高。三种颜色高温大曲中存在大量共有的OTU序列,累积平均相对含量高达91.38%,且黑色和白色大曲中亦存在少量特有的Staphylococcus群落结构。通过传统纯培养技术,从黑色、黄色和白色大曲中各分离鉴定出8株、4株和2株葡萄球菌,其中S.saprophyticus在三种高温大曲中均存在,是高温大曲中Staphylococcus的主要可培养菌种。综上可知,较之黄色和白色大曲,黑色大曲Staphylococcus丰富度和多样性更高,且腐生葡萄球菌(S.saprophyticus)为高温大曲中Staphylococcus的主要可培养菌种。
参考文献:
[1]谢丹,吴成,程平言,等.应用单分子实时测序技术解析酱香型白酒高温大曲制作过程细菌多样性[J].食品与发酵工业,2022,48(19):58-64.
[2]郭敏.基于高通量测序对酱香大曲制曲微生态多样性的研究[D].贵阳:贵州大学,2018.
[3]SHI W,CHAI L J,FANG G Y,et al.Spatial heterogeneity of the microbiome and metabolome profiles of high-temperature Daqu in the same workshop[J].Food Res Int,2022,156(6):111298.
[4] SHANG C H, LI Y J, ZHANG J, et al.Analysis of bacterial diversity in different types of Daqu and fermented grains from Danquan distillery[J].Front Microbiol,2022,13(7):883122.
[5]JIA Y,NIU C T,XU X,et al.Metabolic potential of microbial community and distribution mechanism of Staphylococcus species during broad bean paste fermentation[J].Food Res Int,2021,148(10):110533.
[6]TAMANG J P,SHIN D H,JUNG S J,et al.Functional properties of microorganisms in fermented foods[J].Front Microbiol,2016,7(4):00578.
[7] KYEONG R C,HYE E Y,SANG Y L.Microbial food: microorganisms repurposed for our food[J].Microb Biotechnol,2021,15(1):18-25.
[8]胡传旺,李巧玉,周朝晖,等.酱醪细菌菌株的分离及功能分析[J].微生物学通报,2017,44(8):1899-1907.
[9]龙强,聂乾忠,刘成国.发酵香肠研究进展及展望[J].食品科学,2017,38(13):291-298.
[10]杜木英,陈宗道,阚建全,等.青稞酒发酵过程中生物胺动态变化[J].食品科学,2012,33(3):163-167.
[11]米其利,李雪梅,管莹,等.高通量测序在食品微生物生态学研究中的应用[J].食品科学,2016,37(23):302-308.
[12] WANG Y R, XIANG F S, ZHANG Z D, et al.High-throughput sequencing-based analysis of fungal diversity and taste quality evaluation of Douchi,a traditional fermented food[J].Food Sci Nutr,2020,8(10):6612-6620.
[13]CAI W C,TANG F X,WANG Y R,et al.Bacterial diversity and flavor profile of Zha-Chili,a traditional fermented food in China[J].Food Res Int,2021,141(1):110112.
[14]QI N S,ZHAN X S,MILMINE J,et al.Isolation and characterization of a novel hydrolase-producing probiotic Bacillus licheniformis and its application in the fermentation of soybean meal[J].Ront Nutr, 2023, 10(3):1123422.
[15]ZHANG Z D,WANG Y R,HOU Q C,et al.Description of Lactobacillus enshiensis sp.nov., a novel arsenic-resistant bacterium[J].Int J Syst Evol Micr,2020,70(4):2573-2580.
[16]NING Y G,YANG G M,CHEN Y C,et al.Characteristics of the urinary microbiome from patients with gout:A prospective study[J].Front Endocrinol,2020,11(5):272.
[17]WANG Y R,CAI W C,WANG W P,et al.Analysis of microbial diversity and functional differences in different types of high-temperature Daqu[J].Food Sci Nutr,2020,9(2):1003-1016.
[18]周志立.绍兴黄酒生麦曲的微生物群落演替驱动力研究与制曲工艺优化[D].无锡:江南大学,2021.
[19] CHEN Y P, LIU X H, LI Q, et al.Integrated genomics and transcriptomics reveal the extreme heavy metal tolerance and adsorption potentiality of Staphylococcus equorum[J].Int J Biol Macromol,2022,229(2):388-400.
[20]LIU Z G,MUDASSAR I,ZENG Z B,et al.Comparative analysis of microbial community structure in the ponds with different aquaculture model and fish by high-throughput sequencing[J].Microb Pathogenesis,2020,142(5):104101.
[21]YUAN T M,MCCARTHY A J,ZHANG Y X,et al.Impact of temperature, nutrients and heavy metals on bacterial diversity and ecosystem functioning studied by freshwater microcosms and high-throughput DNA sequencing[J].Curr Microbiol,2020,77(11):3512-3525.
[22]JANDA J M, ABBOTT S L.16S rRNA gene sequencing for bacterial identification in the diagnostic laboratory:pluses,perils,and pitfalls[J].J Clin Microbiol,2007,45(9):2761-2764.
[23]刘力,周其洋.白腐乳中一株腐生葡萄球菌ZH910的分离鉴定[J].中国酿造,2019,38(10):44-48.
[24]李宗军.中国传统酸肉中葡萄球菌的分离鉴定与应用研究[J].生物技术通报,2006(3):77-80,92.
[25] MARTUSCELLI M, CRUDELE M A, GARDINI F, et al.Biogenic amine formation and oxidation by Staphylococcus xylosus strains from artisanal fermented sausages[J].Lett Appl Microbiol,2000,31(3):228-232.
[26] ANNE K S, LOUISE H S.Growth and aroma production by Staphylococcus xylosus,S.carnosus and S.equorum-a comparative study in model systems[J].Int J Food Microbiol,2002,75(5):99-109.
[27]孟庆达,周新虎,陈翔,等.白酒酿造过程酒醅中尿素的控制与减少[J].食品与发酵工业,2017,43(8):33-39.