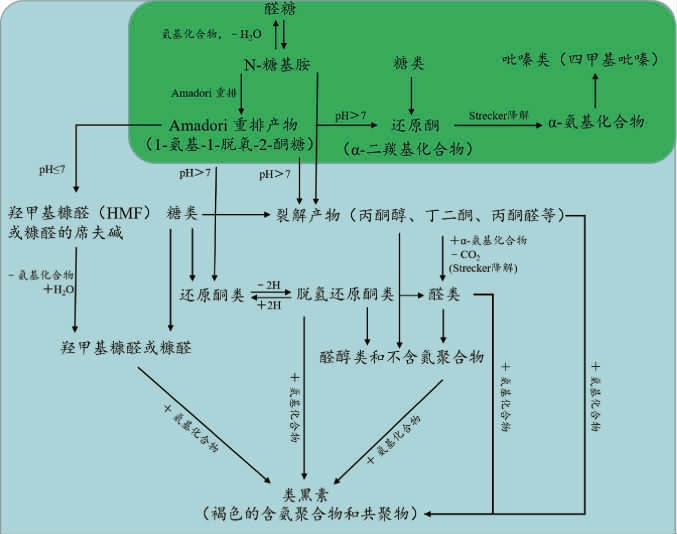
图1 美拉德反应生成吡嗪类化合物的经典途径
Fig.1 Classical pathway for the generation of pyrazine compounds by Maillard reaction
Research progress on formation mechanism of health factor 2,3,5,6-tetramethylpyrazine in Baijiu
白酒作为我国的传统饮品,是老百姓餐饮文化的重要组成部分,具有悠久的历史。随着人民生活水平的提高,人们越来越重视“健康饮酒”[1-2],在追求健康饮用习惯、满足精神愉悦的同时,对这一特殊饮品提出了更高的要求:低酒精度、低醉酒度、不上头、醒的快、人体代谢压力小、高健康功能因子和低有害成分[3]。
2,3,5,6-四甲基吡嗪(2,3,5,6-tetramethylpyrazine,TTMP)又名川芎嗪,属于生物体单碱,白色针状晶体,具有活血化瘀[4]、疏风止痛[5]、理气、治疗心脑血管疾病等多种药理作用[6-11],同时还是国际公认的、安全的一种食品风味添加剂[12],具有令人愉悦的、特殊的烤肉和炒坚果香气。TTMP在白酒中呈现甜香、坚果香及花香等香气,对其他香味物质有显著的的叠加效应,进而起到了丰满白酒香气的作用。吴建峰[13]在2006年率先提出不同香型白酒中TTMP普遍存在,其是白酒中主要功能性成分之一,引起了行业的广泛关注。本文主要回顾了近几年TTMP形成机理,总结了微生物合成TTMP主要分为微生物合成中间代谢产物,后经化学反应合成TTMP两个阶段,其中限制TTMP合成量主要以化学合成为主,针对其存在合成效率低等问题,阐述了微生物高产菌株筛选、改造代谢通路、优化发酵条件等解决措施,并提出以高效的“酶法合成”替换低效的“化学合成”的想法,异源构建微生物从头合成TTMP的策略,为进一步完善TTMP形成机理提供支持,进而对白酒提质增效及引领“健康白酒”的理念具有重要的意义。
美拉德反应(Maillard reaction,MR)机制从1953年开始逐渐被科研工作者解析,由于其反应的复杂性,目前常采用碳模块标记(carbon module labeling,COMLA)技术识别其中间产物的种类和结构[14]。该技术使用13C/15N同位素标记氨基源或13C标记还原糖作为反应底物成功解析吡嗪类化合物生成过程[15-16]。此外,多响应动力学模型已经成功地解析了吡嗪类化合物形成过程中美拉德中间反应产物动力学参数及反应网络[17]。吡嗪类化合物广泛存在于烘焙食品中[18-21],其可由氨基酸和糖分别提供氮源和碳源,在高温烘焙过程中经过美拉德反应生成[22-24];而在发酵食品中,吡嗪类化合物多种合成机制己经被提出,其中多数学者认为是美拉德反应和Strecker降解的结果,首先氨基源和还原糖之间发生缩合反应,其缩合反应通常是由氮的亲核攻击引起的,将一个未共享的电子对给羰基的亲电碳原子。由于氨基的亲核性质,这种亲核攻击高度依赖于pH,当反应条件为碱性时更利于MR的初始阶段,而酸性时氨基酸的质子化致使MR减慢。醛糖中N-糖基胺发生Amadori重排生成1-脱氧-2-酮糖,即Amadori产物;如果以酮糖代替醛糖参与反应,则合成2-氨基-2-脱氧-1-醛糖,即Hyens产物。这两种重新排列的产物都是无色的,非挥发的,尤其是热不稳定的,因此其会进一步迅速发生脱氨脱水反应产生大量的降解产物。在酸性条件下,Amadori和Hyens产物均优选进行1,2-烯醇化生成3-脱氧己酮;在碱性条件下,2,3-烯醇化倾向于生成1-脱氧己酮,这些脱氧己酮进一步裂解成α-二羰基化合物。α-氨基酮通常由Streker降解形成的,主要发生氨基酸的氧化脱胺和脱羧反应,释放二氧化碳和醛类物质,随后这些化合物重新排列形成α-氨基酮[25]。简而言之,即α-氨基酸与还原糖形成Amadori重排产物,随后发生重排形成α-二羰基化合物等还原酮,经Strecker降解为α-氨基化合物,最后缩合成形成吡嗪类化合物(图1)[26];除此之外,GUERRA P V等[27]提出吡嗪类化合物其他合成路径,即甘氨酸-乙醛酸美拉德模型体系,该体系生成的中间产物不参与α-二羰基化合物的形成(图2a),而是生成哌嗪-2,5-二羧酸,然后进行氧化脱羧形成二氢吡嗪,最终通过氧化生成吡嗪类化合物;YU H等[28]提出吡嗪化合物也可以通过高压加成反应生成(图2b),在碱性条件下该反应由吡嗪甲基电离引起。该反应是吡嗪侧链生成的重要途径,可以生产出更多类型的、气味阈值更低的吡嗪类化合物。

图1 美拉德反应生成吡嗪类化合物的经典途径
Fig.1 Classical pathway for the generation of pyrazine compounds by Maillard reaction
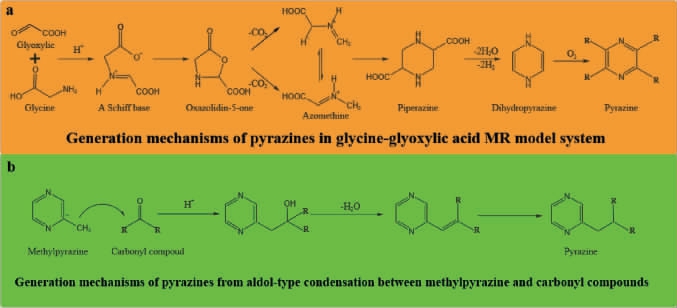
图2 吡嗪类化合物其他生成途径
Fig.2 Alternative pathways for the generation of pyrazine compounds
美拉德反应是羰基化合物与氨基化合物在常温或加热时发生的聚合、缩合等复杂化学反应,其反应过程形成了多种醛类、酮类等中间产物,理论上有可能产生一些可作为TTMP前体的羰基化合物,但KOEHLER P E等[29-30]从还原糖与铵或氨基酸之间反应的美拉德反应模型中发现有甲基吡嗪、2,3-二甲基吡嗪、三甲基吡嗪等多种烷基吡嗪的合成,但却没有检测到TTMP的生成,这可能与TTMP相对其他烷基吡嗪有独特的对称结构有关。人们普遍认为美拉德反应是非酶促的化学反应,其反应条件一般是温度高于100 ℃、pH≥7,含水量不超过25%,这一反应条件在中国白酒酿造过程中很难实现,但张温清[12]研究芝麻香型白酒中TTMP变化时,提出中国白酒中TTMP形成主要存在于温度较高的制曲、高温堆积、蒸馏等阶段。虽然酸碱性对美拉德反应的整体路径有一定影响,但乙偶姻与铵的反应动力学证实了在酸性条件下TTMP也能够生成[31-32]。目前研究表明,关于吡嗪类化合物的产生途径已经非常清楚,微生物的作用占70%以上,而美拉德反应的作用不到30%[26]。吴建峰[33]研究发现,白酒中TTMP主要来源于制曲和堆积发酵过程中的美拉德反应,后经蒸馏带入酒中,因此美拉德反应和微生物代谢是白酒中TTMP的重要来源。
1962年,KOSUGE T等[34]在日本的发酵豆制品“纳豆”中分离得到一株产TTMP的菌株(枯草芽孢杆菌(Bacillus natto))。随着TTMP在越来越多的发酵食品中被发现,研究人员提出TTMP合成路径是基于微生物代谢的乙偶姻合成途径。1967年,DEMAIN A L等[35]提出枯草芽孢杆菌(Bacillus subtilis)培养体系中TTMP生物合成途径——由糖的代谢产物3-羟基丁酮和氨基酸的氨基反应生成,这是最早的关于微生物合成TTMP机制的报道,同时该研究也表明了3-羟基丁酮和氨基酸在TTMP合成中的重要性。TTMP微生物的合成途径(图3):以枯草芽孢杆菌为例,首先体内合成TTMP的前体物——乙偶姻[36-40](图3a),具体路径为葡萄糖经EMP途径生成丙酮酸,随后在α-乙酰乳酸合酶及α-乙酰乳酸脱羧酶分别催化作用下合成乙偶姻;乙偶姻经体外化学反应合成TTMP,具体路径为乙偶姻与氨/铵盐通过非酶促反应生成3-氨基-2-丁酮,随后两分子的3-氨基-2-丁酮脱水缩合生成2,5-二氢四甲基吡嗪,最后非酶氧化生成TTMP[41-42](图3b)。
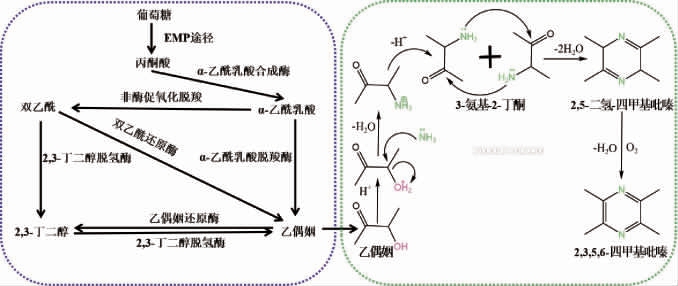
图3 2,3,5,6-四甲基吡嗪前体物乙偶姻合成途径(a)及其形成机理(b)
Fig.3 Synthesis pathway of 2,3,5,6-tetramethylpyrazine precursor acetoin (a) and its formation mechanism (b)
由图3a可知,微生物合成TTMP主要分为微生物合成中间代谢产物——乙偶姻,后经化学反应合成TTMP两个阶段,基于此,微生物体内是否有TTMP从头合成途径及相关的功能酶,目前这方面的研究还是非常有限的。黄晓润[43]通过对高温(45 ℃)和中温(37 ℃)不同发酵温度下菌株转录组进行差异性比对,筛选得到15个差异显著的候选基因,最后通过生物信息学分析得到3个可能与酱香相关的基因(cdoA(半胱氨酸双加氧酶)、panE(酮泛解酸还原酶)、lspA(脂蛋白信号肽酶Ⅱ)),并采取敲除策略验证其酱香功能,结果研究发现分别敲除cdoA、panE、lspA基因后,发酵的豆豉酱香味减弱,尤其是BJ3-2△lspA酱香味显著减弱,TTMP含量较对照分别降低了0.768%、0.025%和4.063%,表明cdoA、panE和lspA基因分别通过调控半胱氨酸和蛋氨酸代谢中半胱氨酸-亚磺酸盐、泛酸生物的生成、蛋白质、糖类和脂肪等物质的运输进而影响丙酮酸的代谢对酱香风味起到正调控。贡献[44]对枯草芽孢杆菌产酱香风味代谢通路研究时发现,pckA基因通过调控三羧酸循环中磷酸烯醇式丙酮酸的生成对酱香风味起负调控,pckA基因敲除菌株发酵的豆豉中乙偶姻的含量从8.618%降至7.721%,TTMP含量从12.444%增至15.394%;而msmE基因通过调控细胞内外低聚糖的转运影响糖酵解中丙酮酸的代谢对酱香风味起正调,msmE基因敲除菌株发酵的豆豉中乙偶姻含量从8.618%增至28.122%,TTMP含量从12.444%降至9.124%。黄璐等[45]研究发现,磷酸烯醇丙酮酸羧化激酶基因(pckA)对TTMP合成有显著的调控作用,其被敲除基因(BJ3-2ΔpckA)后导致发酵的豆豉中TTMP含量比BJ3-2中增加23.71%,酱香更浓郁,氨味明显降低,风味品质显著提升。LIU Z L等[46]在研究大豆发酵食品中风味化合物发现精氨酸酶基因(rocF)对TTMP合成具有调控作用,敲除rocF基因抑制了精氨酸酶活性,造成精氨酸无法通过尿素循环分解为尿素和鸟氨酸,导致尿素含量降低,进而增加了NH4+和TTMP的含量。冯国杨[47]对枯草芽孢杆菌产TTMP生成机制进行研究,通过菌株发酵过程中相关基因转录水平的变化,筛选到15个与TTMP合成相关基因,其中包括编码蛋白质与多肽降解的基因(8个)、与氨基酸降解生产NH3相关酶的基因(4个)、转氨酶的基因(3个)等,这些基因在TTMP快速合成阶段都具有较高的表达水平且呈协同作用趋势。总之,目前关于微生物TTMP合成路径关键基因挖掘的研究较少,多数以枯草芽孢杆菌的报道为主,而枯草芽孢杆菌中相关功能基因的研究对微生物从头合成TTMP具有有一定的借鉴意义和参考价值。
菌株生长和发酵性能对于提高TTMP产量至关重要。张温清[12]以蛋白酶和乙偶姻作为双筛选标记结合高温处理技术,在芝麻香型白酒高温大曲中筛选得到一株高产TTMP解淀粉芽孢杆菌(Bacillus amyloliquefaciens)XJB-104,通过单因素和响应面等优化发酵条件,XJB-104功能麸曲TTMP产量为1.28×103 mg/kg,是优化前的6.3倍。郭春生等[48]采用传统培养分离结合高效液相色谱法从高温大曲中分离筛选到高产TTMP解淀粉芽孢杆菌(Bacillus amyloliquefaciens),并通过单因素试验和响应面法对发酵工艺进行优化,最终TTMP产量可达(166.19±2.79)mg/L,较优化前(112.26 mg/L)提高48%。王庆等[49]采用细胞形态学观察、生理生化试验及分子生物学技术从高温大曲中分离筛选到高产TTMP贝莱斯芽孢杆菌(Bacillus velezensis),菌株发酵条件优化后TTMP产量为728.38 mg/L,比优化前提高了167%。万雨薇等[50]以酱醪中筛选的贝莱斯芽孢杆菌(Bacillus velezensis)CS1.11作为出发菌株,为获得高产TTMP发酵菌株,采用紫外诱变的方法,以酪素平板水解圈直径及乙偶姻显色反应作为突变菌株初筛指标,突变株CS1.11-33经响应面试验优化发酵后TTMP最大积累量达到1 895.08 mg/kg,是其优化前的2.6倍。
由图3可知,乙偶姻和铵合成TTMP的过程为非酶促的化学反应,而TTMP合成代谢途径关键基因的调控主要集中在乙偶姻的合成代谢上。目前针对增加乙偶姻合成量主要是围绕其合成路径的改造和优化展开的,上游路径主要是通过引入外源基因改造和强化原有的丙酮酸代谢路径,从而提高丙酮酸的供应量;中游路径主要是通过过量表达或者组合表达乙偶姻合成途径中的关键酶、定向改造关键酶等措施强化乙偶姻的代谢通量;下游路径主要是敲除乙偶姻竞争路径,减少底物的流失。
XU Y Q等[40]针对白酒酿造微氧环境探究了其对芽孢杆菌产TTMP的影响,通过强化乙偶姻合成代谢路径(过表达葡萄糖摄入蛋白(GlcU)、α-乙酰乳酸合成酶(AlsS)、α-乙酰乳酸脱羧酶(AlsD)、丙酮酸激酶(PYK)、6-磷酸果糖激酶(PFKA))、弱化竞争路径(敲除乙偶姻还原酶(BdhA)、乙偶姻脱氢酶体系(acoABC)),结合补充铵盐和红豆粉等发酵条件优化,重组芽孢杆菌产TTMP为2.37 g/L。MENG W等[51]通过过量表达α-乙酰乳酸脱羧酶强化乙偶姻合成代谢流量,结合补加碳源乙醛强化乙酰-辅酶A(coenzyme A,CoA)合成代谢,进而提高丙酮酸流向乙偶姻代谢流,最终重组枯草芽孢菌株产TTMP为43.75 g/L,比初始菌株提高了15.47%。CUI D Y等[52]采取组合过量表达α-乙酰乳酸合成酶基因(ILV2)、敲除2,3-丁二醇脱氢酶基因(BDH1)、构建二倍体酿酒酵母等措施,最终重组酵母菌株产TTMP为10.55 mg/L,比初始菌株提高了2.6倍。为了让α-乙酰乳酸合成酶更好地适应白酒酿造过程中的酸性环境。ZHAO T等[53]采取定点突变的策略,筛选出耐酸性更强的α-乙酰乳酸合成酶突变体(ALSN210D-H399D),其半衰期在pH 4.0条件下延长了2.2 h(野生型ALS为0.8 h),使其更适合白酒酿造的环境。陈诗佳[54]采取敲除BDH1基因和过表达BDH2基因,结合酵母单倍体融合的策略,构建了高产乙偶姻和TTMP的双倍体酿酒酵母工程菌,并将其应用到麸曲白酒固态发酵实验中,结果显示酒醅中乙偶姻含量提高了320.38%,TTMP提高了74.66%。总之,这些合成策略将为增加乙偶姻、TTMP的合成量提供参考。
调控菌株发酵过程中的各项参数,如温度、pH和溶氧量等,在一定程度上对于提高TTMP产量同样重要,发酵条件优化主要集中在碳源分批补料、最佳铵盐种类筛选、外源添加物调控、发酵参数控制等。乙偶姻是TTMP的前体物,其在发酵前期过量积累有利于TTMP的生成。HAO F等[55]首先采取分批补加碳源葡萄糖,过量积累TTMP前体物—乙偶姻,随后补加3%磷酸氢二铵的策略,最终TTMP的产量为3.01 g/kg,比优化之前提高了6.8倍;为了探究铵盐种类和浓度对TTMP合成的影响,ZHU B F等[22]从磷酸氢二铵、柠檬酸铵、硫酸铵、碳酸氢铵、硝酸铵、乙酸铵和草酸铵七不同铵盐种类中筛选最佳铵盐及浓度,结果表明磷酸氢二铵为最佳铵盐,采用分批补加铵盐的方式,随着其质量浓度增加(<40 g/L)TTMP的产量也随之增加,TTMP的最高质量浓度达到7.46 g/L,比未分批添加铵盐提高了55.1%;外源添加物可以直接或间接影响TTMP中间代谢产物的生成或相关酶的酶活。MENG W等[51]研究发现,外源添加乙醛有助于提高地衣芽孢杆菌(Bacillus licheniformis)合成TTMP的能力,与未添加乙醛相比,TTMP产量从43.75 g/L提高到47.26 g/L。此外,刘蕾[56]研究发现,外源添加维生素B2可以提高多粘芽孢杆菌(Paenibacillus polymyxa)CJX518烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NADH)脱氢酶活性进而影响胞内NADH和NAD+水平,同时也可以提高多粘芽孢杆菌CJX518胞内的2,3-丁二醇脱氢酶和乙偶姻还原酶活性,从而提高乙偶姻的生成量,为此采用与产维生素B2的基因工程大肠杆菌LS02T共培养,TTMP的最大产量达到227 mg/L,与纯培养相比产量提高了。吴建峰[33]提出较高的反应温度有利于乙偶姻和铵离子合成TTMP。XIAO Z J等[39]提出两步控温法的生产策略:第一阶段,枯草芽孢杆菌(B.subtilis)CICC 10211在37 ℃发酵使中间代谢产物乙偶姻过量积累;第二阶段,反应体系温度升高至95 ℃添加磷酸氢二铵,加快TTMP合成速度,最终实现高产TTMP的预期目标,其产量达到8.34 g/L。除温度外,ZHU B F等[57]研究发现,弱酸性条件(pH 5.5)有利于细胞生长和前体物乙偶姻的过量积累,而pH 7.0有利于TTMP的合成,最终通过调控发酵体系中的pH使TTMP的产量达到7.43 g/L,较恒定pH发酵提高了22.20%。
根据吡嗪类化合物的合成机制可知,微生物主要为其合成前体物,前体物经一系列的自发化学反应合成吡嗪类化合物,这就限制了吡嗪类化合物高效合成,如何实现将低效的化学合成转换成更高效的酶法合成将是今后发展的方向。随着基因组学、蛋白组学、代谢组学的发展以及生物信息学的广泛应用,使得在微生物体内挖掘出具有与TTMP化学合成路径中催化相同官能团的同工酶或者相似的酶法合成路径成为可能。合成生物学技术的兴起,诞生了以微生物生物合成法生产具有应用价值化合物的新方法,该方法具有能耗低、绿色环保、可持续等优势。
2020年,曹艳丽等[58-60]解析了枯草芽孢杆菌(B.subtilis)中2,5-二甲基吡嗪(2,5-dimethylpyrazine,DMP)的生物合成路径(图4),其以L-苏氨酸作为底物,在苏氨酸脱氢酶(threonine dehydrogenase,TDH)催化下合成α-氨基乙酰乙酸,经非酶促脱羧生成氨基丙酮,随后两分子的氨基丙酮脱水缩合生成3,6-二氢-2,5-二甲基吡嗪,最后非酶氧化为2,5-二甲基吡嗪(2,5-DMP);也揭示了2,3,5-三甲基吡嗪(2,3,5-trimethylpyrazine,TMP)的生物合成路径(图4),其以L-苏氨酸和D-葡萄糖为底物,产物1分子氨基丙酮与1分子3-氨基-2-丁酮脱水缩合生成2,5-二氢-2,3,6-三甲基吡嗪,随后非酶氧化为2,3,5-TMP;还揭示了2-乙基-3,5-二甲基吡嗪和3-乙基-2,5-二甲基吡嗪的生物合成路径(图4),其以L-苏氨酸和D-葡萄糖为底物,产物1分子氨基丙酮与1分子3-氨基-2-戊酮、1分子2-氨基-3-戊酮分别脱水缩合生成2-乙基-3,6-二甲基-2,5-二氢吡嗪和3-乙基-2,6-二甲基-2,5-二氢吡嗪,随后分别被氧化为2-乙基-3,5-二甲基吡嗪和3-乙基-2,5-二甲基吡嗪。
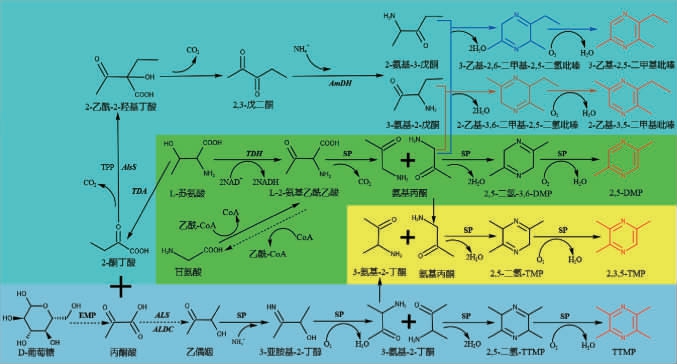
图4 吡嗪类化合物的微生物合成途径
Fig.4 Microbial synthesis pathways of pyrazine compounds
2020年,XU J Z等[61]在大肠杆菌(E.coli)中异源表达苏氨酸脱氢酶和外源的氨基丙酮氧化酶实现从头合成2,5-DMP,产量为1.43 g/L,以上研究表明设计构建一条新的、效率更高的酶法合成TTMP路径可行。总之,目前尚未在微生物体内发现更高效的酶法合成TTMP路径。为了提高其合成效率,可设计构建一条以乙偶姻作为底物,经ω-转氨酶、二氢四甲基吡嗪聚合酶及二氢四甲基吡嗪氧化酶逐步催化合成TTMP的新路径,利用合成生物学和代谢工程的手段构建高效的异源合成TTMP的微生物细胞工厂,进而实现TTMP合成由低效的“化学合成”到高效的“酶法合成”转变(图5),具有重要的理论意义及应用价值。
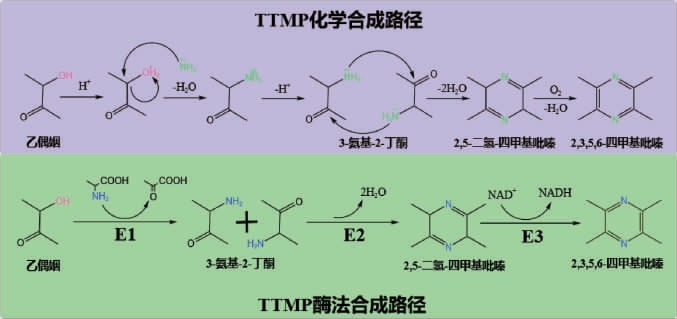
图5 2,3,5,6-四甲基吡嗪化学合成及酶法合成途径
Fig.5 Chemical and enzymatic synthesis pathway of 2,3,5,6-tetramethylpyrazine
在解析微生物合成TTMP机理后,更多研究人员把精力集中到如何提高白酒中TTMP含量上,首先筛选高产TTMP的功能性菌株,通过采取优化发酵条件制备液态增香菌剂串蒸酒醅;制备固态强化大曲,应用于酱香型大曲模拟生产中;制备强化麸曲与传统大曲协同参与窖面糟发酵结合尾酒浸提麸曲后串蒸等措施,使白酒中TTMP的含量达到最大,进而起到提质增效的目的。近年来增加白酒中TTMP含量的策略见表1。
表1 近年来增加白酒中2,3,5,6-四甲基吡嗪含量的策略
Table 1 Strategies on increasing 2,3,5,6-tetramethylpyrazine content in Baijiu in recent years

菌种 来源 策略 含量 参考文献地衣芽孢杆菌(Bacillus licheniformis)古井桃花曲833 mg/L [62]枯草芽孢杆菌(Bacillus suhtilis)B83汾酒大曲5.3 mg/L [63]地衣芽孢杆菌(Bacillus licheniformis)解淀粉芽袍杆菌(Bacillus amyloliguefaciens)XJB-104枯草芽抱杆菌(Bacillus subtilis)M2 MBJ09001高温大曲1)对装料量、氮源、固态培养水分含量、种子液接种量、氮源配比(玉米粉与麸皮配比)、磷酸氢二铵溶液浓度等发酵培养基成分及发酵条件进行优化。1)对不同类型培养基、培养时间、铵盐、热处理温度、热处理时间等发酵条件进行优化;2)芽孢杆菌增香液串蒸实验;3)生产车间芽孢杆菌强化酿酒实验。1)地衣芽孢杆菌菌悬液添加到糟醅中入窖发酵。6.81 mg/L [64]宣酒大曲1)功能菌株接种于麸曲固态培养基。202.54 mg/kg [65][66]地衣芽孢杆菌(Bacillus licheniformis)高温大曲1)菌种强化结合工艺优化。21.98 mg/L高温大曲881.5 mg/kg [67]枯草芽孢杆菌(Bacillus suhtilis)M2高温大曲1)发酵工艺先接种酵母菌和根霉曲,再接种芽孢杆菌发酵。1)产TTMP 功能芽孢杆菌模拟实际制备麸曲与传统大曲协同参与窖面糟发酵;2)功能麸曲协同发酵和尾酒浸提麸曲后串蒸俩种方式相结合的方法,应用于同一窖池窖面酒的生产。21.98 mg/L [68]
续表

菌种 来源 策略 含量 参考文献西姆芽孢杆菌(Bacillus siamensis)索诺拉沙漠芽孢杆菌(Bacillus sonorensis)酱香大曲65.51 mg/kg [69]高温大曲1)筛选高产TTMP功能芽孢杆菌,应用于酱香大曲模拟生产时,发酵产物中四甲基吡嗪产量可以达到65.51 mg/kg。1)筛选高产TTMP功能芽孢杆菌,将其制备固态、液态菌剂应用于酱香大曲模拟生产。23.28 mg/kg [70]
TTMP在白酒中作为健康功能因子已被人们所熟知,“健康白酒”理念的引领对整个白酒界具有重要的现实意义。微生物合成TTMP主要分为微生物合成中间代谢产物,后经化学反应合成TTMP两个阶段。随着合成生物学技术的高速发展,利用合成生物学和代谢工程手段构建一条TTMP从头合成的酶法合成路径,该路径起始于乙偶姻,依次在ω-转氨酶、二氢四甲基吡嗪聚合酶、二氢四甲基吡嗪氧化酶作用下合成TTMP,实现TTMP由低效的“化学反应合成”到高效的“酶法合成”的转变,为在微生物体内异源构建TTMP从头合成路径及其他吡嗪类化合物的机制研究奠定基础,具有重要的理论意义及应用价值。异源构建微生物从头合成TTMP途径强化其合成量,结合工艺优化,进一步提高酒体中TTMP含量,进而为酱香型白酒基酒提质增效提供一种新的、可被企业实际应用的方法。总之,可以从多角度、多方式探究白酒中TTMP对白酒风味及功能的影响,对提升白酒的功能性及推动整个白酒产业的发展具有举足轻重的作用。
[1]孙宝国,李贺贺,胡萧梅,等.健康白酒的发展趋势[J].中国食品学报,2016,16(8):1-6.
[2]吴继红,黄明泉,郑福平,等.健康白酒的研究进展[J].食品科学技术学报,2019,37(2):17-23.
[3] SHAO H K, HE X, ZHANG L J, et al.Efficacy of ligustrazine injection as adjunctive therapy in treating acute cerebral infarction: a systematic review and meta-analysis[J].Front Pharmacol,2021,12:761722.
[4]LI Y Z,TAO T Q,SONG D D,et al.Effects of Xuefu Zhuyu granules on patients with stable coronary heart disease:a double-blind,randomized,and placebo-controlled study[J].Oxid Med Cell Longev,2021:8877296.
[5]WANG Y,SHI Y J,ZHANG X F,et al.A Chinese prescription chuanxiong chatiao san for migraine: a systematic review and meta-analysis of randomized controlled trials[J].Evid-Based Compl Alt,2019:1-17.
[6] ZHAO Y K,LIU Y,CHEN K J.Mechanisms and clinical application of tetramethylpyrazine(an interesting natural compound isolated from Ligusticum wallichii):current status and perspective[J].Oxid Med Cell Longev,2016:2124638.
[7] SHI J H, LI R Y, YANG S Y, et al.The protective effects and potential mechanisms of ligusticum chuanxiong: focus on anti-inflammatory, antioxidant,and antiapoptotic activities[J].Evid-Based Compl Alt,2020:8205983.
[8]GUO M,LIU Y,SHI D Z.Cardiovascular actions and therapeutic potential of tetramethylpyrazine(active component isolated from Rhizoma chuanxiong):roles and mechanisms[J].Biomed Res Int,2016:2430329.
[9]LIN J G,WANG Q Q,ZHOU S M,et al.Tetramethylpyrazine:A review on its mechanisms and functions[J].Biomed Pharmacother,2022,150:113005.
[10]YE T T,LI Y F,XIONG D F,et al.Combination of Danshen and ligustrazine has dual anti-inflammatory effect on macrophages and endothelial cells[J].J Ethnopharmacol,2020,266:113425.
[11] DU H Y, WANG R, LI J L, et al.Ligustrazine induces viability, suppresses apoptosis and autophagy of retinal ganglion cells with ischemia/reperfusion injury through the PI3K/Akt/mTOR signaling pathway[J].Bioengineered,2021,12(1):507-515.
[12]张温清.芝麻香型白酒四甲基吡嗪形成及其高产TTMP酿造工艺研究[D].合肥:合肥工业大学,2020.
[13]吴建峰.中国白酒中健康功能性成份四甲基吡嗪的研究综述[J].酿酒,2006,33(6):13-16.
[14]SCHIEBERLE P.The carbon module labeling(CAMOLA)technique:a useful tool for identifying transient intermediates in the formation of Maillard-type target molecules[J].Ann NY Acad Sci, 2005, 1043(1):236-248.
[15]LIU J B,LIU M Y,HE C C,et al.Effect of thermal treatment on the flavor generation from Maillard reaction of xylose and chicken peptide[J].LWT-Food Sci Technol,2015,64:316-325.
[16]ZOU T T,KANG L,YANG C,et al.Flavour precursor peptide from an enzymatic beef hydrolysate Maillard reaction-II:Mechanism of the synthesis of flavour compounds from a sulphur-containing peptide through a Maillard reaction[J].LWT-Food Sci Technol,2019,110:8-18.
[17] YU H,KEH M Z M,SEOW Y X,et al.Kinetic study of high-intensity ultrasound-assisted Maillard reaction in a model system of D-glucose and L-methionine[J].Food Bioprocess Technol,2017,10(11):1984-1996.[18] ADJOGATSE E, ERSKINE P, WELLS S A, et al.Structure and function of L-threonine-3-dehydrogenase from the parasitic protozoan Trypaosoma brucei revealed by X-ray crystallography and geometric simulations[J].Acta Crystallogr D,2018,74(9):861-876.
[19]MARCUS J P,DEKKER E E.Threonine formation via the coupled activity of 2-amino-3-ketobutyrate coenzyme A lyase and threonine dehydrogenase[J].J Bacteriol,1993,175(20):6505-6511.
[20]MCGILVRAY D,MORRIS J G.Utilization of L-threonine by a species of Arthrobacter.A novel catabolic role for"aminoacetone synthase"[J].Biochem J,1969,112(5):657-671.
[21] ROBACKER D C, ALUJA M, BARTELT R J, et al.Identification of chemicals emitted by calling males of the Sapote fruit fly, Anastrepha serpentina[J].J Chem Ecol,2009,35(5):601-609.
[22]ZHU B F,XU Y.A feeding strategy for tetramethylpyrazine production by Bacillus subtilis based on the stimulating effect of ammonium phosphate[J].Bioproc Biosyst Eng,2010,33(8):953-959.
[23]KREMS I J,SPOERRI P E.The pyrazines[J].Chem Rev,1947,40:279-358.
[24]MOLLA G,NARDINI M,MOTTA P,et al.Aminoacetone oxidase from Streptococcus oligofermentans belongs to a new three-domain family of bacterial flavoproteins[J].Biochem J,2014,464(3):387-399.
[25] YU H Z, YANG R V, XIE F W, et al.Control strategies of pyrazines generation from Maillard reaction[J].Trends Food Sci Tech,2021,112(1):795-807.
[26]谢三款.山西老陈醋四甲基吡嗪形成机制及代谢调控[D].天津:天津科技大学,2021.
[27] GUERRA P V,YAYLAYAN V A.Dimerization of azomethine ylides:An alternate route to pyrazine formation in the Maillard reaction[J].J Agr Food Chem,2010,58(23):12523-12529.
[28] YU H, SEOW Y X, ONG P K C, et al.Kinetic study of high-intensity ultrasound-assisted Maillard reaction in a model system of D-glucose and glycine[J].Food Chem,2018,269:628-637.
[29] KOEHLER P E, MASON M E, NEWELL J A.Formation of pyrazine compounds in sugar-amino acid model systems[J].J Agr Food Chem,1969,17(2):393-396.
[30]HWANG H I,HARTMAN T G,ROSEN R T,et al.Formation of pyrazines from the Maillard reaction of glucose and glutamine-amide-15N[J].J Agr Food Chem,1993,41(11):2112-2115.
[31]SHU C K.Pyrazine formation from amino acids and reducing sugars,a pathway other than strecker degradation[J].J Agr Food Chem, 1998,46(4):1515-1517.
[32] HUANG T C, FU H Y, HO C T.Mechanistic studies of tetramethylpyrazine formation under weak acidic conditions and high hydrostatic pressure[J].J Agr Food Chem,1996,44(1):240-246.
[33]吴建峰.白酒中四甲基吡嗪全程代谢机理研究[D].无锡:江南大学,2013.
[34]KOSUGE T,ADACHI T,KAMIYA H.Isolation of tetramethylpyrazine from culture of Bacillus natto, and biosynthetic pathways of tetramethylpyrazine[J].Nature,1962,195:1103.
[35]DEMAIN A L,JACKSON M,TRENNER N R.Thiamine-dependent accumulation of tetramethylpyrazine accompanying a mutation in the isoleucine-valine pathway[J].J Bacteriol,1967,94(2):323-326.
[36]CELINSKA E,GRAJEK W.Biotechnological production of 2,3-butanediol-current state and prospects[J].Biotechnol Adv, 2009, 27(6): 715-725.
[37]JI X J,HUANG H,OUYANG P K.Microbial 2,3-butanediol production:a state-of-the-art review[J].Biotechnol Adv,2011,29(3):351-364.
[38]XIAO Z J,XU P.Acetoin metabolism in bacteria[J].Crit Rev Microbiol,2007,33(2):127-140.
[39] XIAO Z J, HOU X Y, LYU X, et al.Accelerated green process of tetramethylpyrazine production from glucose and diammonium phosphate[J].Biotechnol Biofuels,2014,7(1):106.
[40] XU Y Q,JIANG Y Y,LI X T, et al.Systematic characterization of the metabolism of acetoin and its derivative ligustrazine in Bacillus subtilis under micro-oxygen conditions[J].J Agr Food Chem, 2018, 66(12):3179-3187.
[41]RIZZI G P.Formation of pyrazines from acyloin precursors under mild conditions[J].J Agr Food Chem,1988,36(2):349-352.
[42]徐岩,吴群,范文来,等.中国白酒中四甲基毗嗓的微生物产生途径的发现与证实[J].酿酒科技,2011(7):37-40.
[43]黄晓润.枯草芽孢杆菌产酱香相关基因的筛选及功能研究[D].贵阳:贵州大学,2020.
[44]贡献.枯草芽孢杆菌pcKA和msmE基因调控酱香的代谢机制研究[D].贵阳:贵州大学,2020.
[45]黄璐,贡献,佟硕秋,等.枯草芽孢杆菌pckA影响四甲基吡嗪合成的研究[J].食品与发酵工业,2023,49(12):47-53.
[46] LIU Z L,WU Y J,ZHANG L C,et al.rocF affects the production of tetramethylpyrazine in fermented soybeans with Bacillus subtilis BJ3-2[J].BMC Biotechnol,2022,22(1):18.
[47]冯国杨.菌株TYF-FGY-BD17的筛选及其四甲基吡嗪生物合成机制研究[D].太原:太原理工大学,2022.
[48]郭春生,杨舟,乔月梅,等.高产四甲基吡嗪微生物的筛选、鉴定及发酵条件优化[J].中国酿造,2022,41(9):80-85.
[49]王庆,王超彦,徐海林,等.高温大曲中高产四甲基吡嗪芽孢杆菌的分离鉴定及发酵条件优化[J].中国酿造,2022,41(10):125-129.
[50]万雨薇,林琛,闫子恒,等.酱醪贝莱斯芽胞杆菌四甲基吡嗪高产菌的选育及其发酵优化[J].中国食品学报,2023,23(8):175-185.
[51]MENG W,DING F,WANG R M,et al.Enhanced production of tetramethylpyrazine in Bacillus licheniformis BL1 through aldC over-expression and acetaldehyde supplementation[J].Sci Rep,2020,10(1):3544.
[52]CUI D Y,WEI Y N,LIN L C,et al.Increasing yield of 2,3,5,6-tetramethylpyrazine in Baijiu through Saccharomyces cerevisiae metabolic engineering[J].Front Microbiol,2020,11:596306.
[53]ZHAO T,LI Y,YUAN S Q,et al.Structure-based design of acetolactate synthase from Bacillus licheniformis improved protein stability under acidic conditions[J].Front Microbiol,2020,11:582909.
[54]陈诗佳.适量高产乙偶姻酿酒酵母菌株的构建[D].天津:天津科技大学,2017.
[55]HAO F,WU Q,XU Y.Precursor supply strategy for tetramethylpyrazine production by Bacillus subtilis on solid-state fermentation of wheat bran[J].Appl Biochem Biotechnol,2013,169(4):1346-1352.
[56]刘蕾.维生素B2介导的混菌体系促进多粘芽孢杆菌生成乙偶姻[D].天津:天津大学,2017.
[57]ZHU B F,XU Y.Production of tetramethylpyrazine by batch culture of Bacillus subtilis with optimal pH control strategy[J].J Ind Microbiol Biot,2010,37(8):815-821.
[58]曹艳丽.枯草芽抱杆菌合成2,5-二甲基吡嗪途径解析及高产菌株构建[D].无锡:江南大学,2019.
[59] ZHANG L J, CAO Y L, TONG J N, et al.An alkylpyrazine synthesis mechanism involving L-threonine-3-dehydrogenase describes the production of 2,5-dimethylpyrazine and 2,3,5-trimethylpyrazine by Bacillus subtilis[J].Appl Environ Microb,2019,85(24):e01807-19.
[60]ZHANG H Z,ZHANG L J,YU X W,et al.The biosynthesis mechanism involving 2,3-pentanedione and aminoacetone describes the production of 2-ethyl-3,5-dimethylpyrazine and 2-ethyl-3,6-dimethylpyrazine by Bacillus subtilis[J].J Agr Food Chem,2020,68:2576-2587.
[61] XU J Z, YU H B, CHEN X L, et al.Accelerated green process of 2,5-dimethylpyrazine production from glucose by genetically modified Escherichia coli[J].ACS Synth Biol,2020,9(9):2576-2587.
[62]李晓欢,葛向阳,汤有宏,等.古井桃花曲中高产四甲基吡嗪功能微生物筛选及其发酵条件优化[J].酿酒,2016,43(3):52-56.
[63]李晓霞.汾酒大曲中高产四甲基吡嗪菌株的筛选及其在酿酒中的应用研究[D].太原:山西师范大学,2016.
[64]王晓丹,雷安亮,王婧,等.产四甲基吡嗪地衣芽孢杆菌的应用[J].中国酿造,2017,36(2):35-38.
[65]张温清,王永军,饶志明,等.宣酒芝麻香型白酒中吡嗪类健康功能因子的分析研究[J].酿酒科技,2014(8):37-39,42.
[66]卢君,张颖,李福荣,等.菌种强化结合工艺优化提高酱香白酒基酒中四甲基吡嗪含量的研究[J].中国酿造,2020,39(10):162-166.
[67]吴钱弟,吴茗花,沈毅,等.芽孢杆菌与酵母菌和根霉曲混合发酵提高四甲基吡嗪含量的研究[J].酿酒科技,2021(5):17-21,31.
[68]张颖.酱香型白酒高产四甲基吡嗪芽孢杆菌的筛选及应用[D].天津:天津科技大学,2021.
[69]范恩帝,黄魏,谢丹,等.酱香大曲中高产四甲基吡嗪微生物的选育及应用研究[J].酿酒科技,2022(11):45-50,71.
[70]梁慧珍,卢延想,刘正,等.高温大曲中高产吡嗪类物质芽孢杆菌的筛选与应用[J].中国酿造,2022,41(1):116-122.