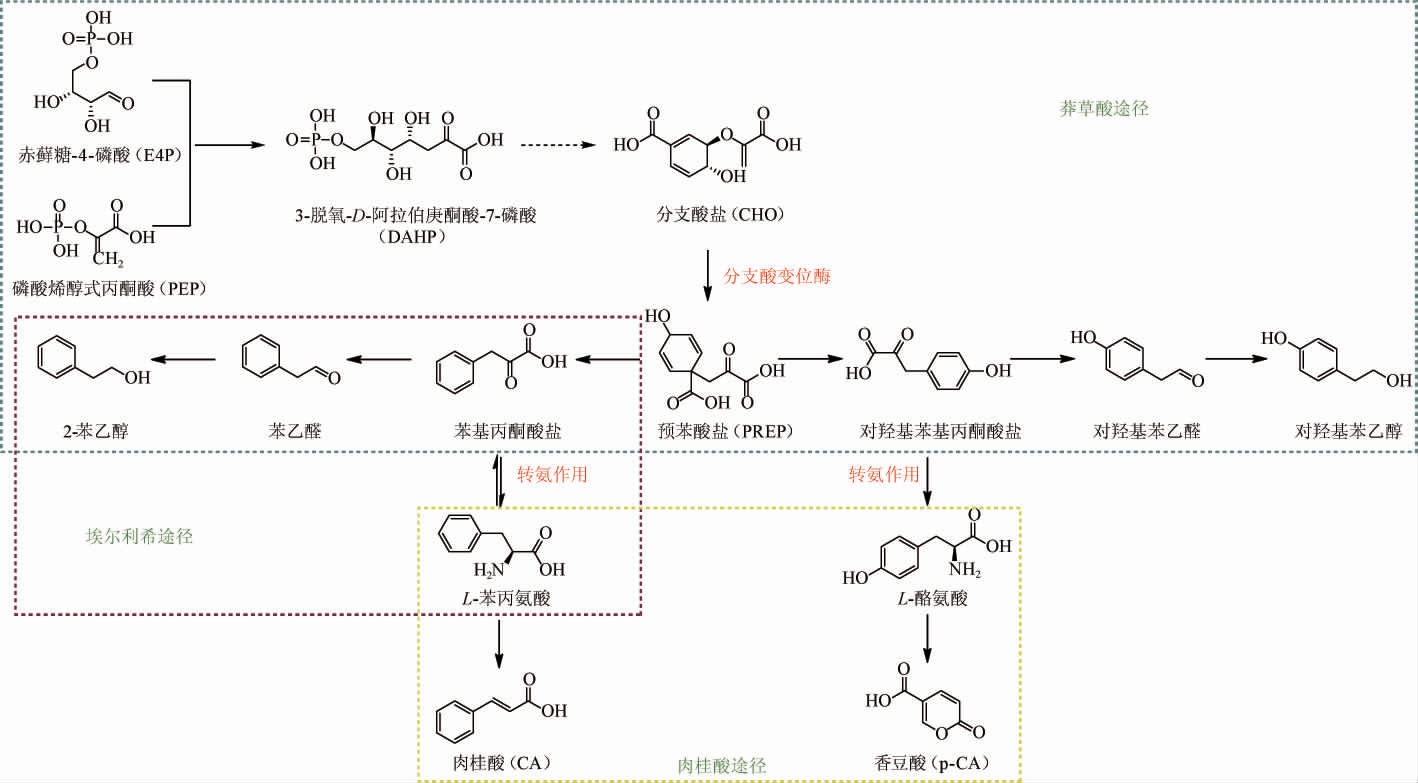
图1 马克斯克鲁维酵母菌代谢合成苯乙醇途径
Fig.1 Metabolic pathway of phenylethanol synthesis by Kluyveromyces marxianus
Research progress on metabolic mechanism of flavor substances in alcoholic beverages regulated by Kluyveromyces marxianus
酒精饮料深受广大消费者青睐。风味品质是决定酒精饮料价值的重要依据,而酒精饮料发酵所用的酵母菌在其风味物质形成过程中发挥着极其重要的作用[1]。目前常用的传统酵母菌主要为酿酒酵母(Saccharomyces cerevisiae),但研究发现,生产中S.cerevisiae与马克斯克鲁维酵母菌(Kluyveromyces marxianus)等野生酵母菌混合发酵可大大提高酒精饮料的风味品质[2]。
马克斯克鲁维酵母菌是一种在乳制品(开菲尔)中被分离得到的食品级安全酵母,被用于发酵食品、产酶、生产果糖、生物修复以及生产各种细胞产品等,且在系统发育上与S.cerevisiae相关,与使用较广泛的乳酸克鲁维酵母(Kluyveromyces lactis)是姊妹种[3]。此外已有大量研究表明,K.marxianus可代谢多种碳糖(葡萄糖、半乳糖、乳糖和菊糖等),从而能够对酿酒原料所含有的多种糖类进行反应。其生长速度迅速且能在38~45 ℃生存,具有突出的耐热性和乙醇发酵能力,以及具有产生多种芳香化合物(主要是酯类和醇类)和酶的能力,能够改善酒的风味和口感,提升品质,从而使这种微生物在食品加工业中成为一种合适的生物技术工具[4-5]。目前国内外研究者已经意识到这种微生物在产香方面的商业价值,对其代谢芳香化合物的机制进行了探究,然而,对其在实际应用中如何发挥最大发酵性能,使其产品的风味更丰满的探究并不深入,很多相关调控技术仍未能研究清晰,大大影响了K.marxianus在酿酒行业的投入使用。本文拟分析现有K.marxianus发酵酒精饮料产主要风味物质的代谢机制,探讨其酿酒发酵风味的调控技术以及阐述了K.marxianus在酒精饮料应用的发展趋势。希望为通过影响发酵风味的调控技术解决酒精饮料风味不足的问题提供有益的借鉴与参考。
酒精饮料的香气是由多种挥发性风味物质共同决定的。这些风味物质是在各种酶的作用下通过酵母细胞的合成代谢和分解代谢途径生成的,主要包括醇类、酯类、醛类、酸类、酚类等,其中高级醇和乙酸酯是影响酒精饮料特殊风味的两种重要化合物,且不同的酵母菌风味物质代谢途径的活性有一定的差异。高级醇提供“背景风味”,也是酯类形成的重要前体物质。乙酸酯及其他酯类会影响酒精饮料的果香和花香风味。目前研究者对K.marxianus的代谢途径研究不够充分,而对酿酒酵母研究较为详细,可为研究K.marxianus的基因、蛋白质、代谢途径奠定基础[6]。已知K.marxianus生产的芳香化合物被集中研究的有2-苯乙醇(2-phenethyl alcohol,2-PE)、2-苯乙基乙酸酯(2-phenethyl acetate,2-PEA)和乙酸乙酯[7]。
2-苯乙醇是一种酵母衍生化合物,已被证明会影响发酵饮料的香气和风味,呈玫瑰状香气,还可作为酒用香料额外添加到各类酒精饮料中[8]。酵母菌的2-PE生物合成主要包括莽草酸途径(shikimate pathway)和埃尔利希途径(Ehrlichpathway),其中最能有效合成的是Ehrlich途径(图1)。对于通过发酵生产2-PE,研究主要集中在S.cerevisiae和K.marxianus。这两种酵母菌均能通过莽草酸途径从糖从头合成2-PE,还可通过埃尔利希途径从L-苯丙氨酸(L-phenylalanine,L-Phe)生产更高含量的2-PE[9-10]。

图1 马克斯克鲁维酵母菌代谢合成苯乙醇途径
Fig.1 Metabolic pathway of phenylethanol synthesis by Kluyveromyces marxianus
1.1.1 莽草酸途径
莽草酸途径是由磷酸烯醇式丙酮酸(phosphoenolpyruvate,PEP)和赤藓糖-4-磷酸(erythrose-4-phosphate,E4P)缩合形成3-脱氧-D-阿拉伯庚酮酸-7-磷酸(3-deoxy-D-arabinoheptulosonic acid-7-phosphate,DAHP)而启动并通过一系列的酶促反应最终生成醇类[11]。DAHP通过一系列反应会生成分支酸盐,再由分支酸变位酶进行催化生成预苯酸盐。在该途径中存在的两种芳族2-含氧酸分别为苯基丙酮酸盐或对羟基丙酮酸盐是由预苯酸盐转化得来的,可通过进行转氨作用分别产生L-苯丙氨酸和L-酪氨酸,也可通过2-含氧酸脱羧酶的酶促反应生成苯乙醛或对羟基苯乙醛,进而再转化成苯乙醇或对羟基苯乙醇。然而,该途径涉及的反应复杂且存在多种抑制作用,产生的2-PE含量很低,因此不是酵母菌产2-PE的主要途径[12]。
1.1.2 埃尔利希途径
酵母生成高级醇主要通过Ehrlich途径。该途径是由埃利希在1906年首次提出的,且证明了高级醇是由氨基酸的分解代谢合成的[13]。K.marxianus通过转化不同的氨基酸底物,可以转化成不同的高级醇,如亮氨酸、蛋氨酸和L-苯丙氨酸转化成它们各自的杂醇:异戊醇、甲硫醇和2-苯乙醇[14]。如图1所示,K.marxianus生产的2-PE来源于L-Phe经氨基酸转氨酶生成的苯基丙酮酸。苯基丙酮酸的脱羧是埃利希途径的开始,经由α-酮酸脱羧酶去除碳酸基形成苯乙醛,最后由氧化还原酶还原成2-PE[15]。然而,当有除L-Phe外其他更容易消化的氮源存在时,L-Phe更容易通过肉桂酸途径代谢,从而会限制2-PE的形成[16-17]。
大量研究表明,酯类物质是酒类风味与品质的关键化合物之一,其中乙酸乙酯是最常见的酯,为白酒的四大酯之一,同时在葡萄酒的果香感知中起着关键作用[13]。在酿酒条件下,乙酸酯多由非酿酒酵母产生,是以生物合成为主[18]。K.marxianus在酯的生产方面有巨大的潜力,但在食品领域关于其生产乙酸酯的报道提及较少,同时该菌的风味积累代谢不如S.cerevisiae那样被人所知[19]。K.marxianus代谢产生最重要的酯是2-PEA、乙酸异戊酯和乙酸乙酯,分别由2-PE、异戊醇和乙醇合成[6]。
K.marxianus的代谢合成乙醇及乙酸酯途径具体表现为碳源底物经酵母菌的糖酵解途径生成丙酮酸盐,在丙酮酸盐脱羧酶的催化下生成乙醛,又通过脱氢酶生成乙醇经酯交换最终形成乙酸乙酯,而其他乙酸酯的生成则是由Ehrlich途径生成的高级醇酯化生成的(图2)[6]。另外,在醇类物质进行酯交换时,主要是乙醇或其他杂醇与乙酰辅酶A通过乙醇乙酰基转移酶(alcohol acetyltransferase,AATase)活性进行反应的,因此决定该菌生成乙酸酯的影响因素包括底物醇的种类和含量、乙酰辅酶A(coenzyme A,CoA)的水平以及AATase的表达[20]。
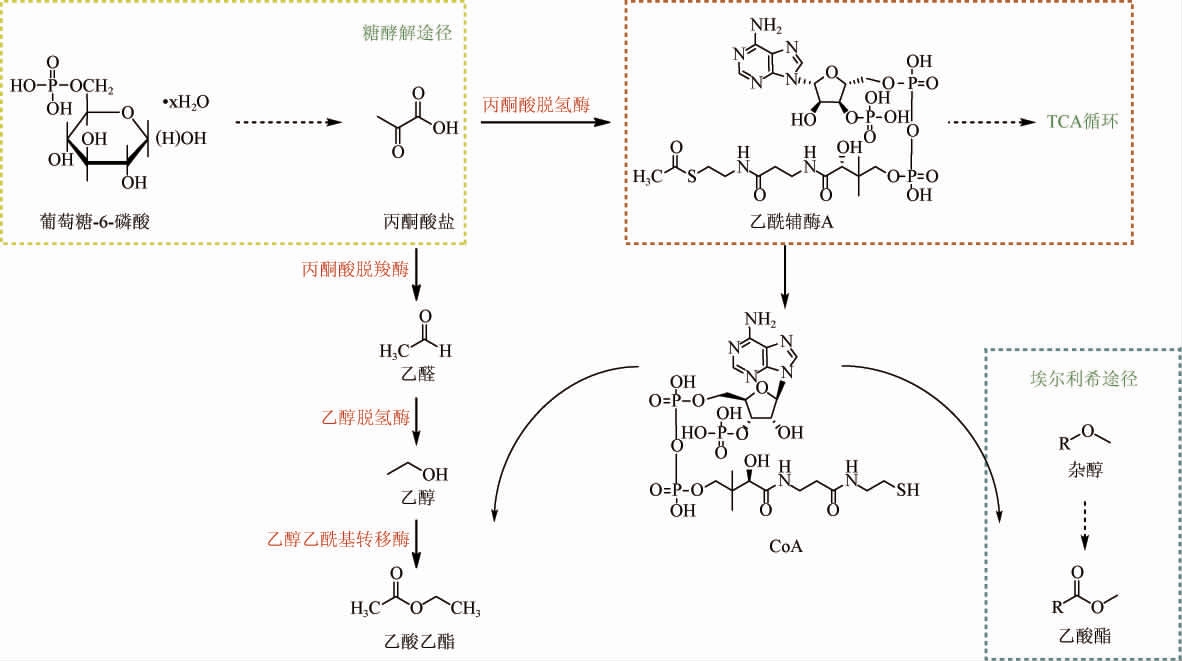
图2 马克斯克鲁维酵母菌代谢合成乙醇及乙酸酯途径
Fig.2 Metabolic pathway of ethanol and acetate synthesis by Kluyveromyces marxianus
合成的芳香化合物是每个微生物的特定代谢所固有的,合成代谢过程中涉及到的酶即使在不同类型中也具有相同的活性。K.marxianus和酿酒酵母均含有编码AATases的基因,其可变表达是确定发酵后最终形成酯的重要因素,并且组成AATase的基因主要是醇乙酰基转移酶编码基因ATF1和ATF2[21],而乙酰辅酶A主要有两种途径合成:①通过糖酵解(glycolytic pathway,EMP)途径生成的丙酮酸盐进入线粒体由丙酮酸脱氢酶(pyruvate dehydrogenase,PDH)促进生成的,然后可以进入三羧酸循环(tricarboxylic acid cycle,TCA);②丙酮酸盐通过丙酮酸脱羧酶催化生成乙醛,再由乙醛脱氢酶形成乙酸,最后可通过乙酰辅酶A合酶生成[22]。在苹果酒发酵中对比于S.cerevisiae,K.marxianus能降低乙酰辅酶A合成从乙酸盐和乙酰辅酶A进入TCA的代谢通量,从而增加乙酸乙酯和相关酯的合成[23]。
基于K.marxianus具有代谢多种碳糖、突出的耐热性和乙醇发酵能力以及生成醇类、酯类等风味物质的特性,将其应用于酒精饮料来达到改善风味的作用。为能使这些优良特性被充分的利用,明悉其酿酒发酵风味的调控技术显得尤为重要。在实际生产中,酒精饮料的风味调控因素包括在发酵过程中的接种方式、发酵温度以及最容易被忽视的营养素的添加等。
2.1.1 接种方式对风味的调控
K.marxianus在酿酒的研究中分为单菌发酵和混菌发酵两种方式。然而K.marxianus单菌接种在实际生产中使用较少,大多是以与S.cerevisiae或乳酸菌混合发酵的形式进行的。但对于马圭果汁和龙舌兰汁这些含糖种类多且不易被S.cerevisiae利用的原料,采用K.marxianus单菌发酵的效果更佳[24]。另外,K.marxianus的代谢通量是针对乙醇发酵而不是可以支持细胞生长的乙酰辅酶A合成,而在S.cerevisiae中,乙醇发酵和乙酰辅酶A合成途径均具有高度活性,因此K.marxianus单菌发酵的时间要比S.cerevisiae发酵酒精饮料所需的时间长[23]。
混菌发酵可以在提高发酵酒风味特性的同时高效率完成发酵过程,在生产中较为常见。采用混合发酵时,K.marxianus在发酵前期积累各种风味物质,随着发酵的进行会受到S.cerevisiae代谢产物的抑制作用、营养物质竞争作用等,其活菌数量会迅速下降[25]。然而两种菌的风味物质的积累会产生独特的风味,因此在利用K.marxianus生产不同酒精饮料时,工厂要根据发酵原料的不同选择适当的接种方式。
2.1.2 混菌发酵接种顺序和初始比例对风味的调控
采用混菌发酵方式时,发酵动力学的差异取决于不同菌种之间的接种顺序和初始比例,其会强烈影响发酵过程中酵母菌种的优势和持久性[26]。恰当的接种方式和初始比例才能使每种酵母菌均能发挥出最大的发酵性能,增加芳香化合物的种类和含量。
目前关于非酿酒酵母和酿酒酵母菌株主要有两种接种方法:①同时接种,即在发酵前同时接种两种酵母菌。该接种方式在黄酒发酵的应用中较为常见;其接种比例在1∶1和1∶20的共发酵试验中可以完成发酵,而在较高接种比例下可能存在发酵缓慢或停滞的风险[27]。刘梦[28]研究发现,K.marxianus与酿酒酵母1∶1同时接种发酵的黄酒口感最佳。②顺序接种,通常先接种非酿酒酵母,在发酵前期充分积累风味物质,间隔一段时间后接种酿酒酵母。顺序接种这种方式能够延长非酿酒酵母在整个发酵体系中的存活时间,缩短酒精发酵完成的时间,并能更有效地改善酒的品质和感官特性,因此在进行混菌发酵时顺序接种是最常使用的方法,大多数间隔48 h为最佳[29-30]。然而,使用两次接种会增加酿酒厂制酒的操作时间和操作步骤,期间易造成污染,在操作时也要着重注意污染的问题。特别的是,K.marxianus的耐热性有利于在高温下减少前期接种造成污染的机会,因此在进行接种时,酿酒厂可考虑在高温下进行操作[31]。
酵母菌的耐热性是酒精饮料工业发酵的关键特性。在一定程度上,升高温度能提高酵母菌胞内酶的活性、膜的流动性和生长代谢速率,能够加速风味物质的合成,形成不同种类和数量的酒类风味代谢产物[32]。以白酒为例,在入池发酵过程中由于微生物生长繁殖会产生生物热,发酵的实际温度最高可上升到45 ℃左右[33]。在发酵过程中,酵母的过早死亡可能导致高残余糖的停滞发酵,那么在众多可进行酒精发酵的非酿酒酵母菌株中,耐热性可以作为这些酵母菌的筛选指标特性。
FU X F等[34]研究发现,K.marxianus在30~45 ℃的温度下葡萄糖消耗量和乙醇产量在发酵的早、中期几乎没有差异,而在45 ℃的温度下的乙醇合成会在发酵晚期停滞。K.marxianus具有能在4~52 ℃的温度范围内生长(即耐热性高)的特性,有利于其在更高温度下进行同步糖化和发酵等步骤,也可防止热敏感的微生物生长,减少发酵过程中微生物的污染[4]。LI P S等[35]在高温发酵条件下对K.marxianus进行代谢组学的分析,发现该菌在高温发酵停滞后大部分代谢途径停止,但上调代谢物的途径富集分析显示与核黄素和氨基酸(甘氨酸、丝氨酸、苏氨酸、丙氨酸、天冬氨酸和谷氨酸)代谢相关的途径显著富集,表明高温条件下通过Ehrlich途径由不同氨基酸生成高级醇的相关代谢会显著加强。这种情况可通过令K.marxianus经受温度逐渐升高的重复长期培养,来提高其在高温发酵产乙醇的能力[36]。
酵母需要多种营养物质来维持其生存、生长和持续代谢活动。营养物质的组成和浓度对酵母菌进行酒精发酵和芳香物质的代谢有非常重要的作用。碳源是酵母菌产生CO2以及生物质或其他非酒精副产物的源头,目前已被大量研究,但氮源、维生素和其他微量元素也值得关注,这些营养物质的缺失会导致停滞或发酵缓慢。K.marxianus和S.cerevisiae之间存在对各种营养物质的竞争作用,且对营养物质的偏好不同。ROLLERO S等[37]证明了K.marxianus对氮源以及其他营养物质具有物种依赖性竞争,还强调了控制营养物浓度的重要性。因此,研究其他营养物质种类或浓度对K.marxianus合成风味物质的影响是有必要的。
2.3.1 氮源
氮是酵母发酵所需的重要营养物质之一,可以增加生物量的产量,刺激糖的利用率,而氮的缺乏直接影响酵母的发酵性能,尤其是对杂醇生产的影响显著[38]。因此,酵母同化氮化合物的可用性和性质是工艺管理的关键因素,可以通过添加不同的有机或无机来源来简单控制。
有研究发现,K.marxianus与S.cerevisiae表现出相同的氮源偏好,比如可消耗γ-氨基丁酸或少量铵[39]。氮源对2-PEA的水平有强烈的影响,当氮源是铵时,可以起到抑制AATase表达或活性的作用,此时只有非常少量的2-PEA被合成但同样由AATase活性合成的乙酸异戊酯没明显的N-效应,因为除2-PEA外,乙酸乙酯和其他重要的合成酯类的合成路线是碳代谢,而不是氮代谢;当使用葡萄糖/铵混合物时K.marxianus的生长速度会加快,另外使用酵母抽提物时,醇的含量会升高[20]。由于2-PE的天然合成水平相当低,由2-PE的代谢途径可知通过添加外源L-Phe,尤其是作为唯一的氮源,也会导致2-PE水平大大增加。
2.3.2 维生素
已知增加某些维生素的浓度可以改善葡萄酒发酵过程中酵母的发酵动力学和细胞活力。与所研究的其他营养素相比,维生素B1(硫胺素)对K.marxianus的发酵性能影响最为显著。硫胺素是一种特殊的水溶性维生素,在酒精饮料发酵过程中维持充足的外源添加水平对酵母发酵性能的有益影响已被充分报道[40]。酵母在某些环境条件下合成硫胺素的能力较差,如在葡萄酒发酵过程中,酵母需要足够的外源硫胺素来诱导最大的生长和发酵速率。在模拟酿酒条件下硫胺素能提高K.marxianus的发酵性能,是这种酵母菌维持最大细胞活力和发酵性能的必要条件,在0.25 mg/L硫胺素的饱和阈值时,表现对该酵母菌发酵性能的最大影响[41]。另外,维生素B7(生物素)也可能影响K.marxianus的生长代谢。METHNER Y等[42]研究发现,K.marxianus无法在啤酒中释放生物素,反而可能将麦汁原本所含的生物素用于自身的新陈代谢中,因此生物素也可能是K.marxianus的重要生长因子。
2.3.3 微量元素和应激因子
一些微量元素(比如镁、铁、锌)和应激因子(真菌毒素、黄曲霉素等)对K.marxianus的发酵效率有一定的影响,能够影响酵母生长、发酵速率、获得的乙醇产量、酵母絮凝行为和发酵期间对外界压力的耐受性。
LÖSER C等[43]通过K.marxianus发酵乳清残渣转化生产乙酸乙酯,说明了铁在这个过程中起重要作用,证明铁吸收动力学对于理解和控制酯合成过程具有重要的实际意义。另外,GSCHAEDLER A等[44]在K.marxianus发酵苹果酒的体系中添加镁、锌和氮后乙醇产量大量增加,证明这些营养物质是发酵所必需的,此外,又发现在不添加任何营养物质的情况下,K.marxianus是唯一能产生更多挥发性化合物的酵母。因此,从发酵酒的应用来看,微量元素也是影响K.marxianus发酵的较为重要的营养元素。
一些应激因子会影响酵母的发酵性能,如污染发酵培养基的真菌毒素。尽管许多酵母可以适应不利的生长条件,这种极端条件可能导致细胞死亡或生长减缓,还可能对产量和发酵指标产生不利影响[45]。JAKOPOVIC′ Ž 等[46]研究了黄曲霉毒素B1、赭曲霉毒素A和玉米赤霉烯酮对酿酒酵母和K.marxianus形态、生长参数和代谢活性的影响发现,在发酵的早期阶段,所有暴露于真菌毒素的酵母代谢活性和生物量生长都比对照低,但是发酵产物和生物量浓度在发酵结束时达到对照水平。
综上所述,发酵酒精饮料风味调控技术是提升产品风味品质的关键,不仅局限于接种方式、比例和温度等,也要注重额外营养素的添加,归根结底就是要安全且能提高菌株本身新陈代谢。采取适当的调控技术有利于充分发挥K.marxianus菌株的发酵性能,可缩短发酵时间、节约成本,更有利于减少K.marxianus停留在实验室阶段而很少实际应用的局限,有利于其在酒精饮料的实际投入生产。
奶啤是以牛乳为主要原料,由乳酸菌、酵母菌两步发酵而成的一种低酒精度、具有碳酸沙口感且质感细腻的新型乳饮料[47]。生产所使用的酵母菌能影响醇、酸、酯类等主要风味物质的产生,是奶啤产品发酵的关键菌种[48]。目前奶啤市场存在风味单一的问题,因此企业一直在寻找代谢产物丰富、酒精产量低、适合直接发酵的乳源酵母菌种作为发酵替代菌株,来降低成本,简化工艺,增加风味。何明迎[49]将K.marxianus应用到奶啤的发酵中,并对发酵工艺及稳定性进行优化,发现优化后的奶啤中的各种风味物质及其相对含量均显著提高,尤其是乙酸酯类和醇类相对含量显著增加,使香气成分更丰富,风味品质得到明显的提高。然而,奶啤的菌种优化和产香机制研究处于初步研究阶段,仍需研究者进行进一步的探究。
K.marxianus在葡萄酒发酵过程中具有高果胶酶活性,并且相比于酿酒酵母(S.cerevisiae)能产生更多的芳香化合物(如苯乙醇、乙酸异戊酯和乙酸乙酯等),使葡萄酒具有更多的果味或花香特征[50]。该菌不仅广泛应用于葡萄酒,也被应用于其他果酒的发酵。陈颖等[51]研究发现,经过K.marxianus发酵的柿子酒可提高芳香化合物的含量,还可生成新的高级醇、酯和酮类化合物,从而提升酒的品质。国外研究者发现K.marxianus对于马圭果汁具有高发酵能力,且发酵产生的乙醇浓度、乙醇产量、效率高于S.cerevisiae,被认为是手工生产马圭果汁酒的合适工具[52]。另外,对K.marxianus和S.cerevisiae发酵的苹果酒中的挥发性和非挥发性成分进行转录组分析,发现K.marxianus更能增加苹果汁发酵过程中高级醇、脂肪酸和酯的含量,尤其是提高乙酸乙酯、己酸乙酯、癸酸乙酯等乙酸酯的产量[23]。这些研究均可证明K.marxianus在不同种果酒发酵的应用潜力之巨大,可增加其对不同品种水果发酵酒产品的开发,以便在果酒产业中对该菌种的拓展使用。
K.marxianus也被应用于龙舌兰酒、乳清酒和米酸酒。研究发现以不同种类的龙舌兰物种为原料发酵蒸馏成酒时,S.cerevisiae不能发酵全部种类的龙舌兰汁,而K.marxianus能够全部发酵,且可以根据发酵的不同底物能产生高水平的乙醇、乙酸乙酯、高级醇和乙醛,比S.cerevisiae更适于某些龙舌兰酒的发酵[25]。已有研究表明,K.marxianus具有通过β-半乳糖苷酶代谢乳糖的能力,是进行乳清发酵的理想候选菌株,其在发酵酸乳清时和S.cerevisiae表现出相似的发酵速率,且K.marxianus产生了特殊的化学香气[53]。
无论是单菌还是混菌发酵试验,K.marxianus会影响酒精饮料中具有芳香特征成分的种类与含量。然而,绝大多数研究还停留在芳香物质数量上的变化,对影响风味的产香机制研究还远远不够,尤其是区别于不同种类、不同风格的酒精饮料关键风味物质的追踪。
K.marxianus作为一种能够利用多种碳源,增加酒精饮料的酯香、醇香,同时具有优秀的发酵能力的食品级安全产香酵母菌,在各类酒精饮料的实际应用逐渐增多。目前研究者在代谢方面对K.marxianus产香机制的探索相对较少,应基于基因组、转录组等组学信息和代谢建模数据来提高其相关生产力,尤其要填补在基因、酶和其他风味物质代谢通路及调控方面的知识空白,以便更好地应于食品领域。在酒精饮料发酵风味的调控技术中,研究者往往容易忽视营养素的添加。确定对K.marxianus菌株发酵性能至关重要的营养素,并随后确保足够的营养素水平是酒精饮料风味品质提升的一大关键,但不同种类的酒精饮料其具体关键风味物质和发酵条件有一定的差异,如何快速找到有效调控产香机制的关键技术仍需进一步研究。另外,在混合发酵的实际应用中不同菌株之间的相互作用是复杂多样的,因此利用组学技术分析蛋白、基因等表达差异研究K.marxianus与酿酒酵母或者乳酸菌之间代谢、生物量的相互作用机制是至关重要的。最后,利用K.marxianus能合成多种芳香化合物的特性,可考虑拓展其在生产香料和其他发酵食品的应用。未来应加强其在酒精饮料的实际应用,应充分挖掘该菌株的优良酿酒特性,并利用适当的调控技术使其发挥出最好的发酵性能,生产出风味品质更佳的酒类产品,以促进我国酿酒产业的良性发展。
[1]TRINDADE DE CARVALHO B,HOLT S,SOUFFRIAU B,et al.Identification of novel alleles conferring superior production of rose flavor phenylethyl acetate using polygenic analysis in yeast[J].mBio,2017,8(6):e01173-17.
[2]MARISA M,LUCILLA L,MARCO V,et al.Craft beer microflora identification before and after a cleaning process[J].J I Brewing,2011,117(3):343-351.
[3]SU M,HU Y,CUI Y,et al.Production of β-glucosidase from okara fermentation using Kluyveromyces marxianus[J].Food Sci Technol,2021,58(1):366-376.
[4] LENOEL L V, ARRUDA P V, CHANDEL A K, et al. Kluyveromyces marxianus:a potential biocatalyst of renewable chemicals and lignocellulosic ethanol production[J].Crit Rev Biotechnol,2021,41(8):1131-1152.
[5] MO W, WANG M, ZHAN R, et al. Kluyveromyces marxianus developing ethanol tolerance during adaptive evolution with significant improvements of multiple pathways[J].Biotechnol Biofuels,2019,12(1):63-78.
[6]MORRISSEY J P,ETSCHMANN M M,SCHRADER J,et al.Cell factory applications of the yeast Kluyveromyces marxianus for the biotechnological production of natural flavour and fragrance molecules[J].Yeast,2015,32(1):3-16.
[7]HO O  LU M.Study of increasing the production of volatile flavor compounds by the yeast Kluyveromyces marxianus through optimization of carbon and nitrogen sources[J].Food Health,2018,4(2):112-123.
LU M.Study of increasing the production of volatile flavor compounds by the yeast Kluyveromyces marxianus through optimization of carbon and nitrogen sources[J].Food Health,2018,4(2):112-123.
[8]CORDENTE A G,ESPINASE N D,SOLOMON M,et al.Aromatic higher alcohols in wine:implication on aroma and palate attributes during chardonnay aging[J].Molecules,2021,26(16):4979.
[9]CHREPTOWICZ K,STERNICKA M K,KOWALSKA P D,et al.Screening of yeasts for the production of 2-phenylethanol(rose aroma)in organic waste-based media[J].Lett Appl Microbiol,2018,66(2):153-160.
[10]WANG Y Q,ZHANG H,LU X,et al.Advances in 2-phenylethanol production from engineered microorganisms[J].Biotechnol Adv,2019,37(3):403-409.
[11]HASSING E J,BUIJS J,BLANKERTS N,et al.Elimination of aromatic fusel alcohols as by-products of strains engineered for phenylpropanoid production by 2-oxo-acid decarboxylase replacement[J].Metab Eng Commun,2021,13:e00183.
[12]杨琪琳,刘双平,赵禹宗,等.黄酒酵母β-苯乙醇合成途径醇脱氢酶I的异源表达及酶学特性[J].中国食品学报,2022,22(6):83-94.
[13]HAZELWOOD L A,DARAN J M,VAN MARIS A J,et al.The ehrlich pathway for fusel alcohol production: a century of research on Saccharomyces cerevisiae metabolism[J].Appl Environ Microbiol,2008,74(8):2259-2266.
[14] VALDEZ C M,TAHMASBI H,PACHAPUR V L,et al.Production of aroma and flavor-rich fusel alcohols by cheese whey fermentation using the Kluyveromyces marxianus and Debaryomyces hansenii yeasts in monoculture and co-culture modes[J].Chem Technol Biotechnol,2021,96:1-13.
[15]REBOLLO-ROMERO I,FERNÁNDEZ-CRUZ E,CARRASCO-GALÁN F,et al.Factors influencing the production of the antioxidant hydroxytyrosol during alcoholic fermentation:Yeast strain,initial tyrosine concentration and initial must[J].LWT-Food Sci Technol,2020,130:109631.
[16]MARTÍNEZ-AVILA O,SÁNCHEZ A,FONT X,et al.Bioprocesses for 2-phenylethanol and 2-phenylethyl acetate production:current state and perspectives[J].Appl Microbiol Biotechnol,2018,102(23):9991-10004.
[17]CHEN X R,WANG Z Y,GUO X N,et al.Regulation of general amino acid permeases Gap1p,GATA transcription factors Gln3p and Gat1p on 2-phenylethanol biosynthesis via Ehrlich pathway[J].J Biotechnol,2017,242:83-91.
[18]张华东.白酒发酵过程中主要微生物对酿酒酵母酯醇代谢的影响[D].天津:天津科技大学,2020.
[19] VILLARREAL-MORALES S L, MUÑIZ-MÁRQUEZ D B, MICHELMICHEL M,et al.Aguamiel a fresh beverage from agave spp.sap with functional properties[J].Nat Bever,2019,179-208.
[20] GETHINS L, GUNESER O, DEMIRKOL A, et al.Influence of carbon and nitrogen source on production of volatile fragrance and flavour metabolites by the yeast Kluyveromyces marxianus[J].Yeast,2015,32(1):67-76.
[21]REYES-SÁNCHEZ F J,PÁEZ-LERM J B,ROJAS-CONTRERAS J A,et al.Study of the enzymatic capacity of Kluyveromyces marxianus for the synthesis of esters[J].J Mol Microbiol Biotechnol,2019,29(1-6):1-9.
[22]樊婧婧,赵雨佳,王晨,等.酿酒酵母乙酰辅酶A精细调控合成萜类化合物研究进展[J].化工进展,2018,37(7):2773-2779.
[23] ZHANG Z, LAN Q, YU Y, et al.Comparative metabolome and transcriptome analyses of the properties of Kluyveromyces marxianus and Saccharomyces yeasts in apple cider fermentation[J].Food Chem Molecul Sci,2022,4:100095.
[24] ALCAZAR-VALLE M, GSCHAEDLER A, GUTIERREZ-PULIDO H,et al.Fermentative capabilities of native yeast strains grown on juices from different agave species used for tequila and mezcal production[J].Braz J Microbiol,2019,50(2):379-388.
[25]ALBERGARIA H,FRANCISCO D,GORI K,et al.Saccharomyces cerevisiae CCMI 885 secretes peptides that inhibit the growth of some non-Saccharomyces wine-related strains[J].Appl Microbiol Biotechnol,2010,86(3):965-972.
[26]BŁASZCZYK U,SATORA P,NOG A.Mixed cultures of Saccharomyces kudravzevii and S.cerevisiae modify the fermentation process and improve the aroma profile of semi-sweet white wines[J].Molecules,2022,27(21):7478.
[27]ZHAO Y Z,LIU S P,YANG Q L,et al.Effects of simultaneous inoculation of non-Saccharomyces yeasts and Saccharomyces cerevisiae jiangnan1#on overall quality,flavor compounds,and sensory analysis of Huangjiu[J].Food Biosci,2023,53:102539.
[28]刘梦.马克斯克鲁维酵母发酵黄酒特性研究及木糖转化工程菌株的构建[D].武汉:武汉轻工大学,2017:1-58.
[29]IVIT N N,LONGO R,KEMP B.The effect of non-Saccharomyces and Saccharomyces non-cerevisiae yeasts on ethanol and glycerol levels in wine[J].Fermentation,2020,6(3):77-99.
[30]PRADIPTA P,MANALI D,PRITAM K,et al.Recent advances in systems and synthetic biology approaches for developing novel ell-factories in non-conventional yeasts[J].Biotechnol Adv,2021,47:107695.
[31]王婧,高娉娉,田秀,等.粟酒裂殖酵母与酿酒酵母顺序接种发酵对干红葡萄酒品质的影响[J].食品与发酵工业,2021,47(9):84-90.
[32]郭建华,郭宏文,邹东恢,等.温度对酱香型白酒酒醅发酵过程中细菌菌群的影响[J].粮食与饲料工业,2019(2):29-32,36.
[33]YI Z,JIN Y,XIAO Y,et al.Unraveling the contribution of high temperature stage to jiang-flavor Daqu,a liquor starter for production of Chinese jiang-flavor Baijiu, with special reference to metatranscriptomics[J].Front Microbiol,2019,10:472.
[34]FU X F,LI P S,ZHANG L,et al.Understanding the stress responses of Kluyveromyces marxianus after an arrest during high-temperature ethanol fermentation based on integration of RNA-Seq and metabolite data[J].Appl Microbiol Biotechnol,2019,103(6):2715-2729.
[35]LI P S,TAN X W,FU X F,et al.Metabolomic analysis reveals Kluyveromyces marxianus' s stress responses during high-temperature ethanol fermentation[J].Process Biochem,2021,102:386-392.
[36]PATTANAKITTIVORAKUL S,TSUZUNO T,KOSAKA T,et al.Evolutionary adaptation by repetitive long-term cultivation with gradual increase in temperature for acquiring multi-stress tolerance and high ethanol productivity in Kluyveromyces marxianus DMKU 3-1042[J].Microorganisms,2022,10(4):798-817.
[37]ROLLERO S,BLOEM A,ORTIZ-JULIEN A,et al.Altered fermentation performances, growth, and metabolic footprints reveal competition for nutrients between yeast species inoculated in synthetic grape juice-like medium[J].Front Microbiol,2018,9:196-213.
[38] COMITINI F, AGARBATI A, CANONICO L, et al.Yeast interactions and molecular mechanisms in wine fermentation: a comprehensive review[J].Int J Mol Sci,2021,22(14):7754-7775.
[39] ROLLERO S, BLOEM A, ORTIZ-JULIEN A, et al.A comparison of the nitrogen metabolic networks of Kluyveromyces marxianus and Saccharomyces cerevisiae[J].Environ Microbiol,2019,21(11):4076-4091.
[40]OUGH,C S,DAVENPORT,M,JOSEPH,K.Effects of certain vitamins on growth and fermentation rate of several commercial active dry wine yeasts[J].Am J Enol Vitic,1989,40(3):208-213.
[41] LABUSCHAGNE P, ROLLERO S, DIVOL B.Comparative uptake of exogenous thiamine and subsequent metabolic footprint in Saccharomyces cerevisiae and Kluyveromyces marxianus under simulated oenological conditions[J].Int J Food Microbiol,2021,354:109206.
[42]METHNER Y,WEBER N,KUNZ O,et al.Investigations into metabolic properties and selected nutritional metabolic byproducts of different non-Saccharomyces yeast strains when producing nonalcoholic beer[J].FEMS Yeast Res,2022,22(1):042.
[43] LÖSER C, HAAS C, LIU W, et al.Uptake of iron by Kluyveromyces marxianus DSM 5422 cultivated in a whey-based medium[J].Eng Life Sci,2018,18(7):459-474.
[44]GSCHAEDLER A,IÑIGUEZ-MUÑOZ L E,FLORES-FLORES N Y,et al.Use of non-Saccharomyces yeasts in cider fermentation: importance of the nutrients addition to obtain an efficient fermentation[J].Int J Food Microbiol,2021,347(4):109169.
[45]BAUER E F,PRETORIUS L S.Yeast stress response and fermentation efficiency:how to survive the making of wine-A review[J].S Afr J Enol Vitic,2000,21(1):27-51.
[46]JAKOPOVIC′ Ž,HANOUSEKCˇICˇA K,MRVCˇIC′ J,et al.Properties and fermentation activity of industrial yeasts Saccharomyces cerevisiae, S.uvarum,Candida utilis and Kluyveromyces marxianus exposed to AFB1,OTA and ZEA[J].Food Technol Biotechnol,2018,56(2):208-217.
[47]WANG L,HE Y,SWANSON C S,et al.Optimization of medium composition and culture conditions for cell multiplication of a high quality milk beer fermentation yeast (Kluyveromyces marxianus)[J].Food Sci Technol Res,2020,26(3):351-361.
[48]WANG L,GAO E Y,HU M,et al.Isolation,identification and screening of high-quality yeast strains for the production of milk beer[J].Dairy Technol,2018,71:944-953.
[49]何明迎.奶啤菌种的优选、冻干菌粉的制备及奶啤发酵工艺的研究[D].镇江:江苏大学,2021.
[50] ERASMUS B, DIVOL B.Exploring the phenotypic diversity of oenological traits in Kluyveromyces marxianus strains[J].FEMS Yeast Res,2022,22(1):foac009.
[51]陈颖,陈晓明,等.不同酵母发酵对柿子酒、柿子醋风味的影响[J].保鲜与加工,2021,21(11):79-86.
[52]NOLASCO-CANCINO H,SANTIAGO-URBINA J A,WACHER C,et al.Predominant yeasts during artisanal mezcal fermentation and their capacity to ferment maguey juice[J].Front Microbiol,2018,9:2900.
[53]LUO S R,DEMARSH T A,DERIANCHO D,et al.Characterization of the fermentation and sensory profiles of novel yeast-fermented acid whey beverages[J].Foods,2021,10(6):1204.