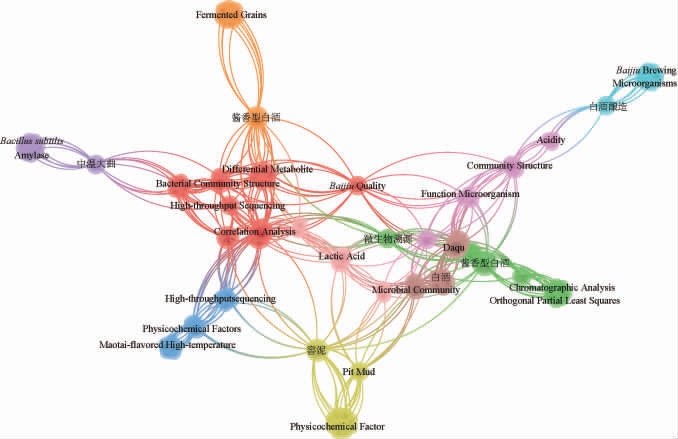
图1 白酒微生物研究热点和交互关系
Fig.1 Research hotspots and interactions of microorganisms in Baijiu
Research progress on microbial diversity during Baijiu brewing
中国白酒是世界六大蒸馏酒之一,经过几千年的发展,它在社会、经济、医疗、饮食等各个方面都发挥着不可替代的作用[1-2]。由于独特的酿造工艺,中国白酒可以分为酱香型、浓香型、清香型、米香型等四大基本香型,其中浓香型是最受欢迎的香型之一,原名泸州味白酒,因泸州老窖的特点而闻名[3-4]。由于酿造原料、发酵剂、发酵容器、酿造工艺、酿造环境的差异,使得白酒的微量成分具有多样性,从而产生出不同香型和口感的白酒[5-6]。
从知网上以“白酒”和“微生物”为主题,筛选了核心期刊和中文社会科学引文索引(Chinese Social Sciences Citation Index,CSSCI)的相关文献,共计847篇(2023年4月13日为节点)。使用VOSviewer可视化软件进行关键词绘图,得到“密度视图”见图1。图1中节点愈大表明以该关键词为重点的论文数量越多,可发现研究重点为酱香型/浓香型白酒、窖泥、中温大曲、微生物功能等。相比于其他蒸馏酒,中国白酒发酵周期最长,且是唯一使用多菌株酒曲为发酵剂,其他多为酵母(单株)发酵[7]。白酒的风味物质包括挥发性和非挥发性成分,由微生物发酵产生。在白酒的酿制过程中,发酵是一个复杂的过程,对酒的风味起着至关重要的作用。发酵过程涉及到微生物主要可分为窖泥微生物、大曲微生物、糟醅微生物和环境微生物。微生物的多样性调控着酒酿造过程中微量成分的组成,决定着白酒的风味和口感,在整个发酵过程中各不相同[8-9]。

图1 白酒微生物研究热点和交互关系
Fig.1 Research hotspots and interactions of microorganisms in Baijiu
本文重点综述了白酒中微生物多样性的研究方法,酿造过程中涉及的微生物的多样性。此外,还介绍了微生物间的相互作用,以及微生物群落对酒风味的影响。本文为白酒酿造中涉及的微生物研究提供了较全面的概述,为白酒品质提升提供了理论数据支撑。
传统的研究方法多依赖于可培养技术从白酒发酵中分离进行物种鉴定,但是对酒中的微生物种群应用受限,自然界能够实现纯菌培养的占少数[10-11]。随着分子生物技术的发展,广泛利用实时荧光定量聚合酶链式反应、基因克隆技术、组学技术,甚至和超高效液相色谱、质谱等高精仪器联用来进行白酒中微生物多样性的鉴定。组学技术包括宏基因组学技术、蛋白组学和代谢组学等,其中的宏基因组学技术通过高通量测序技术进行分析。
高通量测序技术又称“下一代”测序技术("Next-generation"sequencing technology,NGS),是第二代测序,一次可测序几十万至上百万的核酸序列,是传统的Sanger测序方法的巨大发展[12]。ZHAO W H等[13]采用第三代高通量测序技术,同时具有高通量、高效率、长读长的优势,对不同发酵时间的酒曲和豉香型白酒中的微生物种群进行了鉴定,结果显示,豉香型白酒中真菌的多样性不及细菌,而发酵中的酵母菌(Yeast)、复膜孢酵母菌属(Saccharomycosis)、丝孢酵母菌属(Trichosporon)、假丝酵母菌属(Candida)等优势菌属则均来自酒曲。宏基因组学技术是基于NGS在特定环境下进行微生物基因组学分析的一种方法。TIAN N等[14]利用宏基因组学分析了不同发酵批次的十里香白酒大曲中细菌的多样性,结果表明发酵30 d后,有四批十里香白酒大曲样品中厚壁菌门(Firmicutes)为优势门;确定了发酵温度和时间等环境条件对微生物分布的影响;证实十里香白酒大曲中细菌有促进代谢、遗传信息处理和环境信息处理的主要作用。
通过对基因组学(Genomics)、代谢组学、蛋白组学、转录组学(Transcriptomics)等数据整合,可以揭示白酒中的微生物种群组成和基因表达,从而优化发酵过程,提高白酒的品质。田瑞杰等[15]利用宏转录组学(Macro-transcriptomics)对浓香型白酒酒醅中活性微生物群落及其空间异质性进行了研究,表明了酒醅中细菌和真菌的种属组成,且空间异质性相差较小。单组学分析具有局限性,但利用两种及以上的组学技术——多组学研究可以从多个层面揭示发酵微生物的多样性,包括物种、基因和代谢产物等,进而实现白酒微量成分的调控。LIU X G等[16]采用扩增子测序(Amplicon Sequencing)、宏蛋白组学(Macroproteomics)和代谢组学等多组学技术,结合理化指标分析了泸州老窖酒醅中的核心功能菌——乳酸杆菌(Lactobacillus)的“自我净化”及在泸州白酒风味中的关键作用,为分析发酵时长与原酒品质的关系提供了基础数据。
尽管微生物多样性的探究方法存在局限性,但随着现代分子技术的不断发展,各种现代分子技术的结合使研究结果具有高效性、准确性、灵敏性、可重复性等优势。利用多种技术对发酵微生物的揭示,可展现发酵过程的微生态轨迹,实现有效成分的控制。这些技术的应用不仅可以深入了解发酵过程中微生物群落的生态学特征,还能有效控制发酵过程中的微生物代谢,从而提高白酒的品质和风味。
中国白酒酿造过程中,菌群与其生存所处的微环境共同组成了符合物质循环、能量流动和信息传输的微生态系统。源于窖泥、曲药以及环境的各种微生物,通过持续的菌群迁移、演化和代谢物质传递,在糟醅中达到平衡,形成独特的糟醅微生物区系,随着平衡的产生,最终实现了固态白酒发酵生产的基本过程。可以说,浓香型白酒微生态系统是由大曲、窖泥以及酿酒生产现场环境微生物共同演化而来的糟醅微生物区系所组成的。窖池中主要功能菌的存在状态,尤其是曲药微生物和窖泥微生物,是糟醅微生物生态形成的基础。窖池中的所有微生物以及它们所处的特定的窖池环境,组成了相互作用、相互联系的统一体,也就是窖池微生物生态系统。
浓香型白酒(strong-flavor Baijiu,SFB)如泸州老窖、剑南春、五粮液等,采用固态发酵技术[17]。窖池的理化性质影响着窖泥的品质,而窖泥的品质和窖龄又决定着窖泥中微生物的组成,这些微生物与酒的品质密切相关[18]。窖泥中微生物种类组成丰富,为微生物的生长代谢提供了良好的环境。由于微生物组成的多样性,其代谢途径和代谢产物也具有丰富性,可为白酒提供良好的香气组成。细菌和古菌是浓香型白酒窖泥中的主要微生物组成,其中厚壁菌门的梭状芽孢杆菌(Clostridia)是最为丰富的细菌类型,其次是拟杆菌门(Bacteroidetes)中的拟杆菌纲(Bacteroidia)[19-20]。
采用测序技术对窖泥中的微生物群落进行分析可知,其丰富度不断提高,组成也逐渐变化并趋于稳定。不同窖龄的窖泥微生物组成见表1。在泸州老窖的40年和400年发酵池的窖泥中,优势微生物属组成未发生大改变,但在400年的窖泥中的甲烷短杆菌属(Methanobrevibacter)、己酸菌属(Caproiciproducens)平均相对丰度分别增加了117.07%和51.42%,其余优势微生物属比例大都略有下降[21]。Methanobrevibacter和Caproiciproducens共同出现时窖泥样品中有最高的己酸水平,可能表明较老的窖池中具有更多产己酸的菌,是影响SFB质量的关键成分己酸乙酯的重要来源[24]。在泸州白酒中Caproiciproducens和产甲烷古菌(Methanosarcina)同样随着窖龄的增加丰度逐渐增加[19]。枝江白酒共鉴定出73个细菌属,细菌总数不断增加。与泸州白酒不同,克氏梭菌(C.kluyveri)和Clostridiumcluster IV是产己酸菌,在10年、20年、30年的窖泥中数量也是递增的,致使老窖池的窖泥中白酒中己酸乙酯含量升高[20,22]。
表1 不同窖龄和地区白酒窖泥优势微生物
Table 1 Dominant microorganism in Baijiu pit mud with different ages and regions

窖龄 窖泥 优势菌 参考文献30 40/400 10 20 30 30泸州白酒[19,21]枝江白酒[22]仰韶陶融型白酒Caproiciproducens、Syntrophomonas、Lactobacillus、Methanomicrobia、Methanosarcina Methanobrevibacter、Caproiciproducens、Petrimonas、Lactobacillus、Sedimentibacter、Proteiniphilum、Syntrophomonas、Aminobacterium、Christensenellaceae R-7、Caldicoprobacter、Olsenella Syntrophaceticus、Firmicutes Clostridium cluster IV、Firmicutes、Caloramator、Aminobacterium Firmicutes、Clostridium IV、Caloramator、Aminobacterium、Ruminococcaceae Hydrogenispora、Petrimonas、Caproiciproducens、Lactobacillus、Proteiniphilum [23]
分类操作单元(operational taxonomic unit,OTU)数量、Chao1和ACE指数是用于表示窖泥中微生物丰富度的常用指标。在窖池中,不论窖龄,随着深度的增加,OTU数量、Chao1和ACE指数呈现先增后降的趋势。具体而言,胡晓龙等[25]对河南某酒厂的窖泥采样,自上而下,40年窖龄的窖泥α多样性指数在中层达到最大值,微生物多样性和丰富度最高,而4年窖龄的Shannon指数、ACE指数的最大值在底层,原核微生物主要生长在底层。同时,低层次的窖泥α多样性指数低于高层次的窖泥。此外,胡晓龙等[26]在另一酒业的6年和12年窖池的不同深度的窖泥研究中发现,底层具有最高的物种多样性,中层丰富度最高,同层次的物种多样性相差不大。
大曲是中国白酒糖化发酵的主要发酵剂,采用自然接种,对环境具有极强的依赖性[27-28]。大曲根据其形状、工艺、风味特征、发酵温度等特点具有不同的分类方式,如图2所示,经过自然培养后,大曲富含丰富的微生物组成,为酒醅发酵提供微生物、功能酶系及风味物质[29]。大曲发酵处于开放的环境,因此细菌、霉菌(Moulds)、酵母等含量丰富。“糖化靠霉菌,发酵靠酵母,生香靠细菌”,完美阐释了大曲中微生物的相互作用[30]。同时,放线菌(Actinomycestes)具有多种代谢活性,包括糖类物质的水解及产生各级代谢产物[31],是大曲中微生物代谢的重要组成部分。
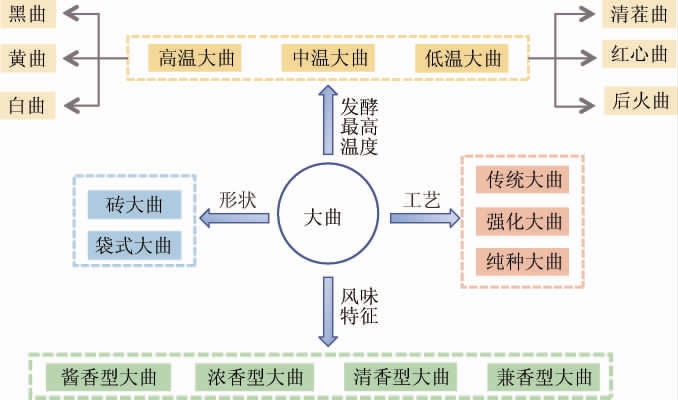
图2 白酒大曲按不同特点的分类
Fig.2 Classification of Baijiu Daqu according to different characteristics
由于不同地区的白酒大曲受到地理环境、发酵原料和方式的影响,其发酵过程中的微生物优势菌属存在差异。根据不同的制曲温度,可以分为高温大曲、中温大曲和低温大曲(表2)。乳酸是生成乳酸乙酯的重要物质,可以降低白酒的刺鼻口感,增加醇厚感和甜味,并提高白酒的品质[35]。在大曲发酵的初期,不同菌群中的乳酸菌和芽孢杆菌(Bacillus)等占据着主导地位,它们能够将糖类转化为乳酸,同时增加有机酸的含量,使总酸度上升,糖和淀粉含量下降。然而,随着环境条件的变化,好氧菌的生长受到抑制,而厌氧菌、兼性厌氧菌和耐酸菌的生长代谢则得到刺激[36]。在杜康白酒的大曲[37]发酵前期,以泛菌属(Pantoea)、葡萄球菌(Staphylococcus)、魏斯氏菌(Weissella)、乳杆菌(Lactobacillus)为优势菌属;发酵后期,优势菌属并未发生大改变,相对丰度提高,以融合魏斯氏菌(Weissella confuse)、植物乳杆菌(Lactobacillus plantarum)、短乳杆菌(Lactobacillus brevis)、消化乳杆菌(Lactobacillus alimentarius)、葡萄球菌(Staphylococcus)为优势菌。
表2 不同白酒大曲的优势微生物
Table 2 Dominant microorganism of different Baijiu Daqu

大曲 优势菌属 参考文献浓香型白酒(中温大曲)酱香型白酒(高温大曲)清香型白酒(低温大曲)浓香型强化大曲Weissella、Lactobacillus、Pediococcus、Leuconostoc、Staphylococcus、Enterobacter Rhizobium、Bacillus、Lentibacillus、Pantoea、Kroppenstedtia、Thermoactinomyces、Weissella、Lactobacillus、Saccharopolyspora、Oceanobacillus Lactobacillus、Pseudomonas、Bacillus、Kroppenstedtia、Thermoleophilum、and Acinetobacter Rhizopus、Thermoascus、Saccharomycopsis、Weissella、Pantoea、Saccharopolyspora[32][33][34][53]
在实际生产中,传统大曲主要依靠自然网络富集周围环境微生物,其微生物群落具有一定的局限性,其糖化能力和酯化能力存在上限。因此,可以采用功能菌株强化大曲,通过改变初始微生物比例来实现大曲发酵品质的改善,进而影响微生物群落的演替进程。在茅台大曲中接种功能酵母,如酿酒酵母菌(Saccharomyces cerevisiae),异常威克汉姆酵母菌(Wickerhamomyces anomalus),库德里阿兹威毕赤酵母菌(Pichia kudriavzevii),扣囊复膜酵母菌(Saccha-romycopsis fibuligera),这些酵母菌可以增加腈水解酶的含量,并显著降低大曲中氰化物的含量。此外,异常威克汉姆酵母菌具有良好的香气和产酶特性,可以改善白酒的香气[38-39]。
酒醅是白酒蒸馏的原料,其发酵阶段可分为高温堆积发酵和入窖密封发酵。其中,高温堆积发酵是好氧发酵,入窖密封发酵是无氧发酵。堆积发酵需要满足糖化、发酵和生香条件[40],为入窖发酵提供必要的微生物和发酵前体物质。李喆等[41]研究发现,堆积发酵后,酒醅的表层具有数量巨大的微生物。在整个白酒的发酵过程中,酒醅是酿酒物料循环、能量流动以及酿酒微生物代谢的重要载体[42]。酒醅发酵过程中,来自大曲、窖泥、周围环境的微生物起着关键作用,能够分解谷物中的淀粉、纤维素、糖类和蛋白质,产生有机酸和香味。因此,酒醅中的微生物是酿造过程中产生香味物质的重要驱动力,其数量、群落结构、生态演替和相关的代谢活动直接影响着白酒的香味质量。基于扩增子测序、宏蛋白组学和代谢组学等多组学技术分析了泸州白酒酒醅中的微生物多样性,酒醅群落演替表明乳酸菌,魏斯氏菌(Weissella)和芽孢杆菌为主要细菌群,真菌群落结构的演替方向是以伊萨酵母属(Issatchenkia),酿酒酵母属(Saccharomyces),根霉属(Rhizopus)和曲霉属(Aspergillus)为主,以Kazachstania、酿酒酵母属(Saccharomyces)和毕赤酵母属为发酵过程中的主要替代者[43]。此外,在中国其他风味白酒中,乳酸菌也是主要的菌种,其原因可能在于发酵基质(高梁和小麦)以及类似的发酵生态系统。
在白酒发酵过程中,微生物间的相互作用会致使微生物的动态变化,进而影响发酵系统的稳定性。微生物与微生物及发酵环境间,经过长期驯化逐步形成一个持续变化又相对稳定的微生物群落结构。发酵过程中,微生物群落的作用可以分为直接接触的直接相互作用和通过引起环境物理化学性质变化触发其他微生物反应的间接相互作用。微生物间的相互作用一般分为共生、拮抗作用,即正反相互作用。正相互作用主要发生在有利于发酵的微生物种属之间,通常表现为微生物的代谢物对其他菌落产生正面影响,如酵母菌和乳酸菌。乳酸菌对营养的要求很高,需要氨基酸、不饱和脂肪酸和维生素,因此在营养较少的情况下,乳酸菌的繁殖会受到限制。然而,与酵母菌共存时,酵母菌可以分泌蛋白酶(Protease),并能有效分解蛋白质产生氨基酸和其他生长因子,弥补了乳酸菌仅靠乳糖代谢而成长缓慢的缺点[44]。乳酸菌由于缺乏过氧化氢酶(Catalase),因此对氧化环境非常敏感。而酵母菌则因含有过氧化氢酶,能够缓解乳酸菌的氧化压力,并通过消耗液体中的氧气形成局部厌氧环境,为乳酸菌提供良好的生长条件。在发酵后期,酵母菌还会进行无氧呼吸生成CO2,从而阻碍了外界环境中的氧气进入发酵液,为乳酸菌创造了良好的生长环境,促进乳酸菌生长繁殖[45]。乳酸菌产生乳酸,降低反应液的酸度,促进酵母菌的生长。同时,多种酵母存在时也会产生互相促进的效果。在酵母营养竞争的过程中,可能是由于酵母之间对营养物质的非特异性竞争和酿酒酵母产生的代谢物(如乙醇)的抑制,对非酵母微生物具有拮抗作用,酵母菌的活性会得到加强,从而可以产生大量乙酸和乙醇,生成乙酸乙酯等风味物质[46]。
拮抗作用一般是通过代谢产物的累积而影响微生物的生长,如乳酸菌产生的乳酸会逐渐降低发酵液的酸度,进而对一些杂菌产生拮抗作用,减少发酵液中因杂菌污染而引起的安全问题[47]。另外,酵母菌在发酵过程中产生的乙醇和其他代谢产物,如乙酸等,也可以对杂菌产生拮抗作用,减少杂菌的生长。
微生物的代谢活动赋予白酒独特的口感和香气。乳酸杆菌在生长发育过程中会消耗糖类,通过己糖磷酸途径产生乳酸。乳酸和乙醇在酯化酶的作用下生成乳酸乙酯,而己酸和乙醇脂肪酶的作用下生产己酸乙酯。此外,红曲霉属(Monascus)和毕赤酵母属(Pichia)也是具有酯化能力的功能真菌。乳酸乙酯、己酸乙酯、丁酸乙酯和乙酸乙酯是酒醅中酯类物质的主要组成[48],是白酒中主要挥发性香味物质,在提高白酒的醇度和香味方面扮演着重要角色。高级醇又是酒中不可或缺的香气和口感成分,是酯类物质的合成前体,可以提高白酒口感的协调性和酒体的饱满度。异常威克汉姆酵母(W.anomalus)可产生高级醇,而地衣芽孢杆菌(Bacillus licheniformis)和贝莱斯芽孢杆菌(Bacillus velezensis)可降低高级醇含量,解决了小曲白酒中高级醇含量高对品质的影响[49-50]。在中国白酒中,有机酸含量是微量的,却是白酒中的一类重要的香味成分,对酒的风味与风格有着决定作用,同时也是酯的前驱物。酸是随着酒精发酵产生的,适量的酸可以促进酯的形成,使白酒更醇厚,回味更长。毕赤酵母属和酿酒酵母属与乳酸呈现正相关,乳酸片球菌(Pediococcus)与乙酸呈现正相关[51]。此外,白酒中生产的各个阶段都伴有功能性成分四甲基吡嗪的生成,主要来自微生物枯草芽孢杆菌(Bacillus subtilis)的代谢[52]。四甲基吡嗪是白酒重要风味物质的组成成分,赋予白酒一定的健康功效。
白酒中酒精和各种风味物质的产生都是以微生物代谢为基础的。微生物在白酒的酿制过程中发挥着至关重要的作用,它们通过不同的代谢途径,将原料中的糖类分解成酒精和其他香味物质。酒精和其他香味物质的存在以一定的方式对白酒的香味、口感、风格和品质产生着决定性的影响。窖泥微生物群落、大曲微生物群落以及糟醅微生物群落是白酒酿制过程中三个重要的微生物群落类型,它们各司其职,相互作用,将原料进行发酵,分解糖类,通过不同的代谢途径,产生不同的香气物质,赋予白酒醇厚感和回味感[53]。
白酒微生物多样性十分丰富,这种多样性体现在不同发酵阶段的同一性菌种和差异性菌种上。这些微生物在白酒的发酵过程中具有丰富的功能性,其代谢产物也表现出良好的风味。目前,对于白酒微生物多样性的研究已经涵盖了多个领域,包括微生物群落结构的变迁、丰富的风味成分和有益代谢物动态变化的鉴定。深入了解白酒中复杂的微生物区系以及微生物与微生物、发酵环境之间的相互作用也是当前研究的热点。从白酒的微生物多样性中筛选出生产所需要的菌株,研究其功能特性,并进行功能性接种,实现强化作用也是研究的热点之一。
[1]SHI X S,ZHAO S M,CHEN S X,et al.Tetramethylpyrazine in Chinese Baijiu:Presence,analysis,formation,and regulation[J].Front Nutr,2022,9:1004435.
[2] XU H Y, LI Q, YU Y G, et al.A thermodynamic and kinetic study on electrochemical esterification in aroma-enhanced distilled liquor (Baijiu)[J].Catalysts,2023,13(3):478.
[3]WANG J S,CHEN H,WU Y S,et al.Uncover the flavor code of strongaroma Baijiu: Research progress on the revelation of aroma compounds in strong-aroma Baijiu by means of modern separation technology and molecular sensory evaluation[J].J Food Compos Anal,2022,109:104499.
[4]SUN H L,NI B,YANG J G,et al.Nitrogenous compounds and Chinese Baijiu:a review[J].J I Brewing,2022,128(1):5-14.
[5] LIU H L, SUN B G.Effect of fermentation processing on the flavor of Baijiu[J].J Agr Food Chem,2018,66(22):5425-5432.
[6]LI H H,QIN D,WU Z Y,et al.Characterization of key aroma compounds in Chinese Guojing sesame-flavor Baijiu by means of molecular sensory science[J].Food Chem,2019,284:100-107.
[7]JIN G Y,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[8]TU W Y,CAO X N,CHENG J,et al.Chinese Baijiu:The perfect works of microorganisms[J].Front Microbiol,2022,13:919044.
[9]XU Y Q,SUN B G,FAN G S,et al.The brewing process and microbial diversity of strong flavour Chinese spirits:a review[J].J I Brewing,2017,123(1):5-12.
[10] LI H D,LIU S Y,LIU Y B, et al.Functional microorganisms in Baijiu Daqu: Research progress and fortification strategy for application[J].Front Microbiol,2023,14:1119675.
[11]山其木格,唐平,王丽,等.微生物分析技术及其在酱香型白酒中的应用进展[J].中国酿造,2021,40(5):18-25.
[12] PENG H, ZHANG J.Commercial high-throughput sequencing and its applications in DNA analysis[J].Biologia,2009,64(1):20-26.
[13]ZHAO W H,LIANG Z,QIAN M,et al.Evolution of microbial communities during fermentation of Chi-flavor type Baijiu as determined by high-throughput sequencing[J].LWT-Food Sci Technol, 2022, 170:114102.
[14]TIAN N,GUO X,WANG M Z,et al.Bacterial community diversity of shilixiang Baijiu Daqu based on metagenomics[J].J Food Biochem,2020,44(10):13410.
[15]田瑞杰,张勇,冯大鸿,等.基于宏转录组学的浓香型白酒酒醅活性微生物群落空间异质性研究[J].轻工学报,2022,37(1):1-11.
[16] LIU X G, MA D N, YANG C, et al.Microbial community succession patterns and drivers of Luxiang-flavor Jiupei during long fermentation[J].Front Microbiol,2023,14:1109719.
[17]杜海.产土味素菌群对白酒酿造的影响机制及监测控制[D].无锡:江南大学,2013.
[18]吴浪涛,丁文骏,谢专,等.不同时期窖泥理化因子、风味物质和细菌组成的相关性[J].微生物学通报,2022,49(3):1030-1047.
[19]CHAI L J,QIAN W,ZHONG X Z,et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production of strong-flavor Baijiu[J].Appl Environ Microbiol,2021,87(17):e0088521.
[20]TAO Y,LI J,RUI J,et al.Prokaryotic communities in pit mud from different-aged cellars used for the production of Chinese strong-flavored liquor[J].Appl Environ Microbiol,2014,80:2254-2260.
[21] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2018,102:68-76.
[22]TAN G X,HU Y L,HUANG Y N,et al.Analysis of bacterial communities in pit mud from Zhijiang Baijiu distillery using denaturing gradient gel electrophoresis and high-throughput sequencing[J].J I Brewing,2020,126(1):90-97.
[23] LIU Y B, SUN M X, HOU P, et al.Analysis of microbial community structure and volatile compounds in pit mud used for manufacturing Taorong-type Baijiu based on high-throughput sequencing[J].Sci Rep,2022,12(1):7347.
[24] HU X, DU H, XU Y.Identification and quantification of the caproic acid-producing bacterium Clostridium kluyveri in the fermentation of pit mud used for Chinese strong-aroma type liquor production[J].Int J Food Microbiol,2015,214:116-122.
[25]胡晓龙,余苗,王康丽,等.浓香型白酒窖泥微生物群落多样性及理化因素对其影响[J].食品研究与开发,2021,42(2):178-185,204.
[26]胡晓龙,王康丽,余苗,等.基于高通量测序的浓香型窖泥原核微生物群落的窖池空间分布[J].中国酿造,2020,39(6):167-172.
[27]XIAO C,LU Z M,ZHANG X J,et al.Bio-Heat is a key environmental driver shaping the microbial community of medium-temperature Daqu[J].Appl Environ Microbiol,2017,83:e1550-e1617.
[28] JIN G,ZHU Y,XU Y.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[29] WANG B W, WU Q, XU Y, et al.Specific volumetric weight-driven shift in microbiota compositions with saccharifying activity change in starter for Chinese Baijiu fermentation[J].Front Microbiol, 2018, 9:2349.
[30] CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Front Microbiol,2021,11:592421.
[31]CHEN C,YANG H,LIU J,et al.Systematic review of Actinomycetes in the Baijiu fermentation microbiome[J].Foods,2022,11:3551.
[32] YANG J G, DOU X, MA Y.Diversity and dynamic succession of microorganisms during Daqu preparation for Luzhou-flavour liquor using second-generation sequencing technology[J].J I Brewing, 2018, 124:498-507.
[33] ZOU Q C,HUANG Y G,MIN G.Evaluation of bacterial diversity during fermentation process: a comparison between handmade and machine-made high-temperature Daqu of Maotai-flavor liquor[J].Ann Microbiol,2020,70(1):https://doi.org/10.1186/s13213-020-01598-1.
[34] XUE Y, TANG F X, CAI W C, et al.Bacterial diversity, organic acid,and flavor analysis of Dacha and Ercha fermented grains of Fen flavor Baijiu[J].Front Microbiol,2022,12:https://doi.org/10.3389/fmicb.2021.769290.
[35]WANG X S,DU H,XU Y.Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J].Int J Food Microbiol,2017,244:27-35.
[36] XIAO C, YANG Y, LU Z M, et al.Daqu microbiota exhibits speciesspecific and periodic succession features in Chinese Baijiu fermentation process[J].Food Microbiol,2021,98:103766.
[37] MAO J J,LIU X L,GAO T,et al.Unraveling the correlations between bacterial diversity,physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J].LWT-Food Sci Technol,2022,154:112764.
[38] LI H D,LIU S Y,LIU Y B, et al.Functional microorganisms in Baijiu Daqu: Research progress and fortification strategy for application[J].Front Microbiol,2023,14:https://doi.org/10.3389/fmicb.2023.1119675.
[39] SHEN T, WU Q, XU Y, et al.Biodegradation of cyanide with Saccharomyces cerevisiae in Baijiu fermentation[J].Food Control,2021,127:108107.
[40]沈怡方.白酒生产技术全书[M].北京:中国轻工业出版社,1998:90-110.
[41]李喆,冯海燕,吴德光,等.酱香型白酒堆积发酵过程中不同空间位置酒醅差异性比较[J].中国酿造,2023,42(3):58-64.
[42]赵蒙,孙安,谭功全.白酒酒醅检测技术的研究进展与展望[J].食品科技,2022,47(12):250-257.
[43] LIU X G, MA D N, YANG C, et al.Microbial community succession patterns and drivers of Luxiang-flavor Jiupei during long fermentation[J].Front Microbiol, 2023, 14: https://doi.org/10.3389/fmicb.2023.1109719.
[44]马鹏,胡斌,何霞,等.大曲发酵剂制备及其微生物相互作用的研究进展[J].食品科技,2021,46(10):1-7.
[45]刘茂柯,唐玉明,赵珂,等.浓香型白酒窖泥微生物群落结构及其选育应用研究进展[J].微生物学通报,2017,44(5):1222-1229.
[46]GAO L,ZHOU J,HE G Q,et al.Effect of microbial interaction on flavor quality in Chinese Baijiu fermentation[J].Front Nutr, 2022, 9:https://doi.org/10.3389/fnut.2022.960712.
[47]LICANDRO H,HO P H,NGUYEN T K C,et al.How fermentation by lactic acid bacteria can address safety issues in legumes food products?[J].Food Control,2020,110(1):106957.
[48]HONG L X,FU G M,LIU T,et al.Functional microbial agents enhance ethanol contents and regulate the volatile compounds in Chinese Baijiu[J].Food Biosci,2021,44:101411.
[49]ORO L,FELIZIANI E,CIANI M,et al.Volatile organic compounds from Wickerhamomyces anomalus, Metschnikowia pulcherrima and Saccharomyces cerevisiae inhibit growth of decay causing fungi and control postharvest diseases of strawberries[J].Int J Food Microbiol, 2018,265:18-22.
[50]黄治国,罗润森,李彦中,等.芽孢杆菌强化发酵降低小曲白酒中高级醇的含量[J].现代食品科技,2023,39(2):145-151.
[51]蒙德俊,张娇娇,郭炳豪,等.酱香型白酒轮次基酒酸类风味物质与酒醅微生物的相关性分析[J].食品科技,2022,47(10):77-83.
[52]冯国杨,杨波,邢俊德,等.发酵食品中四甲基吡嗪的检测、来源及其微生物合成途径研究进展[J].中国酿造,2022,41(4):1-6.
[53]张明珠.文王贡酒微生物群落结构及其与主要风味代谢物的关联研究[D].合肥:合肥工业大学,2022.