Preparation ofanovel fluorescence probe and itsapplication in the detection of Hg2+in tea
茶作为世界上最受欢迎的风味和健康饮品,含有丰富的营养物质和多种功能性成分,具有抗氧化、抗过敏和抗病毒的作用,还能抑制各种慢性疾病[1-3]。近年来有色金属矿产开发、燃煤烟气和固体废弃物焚烧等途径产生重金属有毒物质增多,导致茶叶中剧毒的汞含量超标风险增加。重金属汞容易通过食物链不断富集到人体中,破坏正常新陈代谢功能[4-6]。因此,准确、高效地检测茶叶中痕量Hg2+的含量,避免汞超标变得尤为重要。传统的痕量Hg2+检测方法包括原子荧光光谱法(atomic fluorescencespectrometry,AFS)、原子吸收光谱法(atom ic absorption spectroscopy,AAS)、电感耦合等离子体-原子发射光谱法(inductivelycoupledplasmaatomic emission spectrometry,ICP-AES)等,但此类方法样品所需的检测设备价格高昂、操作过程复杂,单样品成本高,一定程度上限制了其在更广泛领域的应用[7-11]。近年来,相较于有毒小分子荧光染料和量子点,金纳米团簇(gold nanoclusters,AuNCs)因其尺寸较小、生物相容性良好和斯托克斯位移较大,逐渐成为材料科学及生命科学中的前沿热点,特别是在生物样品分析和重金属检测中展示出了十分广阔的应用前景[12-13]。通常所合成的纳米团簇化合物稳定性不好,甚至会在短时间内分解,大大限制了其在荧光探针上的实际应用。本研究以S-亚硝基谷胱甘肽(S-nitrosoglutathione,GSNO)作为保护剂和还原剂合成了水溶性好的金纳米团簇(GSNO@AuNCs),并以此为荧光探针,建立了潜在高灵敏检测实际茶叶样品中Hg2+含量的方法。
S-亚硝基谷胱甘肽(分析纯):国药集团化学试剂有限公司;氯金酸(HAuCl3)(分析纯):西格玛奥德里奇(上海)贸易有限公司;氢氧化钠(NaOH)(分析纯)、硼氢化钠(NaBH4)(分析纯):长春鼎国生物技术有限责任公司;氯化钠(NaCl)、氯化铜(CuCl2)、氯化铅(PbCl2)、氯化镁(MgCl2)、氯化镍(NiCl2)、氯化钙(CaCl2)、氯化锌(ZnCl2)、氯化锰(MnCl2)、氯化镉(CdCl2)、氯化钡(BaCl2)、氯化铝(AlCl3)、氯化铬(CrCl3)、氯化铁(FeCl3)等化学试剂(均为分析纯):天津市化学试剂三厂。透析袋(截留分子质量8000~10000Da):上海易佰聚经贸有限公司;茶叶样品:当地超市。
JEM-2100F场发射透射电子显微镜:日本电子株式会社;970CRT荧光分光光度计:上海精科仪器仪表有限公司;8453UV-VIS紫外可见分光光度计:美国安捷伦科技公司;ZetasizerNano ZS90纳米粒径电位分析仪:英国马尔文仪器有限公司;RH-Basic加热磁力搅拌器:德国艾卡仪器设备有限公司;MARS6微波消解仪:美国培安科技公司;M illi-Q超纯水系统:密理博中国有限公司。
1.3.1 S-亚硝基谷胱甘肽包被的金纳米团簇的合成
根据GUO C等[14-16]的研究,将215 μL 10 mmol/L的HAuC14溶液中逐滴加入2.5m L 2mmol/L的GSNO溶液中,加入105μL 1mmol/L的NaOH溶液,并剧烈搅拌30min后,再逐滴加入25μL 12mmol/L的硼氢化钠溶液,混合物在室温环境下继续搅拌5h。将所得淡褐色水溶液,转移至截留分子质量为8 000~10 000Da透析袋中,于2 000m L超纯水中透析24 h,每4 h更换透析容器中的蒸馏水以便去除小分子杂质。所制备的S-亚硝基谷胱甘肽包被的金纳米团簇(GSNO@AuNCs)用锡箔纸包好置于4℃冰箱中备用。
1.3.2 不同检测条件对GSNO@AuNCs荧光性能的影响
样品的荧光强度值(F)的测定时,其荧光光谱仪激发波长为370nm,扫描范围550~800nm,狭缝宽度均设为5nm,每个浓度平行测定3次。为了考察不同pH值对检测时荧光性能的影响,分别取定量的GSNO@AuNCs溶液,并分别调节体系pH值至(3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0),混匀后静置10m in转移到石英比色皿中测试样品的荧光强度。为了考察体系盐浓度对检测时荧光性能的影响,分别取定量的GSNO@AuNCs溶液,并分别调节体系的NaCl浓度至(0、0.01mmol/L、0.1mmol/L、1.0mmol/L、10mmol/L、100mmol/L和200mmol/L),均混匀后静置10m in转移到石英比色皿中测试样品的荧光强度。为了考察不同混匀时间对检测时荧光性能的影响,分别取定量的GSNO@AuNCs溶液,混摇后静置至(0、5min、10min、15min、20min、25min和30m in)后,转移到石英比色皿中测试样品的荧光强度。为了考察不同温度对检测时荧光性能的影响,在不同反应温度条件下(5℃、10℃、15℃、20℃、25℃、30℃、35℃、40℃、45℃),分别取定量的GSNO@AuNCs溶液,均混摇后静置10m in转移到石英比色皿中测试样品的荧光强度。
1.3.3 GSNO@AuNCs对Hg2+荧光检测的标准曲线建立
在室温(25℃)条件下测量样品的荧光强度值(F)时,荧光光谱仪激发波长为370 nm,扫描范围550~800 nm,狭缝宽度均设为5 nm,每个浓度平行测定3次。取100μL的GSNO@AuNCs溶液,向其中加入200μL磷酸盐缓冲液(phosphate buffer solution,PBS)(pH 7.0),分别加入一系列100μL不同浓度Hg2+溶液,再向其加入适量的蒸馏水定容至1m L后混摇均匀,静置10min,转移到石英比色皿中扫描样品。最低检测限(limitof detection,LOD)是通过计算平行测定6次的空白样品标准差的3倍得到的(3σ)[17]。
1.3.4 精密度及加标回收率实验
按上述步骤,测试每份样品的荧光强度后,复测5次,取其6次实验的平均值(average)计算其标准偏差(standard deviation,SD)和相对标准偏差(relative standard deviation,RSD),以此结果来判定该方法的精密度。样品加标回收是指取相同两组试样,其中一组加入确定含量的待测成分的标准物质,两组同一时间按相同的实验步骤测定荧光强度。加入标准物质的一组所对应值减去未加入标准物质一组所对应值的做差值后,与加入标准物质的含量的比值,为样品加标回收率,其计算公式如下:
1.3.5 干扰金属离子对GSNO@AuNCs检测Hg2+影响
在室温(25℃)条件下,取两组100μL所配制的1mol/L各 离 子(Na+、Cu2+、Pb2+、Mg2+、Ni2+、Ca2+、Zn2+、Mn2+、Cd2+、Ba2+、Al3+、Cr3+、Fe3+)溶液,均加入100 μL的GSNO@AuNCs溶液,均向其中加入200μLPBS缓冲溶液(pH 7.0),其中一组加入100μL的0.1mol/L的Hg2+溶液,两组再加入适量的蒸馏水,分别定容至1m L后混匀,静置10min,转移到石英比色皿中测定这两组样品的荧光强度。
1.3.6 GSNO@AuNCs对实际茶叶样品中的Hg2+检测
称取0.200 0 g干燥过的茶叶样品于聚四氟乙烯(polytetrafluoroethylene,PTFE)高压消解罐中,加入5.0m L浓硝酸及1.5m L过氧化氢,放入微波消解仪内进行消解,结束后转移至石墨炉电热赶酸仪于120℃条件下赶酸。30min后将样品离心(10 000 r/m in),并通过0.22μm微孔滤膜过滤以消除可能的干扰因素,用适量蒸馏水定容至100m L[18-19]。取100μL上述所配制的茶叶消解溶液,加入100μL的GSNO@AuNCs溶液,向其中加入200μLPBS缓冲溶液(pH 7.0),再向其中加入适量的蒸馏水定容至1m L后混匀,静置10min,转移到石英比色皿中扫描样品。
采用高倍透射电子显微镜和动态光散射仪表征GSNO@AuNCs,结果见图1。
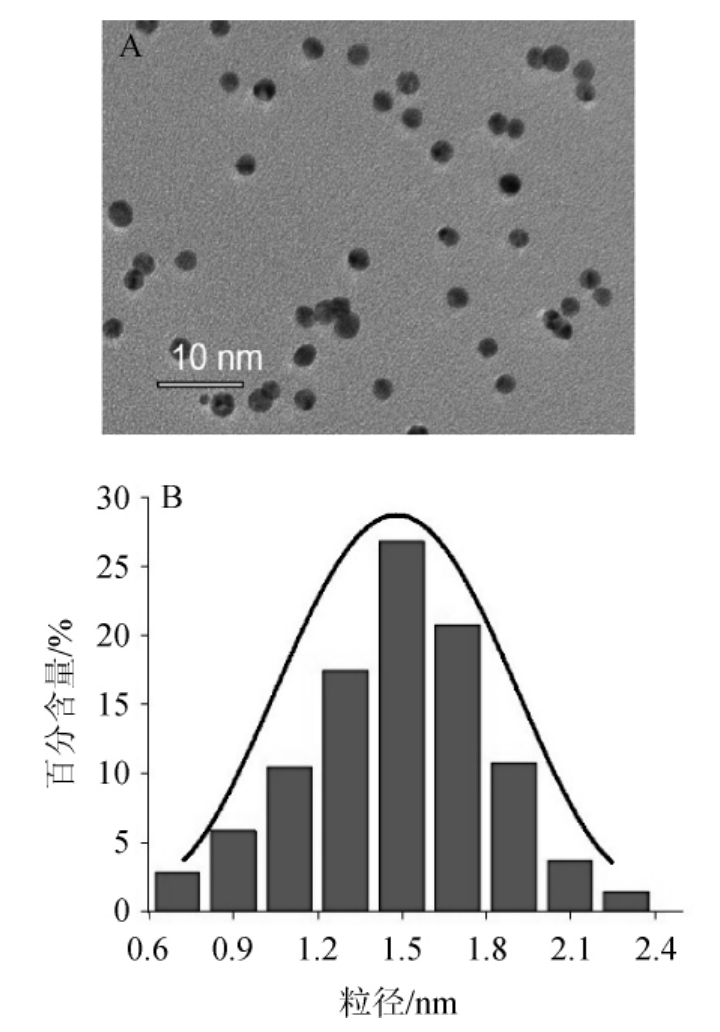
图1 GSNO@AuNCs的透射电镜图(A)纳米粒子尺寸分布(B)
Fig.1 Transm ission electron m icroscopy(A)and the nano particle size distributions(B)of GSNO@AuNCs
由图1A可知,所合成的GSNO@AuNC平均粒径在2.5nm左右,颗粒呈球形并且分散性较好;由图1B可知,GSNO@AuNCs的粒径呈正态分布,其中粒径为1.5 nm的颗粒最多。
采用紫外-可见吸收光谱和荧光光谱表征GSNO@Au NCs,结果见图2。
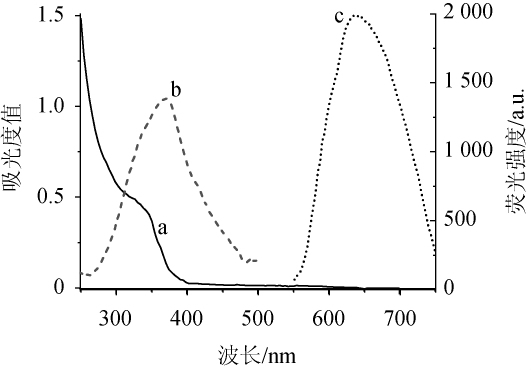
图2 GSNO@AuNCs的紫外吸收光谱图(a)、激发光谱(b)和发射光谱(c)
Fig.2 Ultraviolet-visible spectrophotometer(a),excitation spectrum(b)and em ission spectrum(c)of GSNO@AuNCs
由图2可知,a曲线表明了紫外可见吸收光谱峰的位置在波长约360 nm处,可归属为样品所独有的量子限域效应;而在波长400~600 nm处无特征吸收峰,则表明样品没有形成较大的纳米颗粒而形成了纳米团簇。随后测量了GSNO@AuNCs的最大激发光谱(b)和最大发射光谱(c),其最大激发波长为370 nm,最大发射波长为635 nm。
按1.3.2方法考察了pH值、盐离子浓度、反应时间和温度对GSNO@Au NCs体系荧光猝灭的影响,结果见图3。
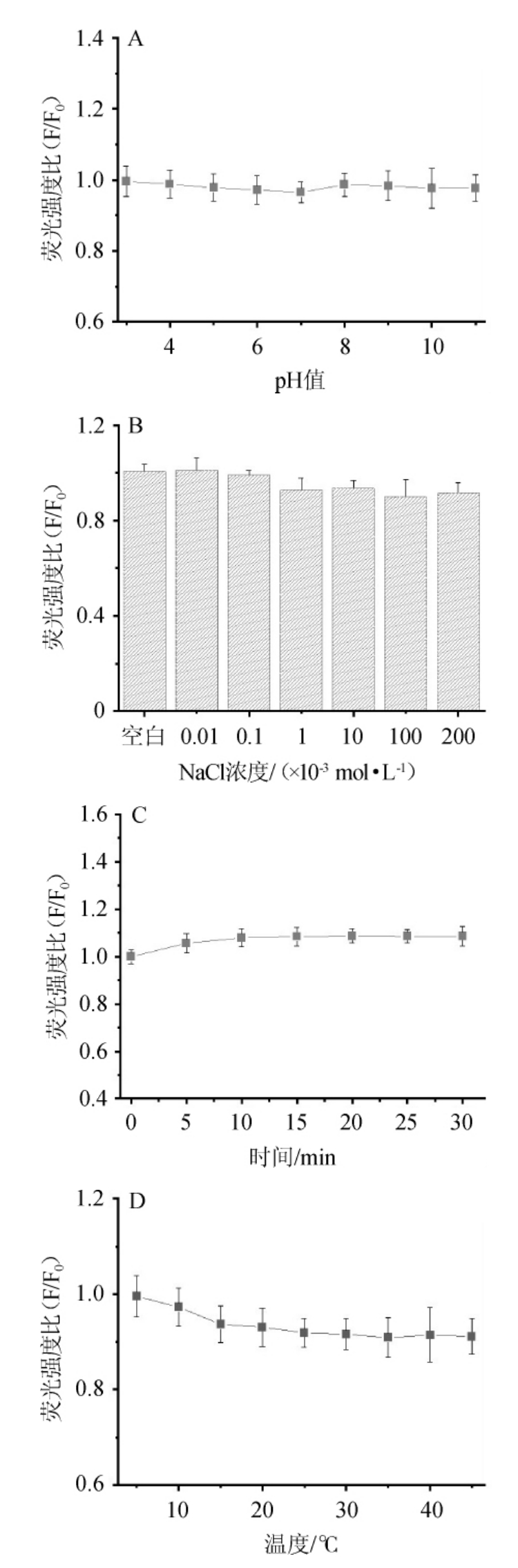
图3 pH值(A)、盐离子浓度(B)、反应时间(C)和温度(D)对GSNO@AuNCs的荧光强度影响
Fig.3 Effect of pH(A),NaCl concentration(B),reaction time(C)and temperature(D)on fluorescence intensity of GSNO@AuNCs
由图3A可知,在pH值在3.0~11.0范围内对GSNO@Au NCs荧光强度影响微不足道。考虑到检测对象Hg2+在碱性环境下可能会形成絮状沉淀,已经实际检测时的便利性,确定pH值为7.0。由图3B可知,当体系中的盐离子(NaCl)浓度在0~200mmol/L时,不会对体系荧光强度造成明显影响。因此为了实际检测的简便性,确定在检测过程中不额外添加盐离子;由图3C可知,GSNO@Au NCs的荧光强度随着反应时间的增加而增加,10min后已趋于平衡,因此确定反应时间为10min;由图3D可知,随着温度在5~45℃范围内升高,金纳米团簇的荧光强度逐渐降低,可能是介质水的黏度降低,提高了荧光分子与水分子发生碰撞荧光淬灭的几率,考虑到为更贴近实际样品的检测,确定检测温度为室温25℃。结果表明,本方法所制备的荧光探针稳定性较好,对Hg2+的检测抗干扰能力较强。
采用1.3.3的方法,GSNO@AuNC对不同浓度的Hg2+进行了定量检测,结果见图4。
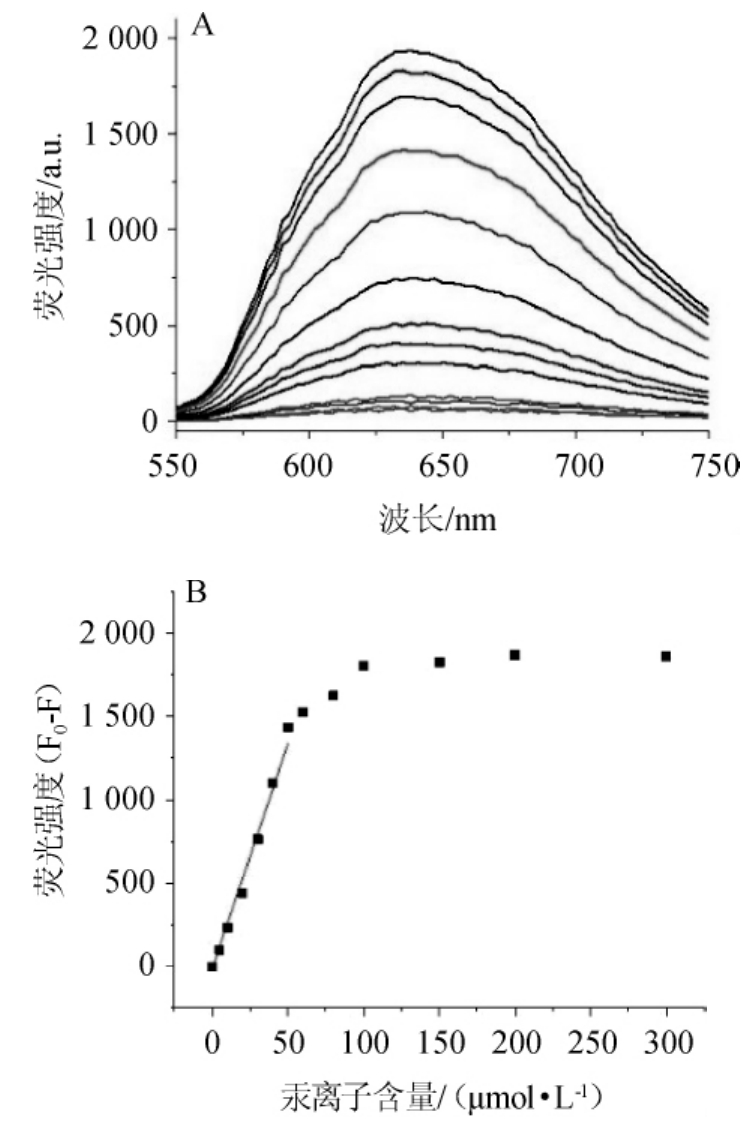
图4 不同浓度的Hg2+对GSNO@AuNCs作用后的荧光光谱(A)及Hg2+与GSNO@AuNCs的荧光猝灭的线性关系(B)
Fig.4 Fluorescence spectra of GSNO@AuNCs after different Hg2+concentrations reaction(A),and linear relationship of the fluorescence quenching of GSNO@AuNCs with Hg2+
由图4A可知,不同浓度的Hg2+对GSNO@Au NCs作用后的荧光光谱可知,GSNO@AuNC在635 nm处的荧光强度随着Hg2+浓度的增加而减小,这是由于Hg2+与金纳米团簇发生了特异性聚集作用导致荧光猝灭。由图4B可知,汞离子溶液浓度(X)与GSNO@AuNC荧光强度的差值(Y)在0.1~40μmol/L范围内呈良好的线性关系,线性方程为Y=1.392+27.28X,相关系数R2=0.999 5。采用1.3.4的方法测得Hg2+的理论最低检测限为0.033μmol/L。
为了考察GSNO@Au NCs对Hg2+检测的抗干扰性,对可能存在的干扰金属离子进行干扰性实验,结果见图5。

图5 共存金属离子对Hg2+测定的影响
Fig.5 Effect of the co-exiting metal ions on detection of Hg2+
由图5可知,与Hg2+相比所加入的这些金属离子未能引起体系明显的荧光猝灭效应,证实了本方法中GSNO@Au NCs作为荧光探针对Hg2+具有选择性。
为了评估GSNO@AuNC检测Hg2+的实用性,选取市售常见红茶、绿茶、茉莉花茶和普洱茶四类样本进行了精密度及加标回收率实验,结果见表1。
表1 加标回收率实验结果
Table 1 Results of adding standard recovery experiment
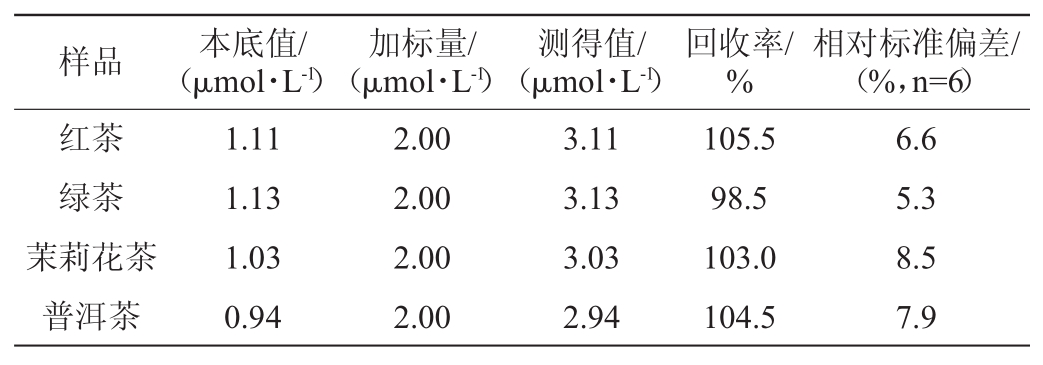
样品 本底值/(μmol·L-1)加标量/(μmol·L-1)测得值/(μmol·L-1)回收率/%相对标准偏差/(%,n=6)红茶绿茶茉莉花茶普洱茶1.11 1.13 1.03 0.94 2.00 2.00 2.00 2.00 3.11 3.13 3.03 2.94 105.5 98.5 103.0 104.5 6.6 5.3 8.5 7.9
结果表明,加标回收率为98.5%~105.5%,相对标准偏差为6.6%~8.5%,表明该检测方法的精密度及准确度良好。
本实验通过S-亚硝基谷胱甘肽作为保护剂和还原剂,合成了稳定性高和荧光强度良好的水溶性金纳米团簇GSNO@AuNC。在最佳优化条件下(25℃,pH 7.0,反应时间为10min),GSNO@AuNCs能有效地使Hg2+的荧光强度猝灭,而且不受Na+、Cu2+、Pb2+、Mg2+、Ni2+、Ca2+、Zn2+、Mn2+、Cd2+、Ba2+、Al3+、Cr3+、Fe3+等离子干扰。汞离子浓度在0.1~40.0μmol/L范围内与GSNO@AuNCs的荧光强度呈良好的线性关系,线性回归方程为Y=1.392+27.28X,相关系数R2=0.999 5,检出限为0.033μmol/L。在实际茶叶样品中汞离子检测中加标回收率为98.5%~105.5%,相对标准偏差为6.6%~8.5%,证明该检测方法有良好的精密度及可靠性。研究成功建立了快速灵敏检测茶叶中汞含量的方法,具有一定的发展前景和推广价值。
[1]郭昊蔚,李春霖,龚淑英,等.光谱技术在茶叶理化指标检测中的研究进展[J].茶叶,2019,45(1):9-12.
[2]YANG Z,BALDERMANN S,WATANABE N,et al.Recent studies of thevolatile compounds in tea[J].Food Res Int,2013,53(2):585-599.
[3]LARGER PJ,JONESA D,DACOMBEC.Separation of tea polyphenols usingm icellarelectrokinetic chromatographywith diodearray detection[J].JChromatogr A,1998,799(1-2):309-320.
[4]HAN A,LIU X,PRESTW ICH G D,etal.Fluorescentsensor for Hg2+,detection in aqueoussolution[J].Sensor Actuat B-Chem,2014,198:274-277.
[5]CRUZ-GUZMAN M D L,AGUILARAGUILAR A,HERNANDEZADAME L,etal.A turn-on fluorescentsolid-sensor for Hg(II)detection[J].Nanoscale Res Lett,2014,9(1):431.
[6]DAIH,SHIY,WANG Y,etal.Label-free turn-on fluorescentdetection of melam ine based on the anti-quenching ability of Hg2+to gold nanoclusters[J].Biosens Bioelectron,2014,53(1):76-81.
[7]BAO,HE J,YU P,etal.Detection of Hg2+using gold nanoparticle probes[J].Acta Chim ica Sinica,2009,67(18):2139-2143.
[8]FANG Q,LIU Q,SONG X,et al.An aqueous fluorescent probe for Hg2+detection with high selectivity and sensitivity[J].Lum inescence,2016,30(8):1280-1284.
[9]FENGW,XUEX,LIU X.One-step,room-temperature,colorimetric detection ofmercury(Hg2+)using dna/nanoparticle con-jugates[J].J Am Chem Soc,2008,130(11):3244-3245.
[10]ADHIKARIB,BANERJEE A.Facile synthesis ofwater-soluble fluorescent silver nanoclusters and Hg(II)sensing[J].Chem Mater,2010,22(15):4364-4371.
[11]CAIY,YAN L,LIU G,et al.In-situ synthesis of fluorescent gold nanoclusters with electrospun fibrousmembrane and application on Hg(II)sensing[J].Biosens Bioelectron,2013,41(1):875-879.
[12]LIS,DONG S.Silver nanocluster-based fluorescent sensors for sensitive detection of Cu(II)[J].JM atter Chem,2008,18(39):4636-4640.
[13]YEH H C,SHARMA J,HAN JJ,etal.A DNA-silver nanocluster probe that fluorescesuponhybridization[J].Nano Lett,2011,10(8):3106-3110.
[14]GUO C,IRUDAYARAJJ.Fluorescent Ag clusters via a protein-directed approach asaHg(II)ion sensor[J].Anal Chem,2011,83(8):2883-2889.
[15]SHANG L,DORLICH RM,BRANDHOLTS,etal.Facile preparation of water-soluble fluorescent gold nanoclusters for cellular imaging applications[J].Nanoscale,2011,3(5):2009-2014.
[16]董哲,谢立娟,李阳,等.基于氧化型谷胱甘肽保护的荧光金纳米团簇的制备及其对 Fe3+的检测[J].分析测试学报,2017,36(9):1155-1158.
[17]胡家勇,柳迪,程银棋,等.荧光分光光度法测定淀粉及其衍生物中二氧化硫残留量研究[J].中国酿造,2017,36(6):175-178.
[18]高双双,陈晓霞,杨晓华,等.原子荧光光谱法测定茶叶中砷和汞的含量[J].理化检验(化学分册),2018,54(7):802-805.
[19]SZYMCZYCHA-MADEJA A,WELNA M,POHL P.Determination of essentialand non-essentialelements in green and black teasby FAASand ICPOES simplified-multivariate classification of different tea products[J].M icrochem J,2015,121(3):122-129.
[20]王兴东,牟明月,任雅奇,等.茅台酱香型酒糟中总黄酮及总多酚含量的测定[J].中国酿造,2015,34(10):86-90.