Mechanism of carbon source-induced starch branching enzyme byBacillus stearothermophilus
在自然界中淀粉主要以直链淀粉和支链淀粉两种形式存在。直链淀粉是通过1,4-糖苷键连接α-D-葡萄糖而成的线性长链分子,其中有少量α-1,6糖苷键[1]。相对于直链淀粉,支链淀粉的α-1,6-糖苷键数量多且具有分支点位置、分支度丰富等特点[2]。淀粉常出现溶解度低、易回生等现象,制约其工业应用[3-4]。因此,通过合理的方法对淀粉的结构组成进行改造,以提高其利用率显得尤为重要[4-5]。近些年,工业上经物理或化学改性手段获得的变性淀粉已产生较高的应用价值,但此种改性途径会存在化学试剂残留、生成多种副产物等问题,不利于整个淀粉工业长期可持续发展[6-9]。鉴于传统改性方法的不足,生物酶法因底物高选择性、产物特异性强、反应条件温和等优势,逐步引起关注。生物酶法改性淀粉领域中,淀粉分支酶是重要的淀粉酶类,其对淀粉改性的应用表现出巨大的应用前景[10-11]。
淀粉分支酶(starch branching enzyme)EC 2.4.1.18是一类糖基转移酶,属于糖苷水解酶家族13(GH 13)或57(GH57)[12-13]。淀粉分支酶能催化淀粉分子中α-1,4-糖苷键的断裂[14],在原主链上形成新的α-1,6-分支点[15]。其广泛分布于动物、植物、微生物中[16],动物和植物来源的淀粉分支酶存在催化过程繁琐、异源表达复杂等问题,而微生物来源的淀粉分支酶有催化方式简单、特异性强、易于基因操作等优势[17]。
研究表明,淀粉分支酶的催化活性与底物的链长[18-19]、空间位置、种类[20-21]均有关系。一般自然菌株产生分支酶能力较低,需要对产酶条件进行优化,才能到达较高的产酶水平。因此,本实验利用嗜热脂肪芽孢杆菌为出发菌株,旨在考察不同碳源为诱导底物对菌株产生淀粉分支酶活性的影响,在此基础上,进一步探索了小试和中试发酵培养中诱导酶的稳定性及其工艺参数,为大规模工业化生产淀粉分支酶提供理论依据。
1.1.1 供试菌株
嗜热脂肪芽孢杆菌(Bacillusstearothermophilus)BTS-Ⅰ(中国科学院微生物研究所编号CGMCC1.1865):澳大利亚昆士兰大学;嗜热脂肪芽孢杆菌BTS-Ⅱ(中国科学院微生物研究所编号CGMCC1.1923):中国科学院微生物研究所;嗜热脂肪芽孢杆菌BTS-Ⅲ(ACTT7953):江苏昆山爱达斯工业公司。
1.1.2 试剂与药品
葡萄糖、麦芽糖、麦芽三糖、异麦芽糖、潘糖、麦芽四糖、麦芽五糖、麦芽六糖(均为色谱纯):美国Sigma公司;琼脂粉、酵母膏、蛋白胨、牛肉浸膏、酵母粉、大豆水解蛋白胨、可溶性淀粉、马铃薯淀粉、麦芽糊精(均为生化试剂):北京奥博星生物技术有限责任公司;NaCl、NaOH、NH4Cl、HCl、NaH2PO4·2H2O、Na2HPO4·12H2O、NaAc、Na2B4O7·10H2O、H2SO4、H3PO3(均为分析纯):天津市大茂化学试剂厂。
1.1.3 培养基
牛肉浸膏琼脂培养基:1 kg牛肉,去筋去脂肪凝浆,加入3 L H2O,煮2~3 h,过滤,补水至总体积2.5 L。121℃灭菌20 min。
种子培养基:葡萄糖0.05%,酵母膏0.1%,大豆蛋白胨0.2%,NaCl 0.1%,pH 7.0~7.5,121℃灭菌20 min。
发酵培养基:淀粉0.1%,大豆蛋白胨0.2%,NaCl 0.1%,K2HPO40.1%,酵母膏0.1%,MgSO4·7H2O 0.05%,pH 7.0~7.5,121℃灭菌20 min。
TGL-16M高速冷冻离心机:上海湘仪离心机仪器有限公司;DW-86L578S超低温保存箱:青岛海尔公司;DK-S12型电热恒温水浴锅:上海森信实验仪器有限公司;LGJ-50F真空冷冻干燥机:北京松源华兴科技发展有限公司;TU-1800PC紫外-可见分光光度计:北京普析通用仪器有限责任公司;HWS-150型恒温培养箱:上海湘仪离心机仪器有限公司;pHS-3C型酸度计:上海雷磁仪器有限公司;AL204电子天平:瑞士梅特勒-托利多仪器(上海)有限公司。
1.3.1 种子及摇瓶培养方法
将嗜热脂肪芽孢杆菌斜面保存培养菌种接种到种子试管培养基,装液量8~10 mL,45℃恒温培养48 h。然后扩培至150 mL,45℃、150 r/min摇床培养72 h。培养期间取样测定菌体密度,当菌密度值达到2.0左右时,停止培养,4℃暂存备用。
1.3.2 发酵培养基碳源种类及含量的确定
分别改变发酵培养基的碳源及添加量为葡萄糖(0.05%、0.10%、0.20%、0.30%、0.40%)、麦芽糖(0.10%、0.20%、0.30%、0.40%、0.50%)、可溶性淀粉(0.10%、0.15%、0.20%、0.25%、0.30%)、麦芽糊精(0.10%、0.15%、0.20%、0.25%、0.30%),采用摇瓶培养,将种子液接种于150 mL发酵培养基中,45℃、150 r/min摇床培养72h。测定菌密度值及淀粉分支酶酶活,考察发酵培养基碳源种类及含量对菌体培养的影响。
1.3.3 菌种发酵稳定性试验
嗜热脂肪芽孢杆菌BTS-Ⅰ种子液以6%的接种量接种于装有4 L优化碳源后的发酵培养基的5 L发酵罐中,45℃、150 r/min、1.5 L/min通气培养42 h,当菌密度值超过2.0时,再接种于装有60L优化碳源后的发酵培养基(添加0.01%~0.05%消泡剂)的100L发酵罐中。48℃恒温、通气量2.0L/min、1mol/LNaOH溶液调整pH值至6.5~7.0、补加已灭菌的去离子水保持总体积不变,发酵38h,当菌体密度值超过2.0后停止发酵,用于酶的分离提取。测定菌体密度值和淀粉分支酶活性。进行5次平行发酵实验,比较小试、中试试验结果稳定性。
1.3.4 3种嗜热脂肪芽孢杆菌发酵比较
分别将3种嗜热脂肪芽孢杆菌BTS-Ⅰ、BTS-Ⅱ、BTS-Ⅲ以6%的接种量接种于装有4 L发酵培养基的5 L发酵罐中。在45℃、150 r/min、1.5 L/min通气条件下培养42h,分别测定菌体密度值和淀粉分支酶活性。比较3种嗜热脂肪芽孢杆菌的发酵性能。
1.3.5 测定方法
(1)淀粉分支酶酶活测定:参考文献[22]的方法略作修改,在比色管中加入1 mL 0.1%的淀粉溶液、0.1 mL的酶液、0.9mL0.2mol/LNaAc-HAc缓冲液(pH5.4),在60℃恒温水浴反应30min后,沸水煮1min使反应终止,然后加入3mL去离子水和1mL 0.2%~2%I2-KI溶液显色,5 min后测定波长660 nm处的吸光度值OD30min。对照反应是在比色管中加入1 mL 0.1%的淀粉溶液、0.1 mL的酶液、0.9 mL 0.2 mol/L NaAc-HAc缓冲液(pH5.4)后,立即沸水煮1 min使反应终止,然后加入3 mL去离子水和1 mL 0.2%~2%I2-KI溶液显色,5min后测定波长660 nm处的光吸收值OD0min。比色时空白对照为去离子水。每个样品测定均重复3次取其平均值。酶活力按以下公式计算:
式中:n为酶液稀释倍数。
淀粉分支酶活力定义:在温度60℃、pH 5.4时,1 mL酶液1 min碘蓝值降低1%即为淀粉分支酶的一个活性单位(U/mL)。
(2)菌密度测定:将培养一定时间的菌种取样,摇匀,以去离子水为空白,测定波长540 nm处的光吸收值,即为菌体密度(一般在1.5~2.5左右)。
碳源种类碳源添加量/%菌体密度淀粉分支酶酶活/(U·mL-1)
表1 发酵培养基碳源种类及含量对淀粉分支酶活性及菌体密度的影响
Table 1 Effect of carbon source types and contents in fermentation medium on starch branching enzyme activity and cell density
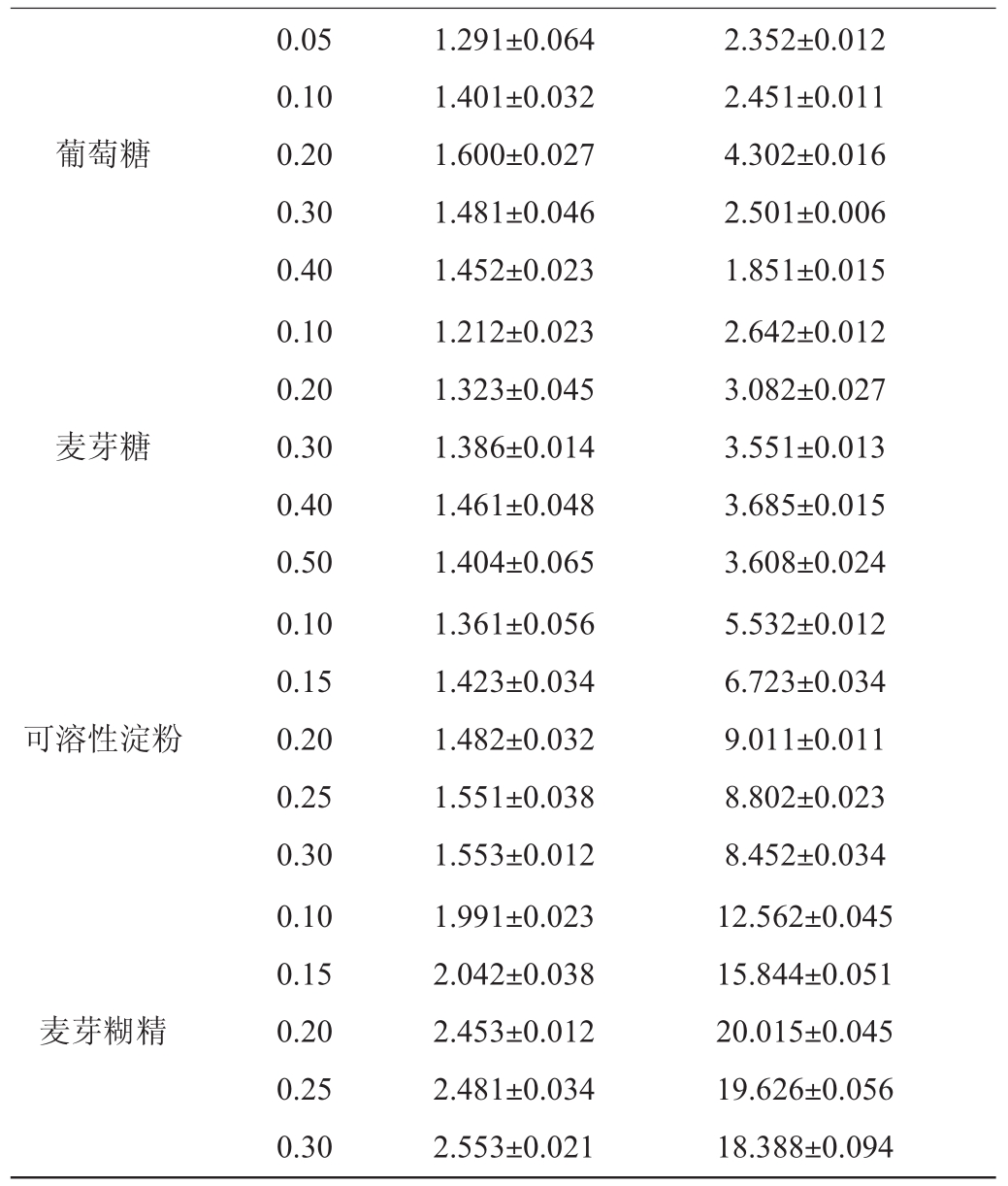
葡萄糖麦芽糖可溶性淀粉麦芽糊精0.05 0.10 0.20 0.30 0.40 0.10 0.20 0.30 0.40 0.50 0.10 0.15 0.20 0.25 0.30 0.10 0.15 0.20 0.25 0.30 1.291±0.064 1.401±0.032 1.600±0.027 1.481±0.046 1.452±0.023 1.212±0.023 1.323±0.045 1.386±0.014 1.461±0.048 1.404±0.065 1.361±0.056 1.423±0.034 1.482±0.032 1.551±0.038 1.553±0.012 1.991±0.023 2.042±0.038 2.453±0.012 2.481±0.034 2.553±0.021 2.352±0.012 2.451±0.011 4.302±0.016 2.501±0.006 1.851±0.015 2.642±0.012 3.082±0.027 3.551±0.013 3.685±0.015 3.608±0.024 5.532±0.012 6.723±0.034 9.011±0.011 8.802±0.023 8.452±0.034 12.562±0.045 15.844±0.051 20.015±0.045 19.626±0.056 18.388±0.094
由表1可知,不同培养基碳源对菌体密度值的影响,最高为麦芽糊精组,次之为可溶性淀粉组,麦芽糊精组的菌体密度值均>1.991。不同培养基碳源对产酶影响大小的顺序是麦芽糊精>可溶性淀粉>麦芽糖>葡萄糖,其中添加0.20%麦芽糊精的诱导培养基,产淀粉分支酶的酶活最高,达20.015 U/mL,约为其他碳源的2~10倍。因此,选择发酵培养基的最适碳源为0.2%麦芽糊精。
表2 嗜热脂肪芽孢杆菌BTS-Ⅰ小试及中试稳定性试验结果
Table 2 Stability experiment results ofBacillus stearothermophilus BTS-I by lab-scale and pilot-scale experiments

项目菌体密度淀粉分支酶酶活/(U·mL-1)小试试验中试试验2.30 2.34 18.00 19.87
由表2可知,经过小试试验,菌密度值为2.30,淀粉分支酶活性为18 U/mL;经过5次的中试发酵平行试验,菌密度值平均值为2.34,淀粉分支酶活性平均值为19.87 U/mL,是小试试验的1.1倍。且嗜热脂肪芽孢杆菌BTS-Ⅰ多次中试发酵试验中均能稳定培养,长势良好。
对嗜热脂肪芽孢杆菌BTS-Ⅰ、BTS-Ⅱ、BTS-Ⅲ的发酵试验进行比较,结果见表3。
表3 菌株BTS-Ⅰ、BTS-Ⅱ、BTS-Ⅲ发酵结果比较
Table 3 Comparison of fermentation results of strains BTS-I,BTS-II and BTS-III

菌种菌体密度淀粉分支酶活力/(U·mL-1)BTS-ⅠBTS-ⅡBTS-Ⅲ2.30 1.39 1.25 18.0 7.3 4.4
由表3可见,不同来源的嗜热脂肪芽孢杆菌,当发酵条件相同时,嗜热脂肪芽孢杆菌BTS-Ⅰ、BTS-Ⅱ、BTS-Ⅲ的菌体密度值分别为2.30、1.39、1.25,淀粉分支酶酶活分别为18.0 U/mL、7.3 U/mL、4.4 U/mL,有明显差异。且以BTS-Ⅰ长势最好,淀粉分支酶活力最高。
淀粉分支酶应用领域广泛,大多数淀粉分支酶的反应温度为30~40℃,为了防止其他杂菌的污染及生产工艺的要求,生产中都必不可少高温处理过程,而反应温度与生产温度的差异性制约了淀粉工业进一步发展[23]。相关嗜热菌株所产的耐高温淀粉分支酶则可克服不足[24-25]。近几年关于微生物生产淀粉分支酶的研究主要集中在常温条件下产酶,嗜热菌所产的耐高温淀粉分支酶方面的研究较少,本研究以嗜热芽孢杆菌为出发菌,底物诱导生产耐高温淀粉分支酶研究尚未见报道。
碳源诱导嗜热脂肪芽孢杆菌生产淀粉分支酶能大幅提升酶活,可能基于以下几种原因:一是底物的种类会影响淀粉分支酶的催化活性[26-27]。由环球节杆菌(Arthrobacter globiformis)、溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)[28]和链球菌(Streptococcus)[29]产生的淀粉分支酶无论对直链淀粉,还是支链淀粉都有较强的活性[30]。但某些淀粉分支酶更青睐于直链淀粉,如来源于Deinococcusgeothermalis的淀粉分支酶[31-32];Rhodothermus obamensis为来源的淀粉分支酶以支链淀粉为底物时表现的活力是以直链淀粉为底物的6倍[33];而来源于创伤弧菌(Vibrio vulnificus)的淀粉分支酶更偏好于直链淀粉,其以直链淀粉为底物时的酶活是以支链淀粉为底物时的10倍[34]。二是不同链长的低聚糖对微生物来源的淀粉分支酶的催化活性也有一定的影响[35]。来源于V.vulnificus和R.obamensis的淀粉分支酶更偏向于转移聚合度(degree of polymerization,DP)值为3~8之间的短链;来源于D.geothermalis和耐辐射球菌(Deinococcus radiodurans)的淀粉分支酶主要转移DP值为4~17的短链,其中常以DP值为6~7的短链居多;来源于B.fibrisolvens的淀粉分支酶以转移DP值为7的短链最多;来源于Anaerobrancagottschalkii和Thermus thermophiles的淀粉分支酶明显偏好转移DP值为6~60与DP值为4~16链长的寡聚糖[36]。三是由底物和淀粉分支酶的相对空间位置,可将淀粉分支酶的催化反应机理分为两类:一类是低聚糖结合于酶分子活性中心模式;另一类是低聚糖不结合于酶分子活性中心模式。来源于Cyanothecesp.ATCC51142的淀粉分支酶与底物的结合模式属于低聚糖结合于酶分子活性中心模式,形成酶-低聚糖中间体的过程中的“糖基化作用”和“去糖基化作用”都发生在底物结合位点,紧接着在发生双取代反应酶分子与新的碳水化合物链结合,碳水化合物链的某一C-6羟基上连接之前切下的低聚糖,从而形成新的α-1,6-分支点(PDB_ID:5GQU)。低聚糖与来源于大肠杆菌(Escherichia coli)的淀粉分支酶距离其活性中心较近的氨基酸残基结合,结合模式为低聚糖不结合于酶分子活性中心,与淀粉分支酶相应的氨基酸残基将糖苷键经过传递、加工等一系列过程完成转糖基反应,最终形成α-1,6分支点或环状产物。此过程相似于环糊精葡萄糖基转移酶(cyclodextrin glucosyltransferse,CGTase)对低聚糖的环化作用:Glu458和Asp405(来源于E.coli的CGTase序列编号)分别为亲电氨基酸和亲核氨基酸,糖苷键在Asp405的协助下断裂并形成共价中间产物,同时在Glu458的驱使下连接于受体链上[37]。
麦芽糊精主要由糊精、多聚糖、四糖或四糖以上的低聚糖,还含少量的麦芽糖和葡萄糖的一种糖类混合物。其线性长链是由α-1,4糖苷键连接α-D-吡喃葡萄糖残基形成的,同时也有由分支点α-1,6糖苷键相连形成的支链[38]。经试验表明来源于嗜热芽孢杆菌的淀粉分支酶,更偏好含有线性长链、聚合度适中,有α-1,6糖苷键的碳源底物。
本试验利用嗜热脂肪芽孢杆菌(Bacillus stearothermophilus)生产淀粉分支酶,研究不同碳源种类及浓度对嗜热芽孢杆菌产酶性能的影响。结果表明,以0.20%麦芽糊精为发酵培养基碳源时,淀粉分支酶的酶活最高,达20.015 U/mL,是其他培养基的2~10倍。在小试试验的基础上进行了扩大培养中试试验,淀粉分支酶酶活稳定,为19.87 U/mL,是小试试验的1.1倍。为将来的诱导试验提供了一定的基础。
[1]MAGALLANES-CRUZ P A,FLORES-SILVA P C,BELLO-PEREZ L A.Starch structure influences its digestibility:A review[J].J Food Sci,2017,82(9):2016-2013.
[2]GUZMAN MALDONADO H,PAREDES LOPEZ O.Amylolytic en zymes and products derived from starch:A review[J].Crit Rev Food Sci Nutr,1995,35(5):373-403.
[3]KEISER J E.Starch:its morphology,chemistry and industrial applications[J].Abstr Pap Am Chem Soc,2003,225:U982-U982.
[4]JOBLING S.Improving starch for food and industrial applications[J].Curr Opin Plant Biol,2004,7(2):210-218.
[5]ZHAOSS,DUFOURD,SANCHEZT,et al.Development ofwaxycassava with different biological and physico-chemical characteristics of starches for industrial applications[J].Biotechnol Bioeng,2011,108(8):1925-1935.
[6]DASTIDAR T G,NETRAVALI A N.Improving resin and film forming properties of native starches by chemical and physical modification[J].J Biobased Mater Bioenergy,2012,6(1):1-24.
[7]WALISZEWSKI K N,APARICIO M A,BELLO L A,et al.Changes of banana starch by chemical and physical modification[J].Carbohydr Polym,2003,52(3):237-242.
[8]DIN Z U,XIONG H G,FEI P.Physical and chemical modification of starches:A review[J].Crit Rev Food Sci Nutr,2017,57(12):2691-2705.
[9]ASHOGBON A O,AKINTAYO E T.Recent trend in the physical and chemical modification of starches from different botanical sources:a review[J].Starch-Starke,2014,66(1-2):41-57.
[10]RAIGOND P,EZEKIEL R,RAIGOND B.Resistant starch in food:a review[J].J Sci Food Agric,2015,95(10):1968-1978.
[11]LI W W,LI C M,GU Z B,et al.Relationship between structure and retrogradationpropertiesofcorn starch treated with 1,4-alpha-glucan branching enzyme[J].Food Hydrocoll,2016,52:868-875.
[12]LEGLER G.Mechanism of enzymatic glycoside hydrolysis and of glycosyl transfer by glycosidases and glycosyltransferases[J].Carbohydr Res,1993,250(1):R7-R20.
[13]SHINOHARA M L,IHARA M,ABO M,et al.A novel thermostable branching enzyme from an extremely thermophilic bacterial species,Rhodothermus obamensis[J].Appl Microbiol Biotechnol,2001,57(5-6):653-659.
[14]HAYASHI M,SUZUKI R,COLLEONI C,et al.Bound substrate in the structure of cyanobacterial branching enzyme supports a new mechanistic model[J].J Biol Chem,2017,292(13):5465-5475.
[15]TETLOW I J,EMES M J.A review of starch-branching enzymes and their role in amylopectin biosynthesis[J].Iubmb Life,2014,66(8):546-558.
[16]SUZUKI E,SUZUKI R.Distribution of glucan-branching enzymes among prokaryotes[J].Cell Mol Life Sci,2016,73(14):2643-2660.
[17]CHOI J H,LEE S Y.Secretory and extracellular production of recombinant proteins usingEscherichia coli[J].Appl Microbiol Biotechnol,2004,64(5):625-635.
[18]KURIKI T,STEWART D C,Preiss J.Construction of chimeric enzymes out of maize endosperm branching enzymes I and II:activity and properties[J].J Biol Chem,1997,272(46):28999-29004.
[19]BALL S G,MORELL M K.From bacterial glycogen to starch:understanding the biogenesis of the plant starch granule[J].Annu Rev Plant Biol,2003,54:207-233.
[20]TETLOW I J,WAIT R,LU Z,et al.Protein phosphorylation in amyloplasts regulates starch branching enzyme activity and protein-protein interactions[J].Plant Cell,2004,16(3):694-708.
[21]DUMEZ S,WATTEBLED F,DAUVILLEE D,et al.Mutants of ara-bidopsis lacking starch branching enzyme II substitute plastidial starch synthesis by cytoplasmic maltose accumulation[J].Plant Cell,2006,18(10):2694-2709.
[22]李太贵,沈波,陈能,等.Q酶对水稻籽粒垩白形成的影响[J].作物学报,1997,23(3):338-344.
[23]SUZUKI H,HASHIDA K,NGUYEN K H,et al.Efficacy of intratympanic steroid administration on idiopathic sudden sensorineural hearing loss in comparison with hyperbaric oxygen therapy[J].Laryngoscope,2012,122(5):1154-1157.
[24]阮森林.酸性α-淀粉酶产生菌的筛选及其酶学性质研究[D].郑州:河南农业大学,2008.
[25]陈晨.耐高温α-淀粉酶菌株的筛选、发酵条件优化及酶基因的克隆[D].长沙:中南大学,2009.
[26]TETLOW I J,WAIT R,LU Z,et al.Protein phosphorylation in amyloplasts regulates starch branching enzyme activity and protein-protein interactions[J].Plant Cell,2004,16(3):694-708.
[27]DUMEZ S,WATTEBLED F,DAUVILLEE D,et al.Mutants of arabidopsis lacking starch branching enzyme II substitute plastidial starch synthesis by cytoplasmic maltose accumulation[J].Plant Cell,2006,18(10):2694-2709.
[28]RUMBAK E,RAWLINGS D E,LINDSEY G G,et al.Characterization of the butyrivibrio-fibrisolvensGlgbgene,which encodes a glycogenbranching enzyme with starch-clearing activity[J].J Bacteriol,1991,173(21):6732-6741.
[29]KIM E J,RYU S I,BAE H A,et al.Biochemical characterisation of a glycogen branching enzyme fromStreptococcus mutans:enzymatic modification of starch[J].Food Chem,2008,110(4):979-984.
[30]KIM E J,RYU S I,BAE H A,et al.Biochemical characterisation of a glycogen branching enzyme fromStreptococcus mutans:enzymatic modification of starch[J].Food Chem,2008,110(4):979-984.
[31]VAN DER VLIST J,REIXACH M P,VAN DER MAAREL M,et al.Synthesis of branched polyglucans by the tandem action of potato phosphorylase andDeinococcus geothermalisglycogen branching enzyme[J].Macromol Rapid Commun,2008,29(15):1293-1297.
[32]VAN DER VLIST J,FABER M,LOEN L,et al.Synthesis of hyperbranched glycoconjugates by the combined action of potato phosphorylase and glycogen branching enzyme fromDeinococcus geothermalis[J].Polymers,2012,4(1):674-690.
[33]ROUSSEL X,LANCELON-PIN C,VIKSO-NIELSEN A,et al.Characterization ofsubstrate and product specificityof the purified recombinant glycogen branching enzyme ofRhodothermus obamensis[J].Biochim Biophys Acta,2013,1830(1):2167-2177.
[34]JO H J,PARK S,JEONG H G,et al.Vibrio vulnificusglycogen branching enzyme preferentially transfers very short chains:N1 domain determines the chain length transferred[J].FEBS Lett,2015,589(10):1089-1094.
[35]SUZUKI E,SUZUKI R.Distribution of glucan-branching enzymes among prokaryotes[J].Cell Mol Life Sci,2016,73(14):2643-2660.
[36]PALOMO M,PIJNING T,BOOIMAN T,et al.Thermus thermophilus glycoside hydrolase family 57 branching enzyme crystal structure,mechanism of action,and products formed[J].J Biol Chem,2011,286(5):3520-3530.
[37]ABAD M C,BINDERUP K,RIOS-STEINER J,et al.The X-ray crystallographic structure ofEscherichia colibranching enzyme[J].J Biol Chem,2002,277(44):42164-42170.
[38]CHRONAKIS I S.On the molecular characteristics,compositional properties,and structural-functional mechanisms of maltodextrins:a review[J].Food Sci Nutr,1998,38(7):599-637.