4-羟基-2,5-二甲基-3(2H)-呋喃酮(4-hydroxy-2,5-dimethyl-3(2H)-furanone,HDMF),商品名称为呋喃酮,又名草莓酮或菠萝酮,广泛分布于自然界中,如在草莓、菠萝、橙桔、黑莓、葡萄、芒果、覆盆子等水果中都有检测出HDMF。另外,在牛肉清汤、新烤面包、炒杏仁、炒榛子、葡萄酒、白兰地酒、爆玉米花、咖啡、木材和烟等众多产品中也有HDMF的发现[1-4]。HDMF香气复杂,是一种具有类似麦芽酚强烈焙烤焦糖气的杂环香料,在低质量浓度时呈现清香的草莓、菠萝的香气特征,高质量浓度时呈现焦糖味,同时具有浓郁的水果香气及果酱味[5-6]。HDMF香气阈值很低,为0.04 μg/L,香味强度分别为麦芽酚和乙基麦芽酚的12.5倍和2.5倍,增香效果明显,且香味持久,是一种优良的甜味香料和增香剂,广泛被用作食品、烟草和饮料等产品中的增香剂,是食品安全国家标准GB 2760—2014《食品添加剂使用标准》、美国食用香料与提取物制造者协会(the flavor and extract manufacturers association of the United States,FEMA)(登记号3174)和欧洲理事会(Council of Europe,COE)(登记号536)认可允许使用的安全食用香料,并被业界冠以“香料之王”的美称[1,4,7-9]。
鉴于HDMF阈值低、香势好和特征性强等优良呈香特性,市场对HDMF的需求量越来越大。然而,天然产物中HDMF的含量很少,远远不能满足迅速发展的香料及其他工业的需要,而当前普遍采用的化学合成法则由于存在合成步骤多、纯度不高、产品香气特征不佳且有溶剂及其他中间产物残留等问题,在一些产品中,尤其是崇尚天然的食品中的应用受到限制。通过生物方法,即利用微生物的代谢合成HDMF成为了一种趋势[6]。为此,本文将对HDMF的研究现状,尤其是微生物法合成HDMF的现状进行简述,以期为相关研究提供参考。
1 HDMF的应用
因其独特的感官特性,HDMF在食品、烟草和化妆品等产品中都有着广泛的应用,具有明显增香和增味的作用。如在成品啤酒中,具有焦糖和烘烤香的HDMF含量远高于其风味阈值,对啤酒风味有着显著贡献,是啤酒呈现麦芽香的物质基础[10];在黍米黄酒中,HDMF有较高的香气活力值,对黄酒香味贡献较为明显,尤其是在半甜、甜型的黍米黄酒中能显著增加产品中的焦甜香味[11];在葡萄酒中,HDMF则与4-羟基-2(5)-乙基-5(2)-甲基-3(2H)呋喃酮(4-hydroxy-2(5)-ethyl-5(2)-methyl-3(2H)-furanone,HEME)共同赋予葡萄酒的果味和焦糖味[12-13];在酱油中,HDMF是重要的特征风味物质,为酱油贡献焦糖香味和酱香味[14];HDMF在茶香中也具有重要的作用,是茶烘焙过程中具有独特甜味和焦糖香的主要贡献者[15];HDMF在烟草产品中可以提高烟草口感和香味品质,是卷烟主流烟气中焦甜香关键成分之一[16];除此之外,HDMF还有屏蔽不愉快味道、抗菌抑菌、预防白内障、抑制黑色素等功能[17-20],如HDMF可用来调配食用香精,在牛肉香精中添加HDMF可增加焦甜香,对牛肉整体风味的形成具有重要贡献,模拟出的烤牛肉香精和实际样品香气相似度达90%以上[21-22];GULE N P等[23]则采用含HDMF的聚乙烯醇制备了具有良好抗菌和抑菌作用的纳米纤维膜;DEVADAS S M等[24]将HDMF用作涂层生物材料,降低了医疗器械的相关感染;LEE J等[20]研究发现,HDMF可以通过抑制环磷酸腺苷信号通路来抑制黑色素生成,推测HDMF可有效抑制色素的过度沉着,应用于皮肤美白产品中。
2 HDMF的检测
HDMF存在于许多产品中,对这些产品的风味品质有着重要的作用,甚至成为衡量这些产品品质以及品种的重要参数,有必要对这些产品中HDMF含量进行测定。另外,在HDMF生产合成过程中,也需要对其含量进行检测,以此评估该合成方法的效率。因此,建立有效的HDMF检测方法十分重要。
2.1 前处理
虽然HDMF广泛存在于多种水果、食品、烟草和化妆品中,但其含量都比较低,并且这些产品中还存在着其他复杂的成分。因此,对这些产品中HDMF的含量进行检测十分困难,需要对其进行适当的前处理,才能有效地准确检测到这些产品中HDMF的含量。另外,在以微生物法合成HDMF中,其含量也往往较低,并且发酵体系中同样存在着较复杂的其他代谢产物,对其含量的检测产生干扰,为此,也需要预先对发酵液进行前处理。目前,检测HDMF常用的前处理方法主要为液液萃取和顶空-固相微萃取等。
液液萃取适用于所有沸点范围的化合物,虽然费时、污染、浪费等问题突出,但萃取成本低、重现性好,是测定食品、烟草等产品中HDMF含量有效的前处理方法[25]。WANG X J等[26]采用液液萃取方法对5种高盐稀态酱油进行前处理,结合全二维气相色谱-嗅闻-质谱联用方法分析表明,HDMF是酱油中的关键风味化合物;张增显[27]采用液液萃取法前处理啤酒,并检测了萃取物中的甜味化合物,结果表明,HDMF对啤酒焦糖甜味和香味具有重要作用。
顶空-固相微萃取利用吸附/脱附技术富集样品中的挥发和半挥发性成分,无需有机溶剂、所需样品量少、灵敏度高且可直接与气质联用仪或液相色谱仪联用,是检测样品中HDMF含量的一种有效的前处理方法。如,VAN DE CANS M G等[28]利用顶空固相微萃取法对特种麦芽中的挥发性风味物质进行前处理,后采用气相色谱质谱法进行分析,结果发现HDMF是麦芽呈焦糖味的重要贡献物质之一。
2.2 检测方法
当前,有关HDMF的检测主要是气相色谱法和高效液相色谱法。气相色谱法适合分析挥发性物质,常与质谱、三重四级杆质谱、嗅闻技术联用,在对样品中HDMF定性和定量分析方面具有灵敏度高和精密度好的特点,是分析检测HDMF含量的主要方法。张海林等[9]采用气相色谱方法对酵母菌发酵产HDMF进行了定量测定;张泽宇等[29]采用气相色谱质谱联用法分析了储存期间热反应香味料的香辛料香气属性,结果表明HDMF与其香气属性具有强相关性,是区分热反应香味料是否添加香辛料的关键化合物之一。虽然气相色谱法在检测样品中HDMF含量时需要对样品进行前处理,不能直接进样,但十分适合于食品等复杂体系中风味物质的分析检测。
高效液相色谱法是一种普及性好,简便易操作,灵敏度高,分析速度快,样品处理相对简单,选择性好的方法,也常被用于检测样品中HDMF含量,尤其是在合成HDMF产物含量的检测中。如王鹏霄等[30-31]在研究产呋喃酮酵母菌分离和发酵条件优化时,都采用了高效液相法对其含量进行检测,但在具体方法参数上存在一定差异,这主要与其所选用的色谱柱不同有关。高效液相色谱法无需对样品进行前处理即可检测其中HDMF含量,但对于含量极少且成分非常复杂的样品则可能受限于其检测灵敏度及色谱柱的分离效果而无法采用。
3 HDMF的生产方法
HDMF生产方法有天然提取、化学合成和生物合成3种[32]。
3.1 天然提取
1965年,RODIN J O等[4]首次在菠萝中发现并用乙醚萃取方法分离出了呋喃酮,呋喃酮类化合物在食品风味中的重要性引起了关注。呋喃酮广泛存在于多种植物体内,主要以四种形式存在:4-甲氧基-2,5-二甲基-3(2H)-呋喃酮、4-羟基-2,5-二甲基-2H-呋喃-3-酮葡糖苷、4-羟基-2,5-二甲基-2H-呋喃-3-酮6'-O-丙二酰基-β-D-吡喃葡萄糖苷和游离糖苷元,因此,可以从含有HDMF的菠萝、草莓等蔬菜水果中直接提取和分离[2,33]。但是,由于植物体内呋喃酮含量均较低,分离、提取困难且成本较高,无法满足当前工业应用中对HDMF的需求量。
3.2 化学合成
1966年,HENRY D W等[34]采用化学合成方法获得了HDMF,后续围绕化学合成HDMF开展了大量的科学研究,开发出了多种化学合成HDMF的方法,如以化学合成原料的来源不同分为:①以烯醇和炔醇为原料;②以丙酮醛为原料;③以3,4-己二酮及其卤化物为原料;④以有机羧酸以及羧酸酯为原料;⑤以呋喃类及吡喃类化合物为原料;⑥以糖类化合物为原料(图1)[5,7,35-36]。
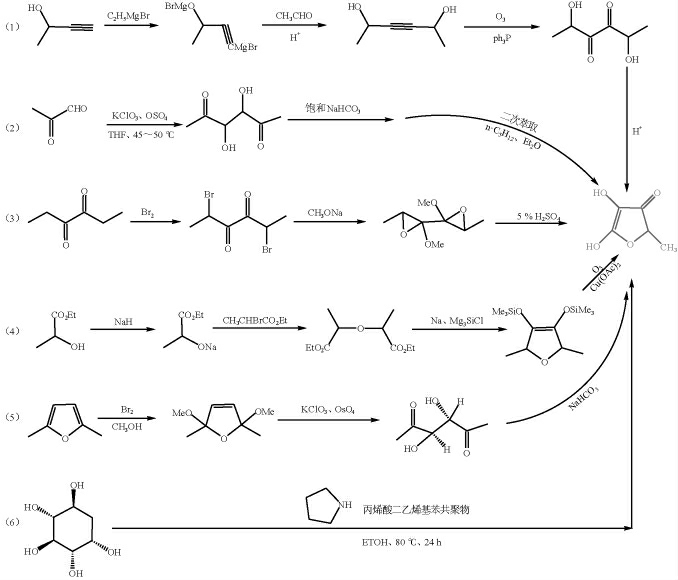
图1 2,5-二甲基-4-羟基-3(2H)-呋喃酮的化学合成方法
Fig. 1 Chemical synthesis methods of 2,5-dimethyl-4-hydroxy-3(2H)-furanone
由于化学合成方法合成速率快,所以目前一般采用此方法生产HDMF。但随着人们生活水平的提高,人们越来越崇尚天然制品。化学合成方法存在的众多弊端,诸如合成步骤较多、得率低、生产成本仍较高、尤其是污染物排放量大、产物香气特征不佳及存在溶剂残留等问题日益显现,不符合人们对当前产品质量的高要求,特别是将其应用于食品产品中[11]。
3.3 生物合成
按照欧洲和美国食品法规的规定,生物技术法生产的HDMF与从蔬菜水果中提取获得的HDMF一样,也属于“天然的”HDMF,与化学合成的HDMF相比,该方法获得HDMF不仅香气纯正浓厚、香韵好、品质高,而且安全性更好,具有不可替代性,逐渐成为生产天然HDMF主流趋势,受到众多研究者的关注[6,32-33]。目前,生物合成法生产HDMF的研究尚处于探索阶段,主要用微生物模拟植物次级代谢产HDMF为主,集中于筛选产HDMF微生物菌株及其发酵条件优化等相关研究。除此之外,也有少量研究侧重于微生物合成HDMF的机制研究,探究其代谢途径[9,30-31]。目前研究发现,能够代谢合成HDMF的微生物种类比较少,且产量普遍偏低,所利用的培养基成本相对较高,尚不能满足市场对天然HDMF的需求量。但相比天然提取而言,其产量相对较高,且步骤简单,是满足人们对天然HDMF需求量日益增加的有效方法。为此,应加强高产HDMF菌种的研究,尤其是利用廉价培养基筛选高产HDMF菌种和优化发酵条件,并解析其形成HDMF的代谢途径及关键酶,通过现代分子生物学改造和构建高产HDMF的工程菌株,从而提高微生物合成HDMF的能力。
4 合成HDMF的微生物种类
起初,研究者认为酱油等食品中的HDMF形成于生产制造过程中的美拉德反应,但随着在更多有酵母菌和乳酸菌参与发酵的食品中(如啤酒、味噌和奶酪等)检测出HDMF,研究者们逐渐意识到微生物在食品HDMF的形成中发挥着重要作用。经过研究发现,某些昆虫、酵母菌和细菌在固定培养基中或特定条件下进行培养,可通过次级代谢合成呋喃酮类化合物。目前,国内外有关微生物转化生产HDMF的研究仍相对较少,已报道能够产HDMF的微生物种类不多,主要有鲁氏酵母(Zygosaccharomyces sp.)、毕赤酵母(Pichia sp.)和乳酸菌等,并且主要集中于酵母菌株(表1)。由表1可知,在已有报道微生物中,其所产HDMF含量普遍较低,且发酵培养中普遍含有1,6-二磷酸果糖(fructose-1,6-diphosphate,FDP)前体物质。
表1 合成4-羟基-2,5-二甲基-3(2H)-呋喃酮的微生物
Table 1 Microorganisms for synthesis of 4-hydroxy-2,5-dimethyl-3(2H)-furanone

菌株 培养基条件 产量/(mg·L-1) 文献Zygosaccharomyces rouxii ATCC13356 Zygosaccharomyces rouxii ATCC13356 Zygosaccharomyces rouxii QOR6 10%FDP、5%葡萄糖、17%NaCl 10 g/L D-葡萄糖、80 g/L FDP、50 g/L CaCl2和120 g/L NaCl酵母浸粉胨葡萄糖(yeast extract peptone dextrose,YPD)培养基80 35 2.9[37][38][31]
续表

菌株 培养基条件 产量/(mg·L-1) 文献Zygosaccharomyces rouxii No.32899 Zygosaccharomyces rouxii No.32899 Zygosaccharomyces rouxii Saccharomyces chevalieri Hansenula anomala var.anomala Cryptococcus laurentii Candida albicans Metschmkowta pulcherrima Issatchenkia orientails Saccharomycodes ludwigii Hanseniasporas sp.Candida versatilis Zygosaccharomyces pseudorouxii Pichia guilliermondii SX-21 Pichia guilliermondii SX-21 Pichia guilliermondii NTG-SX-103 Pichia guilliermondii NTG-SX-103 Pichia caribbica Pichia caribbica P3-UV-DES-12 Zygosaccharomyces bailii Lactobacillus helveticus ATCC15009 Lactobacillus delbrueckii Lactococcus lactis subsp.cremoris IFO3427含120 g/L FDP和180 g/L NaCl的YPD培养基含12 g/L D-果糖的YPD培养基酪蛋白胨15 g/L、L-鼠李糖50 g/L、葡萄糖10 g/L、MgSO4·7H2O 5 g/L、KH2PO4 4 g/L酪蛋白胨15 g/L、果糖120 g/L、MgSO4·7H2O 5 g/L、KH2PO4 4 g/L酪蛋白胨15 g/L、果糖120 g/L、MgSO4·7H2O 5 g/L、KH2PO4 4 g/L酪蛋白胨15 g/L、果糖120 g/L、MgSO4·7H2O 5 g/L、KH2PO4 4 g/L酵母膏5 g/L、蛋白胨5 g/L、NaH2PO4 4 g/L、MgSO4·7H2O 5 g/L、NaCl 80 g/L、葡萄糖100 g/L 10%FDP、14%NaCl的13°Bé麦汁培养基12%NaCl、10%FDP、13°Bé麦汁培养基400 g/L FDP的13°Bé麦汁培养基酪蛋白胨15 g/L、果糖120 g/L、MgSO4·7H2O 5 g/L、KH2PO4 4 g/L果糖141.65 g/L、酪蛋白胨15 mg/L、K2HPO4 4g/L、MgSO4·7H2O 5g/L、初始pH 3.5浓缩葡萄汁19.3 g未发酵乳清粉于水(300 mL)19.3 g未发酵乳清粉于水(300 mL)半乳糖和谷氨酸钠6.77 98 5.67 3.41 3.84 3.73 2.08 3.75 3.82 6.28 6.84 20-24 27.90 3.2 100 320 704.7 10.96 39.43 154.57 0.598 0.467 1.17[39][40][41][30][42][42][43][43][9][43][30][41][44][45][45][46]
4.1 鲁氏酵母
在研究酱油HDMF的形成机制时发现,酱油酿造期间鲁氏酵母可通过次级代谢作用产生HDMF,在酱油独特风味的形成中发挥着积极的作用[47-50]。基于此背景,科研人员加强了对鲁氏酵母产HDMF的研究,相关研究主要是从不同酱油酿造环境中筛选获得鲁氏酵母,并对其发酵产HDMF条件进行优化,如DAHLENT等[38,51]优化了鲁氏酵母产HDMF的培养基组成,在添加10 g/L D-葡萄糖、80 g/L FDP、50 g/L CaCl2和120g/LNaCl的培养基中产HDMF最高,约为35mg/L;周亚男[39]优化了高密度发酵产呋喃酮风味物质的培养条件,结果表明当接种量为5×108 CFU/mL、FDP添加量为120 g/L、NaCl添加量为180 g/L、培养5 d时,HDMF产量最高,为6.77 mg/L;HECQUET L等[37]研究则表明,鲁氏酵母在添加10%的FDP和5%D-葡萄糖的培养基中培养发酵11 d,培养基中HDMF的质量浓度达到最高,约为80 mg/L(表1)。由上述可见,鲁氏酵母是产HDMF的主要微生物菌种,也是研究微生物产HDMF最早的菌种,有关微生物产HDMF的相关机制也主要是基于此菌种开展的,但总体而言,该菌株所产HDMF能力有限,且相关研究多在以高价格的FDP为底物的培养基中进行的,发酵成本较高。
4.2 毕赤酵母
毕赤酵母是另一类能代谢合成HDMF的酵母,早期研究发现该酵母可以转化L-(+)-鼠李糖代谢合成HDMF,如荚膜毕赤酵母(Pichia capsulata)在含有鼠李糖和酪蛋白培养基中可以产HDMF,产量最高约为2 mg/L[52]。另外,该酵母菌属也可利用FDP或果糖产HDMF,如从酒曲中分离筛选获得的季也蒙毕赤酵母(Pichia guilliermondii)SX-21,在高浓度的NaCl和FDP培养基中,其产量为100 mg/L,而从菠萝、草莓等水果中分离筛选到的毕赤酵母在含有D-果糖的培养基中也能产HDMF,产量可达6.84 mg/L[9,30]。值得注意的是,已报道最高产HDMF的菌株是该菌属中的一株突变株,即经亚硝基胍诱变季也蒙毕赤氏酵母的突变株,在含400 g/LFDP的培养基中HDMF产量高达700 mg/L以上(表1)[43]。
4.3 乳酸菌
乳酸菌是一类革兰氏阳性菌的统称,许多乳酸菌被公认为安全的食品级微生物,在部分发酵食品生产过程中能促进产品风味物质的形成。有研究表明,在含有瑞士乳酸杆菌(Lactobacillus helveticus)的氨基酸脱脂牛奶培养基中检测到HDMF,推测该菌株能产HDMF[53],在后来的研究结果中也证实了该推测,瑞士乳酸杆菌和德氏乳杆菌(Lactobacillus delbrueckii)在乳清粉水悬液中都能产HDMF,培养7 d后分别产598 μg/L和427 μg/L[45];广泛用于乳酪生产的菌种-乳酸乳杆菌乳酸亚种(Lactobacillus lactis subsp.cremoris)在含有谷氨酸钠和核糖或半乳糖培养基中均有HDMF产生,且在添加半乳糖的培养基中产量较高,培养3 d时产量可达到1.17 mg/L(表1)[46]。
综上可见,目前天然微生物转化生产HDMF的菌种种类较少,主要是鲁氏酵母,其次为毕赤酵母和乳酸菌,并且所产HDMF能力都较低,通过微生物发酵法尚不能满足工业生产对HDMF的需求。但随着对产HDMF微生物菌株研究的重视,将会有越来越多产HDMF的菌株被挖掘出来,如有研究发现,汉逊酵母(Hansenula sp.)、马克思克鲁维酵母(Kluyveromyces marxianus)、罗伦隐球酵母(Cryptococcus laurentii)、白假丝酵母(Candida albicans)、美极梅奇酵母(Metschnikowia pulcherrima)、东方伊萨酵母(Pichia kudriavzevii)、路德类酵母(Saccharomycodes ludwigii)、酿酒酵母(Saccharomyces cerevisiae)、拜耳结合酵母(Zygosaccharomyces bailii)、佛氏丙酸杆菌(Propionibacterium freudenreichii)和扭脱甲基杆菌(Methylobacterium extorquens)等菌株也能产HDMF,并且随着分子生物技术的发展,可以通过基因构建、改造或修饰来提高微生物法发酵产HDMF的能力[43-44,54-56]。
5 微生物合成HDMF的机制及其关键酶
目前,已知产HDMF的微生物菌株,无论是酵母菌还是细菌,其合成HDMF的内在机制都处于探索阶段,生产机理尚不清楚[57]。从已有研究中可知,微生物合成HDMF需要己糖存在,推测可能是微生物通过代谢己糖直接产生HDMF或者是代谢己糖与氨基酸在高温下发生美拉德反应的中间产物生成HDMF,但均无完整且清晰的代谢途径,这极大限制了微生物合成HDMF的深入研究和生物法工业化的生产[57-58]。相较而言,有关鲁氏酵母生物合成HDMF代谢途径的研究比较多,如HAYASHIDA Y等[55]认为Mugi味噌、大豆酱和大麦曲等发酵基质中含有的己糖和氨基酸首先经美拉德反应产生Amadori中间产物,然后在鲁氏酵母作用下转化为6个碳的1-脱氧二酮糖后再转化形成HDMF;DAHLEN T等[38]采用同位素标记法分析发现,鲁氏酵母细胞壁或细胞膜上相关生物酶在催化FDP产生HDMF时发挥了重要的作用;随后HAUCK T等[51]利用鲁氏酵母细胞质和细胞内蛋白提取液将FDP成功转化合成了HDMF,这表明HDMF的产生需要以上两种提取液中的酶类参与。
基于已知微生物代谢合成HDMF时需要己糖类化合物存在的事实,学者推测与己糖代谢相关的糖酵解代谢途径(Embden-Meyerhof-Parnas pathway,EMP)及磷酸戊糖代谢途径(pentose phosphate pathway,PPP)在微生物合成HDMF中发挥着重要的作用。基于此,有学者提出了如图2所示的有关微生物合成HDMF的代谢途径,有关微生物,尤其是鲁氏酵母合成HDMF的机制基本上是通过以上两条途径展开研究的。
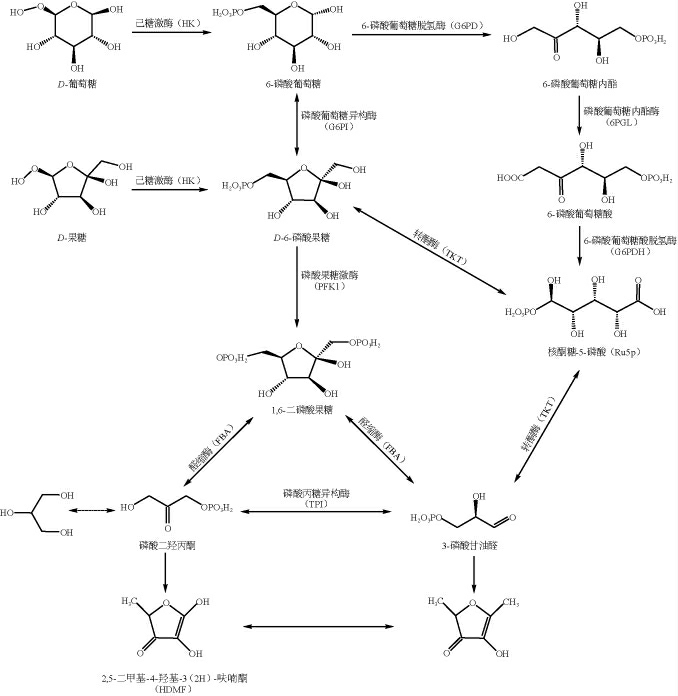
图2 通过EMP和PPP途径合成4-羟基-2,5-二甲基-3(2H)-呋喃酮
Fig. 2 Metabolic synthesis of 4-hydroxy-2,5-dimethyl-3(2H)-furanone through EMP and PPP pathways
5.1 通过EMP合成HDMF及其关键酶
在酵母糖类化合物代谢中,EMP发挥着重要的作用,因此,在酵母合成HDMF中发挥着积极的作用。EMP中磷酸果糖激酶(posphofructokinase,PFK1)、丙酮酸激酶(pyruvate kinase,PK)和己糖激酶(hexokinase,HK)三种单向酶在促进反应进行、调节能量方面起着关键性的作用[59]。果糖和葡萄糖在HK的作用下分别转化为6-磷酸-果糖和6-磷酸-葡萄糖,而6-磷酸-葡萄糖在磷酸葡萄糖异构酶(glucose-6-phosphate isomerase,G6PI)作用下转化为6-磷酸-果糖,在PFK1作用下6-磷酸-果糖催化为FDP,随后在醛缩酶(fructose-bisphosphate aldolase,FBA)作用下将FDP裂解为三磷酸甘油醛(glyceraldehyde 3-phosphate,GAP)和二羟基磷酸丙酮(dihydroxyacetone phosphate,DHAP),后者再经过一系列未知代谢途径转化为HDMF(图2)[60]。
5.2 通过PPP合成HDMF及其关键酶
PPP也是微生物细胞中糖代谢的关键途径,在微生物利用己糖合成HDMF中同样发挥着重要的作用。在氧化过程中,6-磷酸-葡萄糖在6-磷酸葡萄糖脱氢酶(glucose-6-phosphate dehydrogenase,G6PD)作用下氧化为6-磷酸-葡萄糖内酯,然后在6-磷酸-葡萄糖内酯酶(6-phosphogluconolactonase,6PGL)作用下生成6-磷酸-葡萄糖酸,随后在6-磷酸葡萄糖酸脱氢酶(6-phosphogluconate dehydrogenase,G6PDH)的作用下生成5-磷酸核酮糖,经转酮酶(transketolase,TKT)作用转化为3-磷酸甘油醛或6-磷酸-果糖,3-磷酸甘油醛再通过磷酸丙糖异构酶(triose phosphate isomerase,TPI)转化生成磷酸二羟丙酮,继而生成HDMF,而6-磷酸-果糖则通过EMP途径生产HDMF(图2)[40]。
6 微生物合成HDMF的培养条件
影响微生物合成HDMF的因素众多,按其内因和外因主要包括微生物菌种本身的基因特性和其培养发酵条件[61]。微生物菌种本身特性主要通过从不同环境中筛选、基因诱变或基因改造获得优良菌种而得到改善,而一旦菌种确定后就需要通过调控其培养条件,如碳源种类和浓度、氮源种类和浓度、盐浓度、初始pH值、摇床转速、培养温度、接种量、培养时间等因素对其合成HDMF产量进行调控[6,9]。
6.1 糖种类及其浓度
不同的糖种类对微生物合成HDMF会产生不同的影响。在前期研究中认为,酵母合成HDMF的前体物质是FDP,如DAHLEN T等[38]利用同位素标记法证明,HDMF是鲁氏酵母利用FDP产生的次级代谢产物。随着对微生物合成HDMF研究的深入,后续研究表明,除FDP外,麦芽糖、乳糖、鼠李糖、D-果糖等也是微生物合成HDMF的前驱物质,促进HDMF的生成。如张海林[43]探究了葡萄糖、FDP、果糖、乳糖、鼠李糖和麦芽糖等不同碳源对酵母合成HDMF的影响,结果表明,虽然以FDP为碳源时最有利于酵母合成HDMF,但果糖、鼠李糖和麦芽糖也能促进酵母合成HDMF;同样,在王鹏霄[41]研究中也证明了鼠李糖、麦芽糖和果糖都是酵母菌发酵产HDMF的有效前体。另外,糖浓度会对酵母合成HDMF产生一定影响,较高的糖浓度会对微生物细胞产生一定的渗透压胁迫,从而促进EMP和PPP中相关酶活性的提高,增加HDMF的生成[62]。如在周亚男[39]研究中发现,在不同浓度的FDP下酵母所产HDMF量有所不同,在0~120 g/L的FDP质量浓度范围内,随着培养基中FDP浓度的增加,酵母菌所产HDMF的能力呈现先升高后下降的趋势;HECQUET L等[37]研究发现在FDP含量为10%时,鲁氏酵母所产HDMF较高,而当其含量增加至20%时,其合成HDMF的能力则受到一定程度的抑制;DAHLEN T等[38]研究发现FDP浓度与HDMF浓度及酵母细胞数量呈正相关。
6.2 氮源种类及其浓度
有研究表明,美拉德反应的产物可以促进微生物生成HDMF。由此可以推测氮源对微生物合成HDMF具有重要的影响。如在无氮源的L-鼠李糖溶液中接种荚膜毕赤酵母发酵后未检测到HDMF,而将L-鼠李糖加入到含有蛋白胨的培养基中进行湿热灭菌后,再接种荚膜毕赤酵母发酵后则检测出HDMF,可见氮源会影响微生物合成HDMF[63]。然而,在张海林[43]研究中却发现,不同种类的氮源对酵母NTG-SX-103合成HMDF的影响较小,这可能是由于其所采用的初始培养基为麦汁,其中含有比较丰富的氮源的缘故。虽然有关氮源种类及其浓度对微生物合成HDMF的研究较少,但从其对微生物生长繁殖及其对微生物生物酶的调控和表达以及可能通过美拉德反应形成微生物合成HDMF的前体物质等方面分析,氮源种类及其浓度一定会对微生物合成HDMF产生影响。
6.3 NaCl和Ca2+质量浓度
有研究表明,在盐胁迫培养条件下会增加EMP中各代谢产物含量及其相关基因的表达,继而会影响微生物合成HDMF[64]。如周亚男[39]研究发现,随着发酵培养基中NaCl浓度的增加,鲁氏酵母合成HDMF的能力呈现先上升后下降趋势,当NaCl质量浓度为180 g/L时,酵母所产HDMF浓度最高;HAUCK T等[51]研究结果也表明,在NaCl含量为17%时有利于微生物合成HDMF。另外,有研究表明,Ca2+是一种渗透压传递信使,一定浓度的Ca2+有助于微生物合成HDMF,如有研究发现在培养基中添加1 mol/L Ca2+有助于酵母合成HDMF,其产量相比未添加Ca2+的培养基增加了23.3%,并且在0~1 mol/L范围内,HDMF的产量随着Ca2+浓度的增加而提高[43];DAHLEN T等[38]探究了酵母在含有不同浓度CaCl2的培养基中生长和产HDMF的情况,结果表明,在CaCl2质量浓度为10~50 g/L时有助于促进酵母合成HDMF。
6.4 初始pH值
pH值对微生物的生长有多方面影响,主要是通过影响关键酶酶活、微生物细胞膜所带电荷状态等,从而影响微生物对营养物质的吸收和新陈代谢。每种微生物都有其最适生长pH值和一定的生长pH值范围以及所产代谢产物的最佳pH值,适宜的初始pH值有利于促进微生物生长代谢和产代谢产物。如彭辉等[31]研究发现,鲁氏酵母QOR6在不同的初始pH值条件下所产HDMF含量有所不同,随着发酵液初始pH值的增加(由3.7增加至5.7时),其所产HDMF的量呈现先升高后降低趋势,在初始pH值为4.2时,产量最高,为2.18 mg/L;HAUCK T等[51]的研究结果也同样证实了初始pH值对微生物合成HDMF具有较大的影响。
6.5 摇床转速
摇床转速会影响培养基中营养物质与微生物细胞的接触、氧气传递效率以及对微生物细胞的剪切力,从而影响微生物生长代谢,对HDMF的合成产生影响。彭辉等[31]研究表明,转速对酵母合成HDMF也具有较大的影响,随着转速的增加,发酵液中HDMF含量呈现先上升后下降趋势,在转速为180 r/min时最高,适当的转速为其生长提供了充足的氧气;同样,在HECQUET L等[37]研究中也充分证明了相比厌氧发酵而言,有氧发酵更有利于其合成HDMF。
6.6 培养温度
培养温度会对酵母生长和代谢产生重要的影响,从而影响到其合成HDMF的能力,而不同的微生物其发酵合成HDMF的最佳培养温度会有所不同。如毕赤酵母菌株P3发酵产HDMF的最佳培养温度为34 ℃,其产量相比在38 ℃时提高了50%以上[41];而酵母QOR6的最佳发酵温度则为28 ℃,显著高于其他温度条件下发酵HDMF产量[31]。研究表明,发酵温度主要是通过影响微生物生物酶活性来调控其产HDMF的量,温度过低或过高都会影响到微生物代谢途径中合成HDMF的生物酶活性[65]。
6.7 接种量
接种量能调节微生物的生长代谢,适宜的接种量对微生物代谢产物的积累具有积极影响[66]。彭辉等[31]研究表明,随着接种量的增加,鲁氏酵母QOR6合成HDMF的产量先升高后降低,不同接种量之间存在着差异;周亚男[39]研究也发现,接种量会对酵母产HDMF产生一定影响;张海林[43]研究发现,接种量对酵母NTG-SX-103产HDMF影响不显著,这可能是与其所选用的接种量水平相关,在其所选用的不同接种量水平下,发酵后期酵母菌体浓度都没有太大的差异,从而导致HDMF含量差异不明显。
6.8 培养时间
培养时间不同,微生物代谢过程中相关生物酶的表达水平有所差异,对微生物合成HDMF会产生影响,因此,需要选择合适的培养时间[62]。如LI X等[40]在探索添加D-果糖条件下酵母合成HDMF的分子机制时发现,在发酵等3天时,HDMF的合成主要是通过EMP产生,而在第5天时,EMP和PPP则都是生成HDMF的主要途径,且HDMF含量达到最大;周亚男[39]在探究培养时间对微生物生成HDMF的影响时,均发现HDMF的含量随着发酵时间的增加先上升后下降,分别在第4天、7天和6天时HDMF含量达到最大。
7 结论与展望
基于HDMF本身具有的风味特性,未来其将会在众多食品中有着更为广泛的应用,尤其是天然源HDMF。目前,虽然化学法是生产HDMF的主要方法,但随着人们对天然性的偏爱,具有天然属性来源的HDMF的市场需求将会更大。天然源HDMF可以采用天然提取法和微生物法获得,但天然提取方法由于受原料来源及其本身含量的限制,无法满足市场的需求,而微生物法则因其产量相对较高且步骤简单,有希望成为天然HDMF的主要来源。然而,目前仍十分缺乏有关微生物合成HDMF的研究,当前已报道产HDMF的微生物主要集中于酵母菌株,并且产量都相对较低,尚无法满足工业化生产的需要。另外,有关其形成内在机制尚不清楚,无法对其发酵进行有效的调控。因此,后续应加强微生物法合成HDMF的研究,首先从不同环境中网罗一批高产HDMF性能优良的菌株,并对其合成机制进行系统研究,然后采用基因工程和酶工程等技术改造或构建相应工程菌株,并对其发酵条件进行优化,从而逐渐满足人们对天然HDMF的需求。
[1] SCHWAB W, ROSCHER R. 4-hydroxy-3(2h)-furanones: natural and maillard products[J].Recent Res Develop Phytochem,1997,1:643-673.
[2]PEREZ A G,OLIAS R,OLIAS J M,et al.Biosynthesis of 4-hydroxy-2,5-dimethyl-3(2h)-furanone and derivatives in in vitro grown strawberries[J].J Agr Food Chem,1999,47(2):655-658.
[3]PICKENHAGEN W,VELLUZ A,PASSERAT J,et al.Estimation of 2,5-dimethyl-4-hydroxy-3(2H)-furanone (furaneola) in cultivated and wild strawberries,pineapples and mangoes[J].J Sci Food Agr,1981,32(11):1132-1134.
[4]RODIN J O,HIMEL C M,SILVERSTEIN R M,et al.Volatile flavor and aroma components of pineapple. L. Isolation and tentative identification of 2,5-dimethyl-4-hydroxy-3(2H)-furanone[J]. J Food Sci, 1965, 30(2):280-285.
[5]房升,易玲敏,葛挺峰,等.2,5-二甲基-4-羟基-3(2H)-呋喃酮的合成研究[J].高校化学工程学报,2005,19(2):233-237.
[6]潘百玲,戴凌燕,刘微,等.微生物代谢合成呋喃酮的培养条件和酶学调控研究进展[J].黑龙江八一农垦大学学报,2021,33(5):67-73.
[7]朱卓越.2,5-二甲基-4-羟基-3(2H)-呋喃酮的合成研究[D].长沙:湖南师范大学,2005.
[8]罗德智.呋喃酮的绿色合成工艺[D].杭州:浙江大学,2006.
[9]张海林,范文来,徐岩.高产2,5-二甲基-4-羟基-3(2H)-呋喃酮(DMHF)酵母菌株的选育[J].中国酿造,2009,28(11):20-23.
[10]陈华磊,徐楠,杨朝霞,等.啤酒中麦芽风味的研究进展[J].中外酒业,2021(17):9-16.
[11]蒋彰.黍米黄酒关键风味物质研究[D].无锡:江南大学,2021.
[12]FERREIRA V,ORTIN N,ESCUDERO A,et al.Chemical characterization of the aroma of grenache rose wines:aroma extract dilution analysis,quantitative determination,and sensory reconstitution studies[J]. J Agr Food Chem,2002,50(14):4048-4054.
[13]XU Q,YLA B,SHEN H C,et al.Comprehensive investigation of lactones and furanones in icewines and dry wines using gas chromatographytriple quadrupole mass spectrometry[J].Food Res Int,2020,137:109650.
[14]高献礼.高盐稀态酱油在发酵和巴氏杀菌过程中风味物质形成和变化的研究[D].广州:华南理工大学,2010.
[15]HO C T,ZHENG X,LI S.Tea aroma formation[J].Food Sci Hum Well,2015,4(1):9-27.
[16]胡安福,范武,夏倩,等.卷烟主流烟气焦甜、奶香和豆香特征成分组群的分布特征和感官贡献[J].烟草科技,2020,53(12):27-36.
[17] SASAKI T, YAMAKOSHI J, SAITO M, et al. Antioxidative activities of 4-hydroxy-3(2H)-furanones and their anti-cataract effect on spontaneous cataract rat(ICR/F)[J].Biosci Biotech Bioch,1998,62(10):1865-1869.
[18]CHOI S,ZHANG C,MOON S,et al.Inhibitory effects of 4-hydroxy-2,5-dimethyl-3(2H)-furanone(HDMF) on acyl-homoserine lactone-mediated virulence factor production and biofilm formation in Pseudomonas aeruginosa pao1[J].J Microbiol,2014,52(9):734-742.
[19]丁德生.呋喃酮及其在食品饮料等方面的应用[J].中国食品添加剂,2000(1):45-49.
[20]LEE J,JUNG E,LEE J,et al.Mechanisms of melanogenesis inhibition by 2,5-dimethyl-4-hydroxy-3(2H)-furanone[J].Brit J Dermatol,2007,157(2):242-248.
[21] TAKAKURA Y, SAKAMOTO T, HIRAI S, et al. Characterization of the key aroma compounds in beef extract using aroma extract dilution analysis[J].Meat Sci,2014,97(1):27-31.
[22]戴水平,肖作兵,马双双,等.一种烤牛肉的挥发性成分分析及其香气模拟[J].香料香精化妆品,2010(5):43-47.
[23] GULE N P, DE KWAADSTENIET M, CLOETE T E, et al. Furanonecontaining poly(vinyl alcohol)nanofibers for cell-adhesion inhibition[J].Water Res,2013,47(3):1049-1059.
[24] DEVADAS S M, NAYAK U Y, NARAYAN R, et al. 2,5-dimethyl-4-hydroxy-3(2H)-furanone as an anti-biofilm agent against non-Candida albicans candida species[J].Mycopathologia,2019,184(3):403-411.
[25]成晓玲,庄玉婷,李艳.气相色谱及气质联用在葡萄酒香气成分分析检测中的应用进展[J].酿酒科技,2010(11):83-86.
[26] WANG X J, GUO M Y, SONG H L, et al. Characterization of key odor-active compounds in commercial high-salt liquid-state soy sauce by switchable GC/GC×GC-olfactometry-MS and sensory evaluation[J].Food Chem,2021,342:128224.
[27]张增显.啤酒发酵时甜味化合物的产生[J].啤酒科技,2002(10):56-58.
[28]VAN DE CAN S M G,SAISON D,SCHOUPPE N,et al.Optimisation of specialty malt volatile analysis by headspace solid-phase microextraction in combination with gas chromatography and mass spectrometry[J].Anal Chim Acta,2010,671(1-2):55-60.
[29]张泽宇,王蓓,曹雁平.香辛料对牛肉味热反应香味料储存期间香气质量的影响[J].食品科学,2022,44(12):189-198.
[30]王鹏霄,程林坤,陈存社,等.产4-羟基-2,5-二甲基-3(2H)-呋喃酮酵母菌的分离、筛选及分子生物学鉴定[J].食品工业科技,2010,31(2):163-166.
[31]彭辉,姜鹏,李忍,等.鲁氏酵母菌QOR6产呋喃酮发酵条件优化及代谢特征分析[J].食品工业科技,2023,44(2):178-184.
[32]王鹏霄,宋焕禄,陈存社.微生物发酵法制备4-羟基-2,5-二甲基-3[2H]-呋喃酮的研究进展[J].中国酿造,2009,28(10):4-6.
[33]杨尚彤,黄忆楠,姜兴涛.生物转化法生产4-羟基-2,5-二甲基-3[2H]-呋喃酮的研究进展[C].杭州:第十届中国香料香精学术研讨会,2014.
[34]HENRY D W,SILVERSTEIN R M.A rational synthesis of 4-hydroxy-2,5-dimethyl-3(2H)-furanone,a flavor component of pineapple[J].J Org Chem,1966,31(7):2391-2394.
[35]何小玉.呋喃酮的生产与应用[J].化工技术与开发,2003(5):17-19.
[36]黎其万.呋喃酮合成进展[J].精细石油化工,1994(4):36-40.
[37] HECQUET L, SANCELME M, BOLTE J, et al. Biosynthesis of 4-hydroxy-2,5-dimethyl-3(2H)-furanone by Zygosaccharomyces rouxii[J].J Agr Food Chem,1996,44(5):1357-1360.
[38]DAHLEN T,HAUCK T,WEIN M,et al.2,5-dimethyl-4-hydroxy-3(2H)-furanone as a secondary metabolite from D-fructose-1,6-diphosphate metabolism by Zygosaccharomyces rouxii[J]. J Biosci Bioeng, 2001,91(4):352-358.
[39]周亚男.鲁氏酵母高密度培养制备及产呋喃酮条件优化研究[D].大庆:黑龙江八一农垦大学,2018.
[40] LI X, DAI L Y, LIU H, et al. Molecular mechanisms of furanone production through the emp and pp pathway in Zygosaccharomyces rouxii with D-fructose addition[J].Food Res Int,2020,133:109137.
[41]王鹏霄.4-羟基-2,5-二甲基-3(2H)-呋喃酮高产菌株的选育及发酵条件优化[D].北京:北京工商大学,2010.
[42]李蕊,王然,郭艳琼,等.酱醪中产HDMF酵母的分离、筛选及鉴定[J].食品与机械,2011,27(5):11-14.
[43]张海林.高产2,5-二甲基-4-羟基-3(2H)-呋喃酮酵母菌株的选育及培养环境的研究[D].无锡:江南大学,2009.
[44]刘真.降解5-羟甲基糠醛、高产焦糖香酵母菌筛选及其混菌发酵慕萨莱思的研究[D].阿拉尔:塔里木大学,2021.
[45]PREININGER M,GROSCH W.Determination of 4-hydroxy-2,5-dimethyl-3(2H)-furanone (HDMF) in cultures of bacteria[J]. Zeitschrift Fur Lebensmittel-Untersuchung Und Forschung,1995,201:97-98.
[46]HAYASHIDAY,HATANOM,TAMURA Y,et al.4-hydroxy-2,5-dimethyl-3(2H)-furanone(HDMF)production in simple media by lactic acid bacterium,Lactococcus lactis subsp cremoris IFO 3427[J].J Biosci Bioeng,2001,91(1):97-99.
[47] SUGAWARA E. Identification of 4-hydroxy-2(or 5)-ethyl-5(or 2)-methyl-3 (2H)-furanone as a flavor component in miso[J]. Nippon Shokuhin Kogyo Gakkaishi,1991,38(6):491-493.
[48]HAYASHIDA Y,NISHIMURA K,SLAUGHTER J C.The importance of the furanones HDMF and HEMF in the flavour profile of Japanese barley miso and their production during fermentation[J].J Sci Food Agr,1998,78(1):88-94.
[49]韩冉,张珊,余倩倩,等.鲁氏酵母不同时间的添加对高盐稀态酱油的影响[J].中国调味品,2020,45(9):1-4.
[50]郭建,伍学明,樊君,等.鲁氏酵母和球拟酵母不同接种方式对高盐稀态酿造酱油品质的影响[J].中国调味品,2019,44(2):100-104.
[51] HAUCK T, BRUHLMANN F, SCHWAB W. Formation of 4-hydroxy-2,5-dimethyl-3[2H]-furanone by Zygosaccharomyces rouxii: identification of an intermediate[J].Appl Environ Microb,2003,69(7):3911-3918.
[52]ROSCHER R,HILKERT A,GESSNER M,et al.L-rhamnose:progenitor of 2,5-dimethyl-4-hydroxy-3[2H]-furanone formation by Pichia capsulata?[J].J Agr Food Chem,1997,45:3202-3205.
[53]KOWALEWSKA J,ZELAZOWSKA H,BABUCHOWSKI A,et al.Isolation of aroma-bearing material from Lactobacillus helveticus culture and cheese1[J].J Dairy Sci,1985,68(9):2165-2171.
[54] ZABETAKIS I, GRAMSHAW J W, ROBINSON D S. 2,5-dimethyl-4-hydroxy-2h-furan-3-one and its derivatives: analysis, synthesis and biosynthesis-a review[J].Food Chem,1999,65(2):139-151.
[55] HAYASHIDA Y, NISHIMURA K, SLAUGHTER J C. Formation mechanisms of flavour-active furanones,4-hydroxy-2,5-dimethyl-3(2 H)-furanone(HDMF)and 4-hydorxy-2(or 5)-ethyl-5(or 2)-methyl-3(2 H)-furanone(HEMF),in mugi-miso,fermented soy-beans paste with barleykoji[J].J Brew Soc Jpn,1998,93(9):730-738.
[56] DONGMO S N, SACHER B, KOLLMANNSBERGER H, et al. Key volatile aroma compounds of lactic acid fermented malt based beverages-impact of lactic acid bacteria strains[J]. Food Chem, 2017, 229:565-573.
[57]俞兆斌,朱丽霞.4-羟基-2,5-二甲基-3(2H)-呋喃酮的生物与非生物的合成途径研究进展[J].食品与发酵工业,2024,50(4):329-336.
[58]BLANK I,FAY L B.Formation of 4-hydroxy-2,5-dimethyl-3(2H)-furanone and 4-hydroxy-2 (or 5)-ethyl-5 (or 2)-methyl-3(2H)-furanone through maillard reaction based on pentose sugars[J].J Agr Food Chem,1996,44(2):531-536.
[59]刘翠翠.鲁氏酵母胞内高海藻糖发酵调控及代谢特征研究[D].武汉:湖北工业大学,2018.
[60]LU H M,LI J M,HUANG Y H,et al.Genome-wide identification,expression and functional analysis of the phosphofructokinase gene family in Chinese white pear(Pyrus bretschneideri)[J].Gene,2019,702: 133-142.
[61]王旺.毕赤酵母工程菌产植酸酶的发酵优化及放大[D].广州:华南理工大学,2019.
[62]李昕.外源D-果糖促进鲁氏酵母合成呋喃酮碳代谢的分子机制研究[D].大庆:黑龙江八一农垦大学,2020.
[63]HAYASHIDA Y,SLAUGHTER J C.Biosynthesis of flavour-active furanones by Saccharomyces cerevisiae during fermentation depends on the malt type used in medium preparation[J].Biotechnol Lett,1997,19(5):429-431.
[64]李明达,陈霞,韩丹,等.盐胁迫条件下酿酒酵母的代谢通量分析[J].吉林大学学报(理学版),2010,48(4):699-703.
[65] FAN G S, LIU P X, CHANG X, et al. Isolation and identification of a high-yield ethyl caproate-producing yeast from Daqu and optimization of its fermentation[J].Front Microbiol,2021,12:663744.
[66]LI W Z,SHI C E,GUANG J Q,et al.Development of Chinese chestnut whiskey: yeast strains isolation, fermentation system optimization, and scale-up fermentation[J].AMB Express,2021,11(1):17.