果酒是将新鲜水果或果汁全部或部分发酵制成酒精度在8%vol~12%vol之间的发酵酒[1]。近年来,低醇果酒(酒精度<7%vol)备受年轻消费者青睐,不仅含有丰富的生物活性成分,还能降低酒精的危害,低醇果酒现已逐渐延伸水果产业链,以此产品形式提升产业效益[2]。根据中研普华研究院报告《2022-2026年中国果酒行业发展态势与前景展望研究报告》统计分析显示,目前,我国果酒销售额的年增长率为15%,市场前景广阔。
然而,果酒存在酸度过高的现象,这也是制约果酒发展的重要因素[3]。适当的果酒酸度能提升酒的口感[4],而酸度过高则会使酒体风味变得酸涩[5]。果酒酸度主要与果酒中有机酸的组成及其含量有关[6],果酒中的有机酸的来源主要包括水果中本身含有的有机酸,比如柠檬酸、苹果酸和酒石酸等,以及在发酵过程中可能产生有机酸,如醋酸、乳酸[7]。不同的有机酸赋予果酒不同的口感,如苹果酸含量过多会导致果酒口感酸涩,柠檬酸的酸味温和清爽,可以赋予果酒适宜的酸感[8]。苹果酸是果酒中常见的有机酸,葡萄酒中苹果酸和酒石酸的含量可以占到葡萄酒总酸度的70%~90%,当苹果酸含量较多时,会导致水蜜桃果酒口感粗糙[9],同时这也是引起苹果酒酸味高、苦涩感强的的主要原因[10]。降低果酒中苹果酸的含量能提升果酒的口感,有利于扩大果酒的市场规模。
目前,果酒中常见的降酸方法包括化学法、物理法和生物法三种[11]。其中,生物降酸是利用微生物的生长代谢分解有机酸,与物理降酸和化学降酸相比,其具有条件绿色、反应温和、食用安全性高等优点[12],受到广泛关注,其中应用具有降酸能力的酵母成为降低果酒酸度的一种重要手段。刘延岭等[13]从猕猴桃果园筛选出具有苹果酸降解能力的3株酵母菌株,对苹果酸的降解率分别为28.36%、25.92%和25.68%。经鉴定,其中两株是酿酒酵母(Saccharomyces cerevisiae),一株是毕赤酵母(Pichia pastoris)。文连奎等[14]以柠檬酸和苹果酸作为唯一碳源,从葡萄园土壤中筛选得到1株可以降解苹果酸和柠檬酸的酵母菌,经鉴定为陆生伊萨酵母(Issatchenkia terricola)。唐莹等[15]研究发现,陆生伊萨酵母菌WJL-G4具有降解柠檬酸的功能,最大降酸率达到90%。STEYN A等[16]从苹果、葡萄和李子废料中筛选出一株具有较好的降解苹果酸能力的酵母菌,经鉴定为酿酒酵母。不同菌株对苹果酸的降解能力具有差异,REDZEPOVIC S等[17]对来自3个酿酒酵母菌株的苹果酸酶基因的转录调控进行了初步研究,阐明酵母的苹果酸酶可能在对不同生理条件做出反应方面发挥重要作用。
本研究以实验前期筛选出的7株低醇酵母(编号为YK1~YK7)为研究对象,通过测定pH值、总酸含量及苹果酸含量,探讨其对苹果酸的降解能力,并通过形态观察、生理生化试验和分子生物学技术对筛选菌株进行鉴定,对开发低醇低酸度猕猴桃果酒提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 材料与菌株
酵母 菌 株YK1、YK2、YK3、YK4、YK5、YK6 和YK7:均分离自猕猴桃自然发酵液中,保藏于本实验室;新鲜猕猴桃:贵州修文。
1.1.2 培养基
酵母浸出粉胨葡萄糖琼脂(yeast extract peptone dextrose agar,YPD)培养基:杭州百思生物技术有限公司。
YPD-苹果酸液体培养基[7]:YPD液体培养基中添加10 g/L苹果酸,pH值为3.33,121 ℃高压蒸汽灭菌20 min。
1.1.3 试剂
L-苹果酸(分析纯):天津市永大化学试剂有限公司;氢氧化钠(分析纯):成都金山化学试剂有限公司;磷酸氢二铵(分析纯)、甲醇(色谱纯):天津市科密欧化学试剂有限公司;亚硝酸钠(分析纯):重庆江川化工(集团)有限公司;硫酸铵、氯化钠、磷酸氢二钾、七水硫酸镁、尿素、硝酸铵(均为分析纯):天津市致远化学试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
1510型酶标仪:赛默飞世尔科技(中国)有限公司;LT1002C型电子天平:常熟市天量仪器有限责任公司;TG16-WS台式高速离心机:常州朗越仪器制造有限公司;KQ-500DE型数控超声波清洗器:昆山市超声仪器有限公司;LNB96G型基因扩增仪:上海皓庄仪器有限公司;7890B气相色谱(gas chromatography,GC)仪、G1311B液相色谱仪(high performance liquid chromatography,HPLC):安捷伦科技新加坡(国际)有限公司。
1.3 方法
1.3.1 不同酵母菌对苹果酸降解能力的比较分析
将7株酵母菌株接种至YPD-苹果酸液体培养基中,28 ℃、150 r/min条件下培养11 d后,8 000 r/min离心10 min后取上清,测定上清液中的pH值及总酸含量,并计算降酸率,以不接菌的YPD-苹果酸液体培养基为空白,比较不同酵母菌株对酸的降解能力。
1.3.2 猕猴桃果酒的发酵工艺流程及操作要点
猕猴桃→去皮、打浆→加入SO2及果胶酶→水浴→调糖度→灌装→发酵→离心→猕猴桃果酒成品
操作要点:
参考李加兴等[18]的方法并稍作修改,挑选成熟且新鲜的猕猴桃,将其去皮、打浆,并向其中加入质量浓度为90 mg/L的SO2及100 mg/L的果胶酶,分装于发酵罐中,用保鲜膜密封好,置于55 ℃水浴锅中2 h,用白糖将其糖度调至22°Bx,灌装后接种2%(V/V)的酵母菌株种子液(活菌数为1×108 CFU/mL),密封好于培养箱28 ℃恒温发酵11 d,离心(4 500 r/min,10 min)后即得到成品。
1.3.3 分析检测
pH值的测定:采用PHS-3CpH计测定pH值。
总酸含量的测定:采用酸碱指示剂滴定法[19],并计算总降酸率,其计算公式如下:
式中:A0为空白总酸含量,g/L;A1为样品总酸含量,g/L。
酒精度的测定:参考国标GB 5009.225—2023《酒中乙醇浓度的测定》[20] 采用气相色谱仪进行测定并稍作修改。吸取适量离心过后的酒样上清液,过0.22 μm水相滤膜装入进样瓶。GC条件为前进样口温度230 ℃,前检测器温度280 ℃,空气流速380 mL/min,氢气流速30 mL/min,尾气流速30 mL/min,柱温46 ℃,升温程序为以5 ℃/min升至50 ℃,保持5 min,再以20 ℃/min升至230 ℃,保持2 min。
苹果酸含量的测定:采用高效液相色谱法[21],并计算苹果酸的降酸率,其计算公式如下:
式中:A0为空白苹果酸含量,g/L,A1为样品苹果酸酸含量,g/L。
1.3.4 菌株的鉴定
形态学观察:将筛选菌株划线接种于YPD培养基,28 ℃条件下静置培养48 h,挑取单菌落进行纯化,观察菌落颜色、形态、边缘、表面等菌落特征,并通过显微镜观察细胞形态。
生理生化实验:参考文献[22-23]对菌株的碳源(葡萄糖、蔗糖、乳糖、半乳糖、麦芽糖)、氮源(蛋白胨、蛋白胨、硫酸铵、硝酸铵、尿素)利用能力进行分析。
分子生物学鉴定:提取筛选菌株的总脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用通用引物内部转录间隔区1(internal transcribed spacer 1,ITS1)及ITS4进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:Mix 12.5 μL,模板DNA 4 μL,ITS1 1 μL,ITS4 1 μL,双蒸水(ddH2O)6.5 μL。PCR扩增条件:95 ℃预变性5 min;94 ℃变性30 s、52 ℃退火30 s、72 ℃延伸1 min,共35个循环;72 ℃再延伸8 min。PCR扩增产物经2%的琼脂糖凝胶电泳检测、纯化,送至生工生物工程(上海)股份有限公司进行测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对,选取同源性较高的模式菌株的ITS基因序列,采用MEGA7软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.5 数据处理
所有数据分析均使用Origin2023和SPSS26进行,每个样品做3个平行,结果以“平均值±标准差”表示。
2 结果与分析
2.1 不同酵母菌株对苹果酸降解能力的比较分析
刘延岭等[13]研究发现,在苹果酸质量浓度为0~10 g/L范围内,酿酒酵母PJ34、ZJ22和毕赤酵母ZG13对酸的耐受性随着苹果酸质量浓度的增大而下降,但均能正常生长。因此,选择苹果酸质量浓度为10 g/L的YPD液体培养基进行菌株的筛选。7株酵母菌在YPD-苹果酸液体培养基中培养后,pH值和总酸含量及总降酸率见图1。
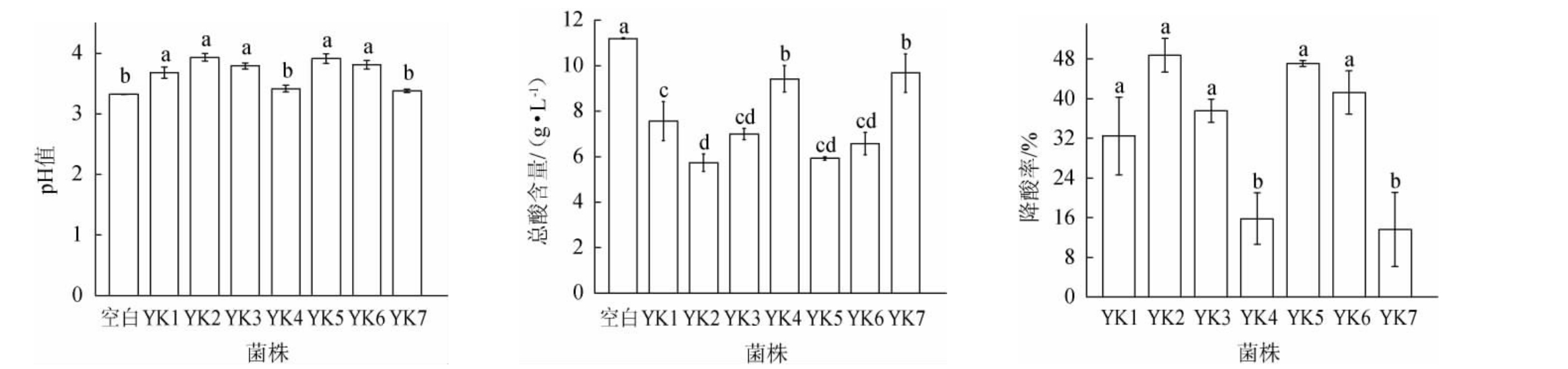
图1 不同酵母菌株苹果酸降解效果的比较
Fig.1 Comparison of malic acid reduction effect of different yeast strains
不同字母表示差异显著(P<0.05)。下同。
由图1可知,YPD-苹果酸液体培养基经不同酵母菌培养后,pH值上升,总酸含量降低。其中接种菌株YK2的YPD-苹果酸液体培养基pH值最高,为3.94,总酸含量最低,为5.74 g/L,其总降酸率为48.75%;其次是菌株YK5,pH为3.91,总酸含量为5.92 g/L,总降酸率为47.09%;菌株YK4和YK7的总降酸率较低,仅为15.79%、13.57%,低于文献[7]中菌株GS1-18的总酸降解率27.18%,因此,选择总降酸率较高的菌株YK1、YK2、YK3、YK5及YK6进行进一步研究。
2.2 不同酵母菌株发酵对猕猴桃果酒的影响
2.2.1 对酒精度的影响
酒精度是果酒的重要指标,不同酵母菌株发酵对猕猴桃果酒酒精度的影响见图2。
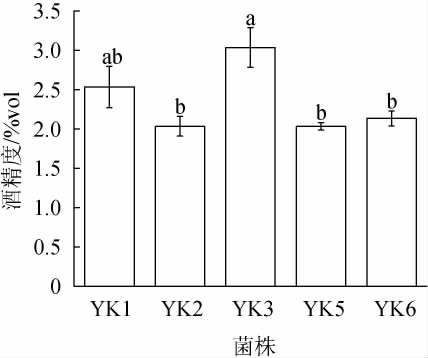
图2 不同酵母菌株发酵对猕猴桃果酒酒精度的影响
Fig.2 Effect of different yeast strains on the alcohol content of kiwifruit wine
由图2可知,5株酵母菌株发酵猕猴桃果酒的酒精度为2.0%vol~3.1%vol,酒精度均低于7%vol[24],说明这几株菌株均为低产醇酵母。其中菌株YK3发酵猕猴挑果酒的酒精度最高,为3.1%vol,菌株YK5发酵猕猴挑果酒的酒精度最低,为2.0%vol。
2.2.2 对pH值、总酸及苹果酸的影响
对猕猴桃果酒的pH值、总酸含量和苹果酸含量进行测定,并计算总降酸率和苹果酸降酸率,结果见表1。
表1 不同酵母菌株对猕猴桃果酒pH值、总酸及苹果酸含量的影响
Table 1 Effects of different yeast strains on pH, total acid and malic acid content of kiwifruit wine
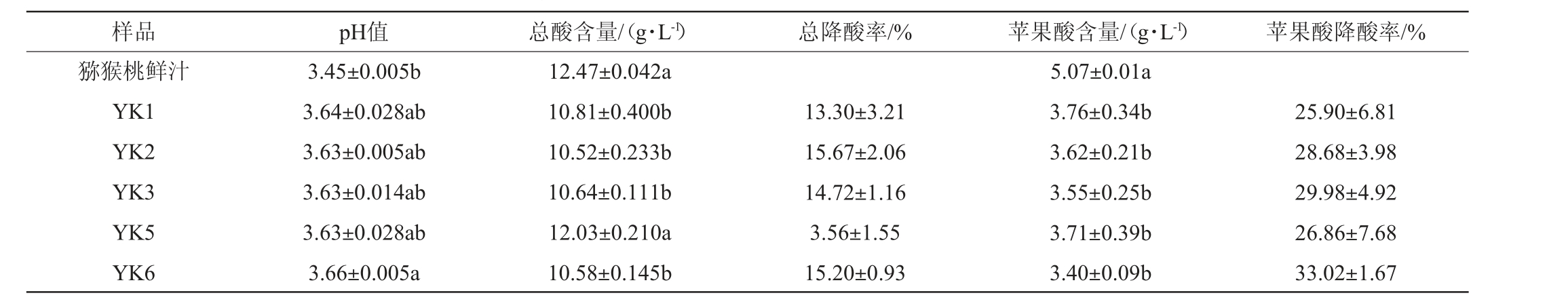
注:同列小写字母不同表示差异显著(P<0.05)。
样品 pH值 总酸含量/(g·L-1) 总降酸率/% 苹果酸含量/(g·L-1) 苹果酸降酸率/%猕猴桃鲜汁YK1 YK2 YK3 YK5 YK6 3.45±0.005b 3.64±0.028ab 3.63±0.005ab 3.63±0.014ab 3.63±0.028ab 3.66±0.005a 12.47±0.042a 10.81±0.400b 10.52±0.233b 10.64±0.111b 12.03±0.210a 10.58±0.145b 13.30±3.21 15.67±2.06 14.72±1.16 3.56±1.55 15.20±0.93 5.07±0.01a 3.76±0.34b 3.62±0.21b 3.55±0.25b 3.71±0.39b 3.40±0.09b 25.90±6.81 28.68±3.98 29.98±4.92 26.86±7.68 33.02±1.67
由表1可知,不同酵母菌株发酵的猕猴桃果酒的pH值均高于猕猴桃鲜汁,但仅菌株YK6发酵的猕猴桃果酒pH值升高显著(P<0.05),为3.66。pH值的升高预示着总酸含量下降,猕猴桃果汁经酵母发酵后,总酸含量下降,为10.52~12.03 g/L,且除菌株YK5外,均下降显著(P<0.05)。其中,菌株YK2发酵猕猴桃果酒的总酸含量下降幅度最大,总降酸率达到15.67%,其次为菌株YK6,总降酸率为15.20%。
由表1亦可知,猕猴桃果汁经酵母发酵后,苹果酸含量均显著下降(P<0.05),为3.40~3.76 g/L,说明5株酵母菌株对苹果酸均具有一定的苹果酸降解能力。其中,菌株YK6的苹果酸降酸率最高,为33.02%,其次为菌株YK3(29.98%)。由于菌株YK2和YK3发酵的猕猴桃果酒在总酸含量和苹果酸含量上差异不显著(P>0.05),菌株YK2总降酸率高于菌株YK3,但苹果酸降酸率低于菌株YK3,分析原因可能是两个菌株对猕猴桃中其他的酸降解有关。徐张宇等[25]研究发现,水蜜桃发酵过程中,酿酒酵母能将水蜜桃原料中的苹果酸降解10%左右。本研究的5株菌株苹果酸降酸率均高于10%。综上,菌株YK6对猕猴桃果酒的降酸效果最好。
2.3 菌株的鉴定
2.3.1 形态学观察5株酵母菌株的菌落及细胞形态见图3。
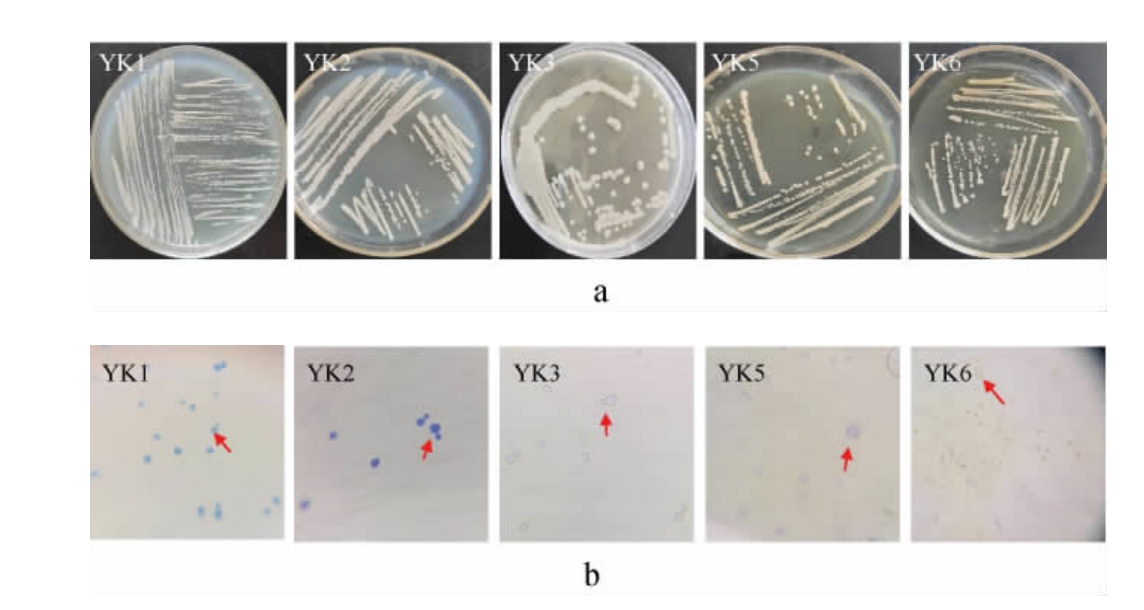
图3 5株酵母菌株的菌落(a)及细胞(b)形态
Fig.3 Colony (a) and cell (b) morphology of 5 yeast strains
由图3a可知,5株菌株的菌落均呈圆形,表面光滑,菌落突起,颜色呈淡黄色。由图3b可知,菌株YK1、YK2及YK3的细胞呈圆形或卵圆形,均以出芽方式进行无性生殖;菌株YK5的细胞呈圆形,未观察到其生殖方式,菌株YK6的细胞呈椭圆形,细胞较小,未观察到其生殖方式。
2.3.2 生理生化鉴定结果
5株酵母菌的生理生化实验结果见表2。由表2可知,5株酵母菌株均不能利用乳糖,除菌株YK6不能利用半乳糖,其他菌株均能利用葡萄糖、蔗糖、半乳糖和麦芽糖;5株酵母菌株均能利用蛋白胨、硫酸铵、硝酸铵和尿素。参考《酵母菌的特征与鉴定手册》[26],初步鉴定这5株菌是酵母菌。
表2 5株酵母菌株对不同碳源及氮源的利用情况
Table 2 Utilization of different carbon and nitrogen sources by 5 yeast strains
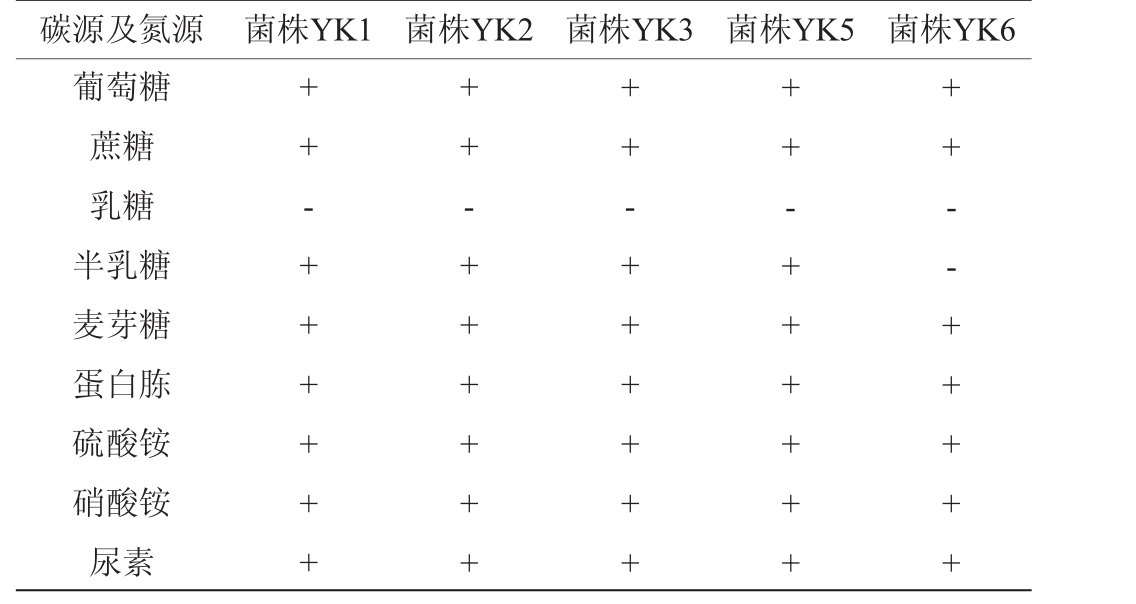
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
碳源及氮源 菌株YK1 菌株YK2 菌株YK3 菌株YK5 菌株YK6葡萄糖蔗糖乳糖半乳糖麦芽糖蛋白胨硫酸铵硝酸铵尿素++-++++++++-++++++++ - + + + + + +++-++++++++ - - + + + + +
2.3.3 分子生物学鉴定
基于ITS基因序列,5株酵母菌株的系统发育树见图4。由图4可知,酵母菌YK1、YK2、YK5与YK6与异常威克汉姆酵母(Wickerhamomyces anomalus)聚于一支,亲缘关系最近,酵母菌YK3与酿酒酵母(Saccharomyces cerevisiae)聚于一支,亲缘关系最近。结合形态观察及生理生化实验结果,将菌株YK1、YK2、YK5与YK6鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus),菌株YK3被鉴定为酿酒酵母(Saccharomyces cerevisiae)。也有研究表明,裂殖酵母(Schizosaccharomyces pombe)、美极梅奇酵母(Metschnikowia pulcherrima)、毕赤克鲁维酵母(Pichia kluyver)、异常威克汉姆酵母等具有降酸能力[26]。
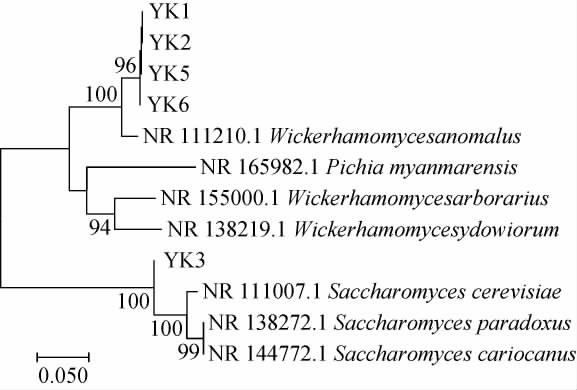
图4 基于ITS基因序列5株酵母菌株的系统发育树
Fig.4 Phylogenetic tree of 5 yeast strains based on ITS gene sequences
3 结论
通过体外苹果酸降解能力测定,从实验室前期保藏的7株酵母菌中筛选出5株具有较明显降解苹果酸的菌株,分别为菌株YK1、YK2、YK3、YK5、YK6,总降酸率为32.45%~48.76%。将这5株酵母菌株应用于猕猴桃果酒,发现苹果酸含量均下降,苹果酸降酸率为25.90%~33.02%。经形态观察、生理生化实验及分子生物学技术鉴定,菌株YK1、YK2、YK5与YK6为异常威克汉姆酵母(Wickerhamomyces anomalus),菌株YK3为酿酒酵母(Saccharomyces cerevisiae)。其中,降苹果酸效果最好的菌株为YK6,其发酵制备的猕猴桃果酒pH为3.66,总酸含量为10.58 g/L,苹果酸含量为3.40 g/L,酒精度为2.2%vol,说明该菌株可作为酿造低酸、低醇猕猴桃果酒的优良酵母。
[1]丁莹,李亚辉,蒲青,等.我国果酒行业发展现状及前景分析[J].酿酒科技,2019(4):104-107.
[2]SAEED K M,YOU L J,CHEN C,et al.Comparative assessment of phytochemical profiles and antioxidant and antiproliferative activities of kiwifruit(Actinidia deliciosa)cultivars[J].J Food Biochem,2019,43(11):e13025.
[3]王华,李维新.猕猴桃干酒的降酸研究[J].食品科学,2000,21(9):29-31.
[4]冯倩,张燕,赵轶男.发酵果酒降酸工艺优化[J].酿酒科技,2021(2):27-31.
[5]覃瑶,吴波,秦晗,等.我国果酒发展及研究现状[J].中国酿造,2020,39(9):1-6.
[6]孙晓璐,杨永学,张源.蜂蜜草莓酒的酿造工艺的优化[J].酿酒科技,2021(2):32-39.
[7]郝爱玲.降酸酵母菌株筛选及其在果酒发酵中的应用初探[D].杨凌:西北农林科技大学,2017.
[8]董霞.啤酒中有机酸类物质的研究[D].无锡:江南大学,2004.
[9]朱胜男.水蜜桃果酒的工艺研究[D].淮安:淮阴工学院,2020.
[10]刘洁莹.葡萄酒混菌苹果酸-乳酸发酵的研究[D].杨凌:西北农林科技大学,2018.
[11]沈凯娇,马永昆,魏本喜,等.2种葡萄酒酵母发酵黑莓酒的降酸效果研究[J].中国酿造,2010,29(3):92-95.
[12]郝雅兰.猕猴桃干酒降酸技术研究[D].杨凌:西北农林科技大学,2014.
[13]刘延岭,邓林,陶瑞霄.降解苹果酸酵母菌的筛选及鉴定[J].食品科技,2020,45(3):8-12.
[14]文连奎,王立芳,王贵珍.陆生伊萨酵母降解L-苹果酸和柠檬酸的研究[J].食品科学,2011,32(7):220-223.
[15]唐莹,王金玲,卢志全,等.陆生伊萨酵母WJL-G4降解柠檬酸的条件研究[J].中国食品学报,2021,21(8):46-56.
[16] STEYN A, VILJOEN-BLOOM M, ZYL W H V.Valorization of apple and grape wastes with malic acid-degrading yeasts[J].Folia Microbiol,2021,66(3):341-354.
[17]REDZEPOVIC S,ORLIC S,MAJDAK A,et al.Differential malic acid degradation by selected strains of Saccharomyces during alcoholic fermentation[J].Int J Food Microbiol,2003,83(1):49-61.
[18]李加兴,陈双平,梁先长,等.猕猴桃干型果酒发酵工艺优化[J].食品科学,2010,31(22):504-507.
[19]中华人民共和国国家卫生健康委员会,国家市场监督管理总局.GB 12456—2021 食品中总酸的测定[S].北京:中国标准出版社,2021.
[20]中华人民共和国国家卫生和计划生育委员会.GB 5009.225—2023酒中乙醇浓度的测定[S].北京:中国标准出版社,2023.
[21]中华人民共和国国家卫生和计划生育委员会.GB 5009.157—2016食品中有机酸的测定[S].北京:中国标准出版社,2016.
[22]程仕伟,韩鹏,赵慧,等.赤霞珠葡萄自然发酵过程中的酿酒酵母筛选及其发酵特性[J].酿酒科技,2015(3):16-19.
[23]崔艳,刘尚,邓琪缘,等.葡萄汁有孢汉逊酵母与酿酒酵母混酿低醇葡萄酒[J].食品工业,2020,41(8):60-64.
[24]张丽华,李珍珠,王维静等.不同杀菌方式对低醇枣酒品质的影响[J].中国酿造,2018,37(12):106-111.
[25]徐张宇,朱胜男,叶华,等.水蜜桃果酒中苹果酸的转化研究[J].农产品加工,2021(17):14-17,26.
[26]BARNETT J A(著),胡瑞卿(译).酵母菌的特征与鉴定手册[M].青岛:海洋大学出版社,1991:89-100.
[27]WHITENER M E B,CARLIN S,JACOBSON D,et al.Early fermentation volatile metabolite profile of non-Saccharomyces yeasts in red and white grape must: A targeted approach[J].LWT-Food Sci Technol,2015, 64(1):412-422.
[28]刘晓柱,黎华,李银凤,等.接种异常威克汉姆酵母对空心李果酒理化特性及香气组分的影响[J].食品科技,2020,45(11):21-27.