白酒以“多菌共酵”体系为基础,在世界各种蒸馏酒之中无出其右,白酒早已成为中国人民生活和文化的重要组成部分[1]。近期,专家提出应促进我国白酒国际标准的形成,让我国白酒得到合理分类及身份界定,鼓励中国白酒申请加入世界非物质文化遗产行列以此提升中国白酒文化在国际上的地位和认可度,我国白酒走向世界指日可待。
固态白酒酿造过程中各种微生物相互影响共同代谢发酵,在白酒的不同发酵阶段中都有不同的优势酿造微生物菌群和菌群结构组成,这些核心微生物不仅使发酵食品在其风味上具有标志性和丰富性,而且对稳定产品质量提供了重要保障[2]。清香型大曲白酒具有清雅纯正的香气特点,其酿造工艺的特点是清蒸清烧、地缸发酵、清蒸二次清[3],大曲作为酿造过程中的糖化生香剂,其质量的优劣直接影响着成品酒的产量和品质,大曲中的微生物种类和丰度对白酒酿造至关重要,在大曲酒发酵过程中起主要作用的是酵母菌、细菌和霉菌[4]。
功能菌研究多以改善白酒风味和质量为目标,由于传统制曲方法容易受环境因素影响而造成曲质量层次不齐且波动大。因此通过筛选并利用功能菌来增进曲的利用效果、丰富大曲的微生态环境,使得白酒特征香气成分得到改善。近年来随着对大曲中功能菌的不断深入研究,已经从大曲中分离筛选出上千种微生物菌种,许多厂家开始将有益功能菌投入传统白酒的生产中,以提高酒醅和大曲中功能菌的种类和数量,提升白酒的质量,并取得了阶段性的成果[5-6]。
酵母菌对产酒、生香等方面都有重要影响,与白酒的出品率和特征香气成分息息相关,在清香型大曲中,酵母菌的作用早已经跨越了纯粹的发酵[7]。因此,对大曲中功能性酵母菌的研究势在必行,从清香型白酒酒曲中筛选新的优良功能性酵母是使白酒出酒率和酒质持续提升的重要方法[8]。酵母菌主要分为酿酒酵母和非酿酒酵母两大类。其中起作用多的主要有酿酒酵母属(Saccharomyces)、毕赤酵母属(Pichia)、伊萨酵母属(Issatchenkia)、假丝酵母属(Candida)、汉逊酵母属(Hansenula)等[9]。
由于在实际生产中,酵母菌会受到高温环境、强酸环境、高乙醇环境、高糖环境等胁迫条件的影响,因此生产中对菌株在窖池环境中的适应性有一定的要求,高耐受性的酵母菌更有助于发酵生产,是进行工业应用的基础[8],目前国内外对于高耐受的酵母菌的研究着重于酒样、酱香型白酒大曲与浓香型白酒大曲,对清香型大曲研究较少。本研究以清香型大曲中酵母菌为研究对象,采用2,3,5-氯化三苯基四氮唑(2,3,5-triphenyte-trazoliumchloride,TTC)显色法初筛,通过发酵力、产酒及产香能力进行复筛,并对筛选菌株进行分子生物学鉴定,旨在获得高产菌株并开展对生存环境的耐受性,以获取耐受性优良的功能性酵母菌。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
清香型白酒大曲:湖北省某酒厂。
1.1.2 化学试剂
酵母浸粉、蛋白胨(均为生化试剂)、无水乙醇、葡萄糖、KH2PO4、NaOH、HCl、MgSO4、NaCl(均为分析纯)、2,3,5-氯化三苯基四氮唑(TTC)(分析纯):国药集团化学试剂有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
马丁培养基:KH2PO41 g/L、MgSO40.5 g/L、蛋白胨5 g/L、葡萄糖10 g/L、琼脂20 g/L、孟加拉红溶液3 mL/L、蒸馏水1 000 mL。121 ℃条件下灭菌15 min。
酵母膏胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:酵母浸粉10 g/L、葡萄糖20 g/L、蛋白胨20 g/L、蒸馏水1 000 mL。121 ℃条件下灭菌15 min。
2,3,5-氯化三苯基四氮唑(TTC)培养基:TTC 0.5 g/L、葡萄糖5 g/L、琼脂15 g/L、蒸馏水1 000 mL(pH调至中性)[10]。121 ℃条件下灭菌15 min。
半固态发酵培养基:取高粱粉700 g,加入420 mL开水,润粮20 h后取出,在121 ℃下蒸粮30 min、加入100 mL开水复水20 min、再次于121 ℃下蒸粮20 min,再加入120%的开水。待温度降至90 ℃时加入2%淀粉酶(2 000 U/g),88~90 ℃保温水解1 h。待温度降至55 ℃时加入2%糖化酶(50 000 U/g)保温糖化1 h,糖化结束后取1滴与碘液反应,碘液不显蓝色即为反应彻底。过滤得滤液,调糖度为12°Bx。115 ℃条件下灭菌20 min。
1.2 仪器与设备
LDZX-50KBS高压蒸汽灭菌锅:上海申安医疗器械厂;LRH-250生化培养箱:上海智城分析仪器有限公司;WFJ 2000紫外分光光度计:江苏海门市麒麟医用仪器厂;5977B-7890B气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)仪:美国安捷伦公司。
1.3 方法
1.3.1 大曲菌悬液的制备
称取10 g粉碎过筛后的大曲,加入90 mL的0.9%生理盐水中,于30 ℃、120 r/min摇床振荡20~30 min,用纱布过滤,并按10倍梯度逐级稀释至10-3、10-4、10-5、10-6。
1.3.2 酵母菌的分离及纯化
分别吸取稀释度为10-3、10-4、10-5、10-6的稀释液150 μL涂布于马丁培养基,于30 ℃培养箱培养48 h。挑取生长较好的、菌落形态不一的单菌落,接种于YPD培养基培养,多次划线分离,直至得到纯种单菌落。
1.3.3 酵母菌的初筛
将分离获得的酵母菌接种于YPD固体培养基,在30 ℃条件下培养24 h后在其上覆盖一层TTC显色剂[11],于30 ℃恒温培养3 h,取出,观察其颜色,初筛出显色较深、生长良好的菌株。
1.3.4 酵母菌的复筛
(1)酵母菌发酵力测定
将经两次划线活化的酵母菌接种于YPD液体培养基中,30 ℃条件下培养72 h获得种子液。按1%(V/V)接种量将种子液接种于半固态高粱发酵培养基(模拟窖池环境),装液量为100 mL/250 mL,28 ℃条件下振荡培养72 h,采用发酵栓法[12]测定发酵力。
(2)酵母菌产乙醇能力测定
将种子液按10%的接种量接种于半固态高粱发酵培养基,装液量为100 mL/250 mL,30 ℃条件下培养7 d,采用蒸馏法[13]测定酒精度,取100 g发酵产物和200 mL的水于1 000 mL蒸馏瓶中,缓慢蒸馏,收集100 mL馏出液,冷却至室温,用酒精计法测得酒精体积分数示值和温度,换算成20 ℃下的酒精体积分数。
(3)酵母菌产香能力的检测
将种子液按10%(V/V)的接种量接种于半固态高粱发酵培养基, 装液量为100 mL/250 mL,30 ℃条件下培养72 h。 利用顶空固相微萃取 (headspace solid-phase microextraction,HS-SPME)气质联用(GC-MS)法[14]对其发酵产物进行检测分析。
1.3.5 筛选酵母菌的鉴定
对具有优良产酒生香的酵母菌进行分子生物学鉴定,引物设计为通用引物:ITS1/ITS4, 引物序列分别为5'-TCC- GTAGGTGAACCTGCGG-3' 和5'-TCCTCCGCTTATTGA- TATGC-3',PCR扩增产物送至北京六合华大基因科技有限公司进行测序,将最终测序结果在美国国家生物技术信息中心(national center of biotechnology information,NCBI)中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,并对近似序列进行系统发育学分析[15]。
1.3.6 酵母菌的耐受特性分析[16-19]
将筛选菌株的种子液按5%(V/V)的接种量接种于YPD液体培养基中,30 ℃培养2 d, 用紫外分光光度计在波长600 nm处测定发酵液OD600 nm值, 考察菌株在温度(27℃、30 ℃、33 ℃、36 ℃、39 ℃、42 ℃)、pH值(2、3、4、5、6、7)、葡萄糖质量浓度(50 g/L、100 g/L、200 g/L、400 g/L、600 g/L)及乙醇体积分数(3%、6%、9%、12%、15%)条件下的生长情况。
1.3.7 数据处理
使用Excel 2019、SPSS Statistics 26.0对数据进行统计分析处理,柱状图与折线图由GrapHPad Prism 9.0绘制而成、挥发性化合物的热图及Venn图利用Chiplot和Hiplot软件绘制,酵母菌基于18S rRNA基因序列的系统发育树在Mega-X软件中制作。
2 结果与分析
2.1 清香型大曲中酵母菌的分离纯化
对培养48 h的稀释涂布的平板进行菌落形态观察,根据菌株在马丁培养基上的不同菌落特征,共分离获得22株酵母菌,从细胞形态上分为椭圆形、卵圆形和有假丝的卵圆形三大类,其繁殖方式均为出芽生殖,具体菌落形态和细胞形态见表1。
表1 大曲中筛选酵母菌的菌落和细胞形态
Table 1 Colony and cell morphology of screened yeasts from Daqu

序号 编号 菌落形态 细胞形态1 23 4 A-1 A-2 A-3 A-4白色、菌落小、圆形、干燥、哑光、中间有白点、边缘模糊白色、菌落小、圆形、平滑白色、菌落小、圆形、干燥、中间有白色褶皱白色、圆形、菌落小、中间有白点,向外虚化,最外有白圈椭圆形椭圆形椭圆形椭圆形5 6 7 B-6 B-7 B-8白色、菌落小、湿润白色、菌落小、扁平白色(后期泛红)、菌落小、圆形、干燥卵圆形椭圆形椭圆形
续表

序号 编号 菌落形态 细胞形态8 9 C-2 C-3中心红边缘白、菌落小、圆形、扁平、光滑白色(泛红)、菌落小、圆形、光滑椭圆形卵圆形10 11 12 13 14 15 C-4 C-5 C-6 D-1 D-2 D-3 16 D-4 17 D-5 18 D-10白色、菌落小、圆形、干燥、扁平无突起、边缘有绒丝中心白、边缘模糊、菌落小、圆形、干燥白色、菌落小、中心模糊、向外有白环、边缘再次模糊、圆形灰白色、菌落十分小、圆形、扁平白色、菌落小、圆形、干燥、光滑白色、菌落小、有凸起、干燥、有绒丝、难挑起白色、菌落小、圆形、有绒丝、从中心向外呈放射状、难挑起白色、菌落小、圆形、边缘模糊、干燥、上有绒丝、难挑起白色、菌落小、圆形、有绒丝、有凸起、难挑起19 20 21 22 D-11 YC-1 YC-3 YD-1白色、菌落小、有凸起、干燥、有绒丝、难挑起白色、菌落小、有光泽、圆形、湿润白色、菌落小、圆形、有光泽白色、湿润、菌落小、圆形椭圆形卵圆形椭圆形卵圆形椭圆形卵圆形、有假丝卵圆形、有假丝卵圆形、有假丝卵圆形、有假丝卵圆形、有假丝卵圆形卵圆形卵圆形
2.2 酵母菌TTC显色初筛
根据菌株产酒能力越强,TTC显色越明显的原理,22株分离菌株显色反应结果见表2。
表2 分离酵母菌的TTC初筛结果
Table 2 TTC preliminary screening results of 22 isolated yeast strains
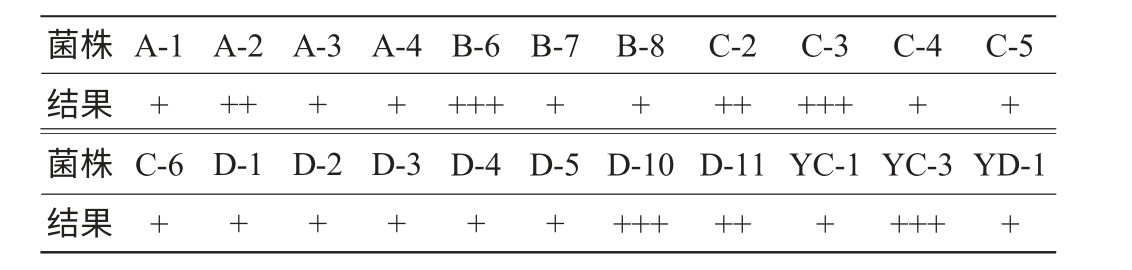
注:“+++”表示显色很明显,颜色为深红色;“++”表示显色较明显,颜色为红色;“+”表示显色程度一般,颜色为浅红色。
?
由表2可知,根据TTC初筛结果,从22株酵母菌中筛选得到7株菌株(A-2、B-6、C-2、C-3、D-10、D-11、YC-3)菌落呈红色或深红色。 因此,选择这7株菌株进行后续发酵力、产酒力、产香能力研究。
2.3 酵母菌的复筛
2.3.1 酵母菌的发酵力与产酒力
分离出的酵母菌的发酵力与产酒力测定结果见图1。
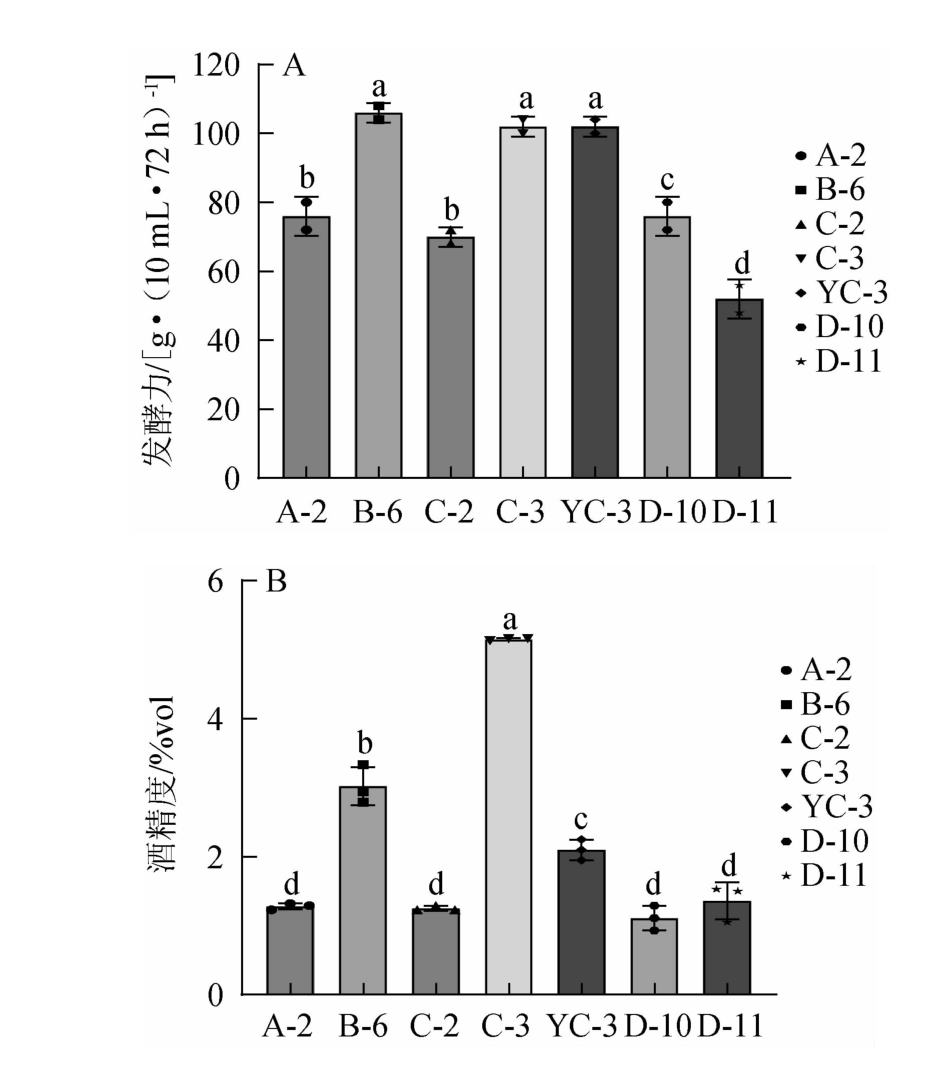
图1 7株酵母菌的发酵力(A)与产酒力(B)测定结果
Fig.1 Determination results of fermentation power (A) and alcohol production capacity (B) of 7 yeast strains
不同字母代表结果具有显著差异(P<0.05)。
由图1A可知,7株酵母菌的发酵力在52~106 g(CO2)/(10 mL·72 h)之间,其中菌株B-6的发酵力最高,达到了106 g(CO2)/(10 mL·72 h),菌株C-3和YC-3次之,菌株A-2、C-2、D-10、D-11的发酵力较低,菌株B-6、C-3与YC-3
由图1B可知,将TTC初筛选择出的7株酵母菌培养7 d,采用蒸馏法测其产酒力,其中菌株C-3的产酒能力显著高于其他酵母菌(P<0.05),单菌发酵产物的酒精度为5.15%vol,属于目前较高水平[20-21]。菌株B-6酒精度为3.02%vol,其余5株菌产酒能力均不高。
2.3.2 酵母菌的产香能力
白酒中含有1 500多种微量成分,如酯类、醇类、酸类、醛酮类、吡嗪类等,这些微量成分虽然含量低,但是其种类与比例对白酒最终的风味及口感的影响非常大。不同品种的酒曲,不同发酵条件,产生的香气成分的种类和含量都不同,以此造就各种酒的不同风味[22]。
通过HS-SPME-GC-MS法对7株酵母菌的半固态高粱发酵产物的香气成分进行检测,结果见图2。由图2可知,7株酵母菌发酵产物共检测出54种香气成分,包括24种酯类、10种醇类、9种酸类、6种醛酮类、5种其他类。
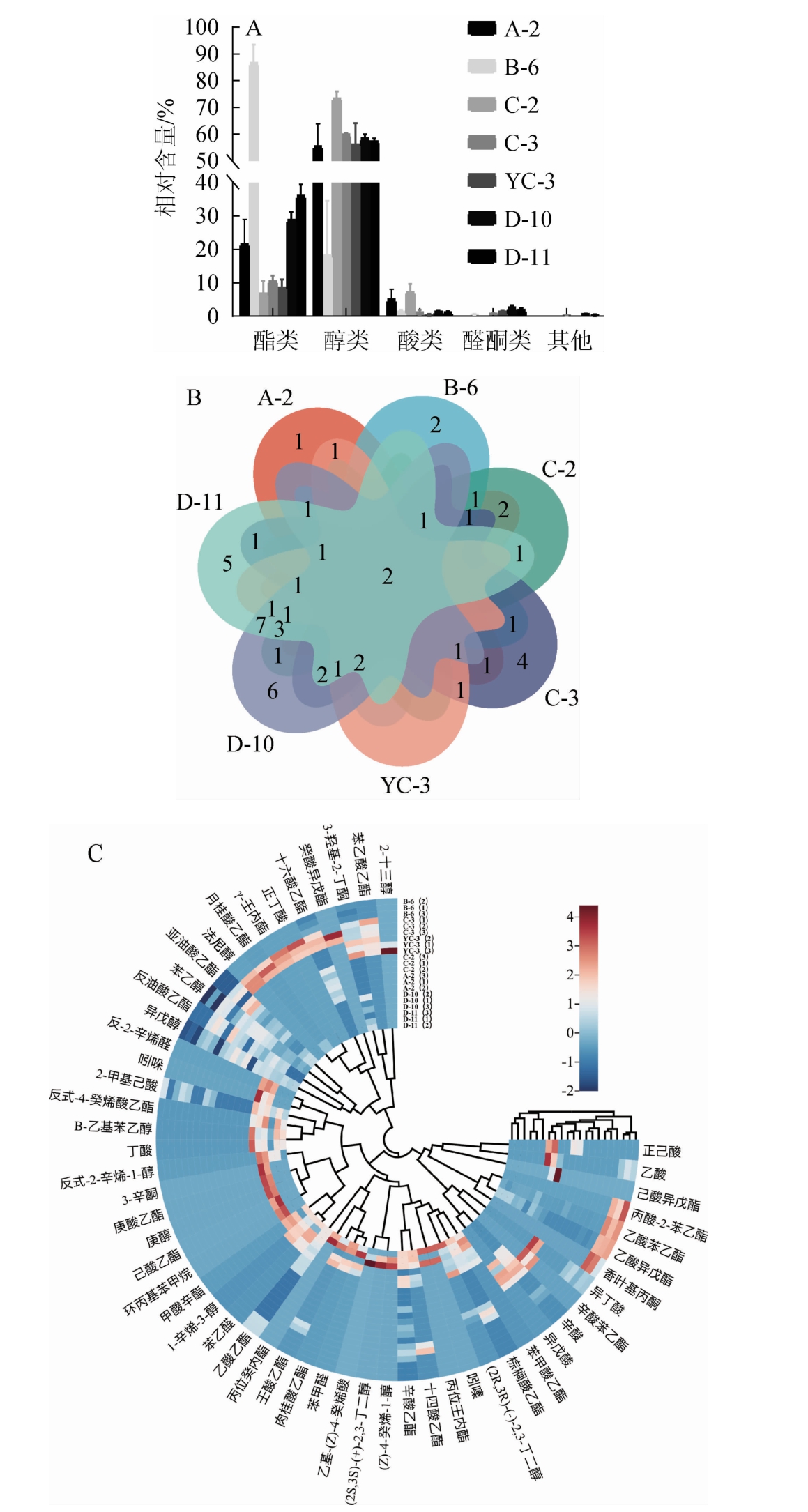
图2 7株酵母菌发酵产物香气成分分析
Fig.2 Analysis of aroma components in 7 yeast strains fermentation products
A:各类香气物质的相对含量;B:香气成分占比Venn图;C:香气成分圈形热图。
由图2A可知,菌株B-6产酯类物质相对含量占比最高,达到86.7%,酯是具有芳香性气味的挥发性化合物,是白酒中的主要香味成分,对形成各种酒的典型风格起着关键性作用[23],另外菌株D-10、D-11、C-3产香气种类较多,分别有32种、27种、20种。由图2B可知,7株酵母菌共有香气成分为苯乙醇和乙酸苯乙酯两种,其中苯乙醇为玫瑰花香、月季花香、花粉香味,能提高酒体的风味与品质,是十分重要的天然香味物质[24],菌株D-10、D-11拥有独特的香气成分种类较多。由图2C可知,菌株B-6的乙酸苯乙酯和乙酸异戊酯相对占比显著高于其他菌种,乙酸苯乙酯有甜味,带有玫瑰花香和粉香的蜂蜜样香气,类似苹果样的果香,并带有可可和威士忌样的香韵[25]。乙酸异戊酯具有香蕉和梨的气味,菌株B-6的发酵产物的确具有强烈的熟香蕉果味。菌株B-6、D10、D11产乙酸乙酯相对占比均在10%左右,这与清香型白酒以乙酸乙酯为主体香味相符合。菌株C-3主要产醇类物质,相对含量占比达60%,菌株C-3还产法尼醇,是清香型白酒的关键萜烯类化合物,主要由酿酒酵母产生[26]。
对初筛得到的7株酵母菌的发酵力、产酒力以及产香能力进行检测,其中菌株B-6与C-3的发酵力和产酒力水平在7株酵母菌中均较高,菌株C-3、D10与D11产香种类多,菌株B-6产酯种类多且有特殊香气。综上,选择菌株B-6、C-3、D10与D11进行分子生物学鉴定。
2.4 酵母菌分子生物学鉴定结果
对高发酵力和产酒能力强的菌株B-6与C-3、产香能力强的菌株D-10和D-11进行菌种鉴定,四株酵母菌的系统发育树见图3。

图3 筛选酵母菌基于18S rRNA基因序列系统发育树
Fig.3 Phylogenetic tree of screened yeasts based on 18S rRNA gene sequence
由图3可知,菌株B-6与费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)、菌株C-3与酿酒酵母(Saccharomyces cerevisiae)、菌株D-10与扣囊复膜孢酵母(Saccharomycopsis fibuligera)、菌株D-11与异常威克汉姆酵母(Wickerhamomyces anomalus)聚于一枝,亲缘关系最近,结合形态特征,菌株B-6被鉴定为费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)、菌株C-3被鉴定为酿酒酵母(Saccharomyces cerevisiae)、菌株D-10被鉴定为扣囊复膜孢酵母(Saccharomycopsis fibuligera)、菌株D-11被鉴定为异常威克汉姆酵母(Wickerhamomyces anomalus)。
2.5 功能酵母菌耐受性
在制曲和酿酒过程中,其温度是在波动的,选育优良的耐高温菌株是实现某些工艺的前提[27]。由图4A可知,4株酵母菌均在30 ℃或者33 ℃时生长状况更好,其中菌株B-6的高温耐受性最好,在33 ℃的生长状况比30 ℃更好;后续随着温度的升高,生长状况逐渐降低;在39 ℃高温时,生长状况明显高于其他3株酵母菌。耐高温能力最差的是菌株D-10,在39 ℃以上高温时,基本不生长。
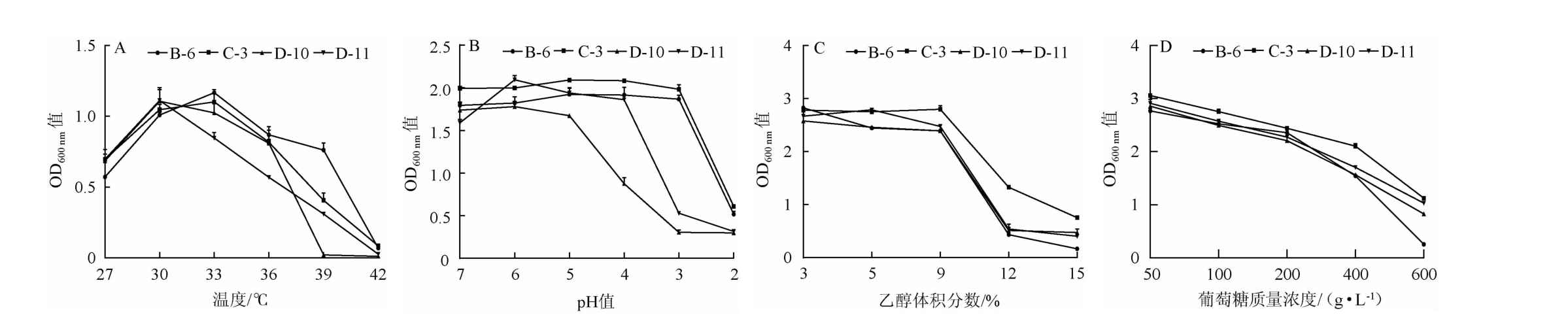
图4 4株功能酵母的耐受性试验结果
Fig.4 Tolerance tests results of 4 functional yeast strains
通常情况下,高酸环境不利于酵母菌的生长繁殖[28]。由图4B可知,菌株B-6和C-3在pH值为3时生长状况依然良好,在pH值为2时亦可以生长,而菌株D-10和D-11在pH值为6之后生长状况随着酸度升高急速下降,相对而言,菌株B-6和C-3的耐酸性更好。
在固态白酒的发酵过程中,随着酒精度的升高,酵母的生长繁殖会受到抑制,酵母会产生一系列的应激反应来保证正常的生长代谢,而酵母的应对机制也称作酵母的酒精耐受性,酵母菌是固态白酒酿造时产酒精最主要的菌种,所以具有一定的乙醇耐受性十分必要[29]。由图4C可知,4株酵母菌均耐体积分数为9%乙醇,其中菌株C-3的耐酒精能力最好,在乙醇体积分数为9%~15%之间的生长状况降低较少,OD600 nm值只降低了52.5%,而另外三株酵母菌OD600 nm值降低了80%左右,随着乙醇体积分数升高,菌株C-3与其余几株酵母比较,生长状况较好。
糖是发酵生产乙醇的主要基质和酵母赖以生存的能源物质,但是高浓糖环境对酵母生长繁殖有抑制作用,高渗透压会导致酵母细胞水分流失[30]。由图4D可知,4株酵母在葡萄糖质量浓度为50~600 g/L时,随着环境中糖度的升高,生长状况变差,其中菌株C-3在高糖环境下的生长状况略好于其他三株酵母菌,菌株B-6的耐高糖能力相对较弱,葡萄糖质量浓度在600 g/L时,生长状况差,葡萄糖质量浓度在400~600 g/L时,其OD600nm值降低了83.9%。
综上,功能性酵母菌B-6对高温(39 ℃)和强酸环境(pH值为3)具有高耐受性、在12%vol高乙醇环境下可以生存,具有较好的耐乙醇能力;菌株C-3在高温39 ℃、酒精度12%vol、pH值为3、葡萄糖质量浓度400 g/L的环境下均可以生存。因此,菌株B-6和C-3耐受性比其他两株菌更强。
3 结论
本研究从清香型大曲中筛选得到4株菌,通过形态学观察及分子生物学鉴定,菌株B-6为费比恩塞伯林德纳氏酵母(Cyberlindnera fabianii)、菌株C-3为酿酒酵母(Saccharomyces cerevisiae)、菌株D-10为扣囊复膜孢酵母(Saccharomycopsis fibuligera)、菌株D-11为异常威克汉姆酵母(Wickerhamomyces anomalus)。通过耐受性实验,获得了耐受性良好菌株B-6和C-3。高耐受性的酵母菌可以在不同发酵环境下作用,不但可以有效解决酿酒糖化过程前的酸碱调节等问题,减少酿酒过程中不必要的环节,降低酿酒生产成本,还可以有效提高工业生产的产酒率、增强其香气和品质;而菌株D-10、D-11作为生香酵母,虽然耐受性一般,但产独特香气成分种类较多,后续可从此方向对其进行研究。
[1]HE G Q,DONG Y,HUANG J,et al.Alteration of microbial community for improving flavor character of Daqu by inoculation with Bacillus velezensis and Bacillus subtilis[J].LWT-Food Sci Technol,2019,111(1):1-8.
[2]胡申才,杜艾明,李良,等.清香型白酒酿造菌群结构组成及来源分析[J].酿酒科技,2021(4):55-60.
[3] WEI Y, ZOU W, SHEN C H, et al.Basic flavor types and component characteristics of Chinese traditional liquors: A review[J].J Food Sci,2020,85(12):4096-4107.
[4] CHEN Y R, LI K M, LIU T, et al.Analysis of difference in microbial community and physicochemical indices between surface and central parts of Chinese special-flavor Baijiu Daqu[J].Front Microbiol,2021,11(1):592421.
[5]王耀,张龙云,张春林,等.有益功能微生物在强化大曲生产中的应用[J].酿酒科技,2014(12):53-59,62.
[6]管健,廖蓓,常煦,等.功能菌在大曲清香型白酒生产中的应用[J].酿酒科技,2018(10):103-107.
[7] SUAREZ-LEPE J A, MORATA A.New trends in yeast selection for winemaking[J].Trends Food Sci Tech,2012,23(1):39-50.
[8]李群,林斌,唐洁,等.清香型小曲白酒酿造中酵母资源解析及其耐受性能研究[J].食品与发酵工业,2022,48(9):41-47.
[9]杜艾明,董孝元,李俊薇,等.清香型白酒酿造体系中酵母菌的分离鉴定及生产特性分析[J].食品科技,2021,46(7):29-36.
[10]胡晓冰,王振伟.TTC法在筛选西瓜果酒酵母中的应用[J].酿酒科技,2011(2):69-70,73.
[11]董博宇,陈叶福,岳瑞雪,等.TTC在发酵木糖高产乙醇的休哈塔假丝酵母选育中的应用[J].酿酒科技,2008(10):40-43.
[12]周娜,简何,唐贤华,等.中高温浓香型大曲发酵力测定条件的优化研究[J].酿酒,2015,42(4):73-75.
[13]陈忠军,杨小冲,赵洁,等.具高乙醇耐受力酵母菌的选育及其在猕猴桃果酒中的应用[J].食品工业科技,2018,39(2):141-145,151.
[14]许柏球,张丽君,罗欢忠,等.顶空固相微萃取-气相色谱-质谱法分析五粮液的香气成分[J].中国酿造,2013,32(6):141-144.
[15]谭川川,何劲,魏雨萌,等.一株耐单宁酵母菌的筛选、鉴定及发酵特性[J].食品与发酵工业,2023,49(15):47-53.
[16]薛梅,张晓双,段开红,等.甜高粱酿酒酵母耐受性分析[J].安徽农业科学,2015,43(35):145-147.
[17]杨宁,唐英,黄杰惠,等.酱香型白酒酒醅中高产酒精酵母的筛选及耐受性研究[J].中国酿造,2023,42(5):50-55.
[18]邬雪莲,黄萧天,文成兵,等.大曲中七株酵母菌耐受性及其枳椇发酵性能研究[J].食品与发酵科技,2019,55(6):13-18,38.
[19]张晓晓,任剑星,刘凯毅,等.TOR1基因缺失对酿酒酵母耐受性的影响[J].食品与发酵工业,2021,47(2):1-7.
[20]李燕荣,杨勇,张龙云,等.中高温大曲发酵过程酿酒酵母的筛选与鉴定[J].酿酒,2020,47(5):44-47.
[21]董琪,蒲顺昌,刘飞翔,等.浓香型大曲中功能性酵母菌的筛选、鉴定及发酵特性研究[J].中国酿造,2020,39(6):106-110.
[22]管健.大曲清香型白酒功能菌的筛选与应用[D].武汉:湖北工业大学,2018.
[23]张健,高海燕,赵镭,等.白酒理化指标及其与香气品质的关系[J].食品科学,2010,31(10):283-286.
[24]FU G M,DENG M F,CHEN Y,et al.Analysis of microbial community,physiochemical indices, and volatile compounds of Chinese Te-flavor Baijiu daqu produced in different seasons[J].J Sci Food Agr,2021,101(15):6525-6532.
[25]高熳熳,胡江南,马立娟,等.毕赤克鲁维酵母与酿酒酵母混合发酵对‘赤霞珠’葡萄酒品质的影响[J].中国酿造,2022,41(12):46-51.
[26]周晨曦,郑福平,李贺贺,等.白酒大曲风味物质研究进展[J].中国酿造,2019,38(5):6-12.
[27]彭俊,杨团元,刘蒲临,等.白酒酿造酒醅与周边土壤中酵母菌多样性及东方伊萨酵母发酵特性比较[J].中国酿造,2019,38(8):77-84.
[28]周阳子,边名鸿,刘文艺,等.高温大曲中一株产香细菌的筛选及香气成分分析[J].四川理工学院学报(自然科学版),2019,32(6):15-21.
[29]SNOEK T,VERSTREPEN K J,VOORDECKERS K.How do yeast cells become tolerant to high ethanol concentrations?[J].Curr Genet,2016,62(3):475-480.
[30]LIU G L,TAO C L,ZHU B S,et al.Identification of Zygosaccharomyces mellis strains in stored honey and their stress tolerance[J].Food Sci Biotech,2016,25(6):1645-1650.