贵州酸汤是贵州省特色的一种传统自然发酵调味品,根据原料不同主要分为红酸汤和白酸汤[1]。红酸汤(red sour soup,RSS)是以西红柿、红辣椒、食用盐及白酒为主要原料经发酵而成,具有独特的酸辣风味[2]。白酸汤(white sour soup,WSS)又称为米酸汤,是以大米、水和食用盐为主要原料经发酵而成[3]。贵州凯里生产的酸汤被授权为中国地理标志保护产品,被认为是一种具有促进消化、调节肠道菌群、清除自由基和增强免疫功能的功能性食品[4-6],故颇受消费者喜爱。分析红酸汤、白酸汤代谢物差异,有助于解析酸汤独特风味的形成机理,实现产品质量控制,需要分析凯里红酸汤和白酸汤的代谢物信息。代谢组学技术已广泛应用于发酵食品风味物质的检测分析研究,如酸汤风味物质、发酵红茶滋味物质和黄酒中的代谢物等[7-9]。目前,常见用于酸汤中代谢物的检测技术主要包括高效液相色谱-质谱(high performance liquid chromatography-mass spectrometer,HPLC-MS)联用技术[10]、气相色谱-质谱(gas chromatography-mass spectrometer,GC-MS)联用技术[11-12]和近红外光谱技术[13]等。现有研究报道多分析单一酸汤中代谢物,且多聚焦于靶向检测有机酸、氨基酸等物质[14-15],缺乏研究红、白酸汤中差异代谢物的研究。借助色谱和质谱等仪器对样本中相对分子质量<1 000的小分子代谢物进行定性定量分析,并准确分析出样本间的差异代谢物,有助于挖掘解析酸汤样本中代谢物的重要信息[16-17]。
本研究以贵州凯里红、白酸汤为研究对象,通过超高效液相色谱-质谱(ultra high performance liquid chromatography-mass spectrometer,UHPLC-MS)非靶向代谢组学方法分析红酸汤、白酸汤中代谢物组成,并利用主成分分析(principal component analysis,PCA)和正交偏最小二乘-判别分析(orthogonalpartial least squares-discriminant analysis,OPLS-DA)筛选差异显著代谢物,探究红酸汤、白酸汤代谢物的差异,旨在为酸汤营养成分、风味化合物研究奠定理论基础,助力贵州酸汤产业发展。
1 材料与方法
1.1 材料与试剂
红酸汤(RSS)、白酸汤(WSS):贵州省凯里市某知名酸汤企业。
甲醇、乙腈(均为色谱纯):美国Merck公司;L-2-氯苯丙氨酸(色谱纯):上海阿拉丁生化科技股份有限公司;甲酸(色谱纯):印度HCL公司。
1.2 仪器与设备
UPLCAcquity I-Class PLUS超高效液相色谱仪、Waters UPLC Xevo G2-XS QTOF高分辨质谱(配有电喷雾离子(electric spray ion,ESI)源):美国Waters公司。
1.3 方法
1.3.1 样品处理
取100 μL酸汤样本,加入500 μL含内标的提取液(甲醇∶乙腈=1∶1(V/V),内标质量浓度20 mg/L),涡旋30 s,置于冰水浴中超声10 min。在-20 ℃条件下静置1 h后,样本在4 ℃条件下12 000 r/min离心15 min,取500 μL上清液真空浓缩干燥。干燥后的代谢物加入160 μL乙腈水提取液(乙腈∶水=1∶1(V/V))复溶,涡旋30 s后置于冰水浴中超声10 min。将样本在4 ℃条件下12 000 r/min离心15 min;取120 μL上清检测,另每个样本各取10 μL混合成质量控制样本(QC)检测。
1.3.2 代谢物的检测分析
红酸汤、白酸汤样品代谢物采用UHPLC-MS进行分析。
超高液相色谱条件:采用Waters Acquity UPLC HSS T3色谱柱(2.1 mm×100 mm,1.8 μm),流动相A为0.1%甲酸-水溶液,流动相B为含0.1%甲酸-乙腈溶液,进样体积为1 μL,流速400 μL/min。梯度洗脱程序为0~0.25 min,2%流动相B;10~13 min,98%流动相B;13.1 min,2%流动相B。
质谱条件:ESI源参数为正离子模式毛细管电压2 500 V,负离子模式毛细管电压-2 000 V,锥孔电压30 V;离子源温度100 ℃,脱溶剂气温度500 ℃;反吹气流速50 L/h,脱溶剂气流速800 L/h;质核比采集范围为50~1 200 m/z。
1.3.3 数据处理
使用Progenesis QI软件进行峰提取、峰对齐,采用京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)数据库(https://www.genome.jp/kegg/path way.html)对代谢物进行注释。对数据进行主成分分析和正交偏最小二乘-判别分析。根据t检验计算统计学意义的P值和样本分组的变量投影重要性(value importance in projection,VIP)值,并结合单变量差异倍数(Fold-Change,FC)筛选样本组间显著差异代谢物。
2 结果与分析
2.1 贵州红酸汤、白酸汤样本的主成分分析
在贵州红、白酸汤样本中共注释到2 929个代谢物,为反映贵州红、白酸汤样本间的总体代谢差异和组内样本之间的变异度大小,分别在正、负离子模式下对代谢物进行主成分分析。PCA得分图中的散点表示一个QC样本点,样本点间距越小表示其代谢物组成和含量相似度越高,间距越大表示其代谢物组成和含量差异越大[18]。酸汤正离子模式(A)和负离子模式(B)下主成分分析(PCA)得分图见图1。
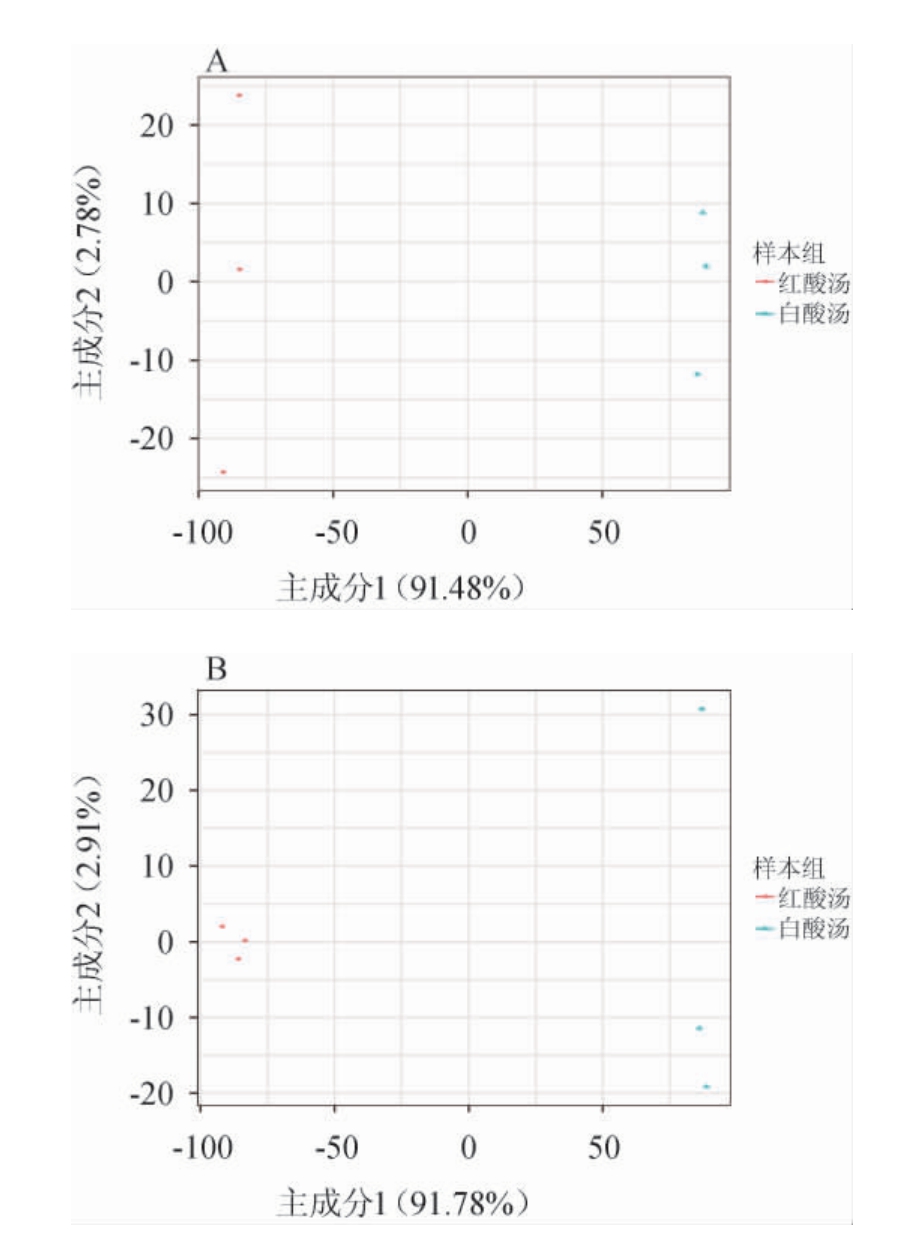
图1 酸汤样品正离子模式(A)和负离子模式(B)下主成分分析得分图
Fig.1 Principal component analysis score plots of sour soup samples in positive ion mode(A)and negative ion mode(B)
由图1可知,在正、负离子模式下红酸汤、白酸汤样本的第一主成分和第二主成分的累计方差贡献率分别为94.26%和94.69%,包含了试验样本中绝大部分物质信息。红酸汤(RSS)和白酸汤(WSS)样本点在第一主成分间距离较远,说明红、白酸汤样本中代谢物组成差异较大。
2.2 贵州红酸汤、白酸汤代谢物的正交偏最小二乘-判别分析
为解析样本中与分类变量相关的差异变量和互相之间可能存在关联的无差异变量,借助OPLS-DA模型剔除与分类变量不相关的变量,进而实现样本组间差异信息的可视化。OPLS-DA适用于比较样本组间差异,找出造成组间差异的代谢物。OPLS-DA模型得分图中横坐标代表组间差异分量,样本点横向距离与组间差异呈正相关,距离越小代表样本组间代谢物组成差异越小。纵坐标代表组内差异分量,样本点间纵向距离远近代表组内差异,距离越小代表样本组内代谢物组成差异越小。括号中的百分比代表该分量在总方差中的占比[19]。R2Y和Q2Y指标是评价模型预测有效性的参数,判别模型能否通过代谢表达量区分正确的样本分组。R2Y和Q2Y的值越接近于1,表示该模型越稳定可靠[20]。酸汤样品在正离子模式(A)和负离子模式(B)下的OPLS-DA模型得分图见图2。
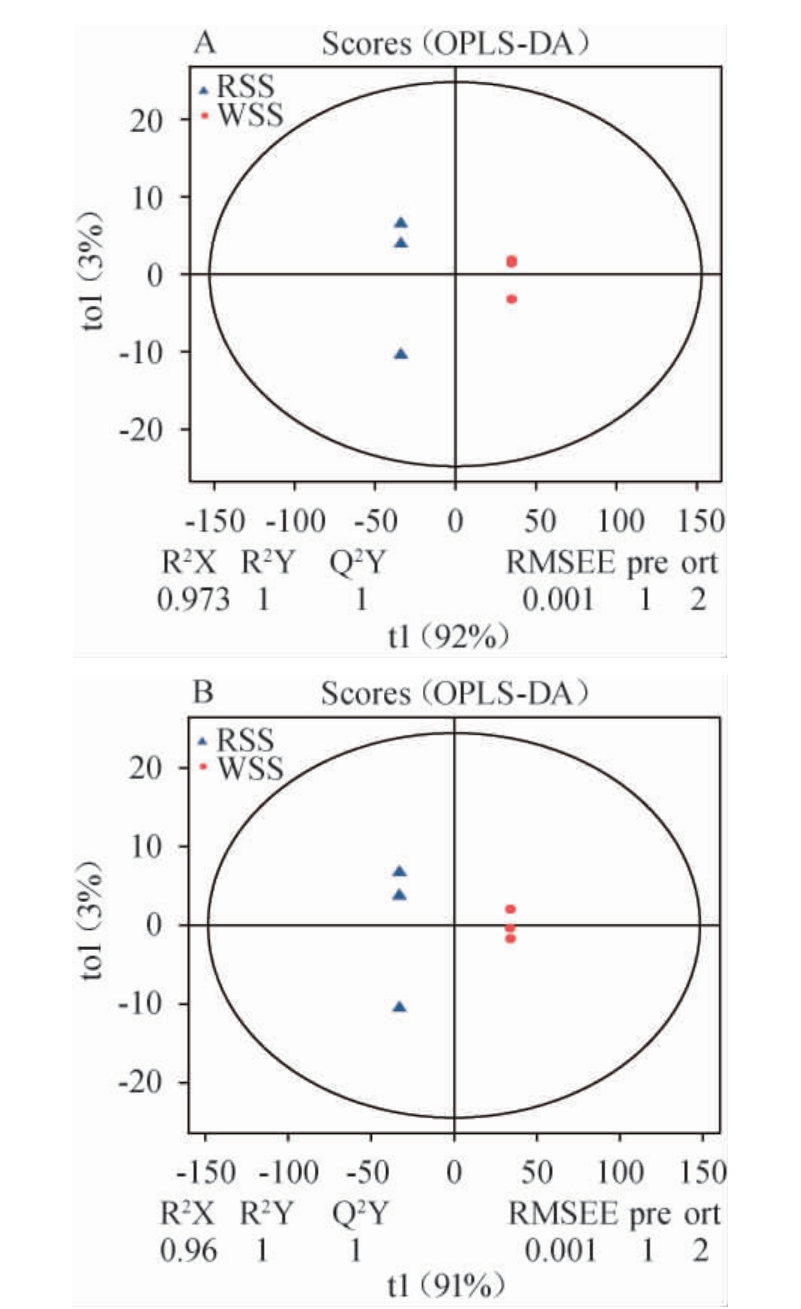
图2 酸汤样品在正离子模式(A)和负离子模式(B)下的正交偏最小二乘-判别分析模型得分图
Fig.2 Orthogonal partial least squares-discriminant analysis model score plots of sour soup samples in positive ion model (A)and in negative ion model (B)
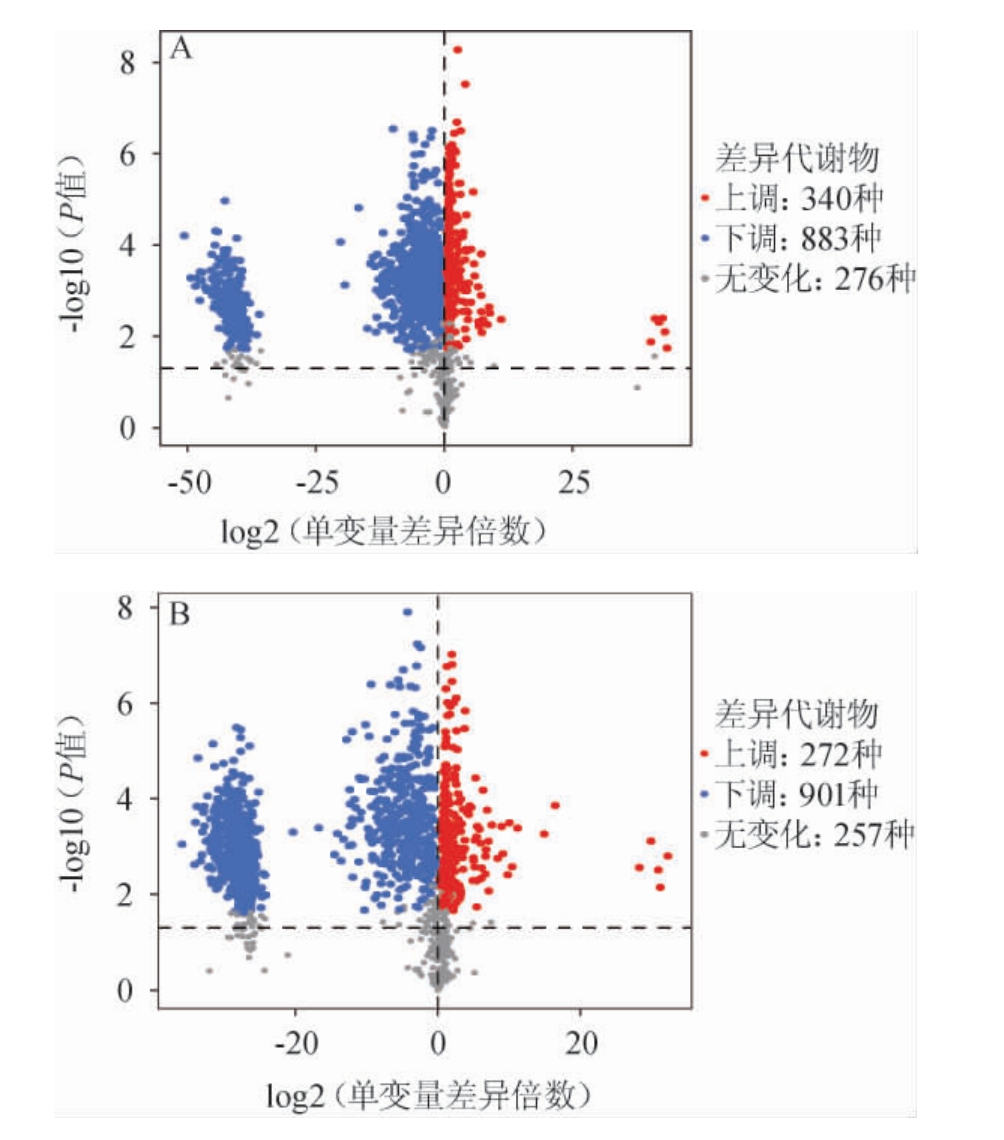
图3 酸汤样品在正离子模式(A)和负离子模式(B)下差异代谢物火山图
Fig.3 Volcano plots of sour soup samples in positive ion model (A)and negative ion model (B)
由图2可知,R2Y和Q2Y值均为1,代表所建立的OPLSDA模型可靠,该模型可用于筛选酸汤样本中的差异代谢物。酸汤样本间横向距离较大且均处于95%置信区间,表明红、白酸汤样本组间的代谢物具有显著差异(P<0.05)。
2.3 贵州红酸汤、白酸汤代谢物的火山图分析
火山图直观展示了代谢物在红、白酸汤样本组中含量差异的总体趋势以及代谢物差异的统计学显著性。火山图中每个点代表一个代谢物,散点大小代表OPLS-DA模型的VIP值,散点越大,VIP值越大,筛选得到的差异表达代谢物越可靠。采用VIP>1和P值<0.05为筛选条件。正离子模式下,红酸汤和白酸汤样本差异显著代谢物数为1 223种,上调的差异显著代谢物数为340种,下调的差异显著代谢物数为883种;负离子模式下,红酸汤和白酸汤样本差异显著代谢物数为1 173种,上调的差异显著代谢物数有272种,下调的差异显著代谢物数有901种。
2.4 贵州红酸汤、白酸汤差异显著代谢物筛选、分类
基于OPLS-DA结果,从获得的多变量分析OPLS-DA模型的VIP值初步筛选出贵州红、白酸汤差异代谢物。筛选出代谢物中VIP>1且P值<0.05的作为差异显著代谢物。差异显著代谢物与人类代谢组数据库(Human Metabolome Database,HMDB)进行匹配的结果,从Super Class分类上看,脂类和类脂类化合物占14.96%,有机酸及其衍生物占8.5%,有机杂环化合物占6.87%,苯环类化合物占4.17%,有机氧化合物占3.52%,苯基丙酸类和聚酮类化合物占2.7%,核苷、核苷酸和类似物占1.72%,机氮化合物占1.23%,生物碱和衍生物占0.65%。差异显著代谢物中脂类和类脂类化合物种类最多,共计183种,其中上调脂类和类脂类化合物43种,下调脂类和类脂类化合物140种。
表1 红、白酸汤差异显著代谢物的占比及种类
Table 1 Proportion and types of metabolites with significant difference of red and white sour soup
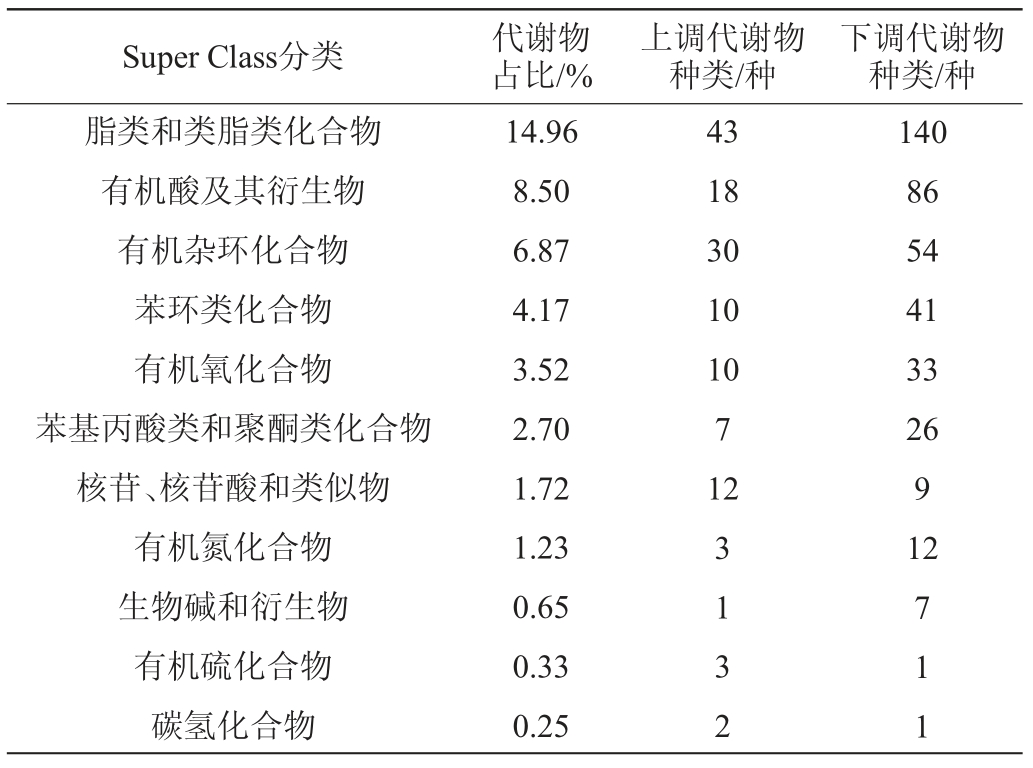
Super Class分类 代谢物占比/%上调代谢物种类/种下调代谢物种类/种脂类和类脂类化合物有机酸及其衍生物有机杂环化合物苯环类化合物有机氧化合物苯基丙酸类和聚酮类化合物核苷、核苷酸和类似物有机氮化合物生物碱和衍生物有机硫化合物碳氢化合物14.96 8.50 6.87 4.17 3.52 2.70 1.72 1.23 0.65 0.33 0.25 43 18 30 10 10 7 12 3 1 3 2 140 86 54 41 33 26 9 12 7 1 1
2.5 贵州红酸汤、白酸汤差异显著代谢物代谢通路分析
KEGG数据库有助于将代谢物含量信息作为一个整体网络进行研究。KEGG COMPOUND数据库是KEGG数据库收录的与生物系统相关的小分子、生物聚合物和其他化学物质的集合,并提供这些物质在KEGG pathway数据库中的注释。为得到差异显著代谢物所参与的通路[21],在KEGG数据库中匹配红酸汤、白酸汤样本中的差异显著代谢物,结果见图4。
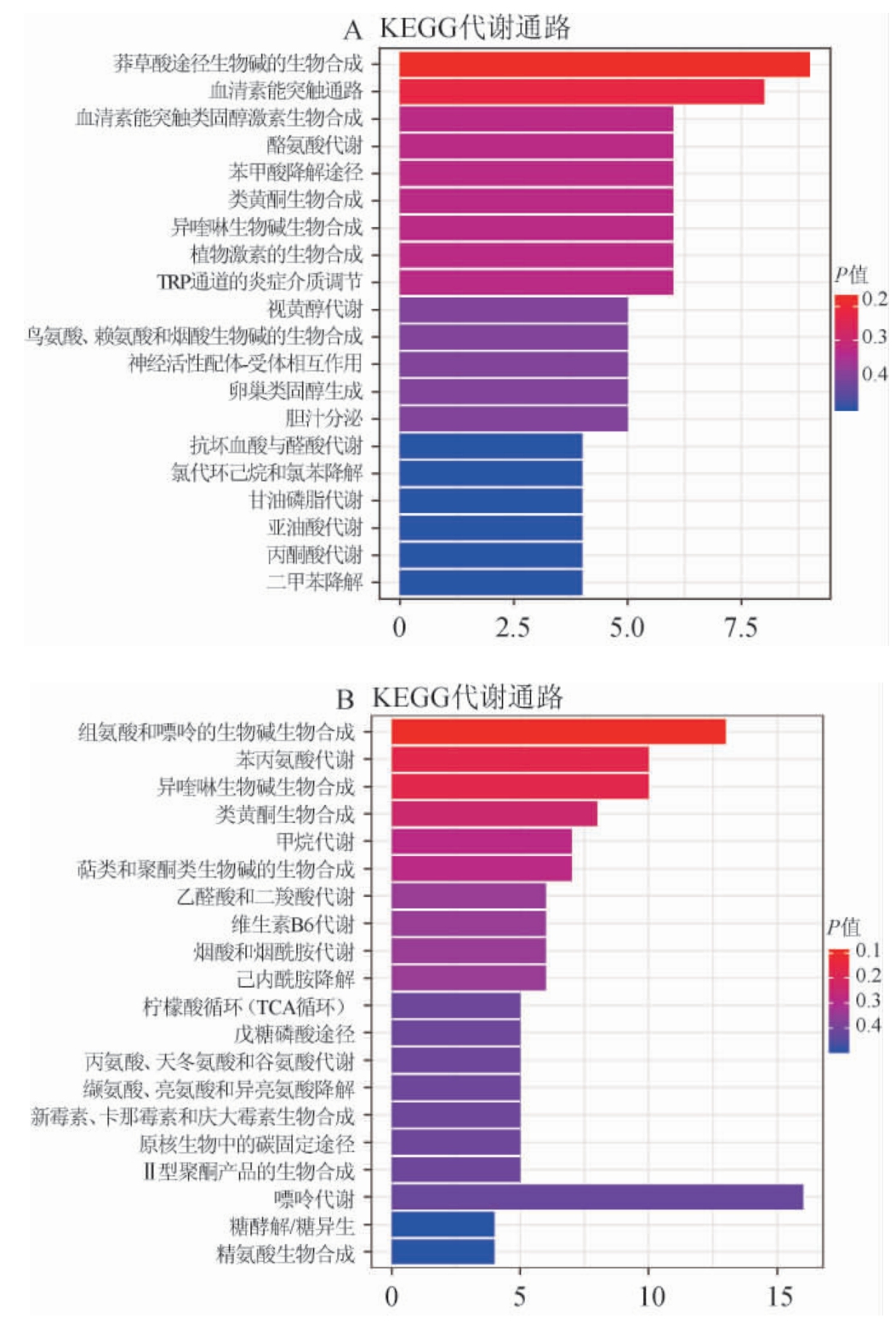
图4 红、白酸汤差异显著代谢物在正离子模式(A)和负离子模式(B)下富集代谢通路
Fig.4 Enriched metabolic pathway of metabolites with significant difference of red and white sour soup under the positive ion model (A) and negative ion model (B)
正离子模式下,红酸汤与白酸汤样品中显著差异代谢物富集到的主要的代谢通路为莽草酸途径生物碱的生物合成(biosynthesisofalkaloidsderivedfromshikimate pathway)、血清素能突触通路(serotonergic synapse)、血清素能突触类固醇激素生物合成(steroid hormone biosynthesis)、酪氨酸代谢(tyrosine metabolism)、苯甲酸降解途径(benzoate degradation)等。负离子模式下,显著差异代谢物富集的主要代谢通路为组氨酸和嘌呤的生物碱生物合成(biosynthesis of alkaloids derived from histidine and purine)、苯丙氨酸代谢(phenylalanine metabolism)、异喹啉生物碱生物合成(isoquinoline alkaloid biosynthesis)和类黄酮生物合成(flavonoid biosynthesis)等。
正离子模式下,莽草酸途径生物碱的生物合成途径中主要的差异代谢物为无盐掌胺、山油柑碱,血清素能突触通路中主要差异代谢物为5(S)-羟基二十碳四烯酸、11,12-二去氢视黄醇,血清素能突触类固醇激素生物合成途径中主要的差异代谢物为2-甲氧基雌酮-3-硫酸盐、22(R)-羟基胆固醇,酪氨酸代谢途径中的主要差异代谢物为N-甲基酪胺、3,4-二羟基扁桃酸盐和L-多巴胺,苯甲酸降解途径主要差异代谢物为2-氨基苯磺酸盐、环己基-1-羧酸酯。负离子模式下,组氨酸和嘌呤的生物碱生物合成途径中主要的差异代谢物为异戊酸,苯丙氨酸代谢途径中主要的差异代谢物为N-乙酰-L-苯丙氨酸、间香豆素酸,异喹啉生物碱生物合成途径中主要的差异代谢物为(S)-全去甲劳单丹碱、二氢血根碱和金黄紫堇碱,类黄酮生物合成途径中主要差异代谢物为毛地黄黄酮、绿原酸和儿茶素。
在KEGG数据库中匹配红、白酸汤中的差异显著代谢物主要为生物碱、酚类和黄酮类。生物碱类:山油柑碱是吡喃并吖啶酮类生物碱,常存在于包瑞山油柑、山油柑和降真香等植物中,是红、白酸汤样品中下调的差异显著代谢物,来源于莽草酸途径生物碱的生物合成[22]。N-甲基酪胺是由酪氨酸经酪氨酸脱羧酶的催化可转成酪胺,进一步代谢生成的一种生物碱[23-24]。在金黄紫堇碱的合成来源于酪氨酸代谢,存在于番茄等植物生源合成途径中[25]。酚类和黄酮类:毛地黄黄酮、绿原酸和儿茶素为红、白酸汤样品中差异显著代谢物,主要原因是红酸汤以番茄为发酵原料,毛地黄黄酮是茄果实中重要的黄酮类化合物[26]。番茄果实中绿原酸和儿茶素是主要的的酚类化合物,具有显著的抗氧化作用[27]。研究表明,随着发酵的进行,红酸汤中的绿原酸含量逐渐上升,是红酸汤中的重要的有机酸之一[28]。
3 结论
本研究基于非靶向代谢组学结合多元分析手段分析贵州红、白酸汤共注释到2 929个代谢物,以VIP>1且P值<0.05为筛选差异显著代谢物,正离子模式下,红、白酸汤差异显著代谢物为1 223种,上调的差异显著代谢物有340种,下调的差异显著代谢物有883种;负离子模式下,样本差异显著代谢物为1 173种,上调的差异显著代谢物有272种,下调的差异显著代谢物有901种。HMDB数据库匹配结果显示,差异显著代谢物主要包括脂类和类脂类化合物、有机酸及其衍生物、有机杂环化合物、苯环类化合物、有机氧化合物、苯基丙酸类和聚酮类化合物。KEGG分析表明,差异代谢物主要富集在正离子模式下的莽草酸途径生物碱的生物合成、血清素能突触通路等及负离子模式下的组氨酸和嘌呤的生物碱生物合成。红、白酸汤样品中显著差异代谢物主要为生物碱、酚类和黄酮类物质。通过对红、白酸汤的代谢产物分析,初步探究差异代谢产物及其代谢途径,为贵州不同品类酸汤的风味和营养成分进一步研究提供理论基础。
[1] LIN L J, DU F M, ZENG J, et al.Deep insights into fungal diversity in traditional Chinese sour soup by Illumina MiSeq sequencing[J].Food Res Int,2020,137:109439.
[2]李娟.贵州红酸汤优势菌群及特征风味相关性研究[D].贵阳:贵州大学,2022.
[3]张馨凌.酸食的地域性研究——以贵州黔东南西江苗寨为例[J].百色学院学报,2015,28(5):75-86.
[4] LI D F, DUAN F X, TIAN Q M, et al.Physiochemical, microbiological and flavor characteristics of traditional Chinese fermented food Kaili Red Sour Soup[J].LWT-Food Sci Technol,2021,142:110933.
[5]舒亚非,廖伟先,杨丽娟,等.贵州11种酸汤品质特性分析[J].中国酿造,2021,40(10):129-133.
[6]曲子晗,王楠兰,杨红梅,等.凯里红酸汤对大鼠肠道脂肪酸吸收和紧密连接蛋白的调控[J].中国酿造,2021,40(5):129-133.
[7]LIN L J,ZENG J,TIAN Q M,et al.Effect of the bacterial community on the volatile flavour profile of a Chinese fermented condiment-Red sour soup-During fermentation[J].Food Res Int,2022,155:111059.
[8]曾议霆,吴雪莉,杨春梅,等.基于非靶向代谢组学比较不同发酵方式红茶滋味物质差异[J].食品安全质量检测学报,2022,13(16):5288-5296.
[9]钱敏,阮凤喜,赵文红,等.基于GC-TOF-MS解析不同甜型广东客家黄酒代谢组分[J].中国酿造,2022,41(4):222-228.
[10]肖甜甜,干昭波,吴君海,等.贵州米酸汤中呈味物质对滋味的影响[J].中国食品学报,2022,22(10):303-313.
[11]李娟,田亚,王晓宇,等.基于GC-IMS技术对多菌系复合发酵特色米酸汤的风味特征研究[J].食品与发酵科技,2022,58(1):72-79,96.
[12]严红光,张建炀,林莉,等.凯里米酸汤挥发性成分HS-SPME-GC-MS和HS-GC-IMS分析[J].食品与发酵工业,2022,48(9):245-252.
[13]周碧云.基于近红外光谱法对红酸汤中氨基酸类滋味物质快速测定的研究[D].贵阳:贵州师范大学,2022.
[14]袁野,李云成,孟凡冰,等.贵州红酸汤研究进展[J].粮食与油脂,2022,35(6):19-23.
[15]何扬波,李国林,李咏富,等.红酸汤发酵过程中微生物区系及挥发性物质组成变化分析[J].食品工业科技,2022,43(19):177-190.
[16]PENG Y,HONG J W,RAFTERY D,et al.Metabolomic-based clinical studies and murine models for acute pancreatitis disease: A review[J].Biochim Biophys Acta Mol Basis Dis,2021,1867(7):166123.
[17] CHUNG H J, SIM J H, MIN T S, et al.Metabolomics and lipidomics approaches in the science of probiotics:A review[J].J Med Food,2018,21(11):1086-1095.
[18]徐晓敏,房城,卢芳.基于代谢组学技术的黄芩-白芍对二型糖尿病模型小鼠的作用机制[J],2023,18(5):600-605.
[19]任小彤,彭婧,韩晓,等.贺兰山东麓产区不同地块酿酒葡萄果实类黄酮物质分析[J].中外葡萄与葡萄酒,2022(6):32-41.
[20]LI M W,SHEN Y,LING T J,et al.Analysis of differentiated chemical components between Zijuan Purple Tea and Yunkang Green Tea by UHPLC-Orbitrap-MS/MS combined with chemometrics[J].Foods,2021,10(5):1070.
[21]洪雅萍,谷梦雅,高婷,等.福州单瓣茉莉和双瓣茉莉不同器官的广泛靶向代谢组学分析[J].食品科学,2023,44(8):184-193.
[22]刘改枝,史礼君,刘萌芽,等.N~(10)-吖啶酮乙酸酯的合成及细胞毒活性研究[J].中国药物化学杂志,2021,31(7):498-503.
[23]董晶,梁兆昌,陈海芳,等.HPLC法同时测定不同采收期江枳壳中辛弗林和N-甲基酪胺的含量[J].井冈山大学学报(自然科学版),2016,37(2):92-96.
[24]王博龙.基于网络药理学的枳术汤活性成分-靶点-通路研究[J].中药新药与临床药理,2018,29(6):759-767.
[25]任虹,张乃元,田文静,等.源于果蔬的黄酮类化合物及其抗肿瘤作用靶点研究进展[J].食品科学,2013,34(11):321-326.
[26]TAN J,WANG B C,ZHU L C.Regulation of survivin and Bcl-2 in HepG2 cell apoptosis induced by quercetin[J].Chem Biodivers, 2009, 6(7):1101-1110.
[27]陶晓亚.脱落酸和茉莉酸甲酯调控番茄果实成熟的效应及相关miRNA调控因子研究[D].杭州:浙江大学,2020.
[28]郑莎莎.干酪乳杆菌H1发酵红酸汤的品质影响及特征代谢物研究[D].贵阳:贵州大学,2020.