克罗诺杆菌(Cronobacter spp.)被国际食品微生物标准委员会(International Commission of Microbiological Specializations on Food,ICMSF)列为对部分人群存在严重危害的致病菌,并于2004年由联合国粮食和农业组织(Food and Agriculture Organization of the United Nations,FAO)和联合国世界卫生组织(World Health Organization,WHO)划分为A类致病菌[1]。阪崎克罗诺杆菌(Cronobacter sakazakii)是克罗诺杆菌属的模式菌株,能引起新生儿严重的败血症、脑膜炎、坏死性结肠炎[2]等,感染阪崎克罗诺杆菌的婴儿死亡率高达80%[3-4]。而近年来在世界范围内发生的多起由阪崎克罗诺杆菌引发的食品召回事件,造成了巨大的社会负担和经济损失[5-6]。作为除母乳外0~6个月婴儿摄取营养成分的最主要来源,婴儿配方奶粉的安全性越来越多地引起消费者、媒体和政府的重视。
克罗诺杆菌的污染来源尚不明确,但多数报告表明婴儿配方奶粉是目前发现的主要感染渠道[7-8]。婴儿配方奶粉在生产过程中的关键步骤是高温杀菌、喷雾干燥和冷藏,并可能伴随射频[9]、辐照[10]、强脉冲光[11]等杀菌方式[12],大多数细菌在此过程中会被杀死,但是克罗诺杆菌普遍具有非常强的低pH耐受性、耐热、耐高渗透压和耐干燥等特性[13],能在水分活度只有0.2的婴儿配方乳粉中存活1年以上[14],并且水化后立刻繁殖[15]。
鉴于克罗诺杆菌对婴儿的高致病性,国际上对该菌的检测方法也越发重视,但仍存在检测周期过长的特性,例如在国际化标准组织(International Organization for Standartization,ISO)/TS 22964:2017《乳和乳制品-阪崎肠杆菌检验》中就需要前增菌、克罗诺杆菌筛选肉汤(Cronobacter screening broth,CSB)培养基增菌、克罗诺杆菌显色分离(Cronobacter chromogenic isolation,CCI)琼脂培养基分离及生化鉴定等步骤,至少需要5 d时间才能得到结果。国标GB 4789.40—2016《食品安全国家标准食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验》,仅增菌时间就高达40 h左右,一旦发生感染事件无法满足溯源工作的时效性。在微生物检测中是否能够分离得到纯菌是检测的重要依据,标准中第一步增菌采用非选择性增菌液缓冲蛋白胨水(buffered peptone water,BPW),而克罗诺杆菌感染剂量低,易被其他杂菌竞争性抑制,导致检出率降低,而分子生物学和免疫学等方法虽然具有效率高、灵敏性强等优势,但无法区分菌体是否存活,也无法满足检出阳性菌的工作需求,仅能作为初筛步骤[16]。根据调查,婴儿配方粉中的克罗诺杆菌的污染水平<1 CFU/100 g[17],目前已经报道的克罗诺杆菌快速检测方法检出限有所限制。因此研制一种能够有效缩短克罗诺杆菌增菌时间,并能够选择性抑制非目标菌的快速增菌液尤为重要。另外,越来越多的市售婴儿配方粉中添加了益生菌,但标准中并没有对添加了益生菌的婴儿配方粉有特殊的检测流程,这对婴幼儿配方奶粉的安全性检测引入了新的不确定因素[18]。
本研究建立一种婴儿配方奶粉中克罗诺杆菌的快速检测方法,采用单因素实验筛选克罗诺杆菌的促进剂、调整抑制剂和修复剂的用量,制备克罗诺杆菌快速增菌培养基(rapid growth medium,RGM),并对该方法进行特异性及增菌效果验证。评价该方法在婴儿配方奶粉检测中的应用结果,为婴幼儿配方奶粉的质量控制提供技术支持,并为进一步的标准修订提供数据基础。
1 材料与方法
1.1 材料与试剂
1.1.1 实验菌株
阪崎克罗诺杆菌(Cronobacter sakazakii)ATCC 29544、大肠埃希氏菌(Escherichia coli)ATCC 25922、鼠伤寒沙门氏菌(Salmonella typhimurium)ATCC 14028、阴沟肠杆菌(Enterobacter cloacae)ATCC 35030、铜绿假单胞菌(Pseudomonas aeruginosa)ATCC 27853、副溶血性弧菌(Vibrio parahaemolyticus)ATCC 17802、金黄色葡萄球菌(Staphylococcus aureus)ATCC 25923、单核细胞增生李斯特氏菌(Listeria monocytogenes)ATCC 19115ATCC 29544:美国菌种保藏中心(American Type Culture Collection,ATCC);穆汀斯克罗诺杆菌(Cronobacter muytjensii)DSM 21870、丙二酸盐阳性克罗诺杆菌(Cronobacter malonaticus)DSM 18702、苏黎世克罗诺杆菌(Cronobacter turicensis)DSM 18703、康迪蒙提克罗诺杆菌(Cronobacter condimenti)DSM 27966、尤尼沃斯克罗诺杆菌(Cronobacter universalis)DSM 27963、都柏林克罗诺杆菌都柏林亚种(Cronobacter dublinensis sub sp.dublinensis)DSM 18705:德国微生物保藏中心(Deutsche Sammlung von Mikroorganismen und Zellkulturen,DSMZ);蜡样芽孢杆菌(Bacillus cereus)CMCC 63301:中国医学细菌菌种保藏管理中心(National Center for Medical Culture Collections,CMCC);长双歧杆菌婴儿亚种(Bifidobacterium longum subsp.infantis)CICC 6069:中国工业微生物菌种保藏管理中心(China Center of Industrial Culture Collection,CICC);3株自婴儿配方奶粉中分离的阪崎克罗诺杆菌(编号1#~3#):本实验室保存。
1.1.2 化学试剂
磷酸盐缓冲液(phosphate buffer solution,PBS)、缓冲蛋白胨水(BPW)、万古霉素(分析纯):北京陆桥技术股份有限公司。D-甘露醇、纤维二糖、半乳糖、低聚半乳糖、低聚果糖、多聚果糖、低聚乳果糖、低聚麦芽糖、低聚异麦芽糖、水苏糖(均为分析纯):北京索莱宝科技有限公司;丙酮酸钠(分析纯):美国Sigma-Aldrich公司;聚葡萄糖(分析纯):上海源叶生物科技有限公司;葡萄糖(分析纯):北京西陇化工股份有限公司。
1.1.3 培养基
阪崎克罗诺杆菌显色[(Druggan-Forsythe-Iversen)DFI)琼脂]培养基、胰酪胨大豆琼脂(tryptose soya agar,TSA)培养基、MRS培养基、平板计数琼脂(plate count agar,PCA)培养基、含0.6%酵母浸膏的胰酪胨大豆琼脂(trypticase soyyeast extract agar,TSA-YE)培养基、3%氯化钠胰蛋白胨大豆琼脂培养基:北京陆桥技术股份有限公司。
1.2 仪器与设备
XSE105DU电子天平(精密度0.01 mg):梅特勒-托利多仪器(上海)有限公司;1300系列A2型二级生物安全柜:美国Thermo Fisher Scientific公司;Memmert IN750PLUS生化培养箱:德国Memmert公司;THZ-D台式恒温振荡器:太仓市实验设备厂;Densicheck Plus电子比浊仪、VITEK2 compact全自动微生物鉴定系统:法国BioMérieux公司。
1.3 方法
1.3.1 菌株活化方法
将-80 ℃冻存的细菌接种到液体培养基中,于(36±1)℃培养24 h后划线接种于TSA培养基(单增李斯特氏菌接种TSA-YE琼脂培养基、副溶血性弧菌接种3%氯化钠胰蛋白胨大豆琼脂培养基,下同),于(36±1)℃条件下培养24 h。
1.3.2 细菌计数方法
将阪崎克罗诺杆菌ATCC 29544复苏后划线接种于TSA培养基,(36±1)℃静置培养24 h后挑取单菌落接种于缓冲蛋白胨水BPW中,(36±1)℃、160 r/min振荡培养6 h。以空白BPW作为对照,用电子比浊仪测量麦氏浊度,并根据国标GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》中的计数方法使用TSA培养基对其进行计数,并绘制菌体计数曲线。利用磷酸盐缓冲液调整菌悬液的麦氏浊度值,得到目标浓度的菌悬液。
1.3.3 快速增菌液的制备
(1)促进剂的选择
根据市售婴儿配方奶粉配料表中的差异,选择12种碳源底物,从中筛选快速增菌液的促进剂。以100 mL BPW为对照,分别加入添加量均为1%的葡萄糖、聚葡萄糖、D-甘露醇、纤维二糖、半乳糖、低聚半乳糖、低聚果糖、多聚果糖、低聚乳果糖、低聚麦芽糖、低聚异麦芽糖、水苏糖等12种碳源,接种5 CFU的阪崎克罗诺杆菌ATCC 29544,(36±1)℃静置培养24 h,按照国标GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》的计数方法对其进行计数。根据菌落计数结果选择最佳碳源,并考察最佳碳源添加量(0、0.5%、1.0%、1.5%、2.0%、2.5%、3.0%、3.5%、4.0%)对克罗诺杆菌的增菌效果的影响,确定最佳碳源添加量。
(2)抑制剂的选择
根据国标GB 4789.40—2016《食品安全国家标准食品微生物学检验克罗诺杆菌属(阪崎肠杆菌)检验》规定,第二步增菌液是在mLST培养液中添加万古霉素以抑制非克罗诺杆菌属菌株的生长。本研究选择添加益生菌的婴儿配方粉作为基质,以100 mL BPW为对照,分别添加0.5%、1.0%、1.5%、2.0%的万古霉素,接种1 mL 106 CFU/mL的长双歧杆菌婴儿亚种CICC 6069菌液,(36±1)℃培养24 h,根据国标GB 4789.35—2016《食品安全国家标准食品微生物学检验乳酸菌检验》对培养前后的双歧杆菌进行计数。在相同万古霉素添加量条件下,分别接种5 CFU的阪崎克罗诺杆菌ATCC 29544,(36±1)℃静置培养24 h,按照国标GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》的计数方法对其进行计数,确定万古霉素添加量。
(3)修复剂的选择
热损伤:分别移取9 mL磷酸盐缓冲液和灭菌牛奶于15 mL无菌离心管中,浸入55 ℃恒温水浴锅内预热30 min。各取1 mL 106 CFU/mL的阪崎克罗诺杆菌ATCC 29544菌悬液,无菌加入到上述离心管中,颠倒混匀后继续加热,于3 min、5 min、10 min时各吸取100 μL进行DFI平板计数,并计算损伤率,其计算公式如下:
以100mLBPW为对照,分别添加0.1%、0.2%、0.3%、0.4%、0.5%的丙酮酸钠,接种经过热处理后的1 mL 106 CFU/mL的阪崎克罗诺杆菌ATCC 29544菌悬液,(36±1)℃静置培养24 h,按照GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》的计数方法对其进行计数,确定丙酮酸钠添加量。
1.3.4 方法特异性验证试验
为探究快速增菌液对常见污染菌增菌效果的特异性,向快速增菌液中加入阪崎克罗诺杆菌ATCC 29544、穆汀斯克罗诺杆菌DSM 21870、丙二酸盐阳性克罗诺杆菌DSM 18702、苏黎世克罗诺杆菌DSM 18703、康迪蒙提克罗诺杆菌DSM 27966、尤尼沃斯克罗诺杆菌DSM 27963、都柏林克罗诺杆菌都柏林亚种DSM 18705、大肠埃希氏菌ATCC 25922、鼠伤寒沙门氏菌ATCC 14028、阴沟肠杆菌ATCC 35030、铜绿假单胞菌ATCC 27853、副溶血性弧菌ATCC 17802、金黄色葡萄球菌ATCC 25923、单核细胞增生李斯特氏菌ATCC 19115、蜡样芽孢杆菌CMCC 63301和阪崎克罗诺杆菌1#、2#、3#,其中革兰氏阴性细菌的添加量为5 CFU,革兰氏阳性细菌的添加量为1.5×103 CFU,(36±1)℃静置培养24 h,按照GB 4789.2—2022《食品安全国家标准食品微生物学检验菌落总数测定》的计数方法对其进行计数。
1.3.5 增菌效果验证试验
为探究克罗诺杆菌快速增菌液在市售婴幼儿配方奶粉中的增菌效果,实验采用12种不同品牌的市售婴儿配方奶粉,其中6种不含益生菌,另外6种含有益生菌。取10 g样品加入到90 mL克罗诺杆菌快速增菌液中,人工加入5 CFU阪崎克罗诺杆菌,用拍击式均质器拍击2 min后制成加标样品,同时以BPW作为对照,于(36±1)℃共同培养24 h,使用DFI培养基对阪崎克罗诺杆菌进行涂布计数。
1.3.6 数据处理
每组平行测定3次,结果以“平均值±标准差”表示,使用SPSS 20.0和Origin 9.0软件进行数据处理和图表绘制,采用方差分析进行显著性差异分析,P<0.05表示差异显著。
2 结果与分析
2.1 菌液浓度的测定
分别以阪崎克罗诺杆菌菌悬液的麦氏浊度(x)和对应的菌液浓度(y)为横、纵坐标作图,得到菌液浓度与麦氏浊度的关系曲线回归方程:y=2.938 4x-0.032 2,相关系数R2=0.994 2。在后续实验中,通过测定所制备的菌悬液的浊度,计算菌液浓度,并根据所需菌液浓度用磷酸盐缓冲液进行梯度稀释。
2.2 克罗诺杆菌增菌促进剂
2.2.1 碳源的选择
糖类是一般为生物较容易利用的良好碳源和能源物质,微生物利用碳源物质具有选择性,不同碳源对克罗诺杆菌的增菌效果见图1。由图1可知,碳源添加组显著高于未添加组(P<0.05)。向BPW中添加不同碳源均能在一定程度上促进克罗诺杆菌的生长繁殖,其中以低聚半乳糖和低聚异麦芽糖的增菌效果最好,其次是低聚果糖、多聚果糖和低聚麦芽糖。经过对市售婴儿配方粉的成分进行比较,发现添加低聚半乳糖的品牌约占总量的80%,添加量为0.36%~3.00%,添加低聚果糖的品牌约占总量的67%,添加量从0.1%~3.6%不等,同时添加低聚半乳糖和低聚果糖的品牌占比为60%,添加多聚果糖,聚葡萄糖的品牌较少,不到总数的10%,未发现以低聚异麦芽糖为原料的奶粉。作为微生物的主要碳源,低聚糖在一定的浓度内能够明显促进菌体的生长繁殖,但过高的浓度会对细菌生长产生抑制效果[19],为降低奶粉基础碳源的影响,选择最适碳源为低聚异麦芽糖。
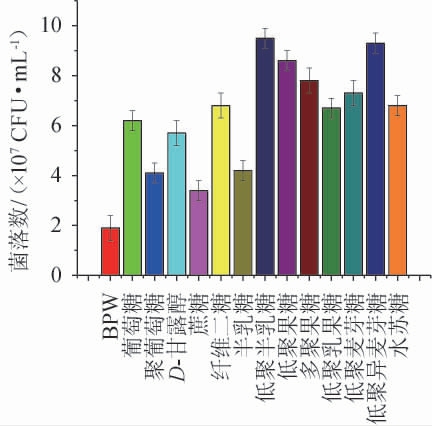
图1 不同碳源对阪崎克罗诺杆菌的增菌效果
Fig.1 Enrichment effect of different carbon sources on Cronobacter sakazakii
2.2.2 低聚异麦芽糖添加量的选择
不同添加量低聚异麦芽糖对克罗诺杆菌的增菌效果见图2。
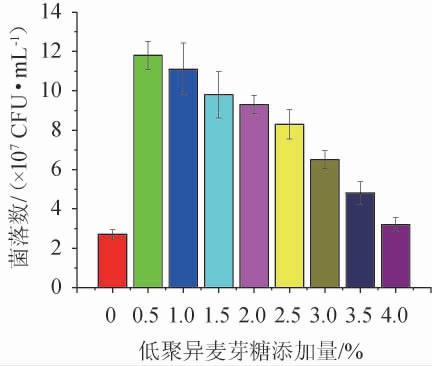
图2 不同低聚异麦芽糖添加量对阪崎克罗诺杆菌的增菌效果
Fig.2 Enrichment effect of different isomaltooligosaccharide addition on Cronobacter sakazakii
由图2可知,低聚异麦芽糖添加量为0.5%时促进效果最好,约为BPW的4.6倍。随着低聚异麦芽糖添加量>0.5%之后,整体促进效果呈下降趋势,但与不加低聚异麦芽糖的对照组相比仍具有显著性差异(P<0.05),低聚异麦芽糖添加量过高时反而不利于微生物的生长繁殖。因此,选择低聚异麦芽糖最适添加量为0.5%。
2.3 克罗诺杆菌增菌抑制剂
2.3.1 万古霉素对双歧杆菌的抑制效果
因双歧杆菌对肠道致病菌具有良好的竞争性抑制作用[20]而被允许添加到婴儿配方奶粉中。在GB 10765—2021《食品安全国家标准婴儿配方食品》和GB 25596—2010《食品安全国家标准特殊医学用途婴儿配方食品通则》中规定:添加活性菌种的产品,其活菌数应不少于106 CFU/g,在此浓度下标准的检测方法能否保持克罗诺杆菌检测的灵敏性尚缺乏足够的数据支持。
不同万古霉素添加量对双歧杆菌的抑制作用见图3。由图3可知,万古霉素能够抑制双歧杆菌的生长繁殖。与不加万古霉素的对照组比较,在万古霉素添加量为0.5%时抑制效果显著(P<0.05),随着万古霉素添加量的提高,抑制效果继续增强。因此,从对双歧杆菌的抑制作用来看,最适万古霉素添加量为0.5%。
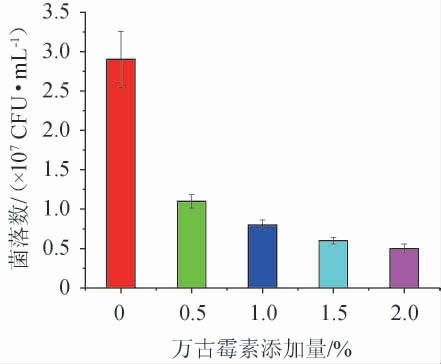
图3 不同万古霉素添加量对双歧杆菌的抑制效果
Fig.3 Inhibitory effect of different vancomycin addition on Bifidobacteria
2.3.2 万古霉素对阪崎克罗诺杆菌的抑制效果
万古霉素属于三环糖肽类抗生素,其作用机制主要是以高亲和力结合到细菌细胞壁前体肽聚末端的D-丙胺酰-D-丙氨酸,阻断构成细胞壁的高分子肽聚糖的合成,从而导致细胞壁缺损而杀灭细菌。此外,万古霉素还能改变细菌细胞膜渗透性及选择性抑制核糖核酸(ribonucleic acid,RNA)的合成[21-22]。不同万古霉素添加量对阪崎克罗诺杆菌的抑制作用,结果见图4。由图4可知,当阪崎克罗诺杆菌的添加量为5 CFU时,向培养基中不同万古霉素添加量对其生长几乎没有抑制效果,证明阪崎克罗诺杆菌对万古霉素具有耐药性。研究表明,向培养基中添加十二烷基硫酸钠(sodium dodecyl sulfate,SDS)、胆盐、结晶紫、新生霉素等革兰氏阴性细菌培养时常用的选择性抑制剂时会出现假阴性的结果[23-24],可能和细菌处于亚致死状态有关,这也是标准中将含有选择性成分的培养基作为二次增菌液的原因。
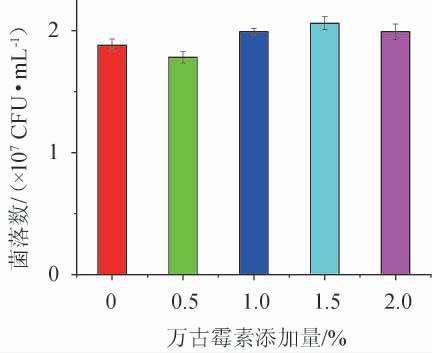
图4 不同万古霉素添加量对阪崎克罗诺杆菌的抑制效果
Fig.4 Inhibitory effect of different vancomycin addition on Cronobacter sakazakii
综合万古霉素对阪崎克罗诺杆菌和双歧杆菌的抑制效果,确定万古霉素最适添加量为0.5%。
2.4 克罗诺杆菌的修复剂
2.4.1 不同热处理方式对阪崎克罗诺杆菌的损伤
婴儿配方粉在制备过程中会经过高温、高压、冷藏、喷雾干燥等工艺,其中的细菌即使能够存活也会受到亚致死性损伤,进入活的不可培养状态,但在适宜条件下却能够很快恢复到正常的生理生化状态,恢复其致病性,因此对克罗诺杆菌进行损伤修复试验是有必要的。本研究模拟婴儿配方奶粉的热加工环境过程对菌体的损伤,结果见表1。
表1 不同热处理方式对阪崎克罗诺杆菌的损伤效果
Table 1 Damage effect of different heat treatment methods on Cronobacter sakazakii

注:“*”表示与处理前的数据相比差异显著(P<0.05)。
菌落数/(CFU·mL-1)磷酸盐缓冲液中55 ℃热处理时间/min 3 5 10灭菌牛奶中55 ℃热处理时间/min 3 5 10处理前处理后损伤率/%3.0×105 1.5×103±200a*99.49±0.06 10±1c*100.00 240±12c*99.92±0.004 1.5×105±10 000b*49.15±3 9.7×104±3 000b*67.12±1 2.8×103±200a*90.51±0.06
由表1可知,不同温度和时间的热处理对克罗诺杆菌的损伤率各不相同,在55 ℃条件下经过3 min的热处理后,克罗诺杆菌在磷酸盐缓冲液中的损伤率可达99.49%,同样处理条件下在灭菌牛奶中的损伤率仅有49.15%,随着热处理时间的延长至5 min,在磷酸盐缓冲液中的克罗诺杆菌的损伤率已经达到99.92%,10 min时已全部死亡,而在灭菌牛奶中热处理10 min时克罗诺杆菌的损伤率也仅有90.51%。考虑到奶粉的实际污染率很低,本研究选择在磷酸盐缓冲液基质下55 ℃热处理5 min的损伤模式进行修复实验。
牛奶的导热能力比磷酸盐缓冲液体系更强,但损伤率反而更低。这与牛奶中富含蛋白质有关。酪蛋白是乳蛋白中最丰富的蛋白质,占牛奶蛋白的80%~82%,是构成乳蛋白胶体体系的重要成分。在牛奶中,酪蛋白大多不是以游离的蛋白分子形式存在,而是结合成一个一个的颗粒束。酪蛋白的疏水端在内部,另一端亲水,在外部与水分子结合。这样能够包裹牛奶中的其他成分,使颗粒束在牛奶中稳定存在[25]。因此在牛奶体系中克罗诺杆菌的损伤程度低于磷酸盐缓冲体系。
2.4.2 丙酮酸钠对热损伤阪崎克罗诺杆菌的修复作用
丙酮酸钠是一种最常见的丙酮酸盐,是一类内源性小分子物质,在生物体内作为无氧呼吸有氧呼吸产生二氧化碳前的重要中间产物,在食品中常用语食品添加剂和膳食补充剂[26]。在微生物培养中,丙酮酸钠是常用的促进剂[27],能够修复细胞损伤,并能够诱导受损细胞进入可繁殖状态[28]。不同丙酮酸钠添加量对阪崎克罗诺杆菌的修复作用,结果见图5。由图5可知,不添加丙酮酸钠时克罗诺杆菌的菌体浓度为2.2×107 CFU/mL,丙酮酸钠添加量为0~0.3%时,阪崎克罗诺杆菌的菌体浓度随之增加;丙酮酸钠添加量为0.3%时,菌体浓度最高,为4.8×107 CFU/mL;丙酮酸钠添加量>0.3%之后,菌体浓度随之下降。因此,选择丙酮酸钠的最适添加量为0.3%。
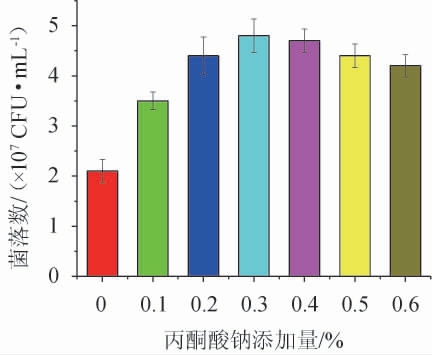
图5 不同丙酮酸钠添加量对热损伤阪崎克罗诺杆菌的修复效果
Fig.5 Repair effect of different sodium pyruvate addition on heat damage Cronobacter sakazakii
2.5 方法特异性试验
婴儿配方奶粉中常见的污染菌主要为肠杆菌科、芽孢杆菌属、李斯特氏菌属等。本研究选择食品中常见的污染菌作为特异性实验的实验菌株,特异性试验结果见表2。由表2可知,克罗诺杆菌快速增菌液有利于大肠埃希氏菌、鼠伤寒沙门氏菌、阴沟肠杆菌等肠杆菌科细菌的生长繁殖,对铜绿假单胞菌的促进效果较弱,对副溶血性弧菌、金黄色葡萄球菌、单核细胞增生李斯特氏菌、蜡样芽孢杆菌等致病菌有良好的抑制作用。
表2 方法特异性试验结果
Table 2 Specific tests results of the method

细菌 细菌添加量/CFU培养后细菌浓度/(CFU·mL-1)阪崎克罗诺杆菌都柏林克罗诺杆菌丙二酸盐克罗诺杆菌穆汀斯克罗诺杆菌苏黎世克罗诺杆菌尤尼沃斯克罗诺杆菌康迪蒙提克罗诺杆菌阪崎克罗诺杆菌分离菌株1#阪崎克罗诺杆菌分离菌株2#阪崎克罗诺杆菌分离菌株3#大肠埃希氏菌鼠伤寒沙门氏菌阴沟肠杆菌铜绿假单胞菌55555555555555(1.0±0.01)×109*(1.5±0.02)×109*(1.2±0.01)×109*(1.3±0.01)×109*(1.5±0.01)×109*(1.9±0.01)×109*(1.7±0.02)×109*(1.5±0.01)×109*(1.8±0.02)×109*(1.2±0.01)×109*(1.1±0.02)×109*(0.9±0.01)×109*(1.3±0.01)×109*(7.5±0.03)×107*
续表
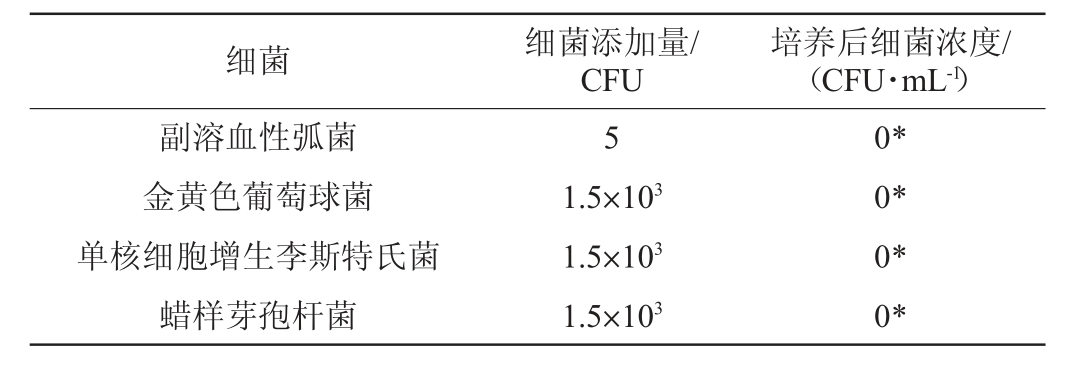
注:“*”代表同列中与对应对照组生长存在显著性差异(P<0.05)。
细菌 细菌添加量/CFU培养后细菌浓度/(CFU·mL-1)副溶血性弧菌金黄色葡萄球菌单核细胞增生李斯特氏菌蜡样芽孢杆菌0*0*0*0*5 1.5×103 1.5×103 1.5×103
2.6 增菌效果验证试验
克罗诺杆菌快速增菌液培养基增菌效果的验证试验结果见表3。由表3可知,在不含有益生菌的婴儿配方奶粉中定量加入阪崎克罗诺杆菌(1 CFU)后,经克罗诺杆菌快速增菌液培养基(36±1)℃培养24 h后,均可检出阪崎克罗诺杆菌,克罗诺杆菌在快速增菌液培养基中的增殖速度是BPW中的2倍。在含益生菌的婴儿配方奶粉检测应用中,加入阪崎克罗诺杆菌(1CFU)后,经过快速增菌液培养基(36±1)℃培养24 h,克罗诺杆菌快速增菌液培养基中的菌体浓度是BPW中的10~20倍。在快速增菌肉汤培养体系中,双歧杆菌对克罗诺杆菌的增殖具有协同增效的作用,这可能是由于一定浓度的双歧杆菌产生的信号分子被克罗诺杆菌利用,从而促进克罗诺杆菌快速增殖。结果表明,快速增菌肉汤培养基增菌效果明显。
表3 不同品牌婴儿配方奶粉增菌效果验证试验结果
Table 3 Verification experiments results of enriching effect of infant formula milk powder with different brands
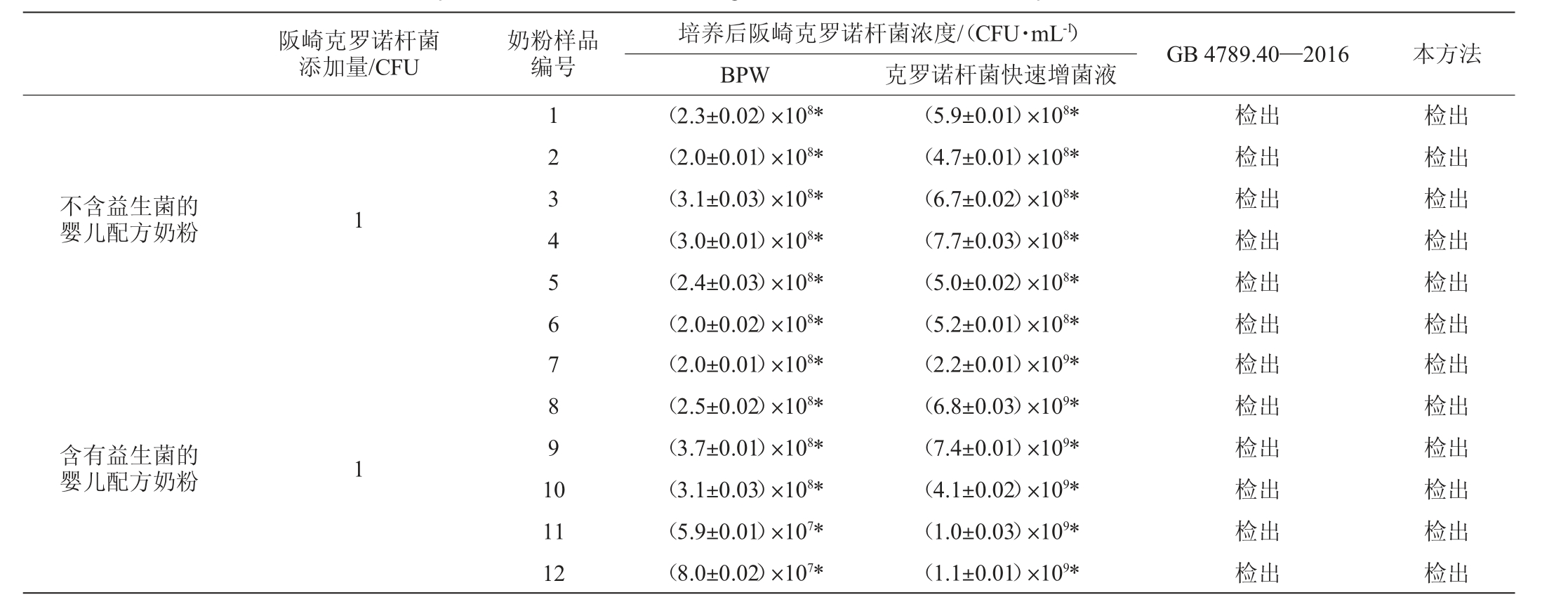
注:“*”代表同列中与对应对照组生长存在显著性差异(P<0.05)。
?
3 结论
本研究从促进剂、抑制剂和修复剂等方面制备克罗诺杆菌快速增菌液培养基,该增菌液添加的5 g/L低聚异麦芽糖能够明显促进克罗诺杆菌的生长、3 g/L丙酮酸钠能够促使在生产加工环节中受损的细菌恢复、5 mg/mL万古霉素对非肠杆菌科细菌有良好的抑制作用。当目标菌初始浓度为1 CFU/mL时,经过24 h的增菌培养后可以达到108 CFU/mL以上,增菌效果优于标准培养基,同时,应用此增菌液能够将克罗诺杆菌的前增菌步骤由标准中的两步缩减到一步,所需时间由国标中需要42 h缩短为24 h,对于不含有益生菌的婴儿配方奶粉能够将增菌效果提高约2倍,对于添加益生菌的婴儿配方奶粉能够将增菌效果提高10~20倍,在大幅缩短克罗诺杆菌的检测周期的同时也提高了检测效率和准确性,能够为婴幼儿食源性疾病溯源提供了更快速的解决方案,也可以用于生产企业的日常监控,有效降低生产成本,具有良好的市场前景,也为今后的检测方法的修订提供了一定的依据。但是,克罗诺杆菌在添加了益生菌的奶粉中能够显著增殖的机理尚不明确,需要做进一步的探索;抑制革兰氏阳性菌的万古霉素的最佳添加浓度还需要进行更深入的研究。
[1]FINKELSTEIN S,NEGRETE F,JANG H,et al.Prevalence,distribution,and phylogeny of type two toxin-antitoxin genes possessed by Cronobacter species where C. sakazakii Homologs follow sequence type lineages[J].Microorganisms,2019,7(11):554.
[2]CHAUHAN R,BANSAL S,AZMI W,et al.Increased thermal tolerance in Cronobacter sakazakii strains in reconstituted milk powder due to cross protection by physiological stresses[J].J Food Safety,2020,40(4):e12810.
[3] STRYSKO J, COPE J R, MARTIN H, et al.Food safety and invasive Cronobacter infections during early infancy,1961-2018[J].Emerg Infect Dis,2020,26(5):857-865.
[4]FORSYTHE S J.dates on the Cronobacter genus[J].Annu Rev Food Sci T,2018,9(1):23-44.
[5] VAN CKER J, DE SMET F, MUYLDERMANS G, et al.Outbreak of necrotizing enterocolitis associated with Enterobacter sakazakii in powdered milk formula[J].J Clin Microbiol,2001,39(1):293-297.
[6]IVERSEN C,FORSYTHE S J.Risk profile of Enterobacter sakazakii,an emergent pathogen associated with infant milk formula[J].Trends Food Sci Technol,2003,14(11):443-454.
[7] PEI X Y,LI Y,ZHANG H N,et al.Surveillance and characterisation of Cronobacter in powdered infant formula processing factories[J].Food Control,2019,96:318-323.
[8]庞立冬,宋丹靓敏,贾嫒,等.克罗诺杆菌环境耐受性的评价[J].食品工业科技,2022,43(23):161-167.
[9]LIN Y W,SUBBIAH J,CHEN L,et al.Validation of radio frequency assisted traditional thermal processing for pasteurization of powdered infant formula milk[J].Food Control,2020,109:106897.
[10]SANTO D,GRAÇA A,NUNES C,et al.Escherichia coli and Cronobacter sakazakii in'Tommy Atkins'minimally processed mangos:Survival,growth and effect of UV-C and electrolyzed water[J].Food Microbiol,2018,70:49-54.
[11] ZHAO W,YANG R J, ZHANG H Q.Recent advances in the action of pulsed electric fields on enzymes and food component proteins[J].Trends Food Sci Technol,2012,27(2):83-96.
[12]陈雪峰,郭玉曦,曾海燕,等.阪崎克罗诺杆菌物理和化学防控方法的研究进展[J].现代食品科技,2022,38(1):1-10.
[13]LING N,FORSYTHE S,WU Q P,et al.Insights into Cronobacter sakazakii biofilm formation and control strategies in the food industry[J].Engineering,2020,6(4):393-405.
[14] GURTLER J B,BEUCHAT L R.Survival of Enterobacter sakazakii in powdered infant formula as affected by composition,water activity,and temperature[J].J Food Prot,2007,70(7):1579-1586.
[15]甘辛,李凤琴.克罗诺杆菌属致病性研究进展[J].中国食品卫生杂志,2018,30(6):663-667.
[16]张清平,张懿翔,刘洋.婴幼儿奶粉中阪崎肠杆菌增菌培养对PCR快速检测的影响[J].中国乳品工业,2021,49(11):9-12.
[17]李艳娟,李朝旭,房新平,等.婴幼儿乳粉中阪崎肠杆菌污染防控与检验技术的研究进展[J].中国乳品工业,2015,43(5):38-42.
[18]姜勇,吕学娜,安玉枝,等.含双歧杆菌的婴儿配方奶粉和原料中阪崎肠杆菌的检测[J].中国乳品工业,2014,42(5):51-53.
[19]范媛媛,罗诗泳,郑冰,等.香蕉低聚糖对鼠李糖乳杆菌增殖条件的优化[J].食品工业科技,2018,39(20):86-91.
[20]郭帅,王昊乾,徐鹏飞,等.真空低温喷雾干燥制备乳双歧杆菌Probio-M8微胶囊[J].中国食品学报,2021,21(12):164-172.
[21]孟祥玉,王钰童,陈官华,等.万古霉素在食源性致病菌检测中的应用[J].化学通报,2019,82(12):1067-1072.
[22] MCGUINNESS W A, MALACHOWA N, DELEO F R.Focus: infectious diseases:vancomycin resistance in Staphylococcus aureus[J].Yale J Biol Med,2017,90(2):269-281.
[23]马文思,刘发山.大肠埃希氏菌在模拟胃肠道环境下耐受性的研究[J].昆明学院学报,2019,41(3):113-116.
[24]李淑英,李燕,胡贵莲,等.表面活性剂胁迫培养对4株细菌生长的影响[J].环境科学导刊,2021,40(5):1-4.
[25]李异凡.高压低温处理对牛奶杀菌效果及品质影响的研究[D].杭州:浙江大学,2022.
[26]李敏,马凌云,陈超阳,等.丙酮酸钠药理学作用的研究现状[J].中国临床药理学杂志,2021,37(3):341-344.
[27]YOON J H,WEI S,OH D H.A highly selective enrichment broth combined with real-time PCR for detection of Staphylococcus aureus in food samples[J].Lebensm-Wiss Technol,2018,94(2): 10.1016/j.lwt.2018.04.054.
[28]HATI R P,DEWANTI H R,NURAIDA L.Cronobacter sakazakii local isolates response to acid stress and their resuscitability[J].Food Res,2019,4(1):244-253.