白酒作为一种典型的蒸馏酒[1],其风味主要来自于白酒发酵过程中酿酒酵母(Saccharomyces cerevisiae)的发酵[2]。酿酒酵母培养基作为酵母培养与干燥的关键载体,在酵母的培养和干燥过程中发挥着十分重要的作用[3]。酿酒酵母培养基中含有碳源、氮源、无机盐和维生素等酿酒酵母细胞生长所必需的成分,这些组分的种类及浓度对酵母的生长具有十分重要的影响[4]。因此,在优化酿酒酵母培养基组分的基础上,对酵母的培养条件和热激工艺进行优化,以达到提高酿酒酵母的生物量和复水存活率的目的,无疑是酿酒酵母等微生物培养与干燥领域的重要研究方向。宋洋洋等[5]利用产朊假丝酵母(Candida utilis)优化培养体系参数,研究装液量、转速、培养pH和培养时间对酵母生物量的影响,优化后的酵母数量达到了9.34×108 CFU/mL;南博[6]利用从葡萄中分出的本土酿酒酵母,优化了酵母的培养组分,优化后的酵母生物量达到11 g/L;李婷婷等[7]利用优化后的培养体系培养酿酒酵母,OD560 nm值达到了60.60。但是目前的研究多集中于葡萄酒酵母等酵母菌种,并专注于提高酵母生物量,对酿酒酵母干燥后复水存活率和高生物量的结合研究较少。
本研究在酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YEPD)培养基、酵母基本培养基、酵母完全培养基、马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基4种培养基中筛选最适培养基,以酵母的生物量和干燥后的复水存活率为考察指标,利用单因素试验和响应面法对酿酒酵母(Saccharomyces cerevisiae)的培养基和培养条件进行优化,进一步提高酿酒酵母在YEPD培养基中的生物量和干燥后的复水存活率,对优选酿酒酵母的培养体系及其工业化生产具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种酿酒酵母(Saccharomyces cerevisiae):陕西科技大学热能与利用干燥技术研究所分离并保存。
1.1.2 试剂
葡萄糖、蔗糖、NaCl、(NH4)2SO4、KH2PO4、K2HPO4、MgSO4、CuSO4、FeSO4、ZnSO4(均为分析纯)、蛋白胨(生化试剂):天津市致远化学试剂有限公司;CaCl2、乳糖、VB1、VB2、肌醇(均为分析纯)、琼脂(生化试剂):浙江一诺生物科技有限公司;酵母膏、牛肉膏(均为生化试剂):山东鑫卓源化工有限公司;甘蔗糖蜜:广西中孚信糖业有限公司。
1.1.3 培养基
YEPD液体培养基:1%酵母膏、2%葡萄糖和2%的蛋白胨[8]。YEPD固体培养基:YEPD液体培养基中加入2%琼脂。
酵母基本培养基:0.1%酵母膏,0.025%(NH4)2SO4,0.025%MgSO4,2%葡萄糖,0.05%K2HPO4[9]。
酵母完全培养基:2.5%蔗糖,0.05%FeSO4,0.05%MgSO4,0.5%ZnSO4,0.05%K2HPO4,0.3%(NH4)2SO4[9]。PDB培养基:20%马铃薯,2%蔗糖[10]。上述培养基均在115 ℃灭菌25 min。
1.2 仪器与设备
UV752型紫外-可见分光光度计:上海佑科仪器仪表有限公司;LHS-24C型高压蒸汽灭菌锅:湖南力辰仪器科技有限公司;VD-650型桌上式洁净工作台:天津市宏诺仪器有限公司;SHA-CA水浴恒温振荡器:常州金坛良友仪器有限公司;80-2型电动离心机:常州杰博森仪器有限公司。
1.3 方法
1.3.1 菌种活化及发酵液的制备
将酿酒酵母加入YEPD液体培养基,于28 ℃、180 r/min培养30 min,4 000 r/min条件下离心10 min,收集菌体。取洗涤后的酵母菌体接种于YEPD固体培养基,于28 ℃条件下静置培养15 h,挑取单菌落接种于5mLYEPD液体培养基中,于29 ℃、195 r/min条件下振荡培养12 h,得到种子液。将种子液按2%的接种量接种于YEPD液体培养基中,195 r/min、29 ℃振荡培养12 h,得到酿酒酵母发酵液[11]。
1.3.2 酿酒酵母培养基筛选
按照5%(V/V)的接种量,将上述酿酒酵母发酵液分别接种于YEPD培养基、酵母基本培养基、酵母完全培养基、PDB培养基中,在195 r/min、29 ℃、pH 5.5的培养条件下振荡培养,每隔2 h测定反映酵母生物量的吸光度值(OD600 nm值),以未接种酵母菌种的空白培养基为对照组,培养30 h,以培养时间(x)作为自变量,OD600 nm值(y)为因变量,绘制酵母生长曲线[12],筛选最佳培养基及确定最佳培养时间。
1.3.3 培养基组分优化
(1)单因素试验
在初选出的YEPD培养基的基础上,进行碳源、氮源、无机盐和生长素的优化。
碳源的选择:在只含蛋白胨和酵母膏的YEPD培养基中,分别添加甘蔗糖蜜、葡萄糖、蔗糖和乳糖,按5%(V/V)的接种量将酵母培养液接种于YEPD培养基,于29 ℃、195 r/min、pH 5.5条件下振荡培养12 h,碳源添加量设置20 g/L、30 g/L、40 g/L、50 g/L、60 g/L五个梯度,每组设置3个平行,测定OD600nm值。
复合氮源的选择:分别用20 g/L的酵母膏、蛋白胨、牛肉膏和(NH4)2SO4代替YEPD培养基中的蛋白胨;分别用10g/L的酵母膏、蛋白胨、牛肉膏和(NH4)2SO4代替YEPD培养基中的酵母膏,其他成分不变,得到20g/L蛋白胨+10 g/L酵母膏(YEPD)、20 g/L牛肉膏+10 g/L酵母膏、20 g/L(NH4)2SO4+10g/L酵母膏、10g/L牛肉膏+20g/L蛋白胨、10g/L(NH4)2SO4+20 g/L蛋白胨5种复合氮源,为保证氮源组合的完整性,添加10 g/L(NH4)2SO4+20 g/L牛肉膏进行试验,共6种复合氮源。其他成分不变,以5%(V/V)的接种量在YEPD培养基中接种培养液,于29 ℃、195 r/min、pH 5.5培养条件下振荡12 h,以YEPD培养基为对照组(CK),每组设置3个平行,测定OD600nm值。
无机盐的选择:在YEPD培养基中分别添加KH2PO4、K2HPO4、MgSO4、CuSO4、ZnSO4、NaCl、CaCl2,按照5%(V/V)的接种量将酵母培养液分别接种于上述YEPD培养基,于29 ℃、195 r/min、pH 5.5条件下振荡培养12 h,无机盐设置0.5 g/L、1.0 g/L、1.5 g/L、2.0 g/L、2.5 g/L五个浓度梯度,每组设置3个平行,测定OD600nm值。
生长素的选择:维生素(vitamin B1,VB1)、VB2、肌醇等作为酵母生长所需要的微量元素,只需要添加极少量即可起到促进酵母细胞生长的作用[13],考虑到酵母的生产成本等因素,故不进行添加量优选,设置生长素的添加量均为0.01 g/L[14]。
(2)响应面试验
根据单因素试验结果,选取甘蔗糖蜜(A)、牛肉膏(B)、酵母膏(C)、K2HPO4(D)添加量为自变量,以酿酒酵母生物量(Y1)为响应值,使用Design-Expert 13.0软件进行Box-Behnken试验设计[15],Box-Behnken试验因素与水平见表1。
表1 培养基组分优化Box-Behnken试验因素与水平
Table 1 Factors and levels of Box-Behnken experiments for medium composition optimization
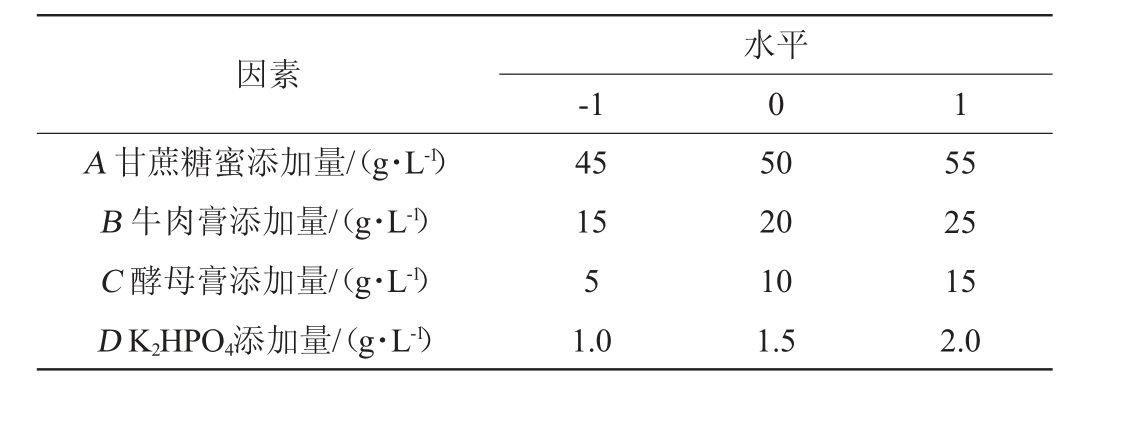
因素A 甘蔗糖蜜添加量/(g·L-1)B 牛肉膏添加量/(g·L-1)C 酵母膏添加量/(g·L-1)D K2HPO4添加量/(g·L-1)-1水平0 1 45 15 5 1.0 50 20 10 1.5 55 25 15 2.0
1.3.4 培养条件优化
(1)单因素试验
在最佳培养基基础上,优化酿酒酵母培养条件。
培养时间的选择:按照5%(V/V)的接种量将酵母培养液接种于YEPD培养基,于29 ℃、195 r/min、pH 5.5条件下,培养时间分别为12 h、14 h、16 h、18 h、20 h、22 h、24 h、26 h、28 h、30 h,每组设置3个平行,测定OD600nm值。
摇床转速的选择:按照5%(V/V)的接种量将酵母培养液接种于YEPD培养基,于29 ℃、pH 5.5条件下培养12 h,摇床转速分别为170 r/min、175 r/min、180 r/min、185 r/min、190 r/min、195 r/min、200 r/min、205 r/min,每组设置3个平行,测定OD600nm值。
培养温度的选择:按照5%(V/V)的接种量将酵母培养液接种于YEPD培养基,于195 r/min、pH 5.5条件下培养12 h,培养温度分别为25 ℃、26 ℃、27 ℃、28 ℃、29 ℃、30 ℃、31 ℃、32 ℃,每组设置3个平行,测定OD600nm值。
培养pH的选择:按照5%(V/V)的接种量将酵母培养液接种于YEPD培养基,于29 ℃、195 r/min培养12 h,培养基pH值分别为4.5、5.0、5.5、6.0、6.5,每组设置3个平行,测定OD600nm值。
(2)响应面试验
根据单因素试验结果,选取培养时间(A)、摇床转速(B)、培养温度(C)、培养pH(D)为自变量,以酿酒酵母生物量(Y2)为响应值,使用Design-Expert13.0软件进行Box-Behnken试验设计,Box-Behnken因素与水平见表2。
表2 培养条件优化Box-Behnken试验因素与水平
Table 2 Factors and levels of Box-Behnken experiments for culture conditions optimization
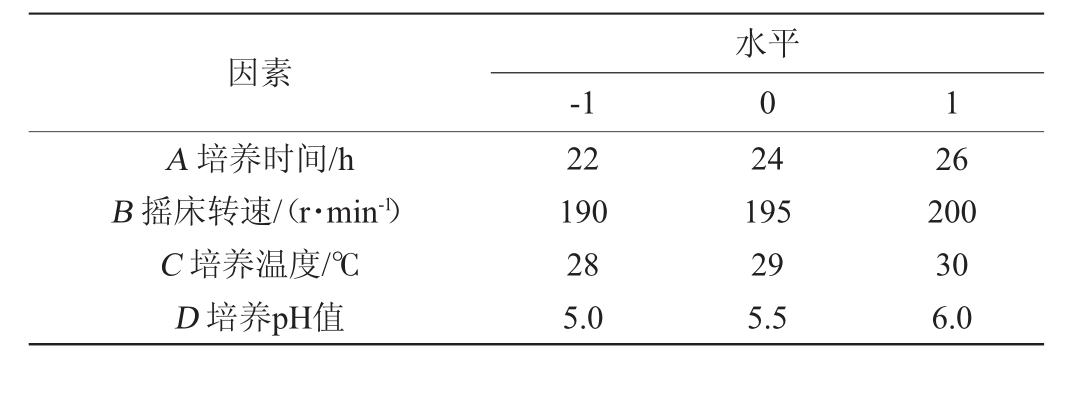
因素A 培养时间/h B 摇床转速/(r·min-1)C 培养温度/℃D 培养pH值-1水平0 1 22 190 28 5.0 24 195 29 5.5 26 200 30 6.0
1.3.5 热激处理参数优化试验
热激处理是指酿酒酵母的发酵温度高于正常的生长温度时,通过对自身基因的调控[16],产生大量的热休克蛋白并改变细胞生理结构,以此来提升酵母细胞对高温的耐受性,从而达到提高干燥后酵母复水存活率的目的[17]。
将酿酒酵母29 ℃、195 r/min培养12 h,4 000 r/min条件下离心10 min,收集菌体,接种于YEPD培养基中培养1 h,再离心收集菌体并置于pH=7.4的磷酸盐缓冲液(phosphate buffer solution,PBS)中混悬,将5 mL样品39 ℃、4 000 r/min恒温振荡培养1.5h,热激温度分别为48℃、50 ℃、52 ℃、54 ℃、56 ℃,热激时间分别为2 min、4 min、6 min、8 min、10 min,并在30 ℃条件下修复培养10 min,在温度40 ℃,真空度0.08 MPa条件下真空干燥6 h,每组设置3个重复,以未进行热激处理的样品为对照组,酵母细胞的复水存活率计算公式如下:

1.3.6 生物量的测定
以未接种酿酒酵母菌的YEPD培养液为对照组,测定接种酿酒酵母菌的YEPD培养液OD600 nm值,生物量计算公式如下[18]:
生物量=(待测酵母培养液OD600 nm值-对应空白酵母培养液OD600 nm值)×对应实验组别稀释倍数
2 结果与分析
2.1 培养基的筛选
酿酒酵母在YEPD培养基、酵母基本培养基、酵母完全培养基、PDB培养基等4种培养基中的生长曲线见图1。
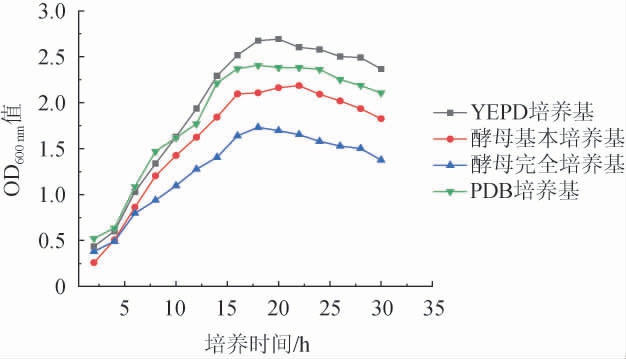
图1 不同培养基中酿酒酵母的生长曲线
Fig.1 Growth curves of Saccharomyces cerevisiae in different media
由图1可知,酵母生物量最高的是YEPD培养基,OD600nm值最高达到了2.561,PDB培养基次之。因此选择YEPD培养基为酵母基础培养基。在培养时间为0~5 h时,酵母细胞在适应新的生长环境,生长较为缓慢,为延缓生长阶段;在培养时间为5~20 h时,酵母细胞的生长繁殖进入对数生长阶段;培养时间>20 h之后,由于培养基中养分的减少,酵母菌生长逐渐趋于稳定,为稳定衰退阶段。为保证酵母细胞的高生长密度和高活性的要求,选择培养时间为24 h的酵母进行后续试验[19]。
2.2 培养基组分优化单因素试验
2.2.1 碳源对酵母生物量的影响
由图2可知,随着碳源添加量的增加,酵母生物量呈先增后减的趋势。其中,当甘蔗糖蜜添加量达到50 g/L时,OD600nm值达到最高的1.523。50 g/L后生物量开始下降,分析可能是因为碳源添加量的不断增加,使得酵母生长代谢加快,导致代谢产物短时间内大量积聚,抑制了酵母细胞的进一步生长[20]。因此,选择甘蔗糖蜜作为酿酒酵母培养基的最佳碳源,最佳添加量为50 g/L。
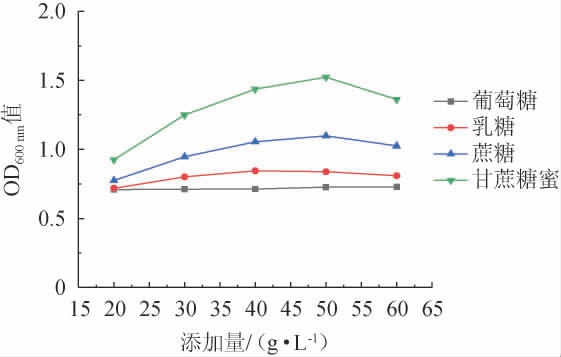
图2 碳源种类及添加量对酵母生物量的影响
Fig.2 Effects of carbon source types and addition on yeast biomass
2.2.2 复合氮源对酵母生物量的影响
由图3可知,20 g/L牛肉膏+10 g/L酵母膏的氮源组合相较于对照组对酵母生物量有明显的提升作用,OD600 nm值最大达到了1.739,其他氮源组合对酵母生长的影响则不显著(P>0.05)。因此,选择20 g/L牛肉膏+10 g/L酵母膏作为最优的复合氮源。
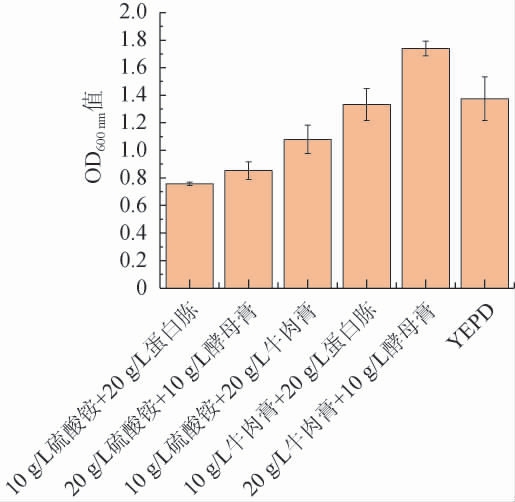
图3 复合氮源对酵母生物量的影响
Fig.3 Effects of compound nitrogen sources on yeast biomass
2.2.3 无机盐对酵母生物量的影响
由图4可知,无机盐对酵母生物量的影响呈先增后减的趋势,其中,K2HPO4在添加量为1.5 g/L时,对酵母生长的影响最大,OD600 nm值为1.329,KH2PO4对酵母的影响次之,其他无机盐对酵母生长的影响有限,OD600 nm值均未超过1。因此,选择K2HPO4作为最佳的无机盐种类,添加量为1.5 g/L。
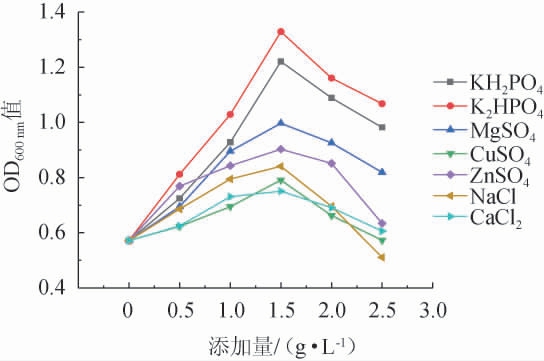
图4 无机盐种类及添加量对酵母生物量的影响
Fig.4 Effects of inorganic salt types and addition on yeast biomass
2.3 培养基组分优化响应面试验
2.3.1 回归模型的建立及方差分析
使用Design-Expert13.0,根据Box-Behnken试验的中心组合试验设计原理,对甘蔗糖蜜(A)、牛肉膏(B)、酵母膏(C)和K2HPO4(D)添加量进行响应面优化,响应值为酵母生物量(Y1),培养组分的Box-Behnken试验设计与结果见表3,回归模型方差分析见表4。
表3 培养基组分优化Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken tests for medium composition optimization
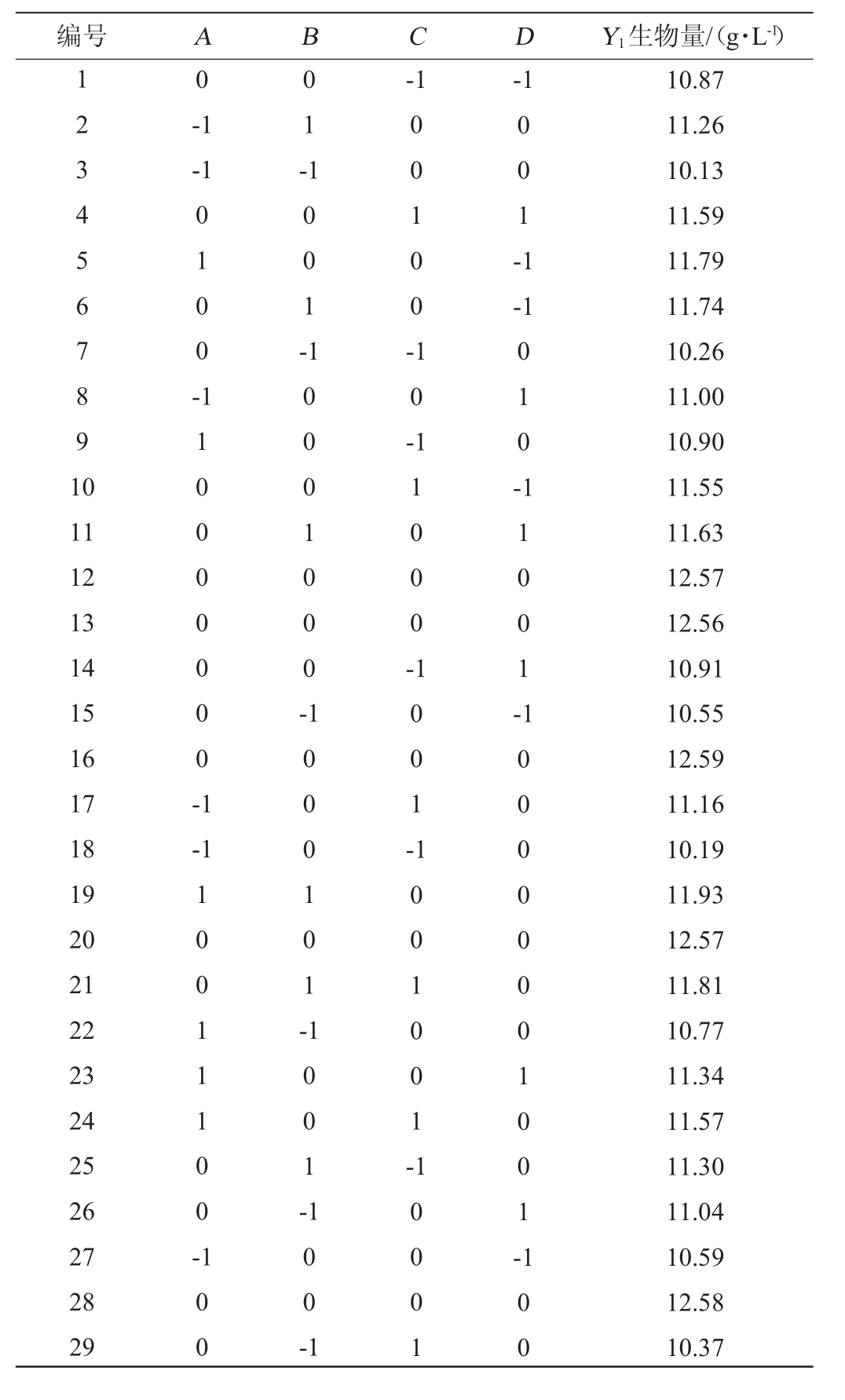
编号 A B C D Y1生物量/(g·L-1)1234567891 0 0-1-1-1-1 0 1 -0 1 0 0 -1 0 0 1 -0 0 1 0 0 -0 0 1 -1-1 0 1 0 -1 0 0 0 1 0 0 0 -11 0 00 0 00 0-1 1 0 -11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1 1 0 0 0 -11 001 --1 1 0 0 1 -1 001 110 0-1 0 0 0 1 0 1 -1 0 0 1 -1 0 0 1 0 0 1 -10 0 1 0 0 -1 1 0 00 1 1 00 0 00 0 01 001 -100 10.87 11.26 10.13 11.59 11.79 11.74 10.26 11.00 10.90 11.55 11.63 12.57 12.56 10.91 10.55 12.59 11.16 10.19 11.93 12.57 11.81 10.77 11.34 11.57 11.30 11.04 10.59 12.58 10.37
表4 培养基组分优化回归模型方差分析
Table 4 Variance analysis of regression model for medium composition optimization
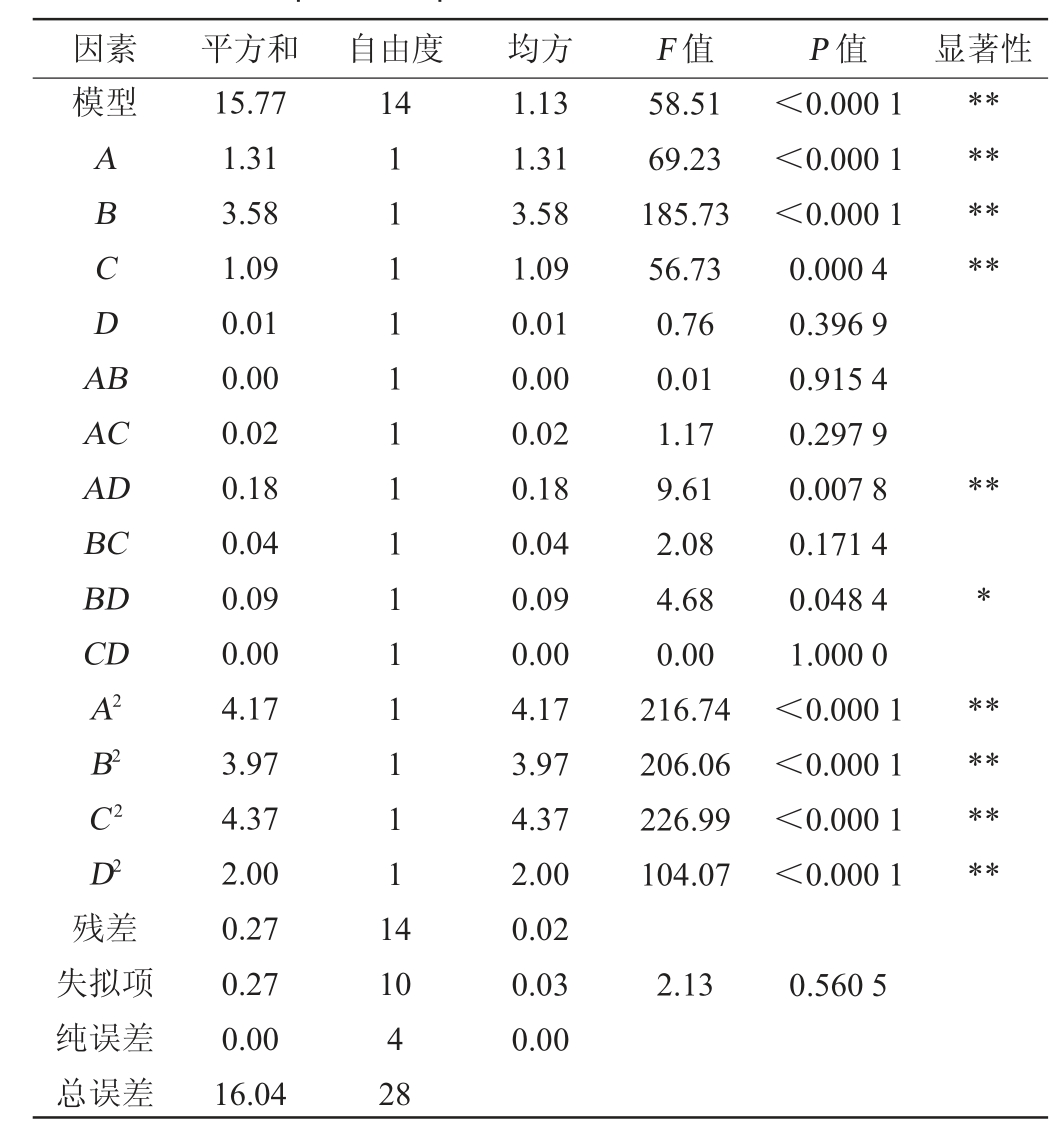
注:“*”表示对结果影响显著(P<0.05);“**”表示对结果影响极显著(P<0.01)。下同。
因素 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B********AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总误差15.77 1.31 3.58 1.09 0.01 0.00 0.02 0.18 0.04 0.09 0.00 4.17 3.97 4.37 2.00 0.27 0.27 0.00 16.04 111111111111111 4 58.51 69.23 185.73 56.73 0.76 0.01 1.17 9.61 2.08 4.68 0.00 216.74 206.06 226.99 104.07<0.000 1<0.000 1<0.000 1 0.000 4 0.396 9 0.915 4 0.297 9 0.007 8 0.171 4 0.048 4 1.000 0<0.000 1<0.000 1<0.000 1<0.000 1***********10 4 28 1.13 1.31 3.58 1.09 0.01 0.00 0.02 0.18 0.04 0.09 0.00 4.17 3.97 4.37 2.00 0.02 0.03 0.00 2.13 0.560 5
使用Design-Expert 13.0对表3中的数据进行拟合分析,得培养基组分对酵母生物量影响的二元多项回归方程为:
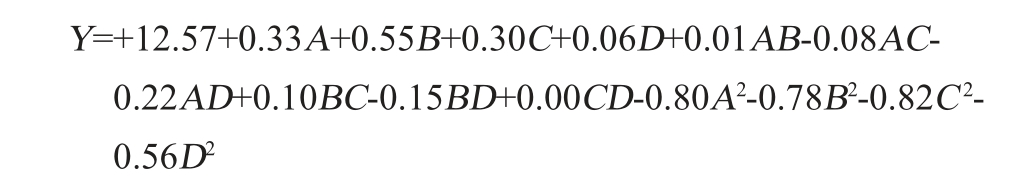
由表4可知,模型的P<0.000 1,极显著,说明该模型有效,失拟项P=0.560 5,失拟项不显著(P>0.05),说明该模型考察因素和响应值之间的函数关系极显著,几乎不存在失拟现象;决定系数R2和调整决定系数R2adj分别为0.983 2和0.966 4,说明该模型拟合程度好,试验误差较小,适用于酿酒酵母培养基组分的优化及预测。由P值可知,一次项A、B、C,二次项A2、B2、C2、D2及交互项AD对酿酒酵母生物量的影响极显著(P<0.01),交互项BD对酿酒酵母生物量的影响显著(P<0.05),其他项对酿酒酵母生物量的影响不显著(P>0.05)。由F值可知,各因素对酿酒酵母生物量的影响顺序为牛肉膏添加量>甘蔗糖蜜添加量>酵母膏添加量>K2HPO4添加量。
2.3.2 影响因子交互作用分析
甘蔗糖蜜、牛肉膏、酵母膏和K2HPO4添加量之间的交互效应对酿酒酵母生物量影响的响应曲面和等高线见图5。
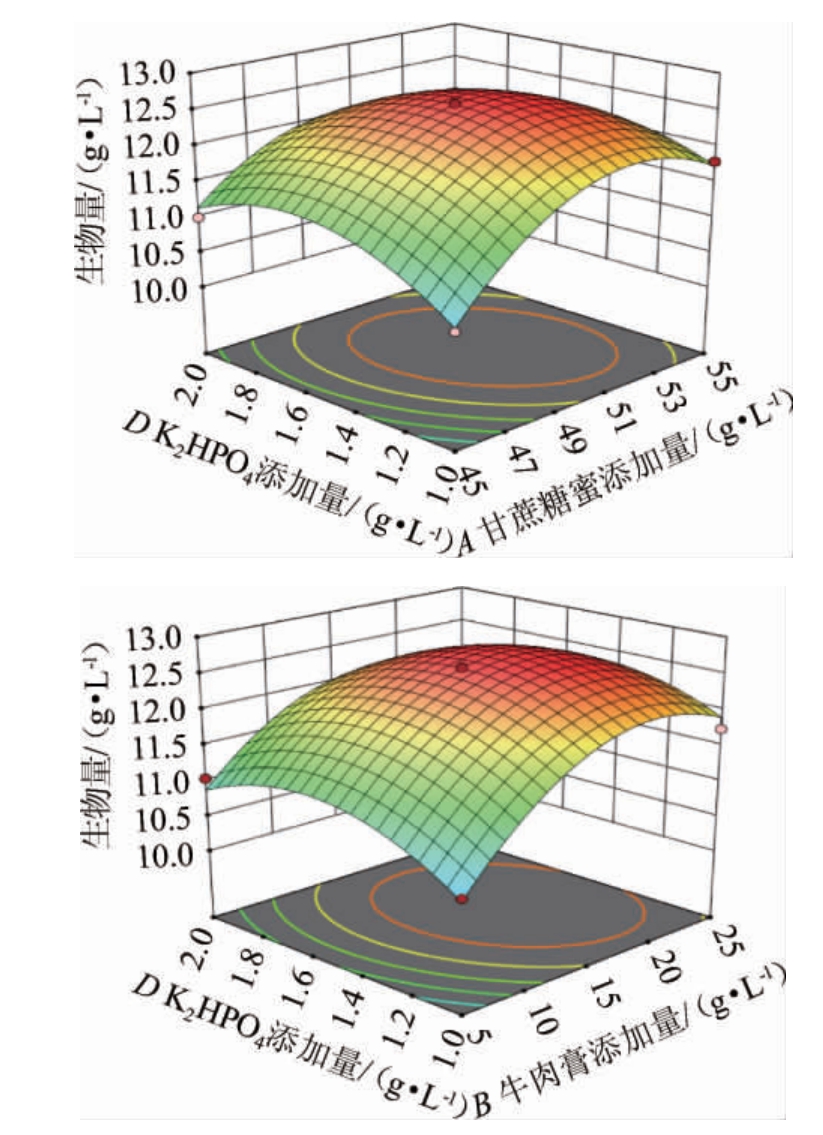
图5 各因素间交互作用对酵母生物量影响的响应曲面及等高线
Fig.5 Response surface plots and contour lines of effects of interaction between various factors on yeast biomass
响应曲面图能够直观的反应出两个因素的交互作用对响应值影响程度的大小,响应曲面越陡,等高线越密集,对应两因素对响应值的影响越显著,等高线越接近椭圆,表明两因素的交互作用对响应值的影响越强。由图5可知,甘蔗糖蜜和K2HPO4(AD)、牛肉膏和K2HPO4(BD)的响应曲面陡峭,等高线密集且相较其他因素更接近于椭圆,表明两因素的交互作用对酵母生物量影响较强,这与方差分析结果一致。
2.3.3 响应面验证试验
利用Design-Expert13.0软件,对生物量求极值,得到培养基组分为甘蔗糖蜜添加量51.04g/L、牛肉膏添加量14.32 g/L、酵母膏添加量15.09 g/L、K2HPO4添加量1.31 g/L。在此条件下,酵母生物量预测值为12.59g/L。为了方便实际操作,修正上述培养基组分为甘蔗糖蜜添加量51 g/L、牛肉膏添加量14 g/L、酵母膏添加量15 g/L、K2HPO4添加量1.3 g/L。最佳培养基组分为甘蔗糖蜜51 g/L、牛肉膏14 g/L、酵母膏15 g/L、K2HPO4 1.3 g/L、VB1 0.01 g/L、VB2 0.01 g/L、肌醇0.01 g/L。在此条件下进行3次平行验证试验,得到的酵母生物量实际值为12.46 g/L,与模型预测的理论值12.59 g/L相对误差为0.64%,误差较小,说明该模型有效,可以较好地预测酿酒酵母的生物量,所得到的酿酒酵母生物量相较于优化前提升了32.73%。
2.4 培养条件优化单因素试验
2.4.1 培养时间对酵母生长的影响
由图6可知,在培养时间为12~20 h为对数生长期,培养液中营养成分和能量充足,酵母生长迅速,20 h后进入稳定衰退期,酵母生物量保持稳定并缓慢下降。为保证酵母细胞活性稳定及保证生物量和存活率维持在高水平值[21],选择最适培养时间为24 h。

图6 培养时间对酵母生物量的影响
Fig.6 Effect of culture time on yeast biomass
2.4.2 摇床转速对酵母生长的影响
由图7可知,酵母生物量随着摇床转速的增加先增后减。分析认为,转速较低时,培养液中含氧量不足,影响酵母生长,同时,CO2和乙醇等副产物会大量堆积,导致培养液中的酸碱平衡被破坏,进一步抑制了酵母生长;转速较高时,培养液中的剪切力增大,导致细胞破裂和死亡,同时会加快营养物质和能量的耗散,细胞生长受到抑制。因此,选择最适摇床转速为195 r/min。
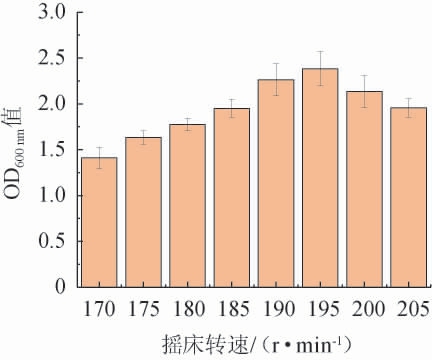
图7 摇床转速对酵母生物量的影响
Fig.7 Effect of shaker speed on yeast biomass
2.4.3 培养温度对酵母生长的影响
由图8可知,酵母生物量随着培养温度的增加先增后减。分析认为,温度较低时,培养液中营养物质向酵母的传输受到影响,酵母生长缓慢;较高温度则会导致细胞内部相关酶的活性降低,抑制酵母细胞对营养物质和能量的吸收,导致酵母生长受限[22]。因此,选择最适培养温度为29 ℃。
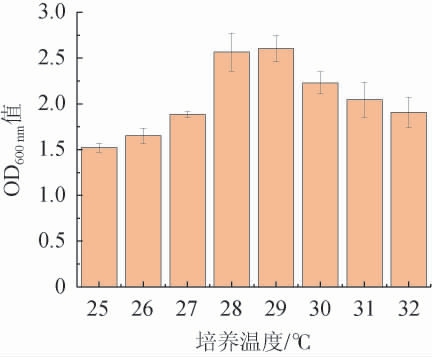
图8 培养温度对酵母生物量的影响
Fig.8 Effect of culture temperature on yeast biomass
2.4.4 培养pH对酵母生长的影响
由图9可知,酵母生物量随着pH值的增加先增后减,在pH为5.5时,OD600nm值达到最大2.741。分析认为,酿酒酵母属于嗜酸性菌种,但当环境pH过低时,发酵过程中产生的乙酸会诱导酵母细胞发生程序化死亡[23];当培养液中pH值超过5.5时,培养液中的氢离子浓度超过酵母生存的最佳浓度范围,阻碍了酵母细胞的生长繁殖[24]。因此,选择最适pH值为pH 5.5。
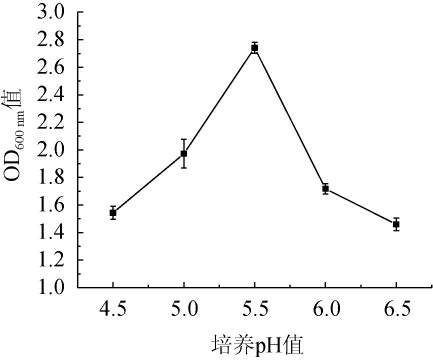
图9 培养pH值对酵母生物量的影响
Fig.9 Effect of culture pH on yeast biomass
2.5 培养条件优化响应面试验
2.5.1 回归模型的建立及方差分析
使用Design-Expert13.0软件,根据Box-Behnken试验的中心组合试验设计原理,对培养时间(A)、摇床转速(B)、培养温度(C)和培养pH值(D)的培养条件进行响应面优化分析,响应值为酿酒酵母菌的生物量(Y2),培养条件的Box-Behnken试验设计与结果见表5,回归模型方差分析见表6。
表5 培养条件优化Box-Behnken试验设计及结果
Table 5 Design and results of Box-Behnken experiments for culture conditions optimization
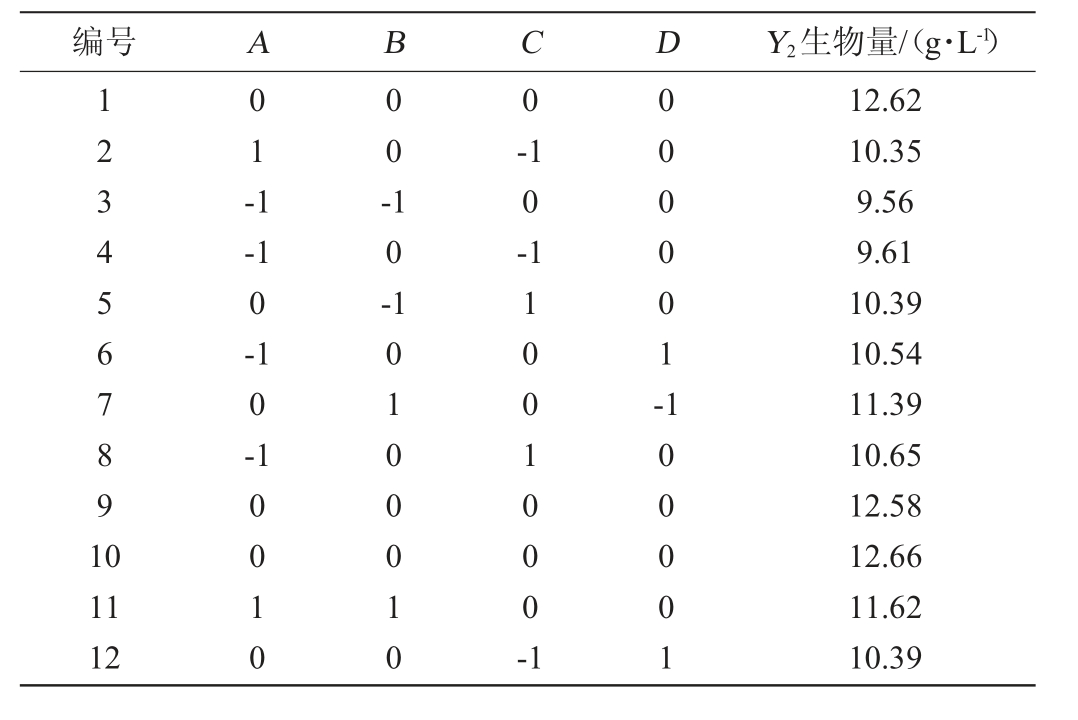
编号 A B C D Y2生物量/(g·L-1)1234567891 0 01-1 00-0-1 0-1 0-1 10--1 0-1 000001-11 12 0010 10100010 1001000-1 100001 12.62 10.35 9.56 9.61 10.39 10.54 11.39 10.65 12.58 12.66 11.62 10.39
续表
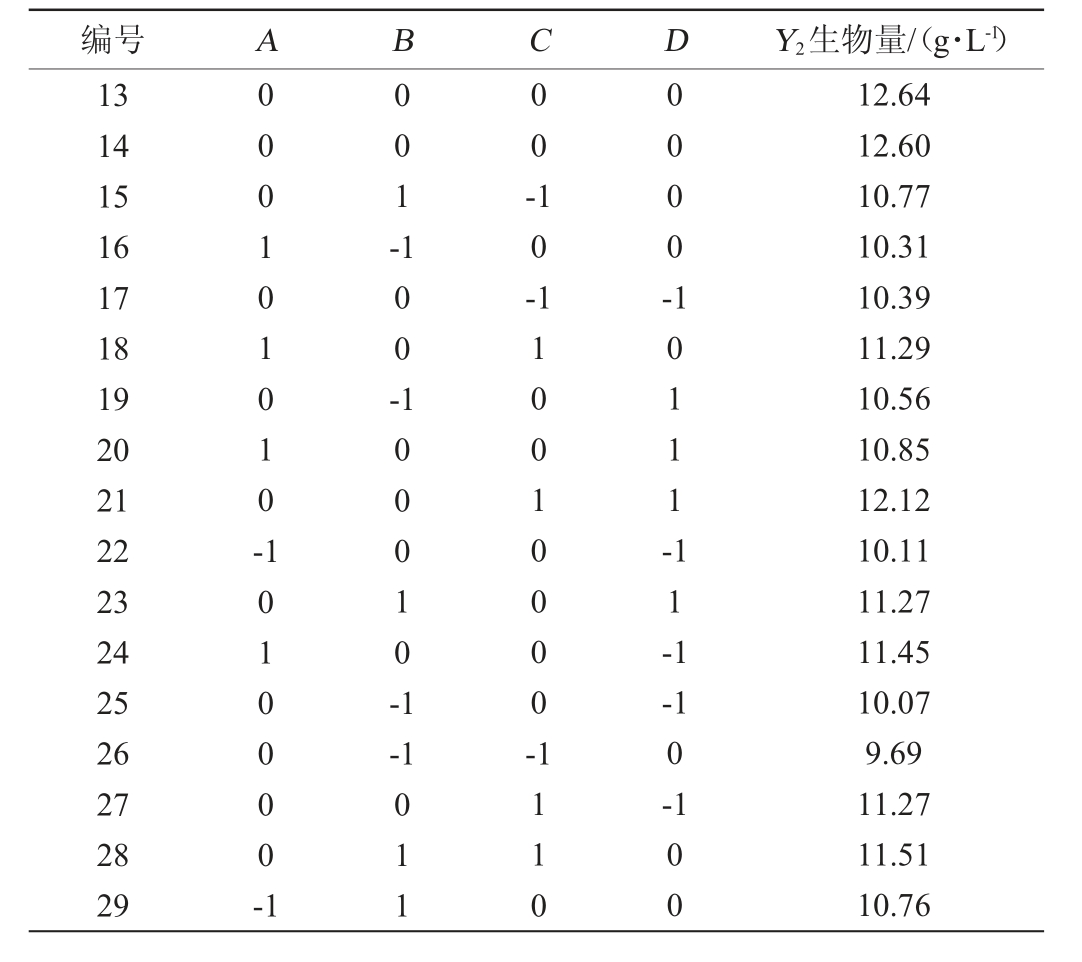
编号 A B C D Y2生物量/(g·L-1)13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 000101010-001-00-100-10-0000-1010000-1 100010-1 10111-11-1-1 110010000-011 1110-1 0-1 00 12.64 12.60 10.77 10.31 10.39 11.29 10.56 10.85 12.12 10.11 11.27 11.45 10.07 9.69 11.27 11.51 10.76
表6 培养条件优化回归模型方差分析
Table 6 Variance analysis of regression model for culture conditions optimization
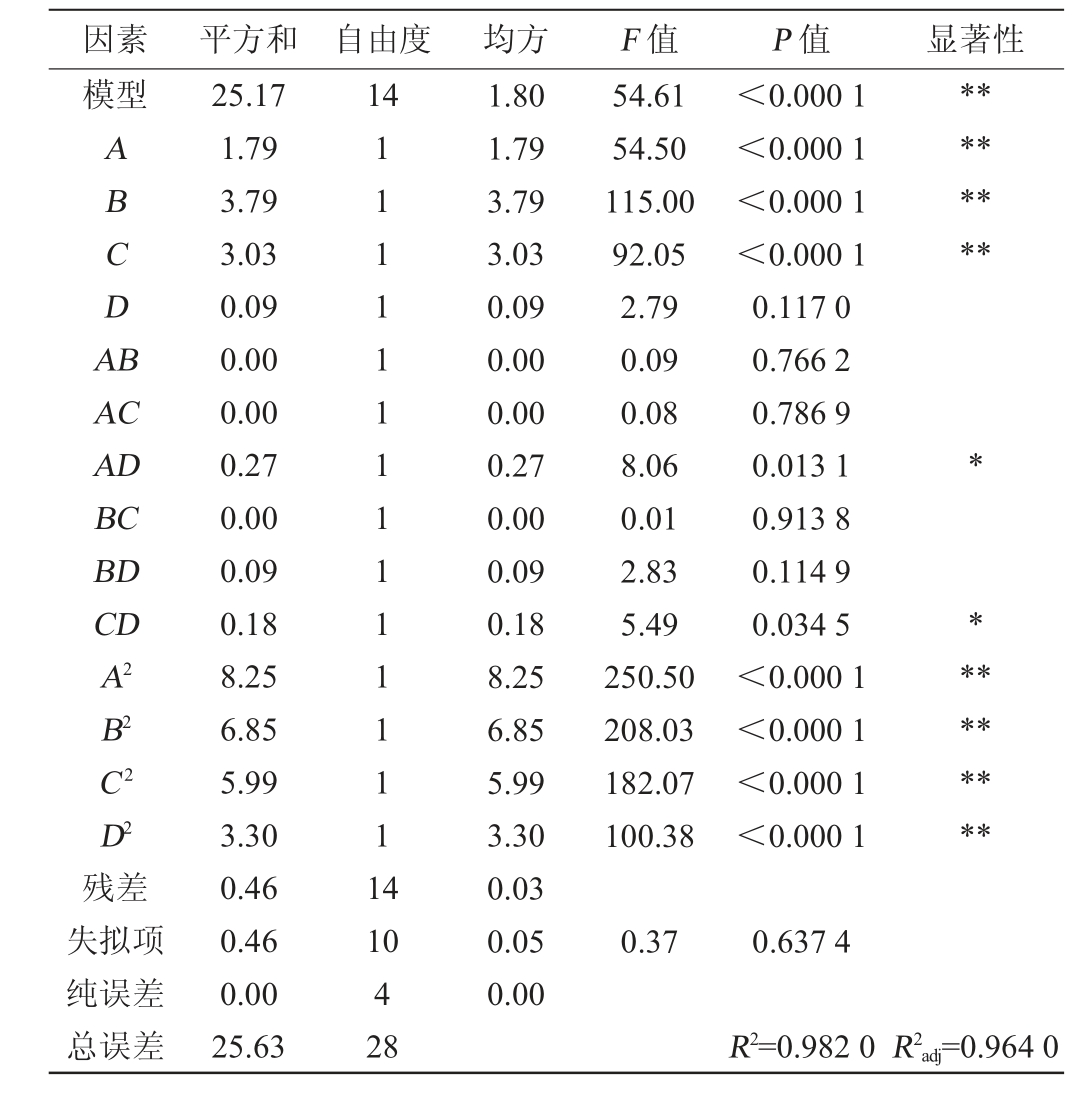
因素 平方和 自由度 均方 F 值 P 值 显著性模型14 ABCDA B********AC AD BC BD CD A2 B2 C2 D2残差失拟项纯误差总误差25.17 1.79 3.79 3.03 0.09 0.00 0.00 0.27 0.00 0.09 0.18 8.25 6.85 5.99 3.30 0.46 0.46 0.00 25.63 111111111111111 4 54.61 54.50 115.00 92.05 2.79 0.09 0.08 8.06 0.01 2.83 5.49 250.50 208.03 182.07 100.38<0.000 1<0.000 1<0.000 1<0.000 1 0.117 0 0.766 2 0.786 9 0.013 1 0.913 8 0.114 9 0.034 5<0.000 1<0.000 1<0.000 1<0.000 1**********10 4 28 1.80 1.79 3.79 3.03 0.09 0.00 0.00 0.27 0.00 0.09 0.18 8.25 6.85 5.99 3.30 0.03 0.05 0.00 0.37 0.637 4 R2=0.982 0 R2adj=0.964 0
对Box-Behnken试验设计及结果表5中的数据进行拟合分析,得出培养时间、培养温度、培养pH和摇床转速对生物量影响的二元多项回归方程为:
Y=+12.62+0.39A+0.56B+0.50C+0.09D+0.03AB-0.03AC-0.26AD-0.01BC-0.15BD+0.21CD-1.13A2-1.03B2-0.96C 2-0.71D2
由表6可知,模型的P<0.000 1,极显著,说明该模型有效,失拟项P=0.637 4,失拟项不显著(P>0.05),说明该模型的考察因素和响应值之间的函数关系极显著,几乎不存在失拟现象;决定系数R2和调整决定系数R2adj分别为0.982 0和0.964 0,说明该模型拟合程度好,试验误差较小,适用于酿酒酵母培养条件的优化及预测。由P值可知,一次项A、B、C和二次项A2、B2、C2、D2对酿酒酵母生物量的影响极显著(P<0.01),交互项AD、CD对酿酒酵母生物量的影响显著(P<0.05),其他项对酿酒酵母生物量的影响不显著(P>0.05)。由F值可知,各因素对酿酒酵母生物量的影响顺序为摇床转速>培养温度>培养时间>培养pH值。
2.5.2 影响因子交互作用分析
培养时间、温度、培养pH值和摇床转速间的交互效应对酵母生物量影响的响应面和等高线见图10。

图10 各因素间交互作用对酵母生物量影响的响应面及等高线
Fig.10 Response surface plots and contour lines of effects of interaction between various factors on yeast biomass
由图10可知,培养时间和培养pH(AD)、培养温度和培养pH(CD)的响应曲面陡峭,等高线密集且比其他因素更接近于椭圆,表明两因素的交互作用对酵母生物量影响较强,这与方差分析结果一致。
2.5.3 培养条件响应面验证试验
利用Design-Expert13.0软件,得到最佳培养条件为培养时间22.35 h,摇床转速195.20 r/min,培养温度28.65 ℃,培养pH值为5.49。在此条件下,酵母生物量预测值为11.25 g/L。为了方便实际操作,修正各培养条件为培养时间22 h、摇床转速195 r/min、培养温度29 ℃、培养pH值为5.5。在此条件下进行3次平行验证试验,酵母菌生物量实际值为11.32 g/L,与模型预测的理论值11.25 g/L的相对误差为0.62%。误差较小。结果表明该模型有效,可以较好地预测酿酒酵母的生物量,所得酿酒酵母菌生物量相较于优化前提升了36.27%,所得干燥后复水存活率为86.3%,相较于优化前提升了10.26%。
2.6 热激处理参数优化
由图11可知,不同热激温度作用下的酿酒酵母复水存活率随着热激时间的增加呈先增后减的趋势。其中,热激温度54 ℃对酵母菌存活率的影响最为明显,当热激时间为8 min时复水存活率达到最高86.3%,超过8 min后存活率开始下降。结果表明,酿酒酵母经过热激处理能够提高干燥后的复水存活率,但当温度过高或时间过长时,存活率会出现下降[25]。因此,选择最适热激温度54 ℃、热激时间8 min。
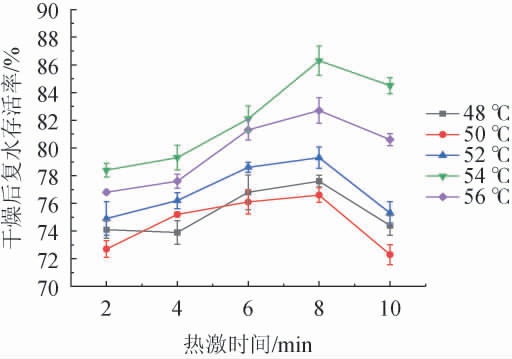
图11 热激时间对酵母存活率的影响
Fig.11 Effect of heat shock time on yeast survival rate
3 结论
本研究以实验室分离保存的酿酒酵母为对象,经过培养基初选后,通过单因素和响应面试验优化酿酒酵母菌的培养基组分和培养条件。优化后的培养基组分为甘蔗糖蜜51 g/L、牛肉膏14 g/L、酵母膏15 g/L、K2HPO4 1.3 g/L、VB1 0.01 g/L、VB2 0.01 g/L、肌醇0.01 g/L。在此优化条件下,酵母菌的生物量为12.46 g/L,比优化前所得到的生物量提高了32.73%。在培养基组分的基础上,优化培养条件为培养时间22 h、摇床转速195 r/min、培养温度29 ℃、培养pH值为5.5,热激温度54 ℃、热激时间8 min,所得到的酵母菌生物量为11.32 g/L,比优化前提升了36.27%,复水存活率提高了10.26%。该研究可为深入研究酿酒酵母的培养工艺提供理论指导。
[1]张华东.白酒发酵过程中主要微生物对酿酒酵母酯醇代谢的影响[D].天津:天津科技大学,2020.
[2]唐洁,杨强,刘源才,等.白酒中产风味微生物研究进展[J].中国酿造,2021,40(11):15-20.
[3] MELISSA C,KRICHELLE M,IAN M.Lupin peptone as a replacement for animal-derived peptone in rich culture media for yeast[J].J Microbiol Meth,2015,109:39-40.
[4] BRUDER S, REIFENRATH M, THOMIK T, et al.Parallelised online biomass monitoring in shake flasks enables efficient strain and carbon source dependent growth characterisation of Saccharomyces cerevisiae[J].Microb Cell Fact,2016,15(1):1-14.
[5]宋洋洋,柴鸿勋,韩蕴琦,等.响应面法优化产朊假丝酵母培养及干燥工艺[J].基因组学与应用生物学,2019,38(5):2094-2103.
[6]南博.活性酿酒酵母的真空干燥技术研究[D].杨凌:西北农林科技大学,2014.
[7]李婷婷,陈雪,程涛,等.基于响应面法优化酿酒酵母培养体系[J].中国酿造,2020,39(11):126-131.
[8]BAE S M,HAN S M,LEE J S.Screening of anti-inflammatory compoundproducing wild yeasts and their microbiological characteristics[J].Kor J Mycol,2017,45(3):212-223.
[9]李雪雁,赵华.酒精发酵副产物对酵母菌生长的影响[J].酿酒,2001,26(6):58-60.
[10] KIM J, KIM K H.Effects of minimal media vs.complex media on the metabolite profiles of Escherichia coli and Saccharomyces cerevisiae[J].Process Biochem,2017,57(4):64-71.
[11]南君勇.真空冷冻干燥技术制备酵母菌菌粉的研究[D].天津:天津大学,2007.
[12]苏昊,梁璋成,林晓姿,等.酿酒酵母高密度增殖酒糟多肽糖蜜培养基优化[J].福建农业学报,2021,36(5):610-618.
[13]张馨文,彭帅,高娉娉,等.葡萄汁有孢汉逊酵母BF-345的高密度培养研究[J].食品与发酵科技,2022,58(3):9-18.
[14]金海炎.猕猴桃酒优良酿酒菌株的选育及混菌发酵工艺优化研究[D].南阳:南阳师范学院,2022.
[15] KITTISUBAN P, RITTHIRUANGDEJ P, SUPHANTHARIKA M.Optimization of hydroxypropyl methyl cellulose,yeast β-glucan,and whey protein levels based on physical properties of gluten-free rice bread using response surface methodology[J].LWT-Food Sci Technol,2014,57(2):738-748.
[16]庄若茹,张巧玲,王俊国.不同应激处理方式对乳酸菌喷雾干燥过程中存活率的影响及内在机制[J].乳业科学与技术,2022,45(1):55-60.
[17]安璟.乳酸菌胁迫反应的影响因素及其耐热性的研究[D].武汉:华中农业大学,2019.
[18]李颖.高生物量富硒酵母的制备和性能改善研究[D].无锡:江南大学,2021.
[19]黄章娆,王昱,崔沛杰,等.响应面法优化富锌酵母培养条件[J].中国酿造,2020,39(11):97-102.
[20] FRÎNCU M, SOREANU G, CRETESCU I.Obtaining active dry wine yeast biomass at the micropilot level[C]//Life sciences in the dialogue of generations: connections between universities, academia and business community.2022:202.
[21]李聪.酿酒酵母培养条件及发酵培养基的优化[J].中国农学通报,2014,30(9):302-306.
[22]韦梦婷,王英,刘文瑞,等.微囊化酿酒酵母FM-S-115的高密度培养[J].食品工业科技,2020,41(15):205-210,224.
[23] NARENDRANATH N V, POWER R.Relationship between pH and medium dissolved solids in terms of growth and metabolism of lactobacilli and Saccharomyces cerevisiae during ethanol production[J].Appl Environ Microbiol,2005,71(5):2239-2243.
[24]赵小丽,甄玉国,王兰惠,等.酿酒酵母高密度有氧发酵条件的研究[J].饲料工业,2015,36(S1):50-54.
[25]杨华.高温和氧化条件下酵母细胞应激产生活性物质的研究[D].天津:天津科技大学,2004.