倍半萜是萜类家族重要的一类化合物,植物来源的倍半萜化合物对植物的生理活动中起到重要的调节作用。这类倍半萜化合物具有独特的风味、香味、抗菌、吸引力和排斥活性,提供了植物的生存特性[1-3]。β-石竹烯是一种重要的倍半萜化合物,不仅具有重要的香精香料和药品开发价值,也是一种潜在的高能量密度生物燃料。β-石竹烯具有温和丁香香气,主要存在于植物人参、丁香花等植物中[4]。β-石竹烯被国标GB2760—2014《食品添加剂使用标准》批准为允许使用的食品香料,用于调配丁香、胡椒、肉豆蔻等食用香精,也可用于合成如乙酰基石竹烯等更有价值的香料;除了用作香料物质外,β-石竹烯还有众多卓越的生理活性,如抗癌、抗炎、抗氧化及保护神经等[5-6];与其他倍半萜一样是一种潜在的高能量密度的新型生物燃料[7-8]。因此,β-石竹烯具有很高的研究意义和开发价值。
β-石竹烯等倍半萜目前主要依赖植物提取和化学合成两种方法来获取。其中植物提取法会受到季节的限制,且因植物生长周期较长与产品含量低,无法保证产品的集约化、规模化生产。化学合成法会有化学试剂的残留以及环境污染的问题。这两种方式都有其限制因素,而生物技术合成法因具有成本低、周期短、能稳定供应、环境友好与可持续发展等优势,近年来越来越受到研究人员的重视[9]。β-石竹烯的生物合成途径已被解析,与其他萜类一样,其生物合成共同的前体是异戊烯焦磷酸(isopentenyl diphosphate,IPP)和二甲基烯丙基焦磷酸(dimethylallyl diphosphate,DMAPP)这两个异戊二烯基单元,其中IPP和DMAPP互为同分异构体[10]。目前研究发现,自然界中有两种途径可以合成IPP和DMAPP,分别是主要在原核生物和植物中存在的2-甲基赤藓糖醇-4-磷酸(2-methyl-D-erythritol-4-phosphate,MEP)途径和主要在真核生物中存在的甲羟戊酸(mevalonate,MVA)途径。MVA途径合成β-石竹烯见图1。
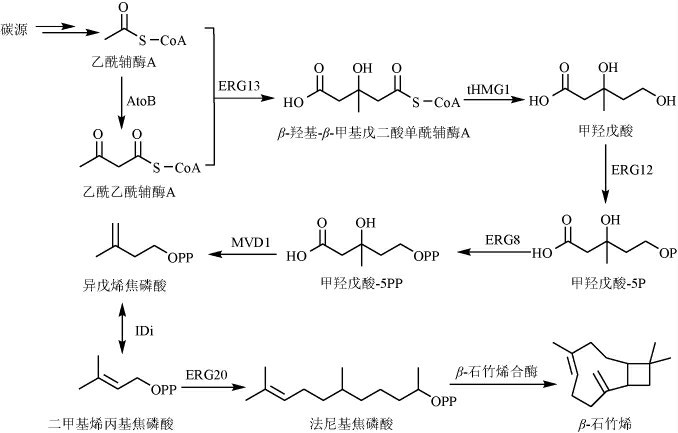
图1 经由MVA途径的β-石竹烯的生物合成途径
Fig.1 Biosynthesis pathway of β-caryophyllene via MVA pathway
目前报道较多的是经由MVA途径加上β-石竹烯合成酶的工程菌合成β-石竹烯的研究。如YANG J M等[11]将来自黄花蒿、拟南芥和玉米的β-石竹烯合成酶基因分别引入代谢工程改造的大肠杆菌(Escherichia coli)中,最终利用黄花蒿β-石竹烯合成酶基因构建的工程菌在补料分批发酵条件下产量最高,β-石竹烯产量达到1.52 g/L。李晓东等[12]将黄花蒿来源的β-石竹烯合成酶基因引入酿酒酵母(Saccharomyces cerevisiae),结合酿酒酵母底盘菌株的改造,工程菌在分批补料发酵β-石竹烯产量达到2 949.1 mg/L。CHENG T等[13]在烟草中发现了一个新的β-石竹烯合成酶TPS7基因,将该基因引入代谢工程改造的大肠杆菌中,β-石竹烯分批补料发酵产量达5.142 g/L。但目前已报道的β-石竹烯产量距离工业化生产还有一定的距离,为进一步提高其产量以满足工业化生成需求,有必要找到效率更高的β-石竹烯合成酶,并优化工程菌代谢途径,进一步提高β-石竹烯产量。
酿酒酵母因其生物安全性高、容易培养等优点在代谢工程高产萜类的成功案例较多,如工程酿酒酵母高产番茄红素[14-15]、青蒿酸[16]、法尼烯[17-18]、瓦伦烯[19]、佛手烯[20]等高附加值萜类化合物,已经走上了生物技术工业化生产的道路。因此本研究选择酿酒酵母作为细胞工厂生产β-石竹烯,从热带经济作物橡胶树中挖掘新的高活性β-石竹烯合成酶基因,并将其在高产萜类前体的酿酒酵母底盘菌株中进行异源表达,结合优化的酿酒酵母发酵技术提升优化工程菌生产性能,最终实现高产β-石竹烯。本研究旨在为利用生物技术工业化生产β-石竹烯奠定基础,也为生物技术高产其他高附加值化合物提供指导和参考。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株、质粒和引物
酿酒菌株原始菌株CEN.PK2-1D、高产萜类前体酿酒酵母底盘菌株YZL141和JCR27[14,21]、酿酒酵母表达质粒pRS426:本实验室保存;引物合成与测序:武汉金开瑞生物工程有限公司。
1.1.2 化学试剂
葡萄糖、硫酸铵、七水硫酸镁、硫酸钠、正己烷、浓盐酸、无水乙醇、氢氧化钠、氯化钠、肉豆蔻酸异丙酯(isopropyl myristate,IPM)(均为分析纯):国药集团化学试剂有限公司;胰蛋白陈、酵母抽提物(均为生化试剂):安琪酵母股份有限公司;PrimeSTAR Max DNA Polymerase、限制性内切酶、质粒提取试剂盒、脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:宝生物工程(大连)有限公司;DNA胶回收试剂盒、同源重组试剂盒:南京诺维赞生物科技有限公司;β-石竹烯标准品(纯度>98%):美国Sigma-Aldrich公司。
1.1.3 培养基
无氨基酸酵母氮源培养基、SC尿嘧啶缺陷培养基:生工生物工程(上海)股份有限公司。
LB(氨苄抗性)液体培养基:胰蛋白胨10 g/L,酵母提取物5 g/L,氯化钠10 g/L。121 ℃蒸汽灭菌15 min,待冷却后添加氨苄青霉素至终质量浓度为50 μg/mL。
酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)液体培养基:葡萄糖20 g/L,胰蛋白胨20 g/L,酵母抽提物10 g/L。121 ℃蒸汽灭菌15 min。
YPD固体培养基:在YPD液体培养基中加入18 g/L的琼脂。121 ℃蒸汽灭菌15 min。
酵母浸出粉胨葡萄糖半乳糖(yeast extract peptone dextrose galactose,YPDG)培养基:在YPD液体培养基的基础上加入10 g/L的半乳糖。121 ℃蒸汽灭菌15 min。
酿酒酵母筛选氨基酸缺陷型液体培养基(SC-尿嘧啶缺陷培养基):6.7 g/L的无氨基酸酵母氮源,0.75 g/L SC尿嘧啶缺陷培养基。121 ℃蒸汽灭菌15 min。
酿酒酵母筛选氨基酸缺陷型固体培养基:在酿酒酵母筛选氨基酸缺陷型液体培养基中加入18 g/L的琼脂。121 ℃蒸汽灭菌15 min。
酿酒酵母全合成培养基:葡萄糖40 g/L,(NH4)2SO4 13 g/L,KH2PO4 8 g/L,MgSO4·7H2O 6.2 g/L。121 ℃蒸汽灭菌15 min,在使用前加入10 mL/L金属离子母液和12 ml/L的维生素母液。并加入10 g/L的肉豆蔻酸异丙酯(isopropyl myristate,IPM)作为覆盖剂。
维生素母液:生物素0.05 g/L,泛酸钙1 g/L,烟酸1 g/L,肌醇25 g/L,盐酸硫胺素1 g/L,盐酸吡哆醛1 g/L,4-氨基苯甲酸0.02 g/L。
金属离子母液:乙二胺四乙酸(ethylenediaminetetraacetic acid,EDTA)15 g/L,ZnSO4·7H2O(3.75 g/L),MnCl2·4H2O(0.32 g/L),CuSO4·5H2O(0.95 g/L),CoCl2·6H2O(0.47 g/L),Na2MoO4·2H2O(0.48 g/L),CaCl2·2H2O(2.9 g/L),FeSO4·7H2O(2.8 g/L)。维生素母液和金属离子母液过滤除菌。
1.2 仪器与设备
PL303电子天平、FE20实验室pH计:梅特勒-托利多仪器公司;Nanodrop 2000c微量紫外可见光光度计、TSQTM 9000三重四极杆气质联用(gas chromatography-mass spectrometry,GC-MS)仪:赛默飞世尔科技公司;Bio-Rad聚合酶链式反应(polymerase chain reaction,PCR)仪;PowerPac电泳仪:伯乐生命医学产品(上海)有限公司;5425R控温微型高速离心机:艾本德(中国)有限公司;BLBIO-5GJ 5 L生物发酵罐:上海百仑生物科技有限公司;SBA-40D生物传感分析仪:山东省科学院;SW-CJ-2FD超净工作台:苏州净化设备有限公司;SH-250恒温生化培养箱:上海森信实验仪器有限公司;ZHWY-211C恒温摇床:上海智城分析仪器制造有限公司。
1.3 实验方法
1.3.1 载体和菌株构建
通过PCR方法扩增目的片段。操作步骤如下:首先利用引物P1/P2(P1:5'-GGGCCCGGGCGTCGACATGGCATTTCAAGATTCAGCTTTTTTC-3';P2:5'-GTACCAAGCTTACTCGAGTCAGAGCACAGGGTCCTTAA-3')克隆橡胶树HbBACS基因片段;利用引物P3/P4(P3:5'-GGGCCCGGGCGTCGACATGGCTTTTCAAGATTCTGCTTTTTC-3';P4:5'-GTACCAAGCTTACTCGAGTCACAAAACTGGATCTTTTAATAAAGAAG-3')克隆HbBACS密码子优化片段,酵母表达载体使用SalI/XhoI双酶切;将正确大小的片段切胶回收后,向胶回收产物中加入体积分数10%的3 mol/L 醋酸钠(pH 6.0),然后加入2倍体积的无水乙醇(置于-80 ℃预冷),混合均匀;-80 ℃冰箱中放置2 h后,在4 ℃、12 000 r/min条件下离心20 min,用移液枪吸去上清;添加500 μL的体积分数为70%的冷乙醇,轻轻颠倒几次,并于4 ℃,12 000 r/min下离心8 min,用移液枪吸净上清;冷冻干燥2 min左右,然后加10 μL 的无菌水溶解。将以上处理后的片段利用同源重组试剂盒重组后转化大肠杆菌感受态中,待长出单克隆后,经PCR鉴定得到阳性克隆,挑取阳性菌单克隆于LB(氨苄抗性)液体培养基37 ℃过夜培养后,提取质粒待酶切验证正确后送测序并保存,分别构建获得pHbBACS01和pHbBACS02质粒。采用醋酸锂转化法[22]将正确质粒分别转化酿酒酵母,并涂布SC-尿嘧啶缺陷培养基上,获得对应的酵母工程菌株。
1.3.2 工程酿酒酵母摇瓶培养
将待发酵的酿酒酵母菌株划线于YPD固体培养基上,30 ℃静置培养2~3 d长出单克隆,在平皿上挑取3个单克隆菌落到含有6 mL YPD液体培养基中,放置于30 ℃、220 r/min振荡培养约16 h,作为种子液,再以1%的接种量转接至50 mL YPD液体培养基中,添加1%半乳糖和1%IPM放置于30 ℃、220 r/min振荡培养约3 d后,取样测定吸光度值(OD600nm)值并放置在-80 ℃冰箱待检测产物。
1.3.3 工程酿酒酵母分批补料培养
将工程酿酒酵母按10%的接种量接种于含2.25L酿酒酵母全合成发酵培养基的5 L发酵罐中进行两阶段分批补料发酵,补料发酵第一阶段(0~30 h)补料流加葡萄糖500 g/L,KH2PO410 g/L,MgSO4·7H2O 5.2 g/L,K2SO4 3.5 g/L,Na2SO4 0.3 g/L,10 mL/L的金属离子母液和15 mL/L的维生素母液,第二阶段(30~140 h)补料流加无水乙醇使产物β-石竹烯积累,并在补料切换过程中加入1%的半乳糖进行诱导,同时添加1%的肉豆蔻酸异丙酯覆盖剂以促进β-石竹烯的分泌。发酵过程温度为30 ℃,溶氧量控制在20%以上,pH值用氨水控制在5左右,通过调节补料速率使发酵罐中残留葡萄糖质量浓度<1 g/L,残留乙醇质量浓度<5 g/L。
1.3.4 β-石竹烯的检测
将上述摇瓶发酵或发酵罐发酵留存的样品8 000 r/min条件下离心10 min,收集覆盖层的有机相,并用正己烷稀释到适当的范围采用GC-MS仪检测β-石竹烯[20]。
气相色谱条件:TR-5MS色谱柱(30m×0.25mm×0.25μm),升温程序为:温度50 ℃保持1 min,然后以15 ℃/min的速度增加到280 ℃,保持1 min,然后以20 ℃/min的速度增加到300 ℃,保持2 min。载气为高纯氦气(He)(纯度>99.999%);流速0.8 mL/min;不分流进样;进样量1.0 μL。
质谱条件:电子电离(electronic ionization,EI)源,离子源温度为230 ℃,电子能量70 eV,接口温度为250 ℃,溶剂延时2 min,倍增器电压为1.165 kV,扫描范围25~550 amu。
定性定量方法:化合物定性通过与标准品的出峰时间和质谱碎片比对确定,采用外标法进行定量。
2 结果与分析
2.1 橡胶树HbBACS基因分析
利用已报道的β-石竹烯合成酶NtTPS07、OsaTPS02和DoECS氨基酸序列对橡胶树基因组序列通过基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源搜寻分析,发现了一个同源性相对较高的萜类合酶基因,其核苷酸序列和编码氨基酸序列见图2。该基因命名为HbBACS(对应酶为HbBaS)。

图2 HbBACS基因核苷酸序列及其对应氨基酸序列
Fig.2 Nucleotide sequence and corresponding amino acid sequence of HbBACS gene
根据其基因序列设计特异引物对P1/P2,以橡胶树互补脱氧核糖核酸(complementary deoxyribonucleic acid,cDNA)为模板,利用Takara公司的Prime STAR MAX PCR酶通过PCR扩增获得特异基因片段HbBACS。该基因全长1 647 bp,编码548个氨基酸,对其氨基酸序列与文献报道的β-石竹烯合成酶进行序列比对分析,结果见图3。

图3 HbBaS与来自其他物种的β-石竹烯合成酶氨基酸序列比对
Fig.3 Amino acid sequence alignment of HbBaS and β-caryophyllene synthases from other species
由图3可知,HbBaS与文献报道的β-石竹烯合成酶有一定的相似性与同源性。该酶与铁皮石斛来源的DoECS[23]同源性为24%、相似性为62%;与红花烟草来源的NtTPS7[13]同源性为52%、相似性为71%;与圣罗勒来源OsaTPS02[20]同源性为44%、相似性为62%。虽然相似性和同源性不是很高,但是作为萜类合成酶仍然含有很多保守的序列,尤其是在C232和G315之间的区域。HbBaS与所有其他β-石竹烯合成酶一样,含有高度保守的发挥催化功能必须的motif氨基酸序列,如“DDXXD”和“NSE/DTE”,这些氨基酸序列是萜类合成酶活性催化中心不可或缺的功能单元[24-25]。因此,推测HbBaS可能具有合成β-石竹烯的功能。
2.2 HbBACS基因在酿酒酵母中功能鉴定
含HbBACS基因片段的表达元件经诺维赞胶回收试剂盒回收后,利用同源重组的方法连接到(SalI/XhoI)双酶切后的酵母表达载体上,经过测序确认无误后,获得含有该特异基因HbBACS的酵母表达质粒,命名为pHbBACS01。通过PEG/LiAC方法将重组质粒pHbBACS01转化到酵母菌株YZL141感受态中,涂布于SC-尿嘧啶缺陷培养基筛选平板上,培养3 d后,利用验证引物,使用诺唯赞PCR试剂进行菌落PCR验证,将阳性菌进行命名为YCAR01。为鉴定HbBACS基因的功能,将YCAR01菌株接种于50 mL补充1%半乳糖的YPD培养基中,加入1%肉豆蔻酸异丙酯,30 ℃摇瓶发酵培养3 d后,8 000 r/min离心10 min收集覆盖层的有机相,并用正己烷稀释到适当的范围进行GC-MS检测,结果见图4。
图4 对摇瓶发酵产物的GC-MS分析鉴定结果
Fig.4 Identification results of shake flask fermentation products analyzed by GC-MS
a.含HbBACS基因工程菌发酵产物GC图;b.β-石竹烯标准品GC图;c.Peak1对应的质谱图;d.Peak2对应的质谱图。
由图4可知,主峰peak1与β-石竹烯标准品峰peak2的保留时间以及质谱碎片一致,由此可以确定菌株YCAR01可以合成β-石竹烯,说明橡胶树HbBACS基因为β-石竹烯合成酶基因。同时根据标准品标准曲线可知,β-石竹烯摇瓶产量为16 mg/L。结果表明,橡胶树中HbBACS基因编码的HbBaS为一个新的β-石竹烯合成酶。
2.3 在高产萜类前体酿酒酵母底盘中表达HbBACS高产β-石竹烯
为进一步提升酿酒酵母产β-石竹烯的潜力,将密码子优化的HbBACS基因表达元件同样构建在上述酵母表达载体上,得到质粒pHbBACS02。同时利用PmeI内切酶酶切pHbBACS02回收含有优化后的HbBACS片段,并通过醋酸锂转化法导入到酵母菌株JCR27感受态中,经过酵母菌落PCR验证后,将阳性菌命名为YCAR02。
菌株YCAR02采用同样的摇瓶发酵方法,添加1%肉豆蔻酸异丙酯(IPM)覆盖后发酵72 h,离心后取有机相,并用正己烷稀释到适当的范围进行GC-MS检测。倍半萜产物β-石竹烯的产量从菌株YCAR01的16 mg/L增加至菌株YCAR02的206 mg/L,产量增加约12.8倍。这是因为高产萜类前体底盘菌株JCR27能提供充足的萜类合成前体,DENG X M等[20]以底盘菌株JCR27高产倍半萜化合物佛术烯,其摇瓶产量最高达到708 mg/L,发酵罐产量达34.6 g/L。
2.4 分批补料发酵高产β-石竹烯
菌株YCAR02分批补料发酵结果见图5。由图5可知,发酵开始140 h后,酿酒酵母的OD600 nm值达到470,β-石竹烯产量在发酵130 h左右达到最高,产量达8.47 g/L。
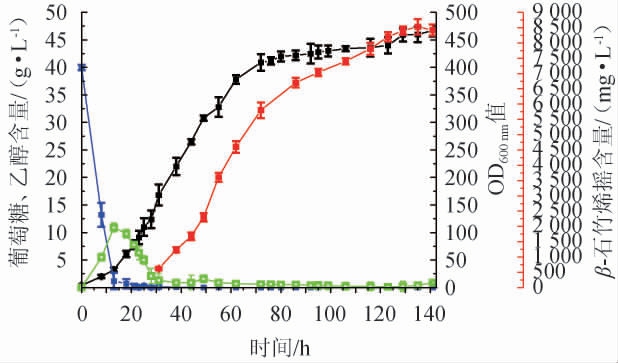
图5 菌株YCAR02的两阶段分批补料发酵
Fig.5 Two-stage batch feed fermentation of strain YCAR02
3 结论
本研究从橡胶树中鉴定到一个β-石竹烯合成酶,这说明橡胶树不仅可以生产高分子橡胶,同样能够利用相同前体合成萜类物质。这拓展了对橡胶树可合成β-石竹烯这一倍半萜化合物的认识。同时橡胶树这一新来源的β-石竹烯合成酶HbBaS与已知的石竹烯合成酶序列相似性和同源性均较低,可作为新的β-石竹烯合成基因元件用于β-石竹烯的大规模生物合成。
本研究利用该新β-石竹烯合成酶基因在高产萜类单元的底盘酵母菌株JCR27基础上,构建了工程菌YCAR02,该工程菌β-石竹烯摇瓶产量达到206 mg/L。进一步利用酿酒酵母高密度发酵技术对工程菌株YCAR02进行两阶段分批补料发酵,在5 L发酵罐中,酿酒酵母生物量OD600 nm值达到470,β-石竹烯发酵产量达到8.47 g/L。本研究是目前已知报道的生物发酵β-石竹烯最高产量,具有应用于β-石竹烯的生物技术生产的潜力。
[1]杨舜伊,袁纯红.向日葵倍半萜类化学成分及生物活性研究进展[J].中国野生植物资源,2022,41(7):55-59.
[2]AHMED M,PEIWEN Q,GU Z,et al.Insecticidal activity and biochemical composition of Citrullus colocynthis,Cannabis indica and Artemisia argyi extracts against cabbage aphid(Brevicoryne brassicae L.)[J].Sci Rep,2020,10:522.
[3] FERNÁNDEZ R M, PETEK M, GERASYMENKO I, et al.Insect pest management in the age of synthetic biology[J].Plant Biotechnol J,2022,20(1):25-36.
[4]CHO I H.Volatile compounds of ginseng(Panax sp.):A review[J].J Korean Soc Appl Biol Chem,2015,58:67-75.
[5]JUNG J I,KIM E J,KWON G T,et al.β-Caryophyllene potently inhibits solid tumor growth and lymph node metastasis of B16F10 melanoma cells in high-fat diet-induced obese C57BL/6N mice[J].Carcinogenesis,2015,36(9):1028-1039.
[6]左天睿,胡晴雯,刘京东,等.β-石竹烯通过激活HSF1/HSP70 通路减轻大鼠脑缺血再灌注损伤[J].中国新药杂志,2023,32(5):513-521.
[7] GUPTA P,PHULARA S C.Metabolic engineering for isoprenoid-based biofuel production[J].J Appl Microbiol,2015,119(3):605-619.
[8]HARVEY B G,MERRIMAN W W,KOONTZ T A.High-density renewable diesel and jet fuels prepared from multicyclic sesquiterpanes and a 1-hexene-derived synthetic paraffinic kerosene[J].Energy Fuels, 2015,29(4):2431-2436.
[9]KEASLING J D.Synthetic biology and the development of tools for metabolic engineering[J].Metab Eng,2012,14(3):189-195.
[10]KIRBY J,KEASLING J D.Biosynthesis of plant isoprenoids:perspectives for microbial engineering[J].Annu Rev Plant Biol,2009,60(1):335.
[11]YANG J M,LI Z F,GUO L Z,et al.Biosynthesis of β-caryophyllene,a novel terpene-based high-density biofuel precursor, using engineered Escherichia coli[J].Renew Energ,2016,99(12):216-223.
[12]李晓东,杨成帅,王平平,等.构建酿酒酵母细胞工厂从头合成倍半萜类化合物α-新丁香三环烯和β-石竹烯[J].合成生物学,2021,2(5):792-803.
[13] CHENG T, ZHANG K, GUO J, et al.Highly efficient biosynthesis of β-caryophyllene with a new sesquiterpene synthase from tobacco[J].Biotechnol Biofuels Bioprod,2022,15:39.
[14]MA T,SHI B,YE Z L,et al.Lipid engineering combined with systematic metabolic engineering of Saccharomyces cerevisiae for high-yield production of lycopene[J].Metab Eng,2019,52:134-142.
[15]SHI B,MA T,YE Z L,et al.Systematic metabolic engineering of Saccharomyces cerevisiae for lycopene overproduction[J].J Agr Food Chem,2019,67(40):11148-11157.
[16] PADDON C J, WESTFALL P J, PITERA D J, et al.High-level semisynthetic production of the potent antimalarial artemisinin[J].Nature,2013,496:528-532.
[17]MEADOWS A L,HAWKINS K M,TSEGAYE Y,et al.Rewriting yeast central carbon metabolism for industrial isoprenoid production[J].Nature,2016,537(9):694-697.
[18]YE Z L,SHI B,HUANG Y L,et al.Revolution of vitamin E production by starting from microbial fermented farnesene to isophytol[J].Innovation,2022,3(3):100228.
[19]YE Z L,HUANG Y L,SHI B,et al.Coupling cell growth and biochemical pathway induction in Saccharomyces cerevisiae for production of (+)-valencene and its chemical conversion to(+)-nootkatone[J].Metab Eng,2022,72(7):107-115.
[20]DENG X M,SHI B,YE Z L,et al.Systematic identification of Ocimum sanctum sesquiterpenoid synthases and(-)-eremophilene overproduction in engineered yeast[J].Metab Eng,2022,69(1):122-133.
[21] SIEMON T, WANG Z, BIAN G, et al.Semisynthesis of plant-derived englerin A enabled by microbe engineering of guaia-6,10(14)-diene as building block[J].J Am Chem Soc,2020,142(2):2760-2765.
[22]GIBSON D G,BENDERS G A,AXELROD K C,et al.One-step assembly in yeast of 25 overlapping DNA fragments to form a complete synthetic Mycoplasma genitalium genome[J].Proc Natl Acad Sci USA, 2008,105(51):20404-20409.
[23]LV M,SUN X,LI D C,et al.Terpenoid biosynthesis in Dendrobium officinale:Identification of(E)-β-caryophyllene synthase and the regulatory MYB genes[J].Ind Crops Prod,2022,182:114875.
[24]SHARON-ASA L,SHALIT M,FRYDMAN A,et al.Citrus fruit flavor and aroma biosynthesis: isolation, functional characterization, and developmental regulation of Cstps1, a key gene in the production of the sesquiterpene aroma compound valencene[J].Plant J,2003,36(5):664-674.
[25]NIEUWENHUIZEN N J,WANG M Y,MATICH A J,et al.Two terpene synthases are responsible for the major sesquiterpenes emitted from the flowers of kiwifruit (Actinidia deliciosa)[J].J Exp Bot,2009,60(11):3203-3219.