浓香型白酒以窖香浓郁、绵柔甘冽、入口绵甜、香味协调及尾净余长等酒体风格而享有盛名[1-2],从其酿造工艺上看,白酒酿造的过程实质上就是相关微生物参与的代谢活动,这些微生物的来源主要有酒曲、原料、酒醅、环境等[3]。其中,酒醅既是白酒酿造过程中的主体部分,同时也作为相关微生物生长代谢的基质,其质量对白酒的品质起着重要作用[4]。
在酒醅所包含的微生物中,细菌是重要的功能微生物[5],可分泌蛋白酶[6]、淀粉酶[7]等多种水解酶类,对白酒的风味形成有着重要的调控作用[8-9]。目前,对于酒醅中微生物的研究多用传统分离培养的方法,但是该方法对于样品中一些不可培养的微生物来说并不适用[10]。高通量测序技术,又称第二代测序技术[11],可一次性对大量脱氧核糖核酸(deoxyribonucleic,DNA)分子测序,具有数据量高、覆盖面广、准确率高的特点[12-13],可以有效的检测样本微生物的组成和多样性,适用于酿酒微生物的研究[14]。HU X等[15]基于高通量测序研究发现,浓香型白酒酒醅中酵母属(Saccharomyces)是相对丰度最高的真菌,Kroppenstedtia是相对丰度最高的细菌。WANG H等[16]对酱味白酒不同轮次发酵过程中微生物群落多样性进行研究,发现芽孢杆菌属(Bacillus)、慢生芽孢杆菌属(Lentibacillus)、Kroppenstedtia、大洋芽孢杆菌属(Oceanobacillus)和乳杆菌属(Lactobacillus)为核心细菌属。
窖池是浓香型白酒酿造必不可少的发酵容器,关于窖池功能的研究多集中于窖泥微生物组成和代谢上,验证了“老窖产好酒”的科学内涵[17]。即随着窖龄的增加,窖泥菌群在长期的生产活动中逐渐被驯化(窖泥逐渐老熟),并有益于白酒酿造[18]。其中,酒醅微生物由大曲微生物和窖泥微生物相互作用演变而来,共同承担酒精发酵和风味物质形成,且酒醅微生物及其代谢产物反作用于窖泥微生物演变及代谢[19-20]。因此,在微生物代谢作用下酒醅中含有多种风味物质,如丁酸乙酯、己酸乙酯、戊酸乙酯、辛酸乙酯、异戊醇、丙醇、乙酸等,这些风味物质对浓香型白酒的酒体和风格有着重要的影响[21]。目前,多数研究集中在窖泥或酒醅整体发酵过程与窖泥的微生物交互作用上[22],但是对不同窖龄中酒醅相关研究较少,而且研究主要集中于理化性质的差异,对新老窖环境下酒醅发酵微生物的代谢和风味物质形成的影响尚未可知。
本研究以赊店老酒新老窖池中酒醅样品为研究对象,通过测定其理化指标,结合高通量测序分析细菌群落结构和顶空固相微萃取-气相色谱-质谱(headspace-solid phase microextraction gas chromatography-mass spectrometry,HSSPME-GC-MS)测定挥发性风味物质,全面分析两种酒醅在理化指标、细菌群落结构和风味物质方面的差异,为优化生产工艺和提高酒质提供科学依据。
1 材料与方法
1.1 材料与试剂
1.1.1 样品收集
采用五点三层取样从河南赊店老酒股份有限公司的新老窖池(新窖,3年;老窖,30年)中采集酒醅样品,并按照一定比例混匀[23]。从老窖池采集的酒醅样品编号为A,新窖池采集的样品编号为B。
1.1.2 试剂
氢氧化钠、葡萄糖、无水乙醇(均为分析纯):天津市科密欧化学试剂有限公司;盐酸、硫酸(均为分析纯):天津市永大化学试剂有限公司;碘、碘化钾(均为分析纯):西陇科学股份有限公司;五水硫酸铜、酒石酸钾钠(均为分析纯):成都金山化学试剂有限公司;可溶性淀粉:天津永城精细化工有限公司;Qubit3.0 DNA检测试剂盒:生工生物工程(上海)股份有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
PICO17小型台式离心机:赛默飞世尔科技(中国)有限公司;GL88-B型漩涡混合器:海门市其林贝尔仪器制造有限公司;TND03-H-H型混匀干式恒温器:深圳拓能达科技有限公司;DYY-6型电泳仪电源、DYCZ-21电泳槽:北京市六一仪器厂;Gel Doc-IT2 315凝胶成像系统:美国UVP公司;QubitR3.0型荧光计:美国Invitrogen公司;Gene AmpR 9700型聚合酶链式反应(polymerase chain reaction PCR)仪:赛默飞世尔科技(中国)有限公司。
1.3 方法
1.3.1 酒醅理化指标的检测
水分、淀粉、酸度、还原糖的测定:参照GAOJ等[22]的方法。
1.3.2 酒醅样品总DNA的提取
按照E.Z.N.ATM Mag-Bind Soil DNA Kit使用说明书提取酒醅样品中的细菌菌群基因组DNA。
1.3.3 PCR扩增及高通量测序
利用Qubit 3.0 DNA检测试剂盒对基因组DNA精确定量,以基因组DNA为模板,采用V3-V4通用引物341F(5'-CCCTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG-3')和805R(5'-GACTGGAGTTCCTTGGCACCCGAGAATTCCAGACTAC-HVGGGTATCTAATCC-3')进行第一轮PCR扩增。PCR扩增体系:上下游引物(10 μmol/L)各1 μL,2×Taq Master Mix 15 μL,基因组DNA 10~20 ng,加水至30 μL。PCR扩增程序:94 ℃、3 min;94 ℃、30 s,45 ℃、20 s,65 ℃、30 s(进行5个循环);94 ℃、20 s,55 ℃、20 s,72 ℃、30 s(进行20个循环);72 ℃、5 min;10 ℃保存。第一轮PCR扩增结束后进行第二轮PCR扩增。第二轮PCR扩增引入Illumina桥式PCR兼容引物,PCR扩增体系:2×Taq master Mix 15 μL,上下游引物(10 μmol/L)各1 μL,PCR扩增产物(上一轮)20 ng,加水至30 μL。PCR扩增程序:95 ℃、30 s;94 ℃、20 s,55 ℃、20 s,72 ℃、30 s(进行5个循环);72 ℃、5 min;10 ℃保存。PCR扩增结束后,PCR扩增产物进行琼脂糖凝胶电泳检测。
选用0.6倍的磁珠(Agencourt AMPure XP)对于PCR扩增产物进行处理。利用Qubit 2.0 DNA检测试剂盒对回收的DNA精确定量,按照1∶1等量混合后测序。等量混合时,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol/L。将定量混合后的样品依托生工生物工程(上海)股份有限公司应用Miseq 2×300 bp测序平台进行Illumina Miseq高通量测序。
1.3.4 测序数据处理
利用CASAVA碱基识别(Base Calling)分析Illumina MiseqTM得到的原始图像数据文件,将其转化为原始测序序列,并进行去接头、质量控制(quality control,QC)等处理,得到各样本的有效数据。
使用Uparse(v7.0.1090)(http://drive5.com/uparse/)在97%序列同一性的阈值下将唯一序列分类为操作分类单元(operational taxonomic unit,OTU)。采用RDPclassifier(v2.13)(https://sourceforge.net/projects/rdp-classifier/)对97%相似水平的OTU代表序列进行分类学分析,然后将来自每个聚类OTU的代表序列与Silva细菌16S r RNA数据库(Re lease138 http://www.arb-silva.de)进行比对。
用QIIME(v1.8.0)和R软件(4.2.3)对样本进行Alpha多样性分析和群落结构的分析等。
1.3.5 酒醅挥发性风味物质的分析
参考石馨等[21]的方法,利用顶空固相微萃取结合气质联用(HS-SPME-GC-MS)技术测定赊店老酒新老窖池酒醅中的挥发性风味物质。
1.3.6 数据处理及统计分析
利用Microsoft Office Excel 2019、SPSS Statistics 22.0等统计软件对理化性质及风味物质数据进行处理及分析;微生物群落结构分析基于美吉生物云平台进行,绘制稀释曲线图、群落组成堆积柱状图和热图等。
2 结果与分析
2.1 新老窖池酒醅的理化指标
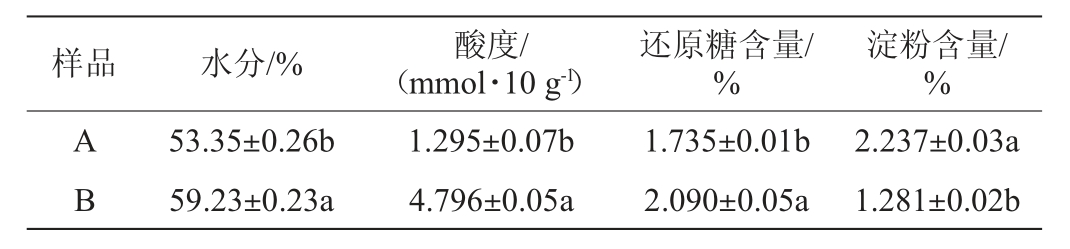
新老窖池酒醅样品的理化指标测定结果见表1。
表1 新老窖池酒醅样品理化指标的测定结果
Table 1 Determination results of physicochemical indexes of fermented grains samples in new and old pits
注:不同字母表示差异显著(P<0.05)。
样品 水分/% 酸度/(mmol·10 g-1)还原糖含量/%淀粉含量/%AB 53.35±0.26b 59.23±0.23a 1.295±0.07b 4.796±0.05a 1.735±0.01b 2.090±0.05a 2.237±0.03a 1.281±0.02b
有研究表明,理化性质和微生物群落具有一定的相关性,可以根据理化指标间接反映群落组成[24]。由表1可知,新老窖池酒醅样品的理化指标存在显著差异(P<0.05)。其中酒醅样品B的水分(59.23%)和酸度(4.796 mmol/10 g)显著高于样品A(P<0.05),适宜的水分有利于酒醅的糖化过程,保证微生物的生长代谢,并为其代谢产物(醇、醛、酸、酯等)提供有效溶剂[25]。水分过多则容易导致细菌生长旺盛从而使酒醅酸化影响酒质[24],这也可能是样品B的酸度显著高于样品A的原因之一。在发酵过程中,酒醅中的淀粉被淀粉酶水解为糖类物质,进而被酵母发酵生成酒精,较多的酸同样也可以促进淀粉等物质水解成糖类物质[26]。此外,有研究发现淀粉和酸度对细菌群落组成有极其显著的影响[27-29]。因此,样品中酸度、还原糖含量和淀粉含量可以间接表明样品微生物群落丰度。
由表1亦可知,酒醅样品B的还原糖含量(2.090%)显著高于样品A,但淀粉含量(1.281%)显著低于与样品A(P<0.05)。由此可说明,新老窖池酒醅在微生物群落上具有一定的差异,且淀粉和酸度的显著差异在一定程度上贡献了群落差异。
2.2 新老窖池酒醅细菌菌群多样性分析
2.2.1 测序数据处理结果
新老窖池酒醅样品细菌菌群的高通量测序结果见表2。
表2 新老窖池酒醅样品细菌菌群高通量测序结果
Table 2 High-throughput sequencing results of bacterial community of fermented grains samples in new and old pits
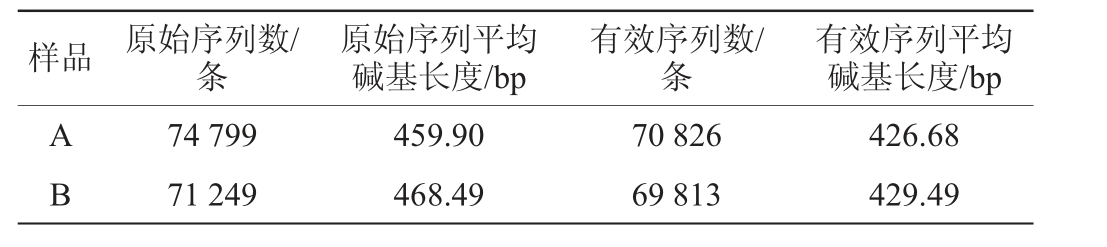
样品 原始序列数/条原始序列平均碱基长度/bp有效序列数/条有效序列平均碱基长度/bp AB 74 799 71 249 459.90 468.49 70 826 69 813 426.68 429.49
由表2可知,样品A得到74 799条原始序列,原始序列平均碱基长度为459.90 bp,质控后得到70 826条有效序列,序列平均碱基长度为426.68 bp。样品B得到71 249条原始序列,序列平均碱基长度为468.49 bp,质控后得到69 813条有效序列,有效序列平均碱基长度为429.49 bp。
2.2.2 细菌菌群多样性分析结果
为反映酒醅样品的测序数据量是否合理,绘制新老窖池酒醅样品细菌菌群多样性分析稀释曲线,结果见图1。由图1可知,随着测序量的增加,样品A和B的稀释曲线都趋向平坦,说明测序数据量合理。
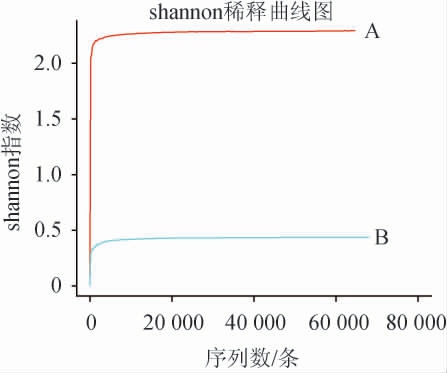
图1 新老窖池酒醅样品细菌菌群多样性分析稀释曲线
Fig.1 Dilution curves of bacterial community diversity analysis of fermented grains samples in new and old pits
Alpha多样性分析可以反映微生物群落的丰度和多样性,Coverage指数代表了测序结果的真实程度,Chao1指数估计群落中物种总数,ACE指数用来估计群落中OTU数目,代表着菌群丰度,Chao1或ACE指数越高表明菌群丰富度越高。Shannon指数综合考虑了菌群的丰富度和均匀度,Shannon指数值越高,表明菌群多样性越高。Simpson指数对菌群的丰富度以及稀有物种更敏感,Simpson指数值越低,表明菌群多样性越高[30]。由表3可知,样品A和B的Coverage均为100%,说明样品测序情况良好,测序结果可以代表样本的真实情况。样品A的Chao1指数和ACE指数均大于样品B,表明样品A中群落丰度高于样品B,样品A的Shannon指数大于样品B,但Simpson指数低于样品B,说明样品A细菌菌群多样性较高。
表3 新老窖池酒醅样品Alpha多样性分析结果
Table 3 Alpha diversity analysis results of fermented grain samples in new and old pits
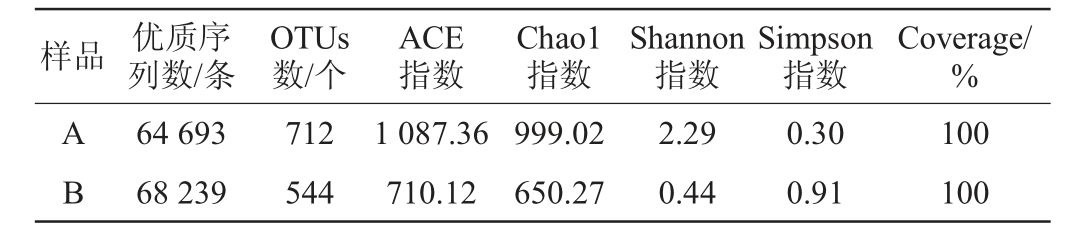
样品 优质序列数/条OTUs数/个ACE指数Chao1指数Shannon指数Simpson指数Coverage/%AB 64 693 68 239 712 544 1 087.36 710.12 999.02 650.27 2.29 0.44 0.30 0.91 100 100
2.2.3 OTU分布韦恩图
酒醅样品中OTU数目的韦恩图见图2。由图2可知,样品A和B共有的OTU数为235个,占总OTU数的23.02%。样品A特有的OTU数为477个,占该样品总OTU数目的66.99%。样品B特有的OTU数为309个,占该样品总OTU数目的56.80%。由此说明,样品A的细菌菌群的多样性更加丰富。
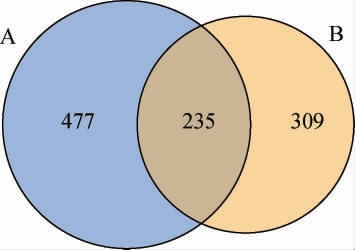
图2 新老窖池酒醅样品细菌菌群OTU分布韦恩图
Fig.2 Venn diagram of OTU distribution of bacterial community of fermented grain samples in new and old pits
2.2.4 细菌群落结构分析
基于门、属分类水平对新老窖池酒醅样品中的细菌群落组成进行分析,结果见图3。

图3 基于门(a)和属(b)水平新老窖池酒醅样本细菌群落结构分析结果
Fig.3 Analysis results of bacterial community structure of fermented grains samples in new and old pits based on phylum (a) and genus (b) levels
other:相对丰度排名50之后的所有细菌属。
由图3a可知,在门水平上,酒醅样品共注释到28个细菌门,其中样品A、B分别有15、16个细菌门。样品A中有3个优势细菌门(相对丰度>0.5%),分别为厚壁菌门(Firmicutes)(87.77%)、变形菌门(Proteobacteria)(9.57%)、放线菌门(Actinobacteria)(1.81%)。样品B中有3个优势细菌门,分别为厚壁菌门(Firmicutes)(98.03%)、拟杆菌门(Bacteroidetes)(1.18%)、变形菌门(Proteobacteria)(0.66%)。两样品中的绝对优势细菌门均为厚壁菌门,样品A独有的优势细菌门为放线菌门,样品B独有的优势细菌门为拟杆菌门。与文献[31-32]报道一致,厚壁菌门、拟杆菌门、变形菌门和放线菌门是酒醅中的优势菌群。此外,有研究报道,这4个优势细菌门也是窖泥的主要优势菌门[25,33]。
由图3b可知,在属水平上,样品共注释到124个细菌属,其中样品A、B分别有98、56个细菌属。样品A中有9个优势细菌属(相对丰度>0.5%),分别为乳杆菌属(Lactobacillus)(16.74%)、魏斯氏菌属(Weissella)(10.8%)、醋杆菌属(Acetobacter)(3.85%)、葡萄球菌属(Staphylococcus)(2.19%)、片球菌属(Pediococcus)(2.01%)、鞘氨醇单胞菌属(Sphingomonas)(0.91%)、糖多孢菌属(Saccharopolyspora)(0.84%)、芽孢杆菌属(Bacillus)(0.77%)、假单胞菌属(Pseudomonas)(0.56%)。样品B中有绝大部分为未分类细菌属(unclassifield genus)(97.73%),此外,普雷沃氏菌属(Prevotella)(0.50%)为优势细菌属。
在不同的酒醅和窖泥中检测出相似的菌群结果,所以白酒的窖泥与酒醅中的细菌群落结构可能存在一定的相似性,且不同窖龄窖泥中菌群组成存在明显的差异。随着窖泥的老熟,窖泥中的菌群结构趋于协调稳定,富含大量有利于白酒酒质的功能微生物。在酒醅发酵的过程中,老窖窖泥中经过长期驯化的细菌和一系列代谢产物进入酒醅中,对酒醅的品质产生重要的影响。因此推断,新老窖泥菌群结构的差异是导致酒醅细菌群落结构不同的重要原因。
2.3 基于属水平新老窖池酒醅样品细菌群落差异分析
为了明确新老窖池酒醅细菌群落组成差异,对两样本中属水平相对丰度>0.5%的细菌属进行热图比较,结果见图4。
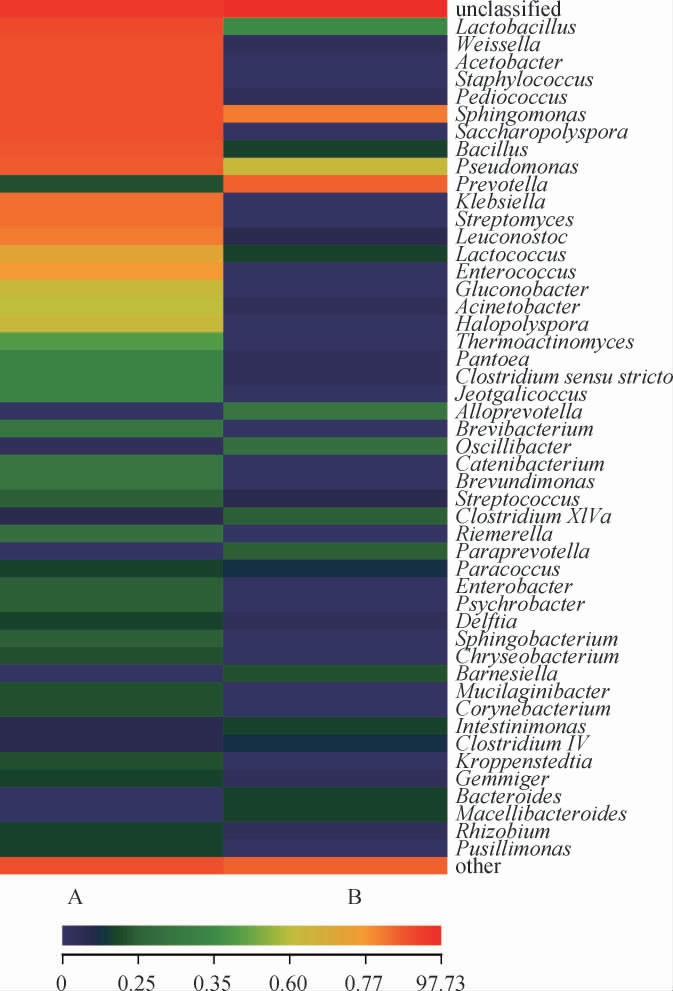
图4 基于属水平新老窖池酒醅样品细菌群落差异分析热图
Fig.4 Heat map of bacterial community difference of fermented grains samples in new and old pits based on genus level
由图4可知,乳杆菌属(Lactobacillus)、魏斯氏菌属(Weissella)和未分类细菌属(unclassifield genus)是造成差异的主要贡献者,其中乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)为样品A的主要细菌属,未分类细菌属(unclassifield genus)是样品B的主要成分。乳杆菌属(Lactobacillus)在老窖酒醅样品中丰度较高,可以利用自身代谢产生的乳酸与酒精酯化产生乳酸乙酯,乳酸乙酯是浓香型白酒中重要的香气成分之一,可以丰富酒体,延长白酒后味[34-35]。魏斯氏菌属(Weissella)可能与吡嗪类、酮类、酸类、酯类等形成有关[32,36]。
2.4 新老窖池酒醅挥发性风味物质分析结果
利用HS-SPME-GC-MS技术测定赊店老酒新老窖池酒醅中挥发性风味物质含量,结果见表4。由表4可知,从新老窖池酒醅样品中共检测出63种挥发性风味物质,其中酯类30种,酸类17种,酚类5种,醇类3种,醛类2种,其他类6种。酯类和酸类物质是酒醅中主要的两类风味物质,新老窖池酒醅间酯类和酸类物质及含量有较大差异。戊酸乙酯是样品B中相对含量最高的酯类物质,其相对含量为52.46%,而在样品A中只有3.19%。正己酸乙酯是样品A中相对含量最高的酯类物质,其相对含量为62.96%,而在样品B中只有0.28%。浓香型白酒的四大乙酯分别为己酸乙酯、乳酸乙酯、乙酸乙酯、丁酸乙酯,在老窖池酒醅中四大乙酯的含量高于新窖池酒醅。浓香型白酒的香气成分以己酸乙酯为主要成分,该种成分的含量比较高,而且香气极为突出[37],己酸乙酯含量的增长有益于突出浓香型白酒的主体香气[38]。而老窖池酒醅中正己酸乙酯的相对含量显著高于新窖池酒醅,新老窖池正己酸乙酯含量上的差异也体现出新老窖池其浓香风格特征上的差异,且老窖池的浓香型风格更为突出。从样品A和样品B中检测到酯类物质分别为27种、19种,酸类物质分别为7种、16种。酸类物质中亚油酸在新窖池酒醅中的相对含量(9.94%)最高。老窖池酒醅中含有多种功能性微量成分,例如苯甲醛、己酸酐和2,4-二叔丁基酚等,其中酚类物质不仅具有呈色呈香的作用,而且还具有一定的保健作用[39],然而在新窖池中并未检测到,因此,在功能性方面老窖池的表现更加优异。综上所述,新老窖池在挥发性风味物质上具有一定的差异,且老窖池的浓香型特征更加突出。
表4 新老窖池酒醅样品挥发性风味成分GC-MS分析结果
Table 4 Results of volatile flavor components of fermented grains in new and old pits analyzed by GC-MS
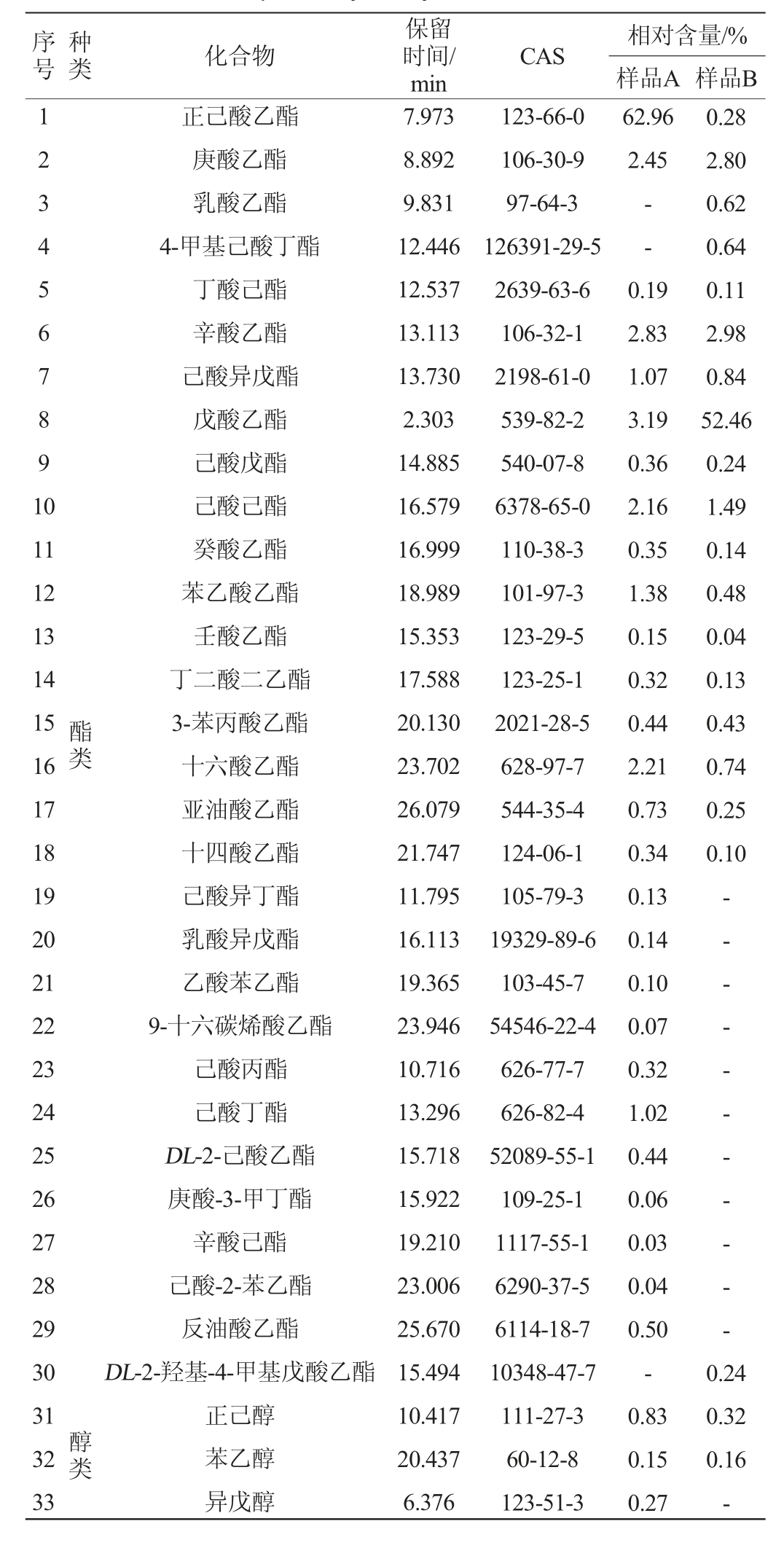
相对含量/%样品A 样品B 62.96 2.45--20 21 22 23 24 25 26 27 28 29 30 31 32 33 0.28 2.80 0.62 0.64 0.11 2.98 0.84 52.46 0.24 1.49 0.14 0.48 0.04 0.13 0.43 0.74 0.25 0.10-- - - - - - - - - -醇类乳酸异戊酯乙酸苯乙酯9-十六碳烯酸乙酯己酸丙酯己酸丁酯DL-2-己酸乙酯庚酸-3-甲丁酯辛酸己酯己酸-2-苯乙酯反油酸乙酯DL-2-羟基-4-甲基戊酸乙酯正己醇苯乙醇异戊醇16.113 19.365 23.946 10.716 13.296 15.718 15.922 19.210 23.006 25.670 15.494 10.417 20.437 6.376 09 9-5-6 1-0 28-03351-57413 19329-89-6 103-45-7 54546-22-4 626-77-7 626-82-4 52089-55-1 109-25-1 1117-55-1 6290-37-5 6114-18-7 10348-47-7 111-27-3 60-12-8 123-51-3 0.19 2.83 1.07 3.19 0.36 2.16 0.35 1.38 0.15 0.32 0.44 2.21 0.73 0.34 0.13 0.14 0.10 0.07 0.32 1.02 0.44 0.06 0.03 0.04 0.50-0.83 0.15 0.27 0.24 0.32 0.16-
续表
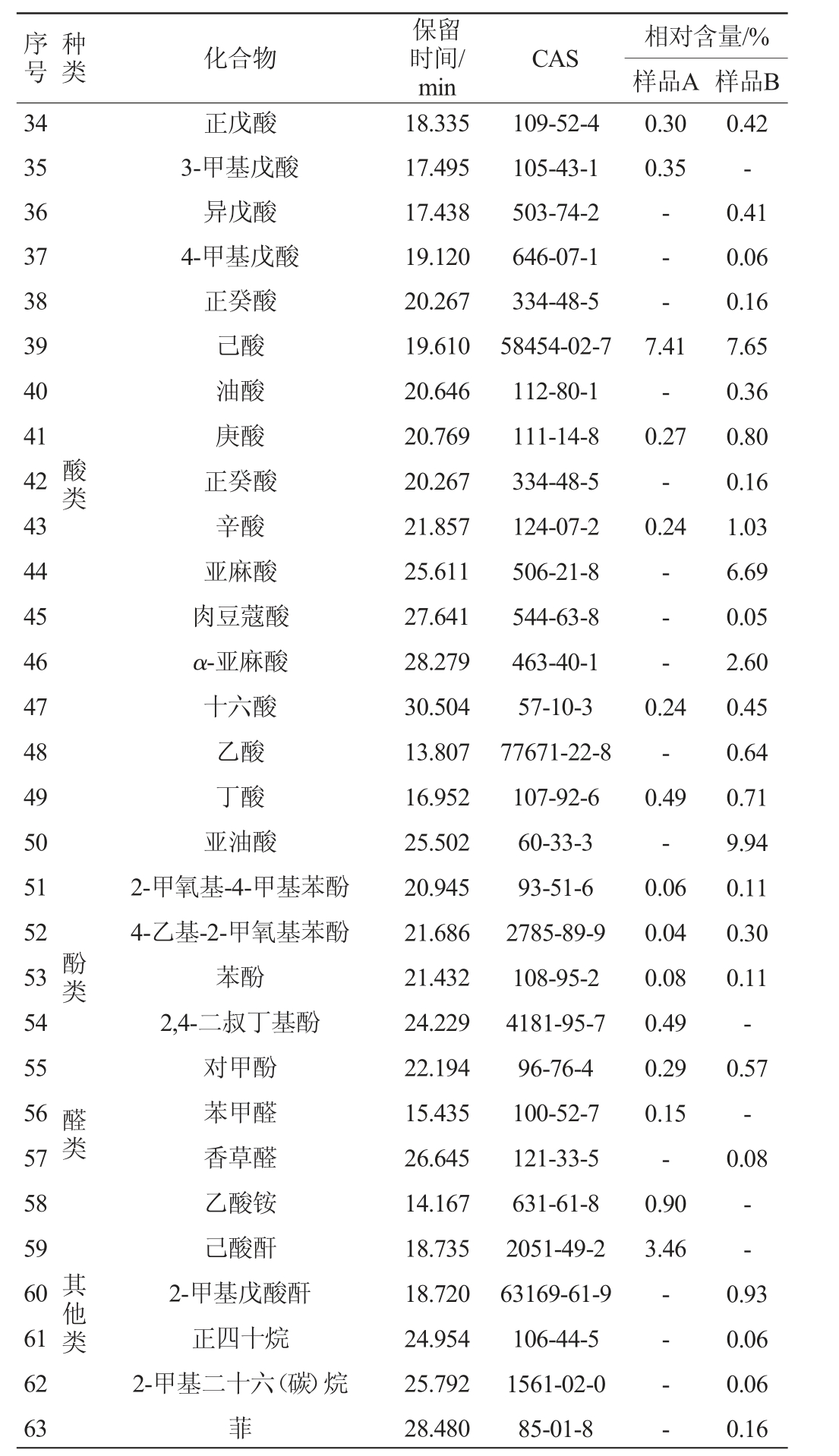
注:“-”表示未检出。
序号类种化合物保留时间/min CAS 相对含量/%样品A 样品B 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 0.30 0.35-- -酸类7.41-0.27-0.24-- -酚类 醛类 其他类正戊酸3-甲基戊酸异戊酸4-甲基戊酸正癸酸己酸油酸庚酸正癸酸辛酸亚麻酸肉豆蔻酸α-亚麻酸十六酸乙酸丁酸亚油酸2-甲氧基-4-甲基苯酚4-乙基-2-甲氧基苯酚苯酚2,4-二叔丁基酚对甲酚苯甲醛香草醛乙酸铵己酸酐2-甲基戊酸酐正四十烷2-甲基二十六(碳)烷菲18.335 17.495 17.438 19.120 20.267 19.610 20.646 20.769 20.267 21.857 25.611 27.641 28.279 30.504 13.807 16.952 25.502 20.945 21.686 21.432 24.229 22.194 15.435 26.645 14.167 18.735 18.720 24.954 25.792 28.480 109-52-4 105-43-1 503-74-2 646-07-1 334-48-5 58454-02-7 112-80-1 111-14-8 334-48-5 124-07-2 506-21-8 544-63-8 463-40-1 57-10-3 77671-22-8 107-92-6 60-33-3 93-51-6 2785-89-9 108-95-2 4181-95-7 96-76-4 100-52-7 121-33-5 631-61-8 2051-49-2 63169-61-9 106-44-5 1561-02-0 85-01-8 0.24-0.49-0.06 0.04 0.08 0.49 0.29 0.15-0.90 3.46 0.42-0.41 0.06 0.16 7.65 0.36 0.80 0.16 1.03 6.69 0.05 2.60 0.45 0.64 0.71 9.94 0.11 0.30 0.11-0.57-0.08——- -0.93 0.06 0.06 0.16
3 结论
新老窖池中酒醅的理化指标差异显著(P<0.05),新窖池酒醅的水分、酸度、还原糖含量显著高于老窖池酒醅(P<0.05),而淀粉含量显著低于老窖池酒醅(P<0.05),但老窖池酒醅理化性质更有利于酿酒功能微生物生长代谢。通过高通量测序发现,老窖池酒醅的细菌菌群多样性和丰富度高于新窖池酒醅,从新老窖池酒醅样品中共注释到28个细菌门、124个细菌属,绝对优势细菌门均为厚壁菌门(Firmicutes),乳杆菌属(Lactobacillus)和魏斯氏菌属(Weissella)在老窖池酒醅中相对含量较高,其是导致新老窖池酒醅中细菌菌群差异的主要细菌属。采用HS-SPMEGC-MS从新老窖池酒醅中共检测出63种挥发性风味物质,酯类30种,酸类17种,酚类5种,醇类3种,醛类2种,其他类6种,老窖池酒醅的酯类含量和种类高于新窖池酒醅,且老窖池酒醅中含有多种功能性微量成分(苯甲醛、己酸酐和2,4-二叔丁基酚等)。综上,老窖池酒醅质量优于新窖池酒醅。
[1]张霞,郑佳,赵东,等.多粮浓香型白酒中特征酵母菌与耐酸乳杆菌的关系[J].微生物学通报,2019,46(7):1571-1581.
[2]曹静,余有贵,曹智华,等.中国复合香型白酒研究进展[J].食品与机械,2017,33(7):200-204.
[3]赵爽,杨春霞,窦屾,等.白酒生产中酿酒微生物研究进展[J].中国酿造,2012,31(4):5-10.
[4]李璇,戚居胜,韩四海,等.浓香型白酒杜康酒醅发酵过程中理化指标变化规律[J].食品与发酵工业,2019,45(11):52-57.
[5]王海燕,唐洁,徐岩,等.清香型小曲白酒中微生物组成及功能微生物的分析[J].酿酒科技,2012(12):48-52.
[6]王丽,韩建荣,赵景龙,等.汾酒曲醅中产高温蛋白酶芽孢杆菌的分离[J].中国酿造,2009,18(1):67-69.
[7]秦立芹,马景浩,李二浩,等.一株源于北派酱香白酒酿造环境中产淀粉酶细菌的筛选、鉴定及其特性研究[J].中国酿造,2021,40(11):154-160.
[8]杜海,邢敏钰,徐岩.芝麻香型白酒酿造过程中乳酸菌分离及其碳源利用特征[J].食品与发酵工业,2018,44(1):13-18.
[9]唐婧,苏迪,徐小蓉,等.基于宏基因组学的茅台酒酒曲细菌的多样性分析[J].贵州农业科学,2014,42(11):180-183.
[10]吴成,程平言,谢丹,等.酱香型白酒4轮次堆积发酵理化因子、风味物质与微生物群落相关性分析[J].食品科学,2023,44(2):240-247.
[11]LIU L,LI Y,LI S,et al.Comparison of next-generation sequencing systems[J].BioMed Research Int,2012,2012:251364.
[12]SHENDURE J,JI H.Next-generation DNA sequencing[J].Nat Biotechnol,2008,26(1):1135.
[13]刘博,杜海,王雪山,等.基于高通量测序技术解析浓香型白酒中窖泥臭味物质4-甲基苯酚的来源[J].微生物学通报,2017,44(1):108-117.
[14]沈毅,程伟,邓小波,等.酱香高温大曲、酒醅和窖泥的真菌多样性分析[J].酿酒科技,2019(3):17-23.
[15]HU X,WANG K,CHEN M,et al.Profiling the composition and metabolic activities of microbial community in fermented grain for the Chinese strong-flavor Baijiu production by using the metatranscriptome, highthroughput 16S rRNA and ITS gene sequencings[J].Food Res Int,2020,138:109765.
[16]WANG H,HUANG Y,HUANG Y.Microbiome diversity and evolution in stacking fermentation during different rounds of Jiang-flavoured Baijiu brewing[J].LWT-Food Sci Technol,2021,143:111119.
[17] WANG X J, ZHU H M, REN Z Q, et al.Characterization of microbial diversity and community structure in fermentation pit mud of different ages for production of strong-aroma Baijiu[J].J Microbiol,2020,69(2):151.
[18]WANG X S,DU H,XU Y.Source tracking of prokaryotic communities in fermented grain of Chinese strong-flavor liquor[J].Int J Food Microbiol,2017,244(6):27-35.
[19]CHAI L J,QIAN W,ZHONG X Z,et al.Mining the factors driving the evolution of the pit mud microbiome under the impact of long-term production of strong-flavor Baijiu[J].Appl Environ Microbiol, 2021, 87(17):e00885-21.
[20]张会敏,孟雅静,王艳丽,等.新老窖池黄水的差异性及静置培养对其影响[J].食品科学,2020,41(2):215-222.
[21]石馨,惠明,田青,等.异常威克汉姆酵母Y-1对模拟固态发酵白酒酒醅理化指标及风味的影响[J].中国酿造,2022,41(9):31-36.
[22]GAO J,LIU G,LI A,et al.Domination of pit mud microbes in the formation of diverse flavour compounds during Chinese strong aroma-type Baijiu fermentation[J].LWT-Food Sci Technol,2021,137:110442.
[23]刘凡,周新虎,陈翔,等.洋河浓香型白酒发酵过程酒醅微生物群落结构解析及其与有机酸合成的相关性[J].微生物学报,2018,58(12):2087-2099.
[24]陶勇,徐占成,李东迅,等.窖泥细菌群落结构演替及其与环境因子的相关性[J].酿酒科技,2011(9):42-46.
[25]周晓阳,姚毅,贾金玲,等.基于信息融合的浓香型白酒发酵入窖条件研究[J].四川理工学院学报(自然科学版),2017,30(6):61-65.
[26]HU X,TIAN R,WANG K,et al.The prokaryotic community,physicochemical properties and flavors dynamics and their correlations in fermented grains for Chinese strong-flavor Baijiu production[J].Food Res Int,2021,148:110626.
[27]MAO J,LIU X,GAO T,et al.Unraveling the correlations between bacterial diversity, physicochemical properties and bacterial community succession during the fermentation of traditional Chinese strong-flavor Daqu[J].LWT-Food Sci Technol,2022,154:112764.
[28] HAO F, TAN Y, LV X, et al.Microbial community succession and its environment driving factors during initial fermentation of Maotai-flavor Baijiu[J].Front Microbiol,2021,12:960.
[29]王世伟,王卿惠,芦利军,等.白酒酿造微生物多样性,酶系与风味物质形成的研究进展[J].农业生物技术学报,2017,25(12):2038-2051.
[30] LIU M K, TANG Y M, GUO X J, et al.Deep sequencing reveals high bacterial diversity and phylogenetic novelty in pit mud from Luzhou Laojiao cellars for Chinese strong-flavor Baijiu[J].Food Res Int,2017,102:68-76.
[31] ZHENG J, WU C, HUANG J, et al.Spatial distribution of bacterial communities and related biochemical properties in Luzhou-flavor liquorfermented grains[J].J Food Sci,2014,79(12):M2491-M2498.
[32]曹润洁,何宏魁,葛向阳,等.芝麻香型酒醅堆积过程中微生物结构变化分析[J].微生物学通报,2019,46(6):1371-1380.
[33]张应刚,邓宇.基于高通量测序的不同窖龄窖泥微生物结构与多样性分析[J].中国沼气,2019,37(3):3-8.
[34] LEITE A M O,MAYO B,RACHID C T C C, et al.Assessment of the microbial diversity of Brazilian kefir grains by PCR-DGGE and pyrosequencing analysis[J].Food Microbiol,2012,31(2):215-221.
[35] PANG X N, HAN B Z, HUANG X N, et al.Effect of the environment microbiota on the flavour of light-flavour Baijiu during spontaneous fermentation[J].Sci Rep,2018,8(1):3396.
[36]李俊辉,刘英杰,隋丽娜,等.浓香型白酒增加己酸乙酯降低乳酸乙酯的研究进展[J].中国酿造,2019,38(1):1-4.
[37] WANG M Y, ZHAO Q S, SU C, et al.Analysis of the microbial community structure during brewing of Sichuan Xiaoqu Baijiu[J].J Am Soc Brew Chem,2019,77(3):210-219.
[38]FAN G,LIU P,CHANG X,et al.Isolation and identification of a highyield ethyl caproate-producing yeast from Daqu and optimization of its fermentation[J].Front Microbiol,2021,12:663744.
[39] HONG J, CHEN L, ZHAO D, et al.Multivariate analysis on the relationship between radical scavenging activities and phenolic compounds of Baijiu and its protective effect against LPS-induced inflammation in THP-1 cells[J].Int Food Res J,2022,29(1):116-127.