金樱子(Rosa laevigata Michx.)俗称刺榆子、灯笼果、金罂子等,为蔷薇科(Rosaceae)蔷薇属(Rosa)植物金樱子的干燥果实。2020版《中国药典》记载其性甘、涩、平;归肾、膀胱、大肠经,分布于华中、华南、华东、西南各地[1]。金樱子药用历史悠久,在古医籍中多有记载。《蜀本草》云“脾泄下痢,止小便利,涩精气。”[2],《本草从新》云“酸涩平,固精秘气,治滑精泄痢,便数。”[3],现代医学研究发现,金樱子中含有黄酮类、三萜类、多酚类、多糖类等物质[4-5],具有抗氧化、抗炎、抗肿瘤、降糖降脂、保护肾脏等多种药理作用[6-7]。目前,关于金樱子中活性成分研究多以多糖类和黄酮类为主,对多酚类的研究较少[5,8],具有很大挖掘空间。
多酚类化合物是一种植物中最常见的生物活性成分,因其具有很强的抗氧化、抗衰老、抗辐射等作用,在食品、医疗保健领域都有广泛应用[9-11]。提取多酚的方法有很多,如传统的有机溶剂萃取、回流提取等,目前,有微波、电脉冲和超声波等创新技术,使提取多酚的过程易于操作,具有更强经济性和环境发展可持续性[12]。其中,超声波提取法作为提取多酚的重要方法,通过空化效应和机械效应,打破物质的细胞壁,增加扩散系数,从而提高提取效率[13-14]。与传统技术相比,超声波提取具有提取时间短,提取物产量高,有效成分不易破坏等优点。CHMELOVÁ D等[15]研究发现,采用超声提取云杉中多酚类化合物的提取量是传统溶剂萃取的1.1~7.1倍。段宙位等[16]比较了不同提取工艺下益智仁壳多酚的得率和抗氧化活性,发现超声辅助提取多酚得率高于热水浸提和乙醇浸提,并且抗氧化活性更好。
影响超声提取结果的因素很多,如溶剂极性、提取温度、液料比、粉碎粒度、超声时间、超声功率等[17]。因此,本研究采用超声提取法对金樱子中的总多酚进行提取,以总多酚得率为响应值,采用Plackett-Burman(PB)试验设计、单因素试验及响应面法对提取工艺条件进行优化,得出最佳工艺条件,并研究其体外抗氧化活性,旨在为该药材的综合开发利用提供理论依据。
1 材料与方法
1.1 材料与试剂
金樱子药材:吉林市保康大药房提供。
没食子酸对照品(纯度>98%):中国食品药品检定研究院;抗坏血酸对照品(纯度>99.8%):天津市大茂化学试剂厂;福林酚(分析纯):上海艾研生物科技有限公司;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH):西安热默尔生物科技有限公司;2,2'-联氨-双(3-乙基苯并噻唑啉-6-磺酸)二胺盐(2,2'-azino-bis(3-ethylben zothiazoline-6-sulfonic acid)diamine salt,ABTS+):合肥博美生物科技有限公司;过硫酸钾(分析纯):天津市大茂化学试剂厂;无水乙醇(分析纯):天津市致远化学试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
SHZ-D(Ⅲ)型水循环真空泵:巩义市子华仪器设备有限责任公司;AUI-220型电子分析天平:日本岛津精密仪器有限公司;UV1950紫外-可见分光光度计:日本岛津公司;KQ-500DB超声波清洗仪:昆山市超声仪器有限公司。
1.3 方法
1.3.1 金樱子总多酚超声提取
称取处理后的金樱子粉末10 g置于圆底烧瓶中,加入体积分数40%乙醇溶液100 mL,混合后置于超声仪中,设定超声功率200 W,提取温度30 ℃条件下进行超声提取10 min,过滤,合并滤液,减压回收溶剂,置于100 mL容量瓶中,蒸馏水定容,备用。
1.3.2 金樱子总多酚超声提取工艺优化Plackett-Burman试验设计
选取液料比(A)、乙醇体积分数(B)、超声功率(C)、超声时间(D)和提取温度(E)为5个考察因素,每个因素取2个水平:-1、1,以金樱子总多酚得率为评价指标,采用Design-Expert 10.0软件设计12组PB试验筛选对试验影响显著的因素,PB设计试验因素与水平见表1。
表1 金樱子总多酚超声提取工艺优化Plackett-Burman设计试验因素与水平
Table 1 Factors and levels of Plackett-Burman experiments design for total polyphenols extraction process optimization from Rosa laevigata
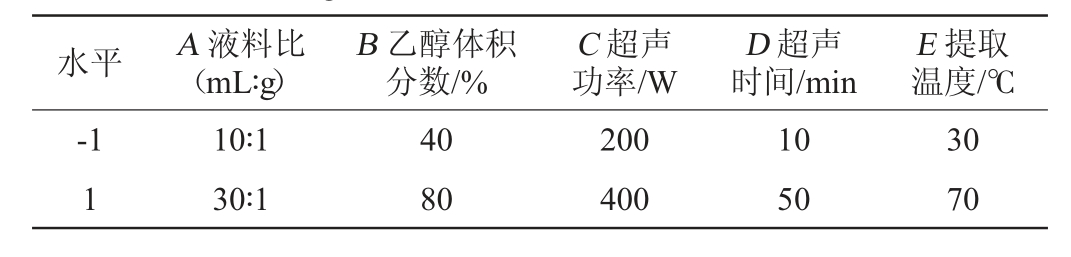
水平 A 液料比(mL∶g)E 提取温度/℃-1 1 B 乙醇体积分数/%C 超声功率/W D 超声时间/min 10∶1 30∶1 40 80 200 400 10 50 30 70
1.3.3 金樱子总多酚超声提取工艺优化单因素试验
根据PB试验结果,选取影响显著的因素,以金樱子总多酚得率为评价指标,固定其他条件,分别考察液料比(5∶1、10∶1、15∶1、20∶1、25∶1(mL∶g))、乙醇体积分数(40%、50%、60%、70%、80%)、超声时间(10 min、20 min、30 min、40 min、50 min)、提取温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)对金樱子总多酚得率的影响。
1.3.4 金樱子总多酚超声提取工艺优化响应面试验
在单因素试验的基础上,以金樱子总多酚得率(Y)为响应值,液料比(X1)、乙醇体积分数(X2)、超声时间(X3)和提取温度(X4)为影响因素,采用Design-Expert 10.0软件设计4因素3水平的Box-Behnken响应面试验,试验因素与水平见表2。
表2 金樱子总多酚超声提取工艺优化响应面试验因素与水平
Table 2 Factors and levels of response surface experiments for total polyphenols extraction process optimization from Rosa laevigata
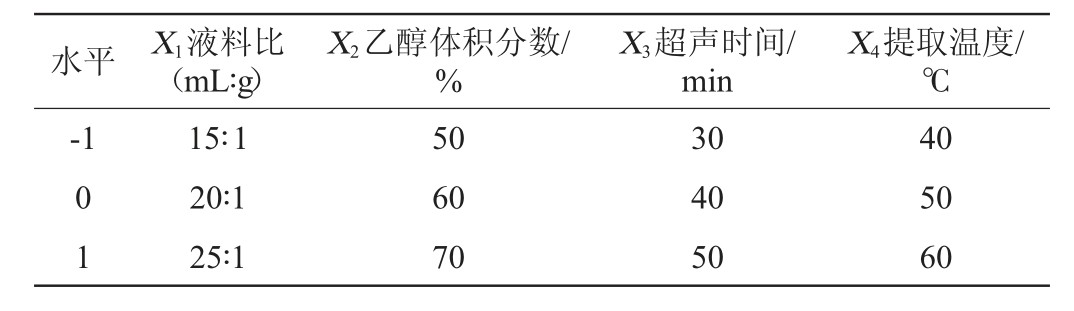
水平 X1液料比(mL∶g)X4提取温度/℃-1 X2乙醇体积分数/%X3超声时间/min 0 1 15∶1 20∶1 25∶1 50 60 70 30 40 50 40 50 60
1.3.5 总多酚含量的测定方法[9]
(1)标准曲线的绘制
精密称取没食子酸对照品5.0 mg于50 mL容量瓶中,去离子水溶解并定容至刻度,得到质量浓度为0.1 mg/mL对照品溶液。分别吸取0.2 mL、0.3 mL、0.4 mL、0.5 mL、0.6 mL没食子酸对照品溶液,置于10 mL容量瓶中,加入Folin-Ciocalteu试剂1 mL,摇匀,加入7%碳酸钠溶液2.5 mL,蒸馏水定容,70 ℃水浴反应40 min,采用紫外分光光度法,在波长760 nm处测定吸光度值。以没食子酸质量浓度为横坐标(X),吸光度值为纵坐标(Y)绘制标准曲线,得到标准曲线回归方程为Y=1.372X+0.056 4,(R2=0.999 1),说明在0~60 μg/mL质量浓度范围内线性关系良好。
(2)金樱子总多酚得率测定
精密吸取金樱子总多酚提取液1 mL,置于25 mL容量瓶中,蒸馏水稀释至刻度,摇匀,得稀释液。精密吸取稀释液0.5 mL置于10 mL容量瓶中,依次加入Folin-Ciocalteu试剂1 mL,摇匀,加入7%碳酸钠溶液2.5 mL,摇匀,蒸馏水定容,70 ℃水浴反应40 min后,在波长760 nm处测定吸光度值。采用标准曲线回归方程计算总多酚含量,并计算金樱子总多酚得率,其计算公式如下:
式中:Y为总多酚得率,%;W为金樱子取样量,g;C为总多酚质量浓度,mg/mL;V0为提取液的总体积,mL;D为稀释倍数。
1.3.6 抗氧化活性研究
(1)DPPH自由基清除作用
参考文献[18]报道的方法,精密量取不同质量浓度样品溶液各0.1 mL于棕色瓶中,加入0.1 mmol/L DPPH乙醇溶液3.9 mL,溶液混合均匀后,室温下避光放置40 min,于波长517 nm处测定吸光度值Ai。同法测定Aj(样品溶液+无水乙醇)和A0(DPPH溶液+无水乙醇),计算DPPH自由基清除率,其计算公式如下:
(2)ABTS+自由基清除作用
参考文献[19]报道的方法,准确称取0.006 76 g过硫酸钾和0.038 4 g ABTS,分别置于10 mL容量瓶中,蒸馏水定容,分别取ABTS+溶液和过硫酸钾溶液按照1∶1的比例混合,避光放置12~16 h,备用。将不同质量浓度样品溶液1 mL加入到8 mL稀释后的ABTS+溶液中,静置6 min后,于波长734 nm处测定吸光度值Ab。同法测定Ac(样品溶液+无水乙醇)和A0(ABTS+溶液+无水乙醇),计算ABTS+自由基清除率,其计算公式如下:
1.3.7 数据处理
所有试验重复3次,取平均值,结果用“平均值±标准差”表示;采用Origin 2019b软件进行数据处理和图片绘制。
2 结果与分析
2.1 金樱子超声提取工艺优化Plackett-Burman设计试验结果
金樱子超声提取工艺优化PB设计试验及结果见表3,方差分析见表4。
表3 Plackett-Burman试验设计与结果
Table 3 Design and results of Plackett-Burman experiments
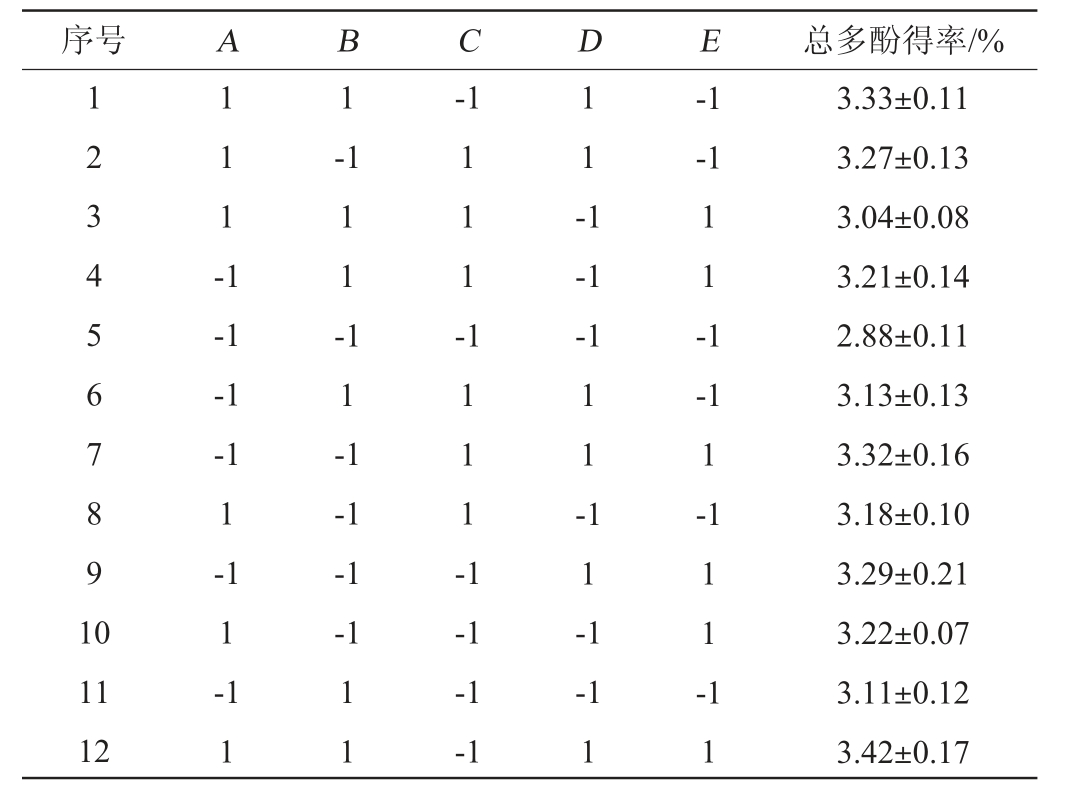
序号 A B C D E 总多酚得率/%1 2 3 4 5 6 7 8 9 1 0 1 1 1 -1 1-1-1-1-1 1 1 -1 1 1 -1 1 1 -1 1 1 --1-1-1 1-1 1-1 1-1-1 1 1 -1-1-1-1 1 1 1 1 -1 1 1 -1 1 -1-1 1-1 11 12 1 1-1-1-1-1 1 1 1 -1 1 3.33±0.11 3.27±0.13 3.04±0.08 3.21±0.14 2.88±0.11 3.13±0.13 3.32±0.16 3.18±0.10 3.29±0.21 3.22±0.07 3.11±0.12 3.42±0.17
表4 Plackett-Burman设计试验结果的方差分析
Table 4 Variance analysis of Plackett-Burman design test results
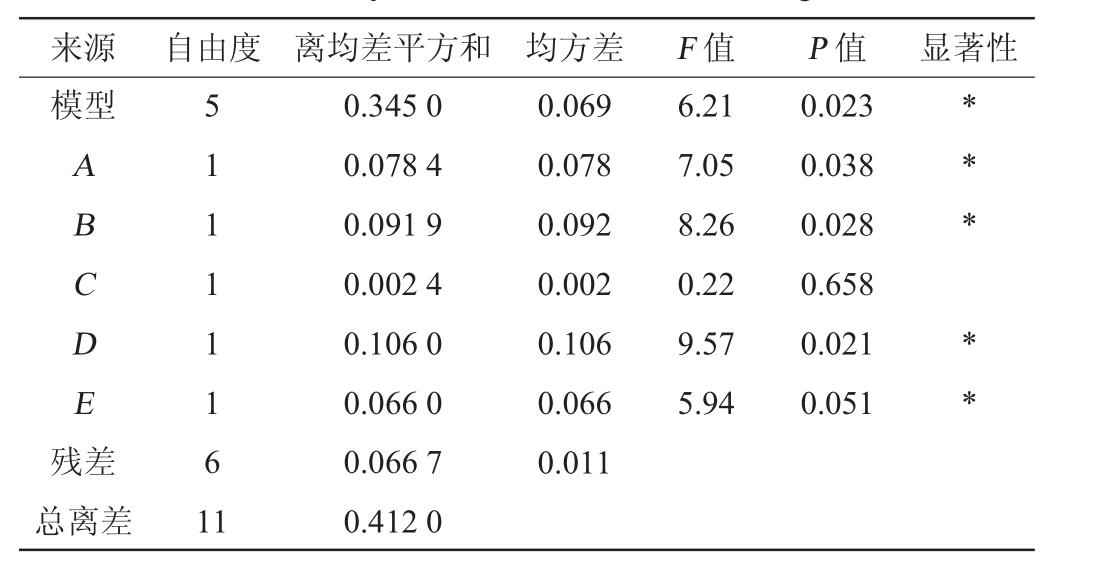
注:“*”表示对结果影响显著(P<0.05)。
来源 自由度 离均差平方和 均方差 F 值 P 值 显著性模型ABCDE残差0.069 0.078 0.092 0.002 0.106 0.066 0.011 6.21 7.05 8.26 0.22 9.57 5.94 0.023 0.038 0.028 0.658 0.021 0.051** * * *总离差5 1 1 1 1 1 6 1 1 0.345 0 0.078 4 0.091 9 0.002 4 0.106 0 0.066 0 0.066 7 0.412 0
由表4可知,模型的P<0.05,说明模型显著。乙醇体积分数(A)、液料比(B)、超声时间(D)、提取温度(E)对总多酚得率影响显著(P<0.05),而超声功率(C)对总多酚得率影响不显著(P>0.05)。基于Plackett-Burnham试验设计的响应分析,将液料比、乙醇体积分数、超声时间和提取温度确定为BB试验设计的自变量。
2.2 金樱子总多酚超声提取工艺优化单因素试验结果
2.2.1 液料比对总多酚得率的影响
液料比对金樱子总多酚得率的影响见图1。由图1可知,随着料液比增加总多酚得率呈先升高后降低的趋势,可能是由于随着溶剂比例的增加导致细胞的渗透压升高,从而加速了细胞内物质的溶出,使其得率升高[20]。当料液比为20∶1(mL∶g)时,总多酚得率达到最高,达到3.02%,此时总多酚基本溶出,继续增加溶剂比例,相当于将已溶出的多酚稀释,导致多酚浓度的降低[19],因此,确定最佳液料比为20∶1(mL∶g)。
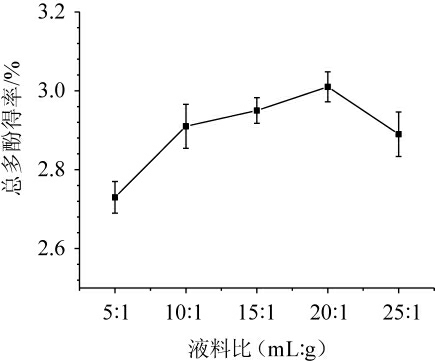
图1 液料比对总多酚得率的影响
Fig.1 Effect of liquid and solid ratio on total polyphenols yield
2.2.2 乙醇体积分数对总多酚得率的影响
乙醇体积分数对金樱子总多酚得率的影响见图2。由图2可知,随着乙醇体积分数的增加,总多酚得率呈先升高后下降的趋势,当乙醇体积分数为60%时,总多酚得率最高,达到3.28%,推测金樱子总多酚在体积分数60%的乙醇作用下扩散能力最强[14],乙醇体积分数>60%时,得率降低,可能是过高的乙醇体积分数会使溶液极性增大,导致多酚类物质溶解度降低[21],崔巧玉等[22]采用超声提取郁金香总多酚时也发现,乙醇体积分数为60%时总多酚得率最大,因此,确定最佳乙醇体积分数为60%。
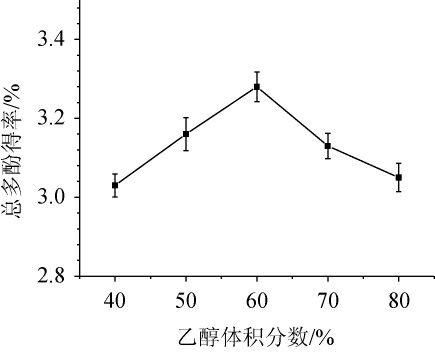
图2 乙醇体积分数对总多酚得率的影响
Fig.2 Effect of ethanol volume fraction on total polyphenols yield
2.2.3 超声时间对总多酚得率的影响
超声时间对金樱子总多酚得率的影响见图3。由图3可知,随着超声时间的增加,总多酚得率不断增加,当超声时间为40 min时达到最大值3.59%。表明超声时间在40 min以下,超声时间对总多酚得率有显著的正影响。继续延长超声时间,总多酚得率开始下降,可能是因为延长提取时间会使溶出的多酚分解或氧化[18]。因此,确定最佳超声时间为40 min。
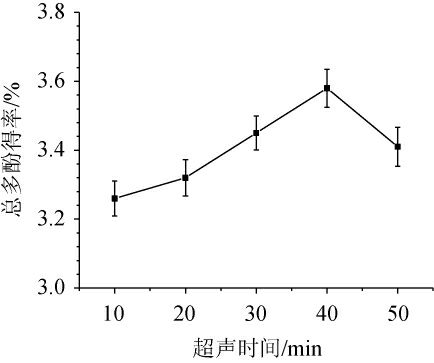
图3 超声时间对总多酚得率的影响
Fig.3 Effect of ultrasonic time on total polyphenols yield
2.2.4 提取温度对总多酚得率的影响
提取温度对金樱子总多酚得率的影响见图4。由图4可知,随着提取温度升高,总多酚得率升高,当提取温度为50 ℃时最高,达到3.78%,随后开始降低。分析原因可能是温度升高会提高提取物的溶解度和扩散系数,从而提高得率,但是过高温度会使该成分热稳定性发生变化,同时乙醇挥发也会影响成分的溶出[23]。因此,确定最优提取温度为50 ℃。
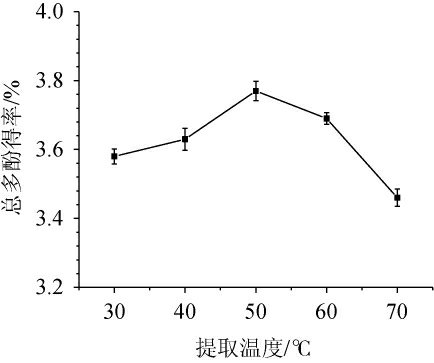
图4 提取温度对总多酚得率的影响
Fig.4 Effect of extraction temperature on total polyphenols yield
2.3 金樱子总多酚超声提取工艺优化响应面试验结果
在单因素试验的基础上,以金樱子总多酚得率(Y)为响应值,液料比(X1)、乙醇体积分数(X2)、超声时间(X3)和提取温度(X4)为影响因素,采用Design-Expert 10.0软件设计4因素3水平的Box-Behnken响应面试验,试验设计与结果见表5,方差分析见表6。
表5 金樱子总多酚超声提取工艺优化响应面试验设计与结果
Table 5 Design and results of response surface experiment for total polyphenols extraction process optimization from Rosa laevigata
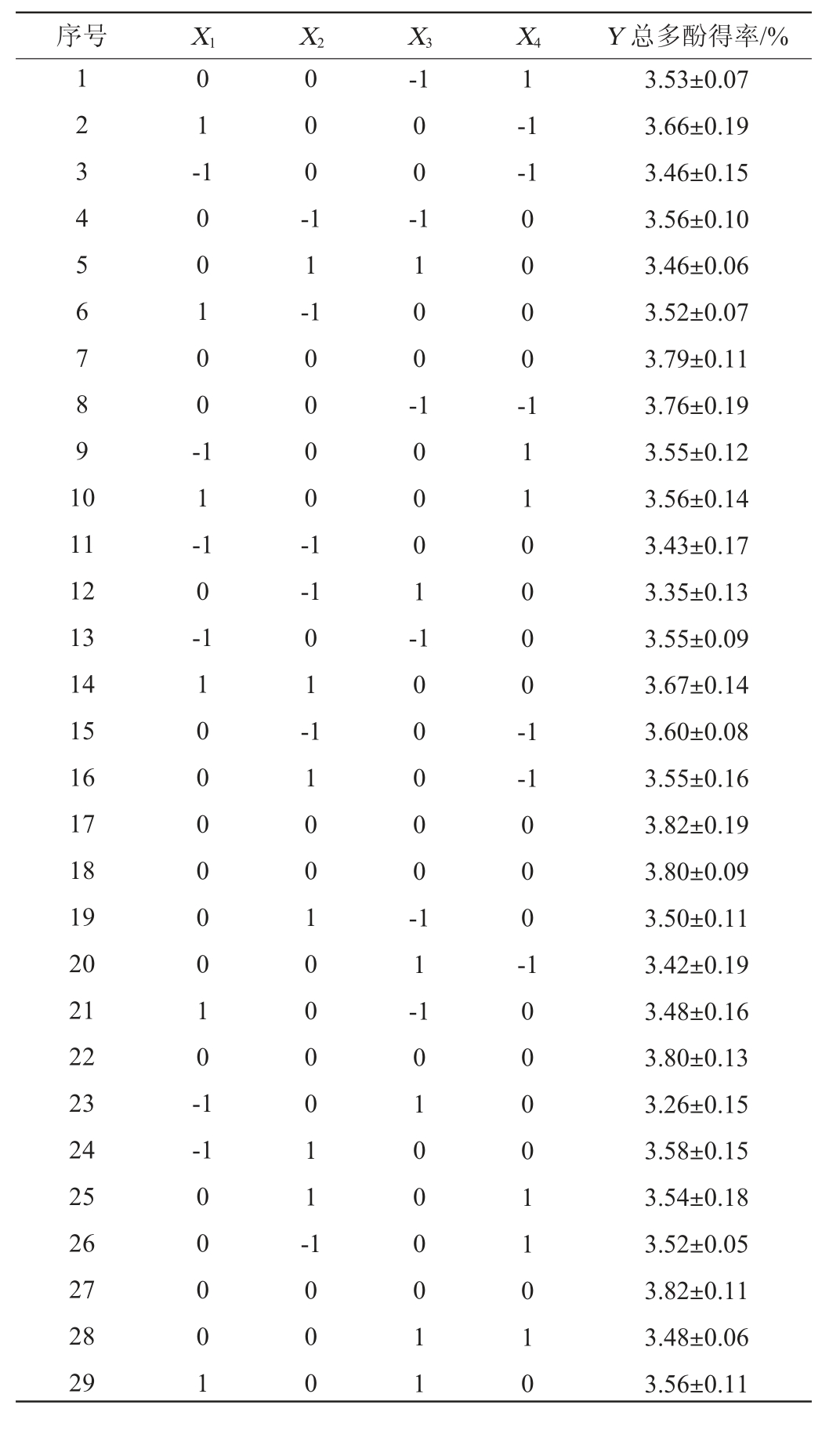
序号 X1 X2 X3 X4 Y 总多酚得率/%1 2 3 4 5 6 7 8 9 1 0 0 1 --1 1 1 0 0 1 0 0 -0 0 0 --1-1 1 1 -0 0 -1 1 0 0 -0 0 0 0 -11 12 13 14 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 1 1 -1 0 -1 0 0 0 0 -1-1 1 1 0 0 0 0 0 0 1 0 -1 0 1 -1 0 0 0 1 -1 0 0 0 0 0 -1 1 1 0 0 0 0 -1 1 1 0 0 1 0 0 0 0 1 1 --1 1 1 -0 0 0 --1 0 0 0 0 1 1 0 0 0 1 0 1 0 0 0 0 1 1 1 0 0 0 0 1 1 0 1 0 3.53±0.07 3.66±0.19 3.46±0.15 3.56±0.10 3.46±0.06 3.52±0.07 3.79±0.11 3.76±0.19 3.55±0.12 3.56±0.14 3.43±0.17 3.35±0.13 3.55±0.09 3.67±0.14 3.60±0.08 3.55±0.16 3.82±0.19 3.80±0.09 3.50±0.11 3.42±0.19 3.48±0.16 3.80±0.13 3.26±0.15 3.58±0.15 3.54±0.18 3.52±0.05 3.82±0.11 3.48±0.06 3.56±0.11
表6 回归模型方差分析
Table 6 Variance analysis of regression model
注:“*”表示对结果影响显著(P<0.05),“**”表示对结果影响极显著(P<0.01)。
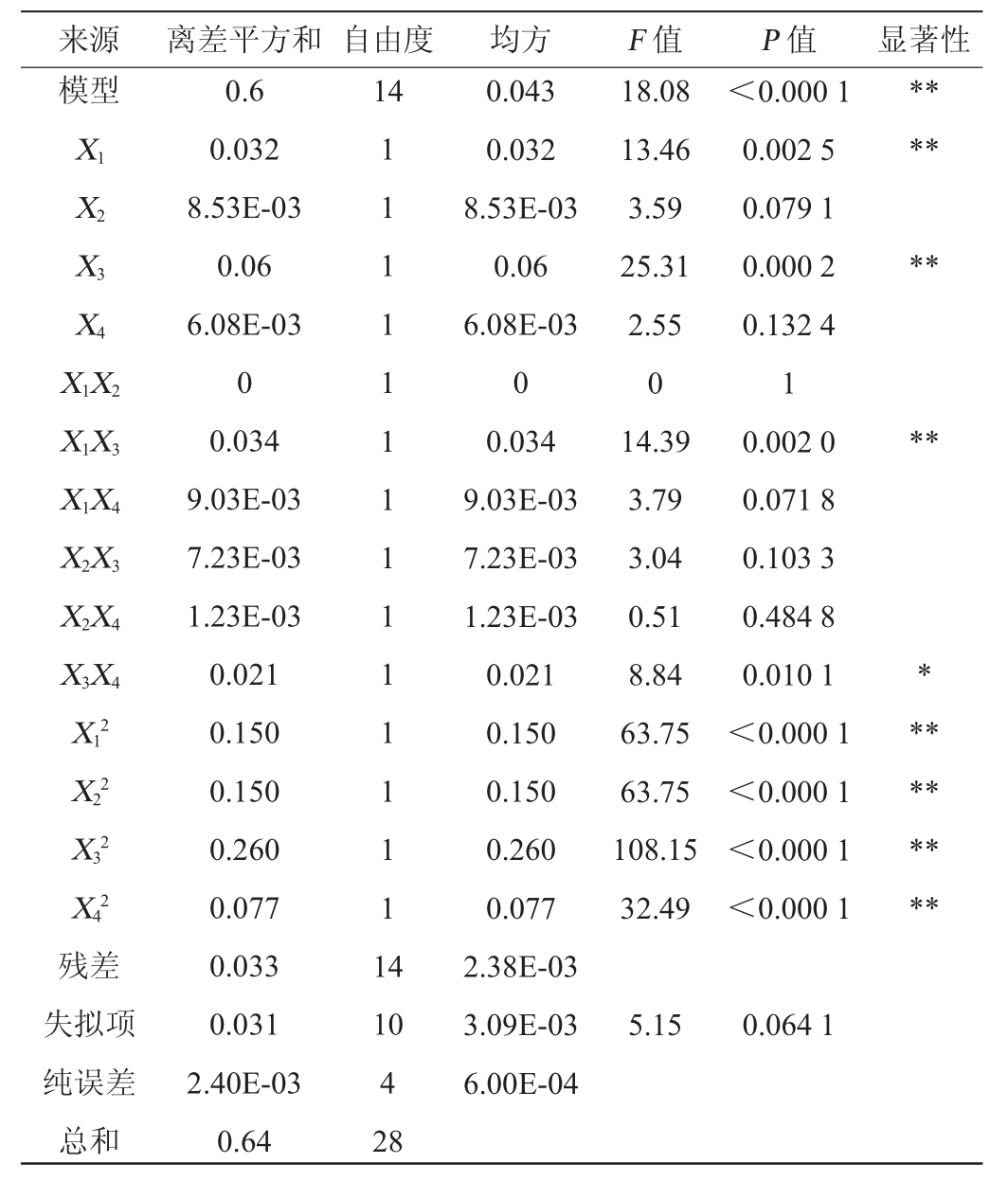
来源 离差平方和 自由度 均方 F 值 P 值 显著性模型X1 X2 X3 X4 X1X2 X1X3 X1X4 X2X3 X2X4 X3X4 X12 X22 X32 X42残差失拟项纯误差总和0.6 0.032 8.53E-03 0.06 6.08E-03 0 0.034 9.03E-03 7.23E-03 1.23E-03 0.021 0.150 0.150 0.260 0.077 0.033 0.031 2.40E-03 0.64 14 1 1 1 1 1 1 1 1 1 1 1 1 1 1 1 4 18.08 13.46 3.59 25.31 2.55 0 14.39 3.79 3.04 0.51 8.84 63.75 63.75 108.15 32.49<0.000 1 0.002 5 0.079 1 0.000 2 0.132 4 1 0.002 0 0.071 8 0.103 3 0.484 8 0.010 1<0.000 1<0.000 1<0.000 1<0.000 1*****************10 4 28 0.043 0.032 8.53E-03 0.06 6.08E-03 0 0.034 9.03E-03 7.23E-03 1.23E-03 0.021 0.150 0.150 0.260 0.077 2.38E-03 3.09E-03 6.00E-04 5.15 0.064 1
运用Design Expert 10.0软件对表5的响应值与各因素进行多元回归拟合,得回归方程:Y=-6.483 33+0.228 50X1+0.160 42X2+0.053 500X3+0.086 417X4-2.775 56E-019X1X2+1.850 00E-003X1X3-9.500 00E-004X1X4+4.250 00E-004X2X3+1.750 00E-004X4X4+7.250 00E-004X3X4-6.116 67E-003X12-1.529 17E-003X22-1.991 67E-003X32-1.091 67E-003X42。
由表6可知,模型的P<0.000 1,说明模型极显著(P<0.01);失拟项的P值(P=0.064 1)>0.05,说明失拟项不显著,表明失拟项与预测值之间拟合程度较高[24],因此该模型可作为金樱子总多酚提取工艺参数的预测模型。一次项X1、X3、交互项X1X3及二次项X12、X22、X32、X42对总多酚得率影响极显著(P<0.01),交互项X3X4对总多酚得率影响显著(P<0.05),其他项对结果影响不显著(P>0.05)。各因素对总多酚得率的影响为:超声时间>液料比>乙醇体积分数>提取温度。三维图和等高线能够预测和检验自变量的响应值及自变量之间的关系[25]。为更加直观展示响应值随自变量变化而变化的趋势,绘制交互项X1X3、X3X4对总多酚得率影响的响应面及等高线图,结果见图5。
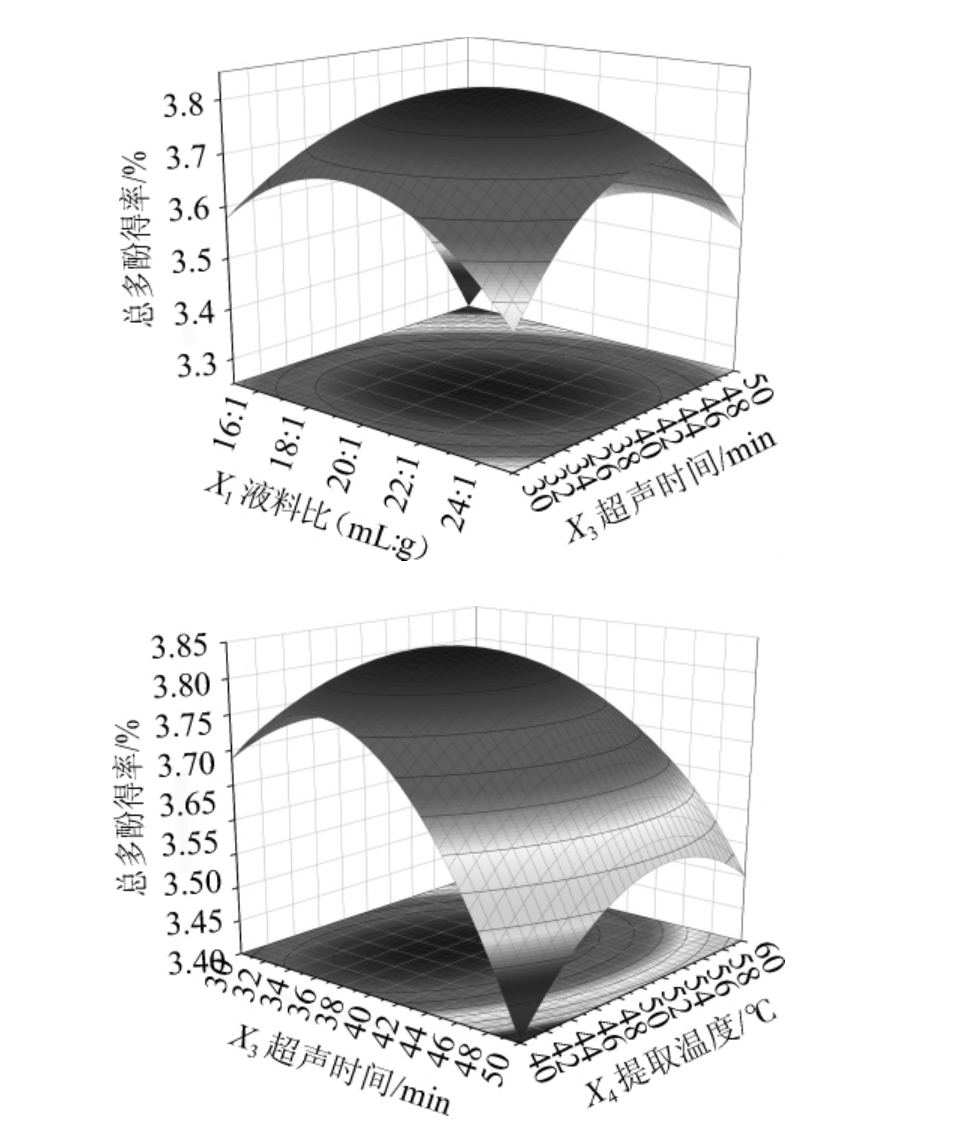
图5 超声时间与液料比、提取温度间交互作用对总多酚得率影响的响应面及等高线
Fig.5 Response surface plots and contour lines of effect of interaction between ultrasonic time, liquid and material ratio and extraction temperature on total polyphenols yield
由图5可知,超声时间与液料比、超声时间与提取温度间交互作用响应曲面陡峭,等高线呈椭圆形,对提取工艺有极显著影响,这与表6的方差分析结果相吻合。采用Design 10.0对回归方程进行最优求解,最终确定金樱子总多酚的最佳超声提取工艺条件为:液料比20.73∶1(mL∶g),乙醇体积分数60.52%,超声时间38.72 min,提取温度48.12 ℃,预测的总多酚得率为3.84%。结合生产实际操作的便利性,将提取工艺最佳参数调整为:液料比21∶1(mL∶g),乙醇体积分数61%,超声时间39 min,提取温度48 ℃。采用最优提取工艺,提取3批样品进行验证试验,测得总多酚平均得率为(3.85±0.39)%,与预测值接近,表明工艺稳定可行。
2.4 金樱子总多酚抗氧化试验结果
金樱子总多酚抗氧化试验结果见图6。由图6可知,金樱子总多酚在质量浓度0.2~1.2 mg/mL范围内,对DPPH自由基、ABTS+自由基都有一定的清除作用,且清除能力与质量浓度呈正相关。当金樱子质量浓度为1.2 mg/mL时,金樱子总多酚对DPPH自由基、ABTS+自由基清除率达到最大值,分别为79.97%、84.38%,低于同质量浓度下维生素C对DPPH自由基、ABTS+自由基的清除率。金樱子总多酚对不同自由基清除效果存在一定差异,其中,对ABTS+自由基清除能力强于DPPH自由基清除能力,其半数抑制浓度(half maximal inhibitory concentration,IC50)值分别为0.425 mg/mL、0.502 mg/mL。
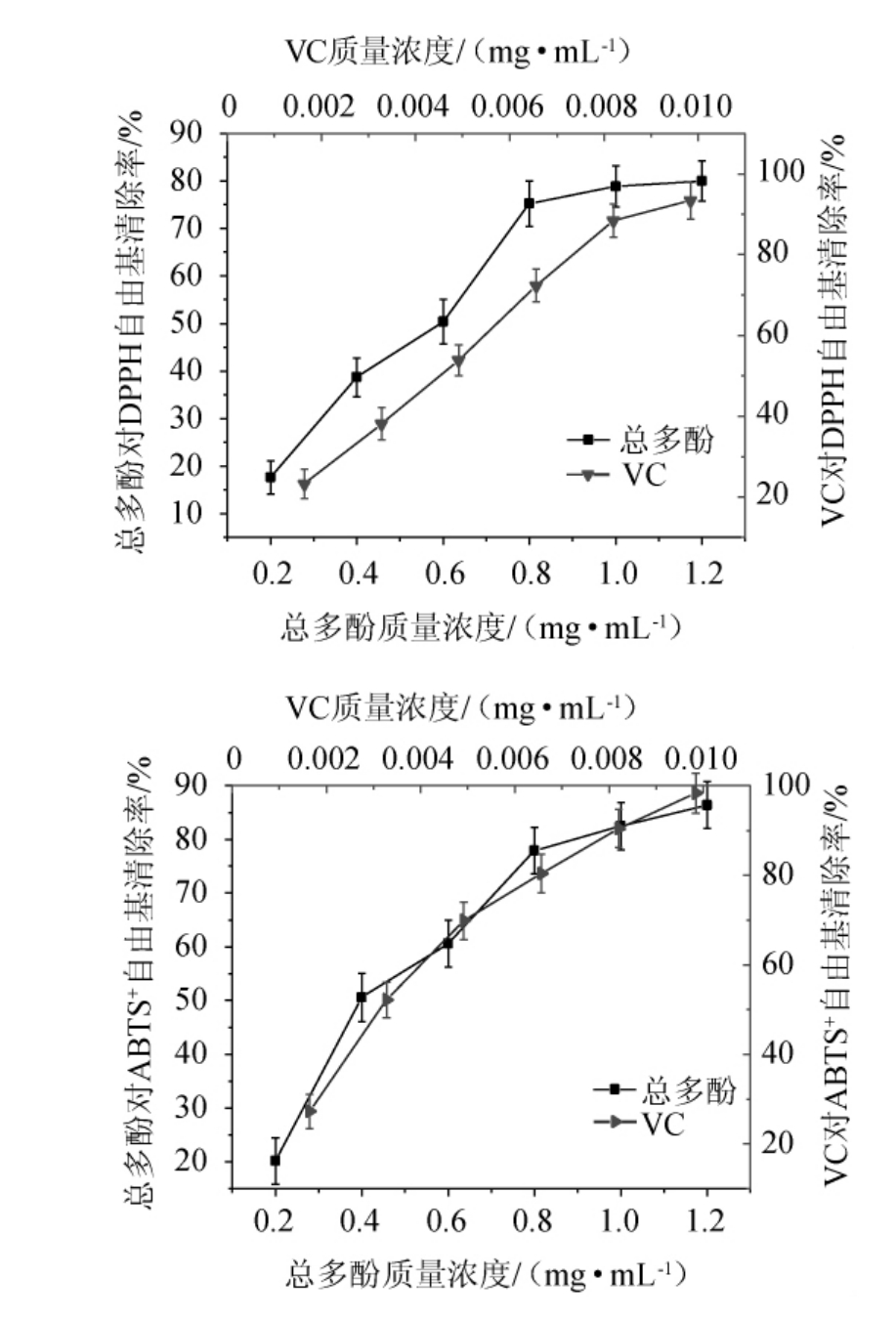
图6 金樱子总多酚体外抗氧化活性测定结果
Fig.6 Determination results of in vitro antioxidant activity of total polyphenols from Rosa laevigata
3 结论
本研究采用超声提取法提取金樱子总多酚,结合PB设计试验、单因素试验和响应面试验,以总多酚得率为评价指标,优化得到金樱子总多酚超声提取的最优提取工艺条件为液料比21∶1(mL∶g),乙醇体积分数61%,超声时间39min,提取温度48 ℃。在此优化条件下总多酚得率为3.84%,比优化前提高40.15%。金樱子总多酚的体外抗氧化活性研究表明,总多酚质量浓度在0.2~1.2 mg/mL内,对DPPH自由基、ABTS+自由基清除能力随着质量浓度增大而增大,当质量浓度在1.2 mg/mL时,达到最大值,分别为79.97%、84.38%,IC50值分别为0.425 mg/mL、0.502 mg/mL。说明金樱子总多酚具有一定抗氧化活性,但抗氧化能力弱于VC。后期将对金樱子中多酚类物质组成及抗氧化作用机制进行深入研究,为其在保健功能食品和药品领域中应用提供理论依据。
[1]国家药典委员会.中华人民共和国药典:一部[M].北京:中国医药科技出版社,2020:232.
[2]韩保昇.蜀本草[M].合肥:安徽科学技术出版社,2005:418.
[3]吴仪洛.本草从新[M].上海:上海科学技术出版社,1958:105.
[4]李进,谢云,定天明,等.一测多评法测定金樱子中黄酮类成分的含量[J].中药材,2021,44(2):400-403.
[5]陈倩,李娜,张雨林,等.HPLC法同时测定金樱子中7种多酚类成分[J].中药材,2018,41(2):394-396.
[6]王晓静,张丽,陈莉华,等.湘西野生金樱子多糖的抗氧化活性分析[J].药物分析杂志,2016,36(3):438-443.
[7]樊小瑞,李娆娆,林丽美,等.金樱子药材研究进展[J].中国药学杂志,2018,53(16):1333-1341.
[8]李娜,陈倩,刘赫男,等.金樱子总多酚降脂作用[J].中成药,2019,41(11):2773-2776.
[9]杨勇帮,胡栋宝,普晓燕,等.响应面法优化滇黄精多酚的提取工艺及抗氧化活性[J].西北药学杂志,2021,36(4):537-541.
[10]袁莹,李乐,陈静霞,等.多酚类化合物的提取及功效研究进展[J].粮食与油脂,2018,31(7):15-17.
[11]白晓琳,攀梓鸾,李璐,等.多酚类化合物与其他活性物质协同作用研究进展[J].食品工业科技,2019,40(6):308-311.
[12]ELEZ GAROFULIC' I,ZORIC' Z,PEDISIC' S,et al.UPLC-MS2 profiling of blackthorn flower polyphenols isolated by ultrasound-assisted extraction[J].J Food Sci,2018,83(11):2782-2789.
[13]WU L,GAMLATH C J,PATHAK R,et al.Ultrasound-the physical and chemical effects integral to food processing[J].Innov Food Proc Technol,2021,1(21):329-358.
[14]李品月,张威明,陶俊,等.应用响应面法优化芍药花瓣多酚超声提取工艺[J].北方园艺,2022(23):112-119.
[15] CHMELOVÁ D, ŠKULCOVÁ D, LEGERSKÁ B, et al.Ultrasonic-assisted extraction of polyphenols and antioxidants from picea abies bark[J].J Biotechnol,2020,314:25-33.
[16]段宙位,陈婷,陈龙,等.益智仁壳多酚不同提取工艺优化及其提取物的抗氧化性比较[J].食品科技,2021,46(4):180-187.
[17]王鹏旭,成传香,马亚琴,等.超声声学效应在果蔬酚类化合物提取中的研究进展[J].食品科学,2019,10(17):338-347.
[18]宁志雪,朱立斌,朱丹,等.响应面法优化超声波辅助提取黑加仑多酚工艺及其抗氧化活性分析[J].食品工业科技,2022,43(22):221-228.[19]王萍,王宇鹤,许刚,等.大叶秦艽总环烯醚萜苷3种提取工艺优化及其抗氧化活性研究[J].中成药,2022,44(8):2435-2443.
[20] TANG Z Z,LIN W J,YANG J,et al.Ultrasound-assisted extraction of Cordyceps cicadae polyphenols:Optimization,LC-MS characterization,antioxidant and DNA damage protection activity evaluation[J].Arab J Chem,2022,15(8):1-17.
[21] RIVERA-TOVAR P R, TORRES M D, CAMILO C, et al.Multi-response optimal hot pressurized liquid recovery of extractable polyphenols from leaves of maqui(Aristotelia chilensis[Mol.]Stuntz)[J].Food Chem,2021,357:1-11.
[22]崔巧玉,沈雯娟,孙小璐,等.郁金香总多酚提取工艺优化及其抗氧化活性研究[J].中成药,2022,44(6):1918-1922.
[23]ZHU S Y.Optimization of extraction of polyphenol from Panax quinquefolius L.using central composite design/response surface methodology[J].Starch,2021,73(7):1-5.
[24]王俪桦,应泽茜,孙贝贝,等.基于Box-Behnken设计-响应面法优化蜜麦麸的制备工艺[J].中草药,2021,52(12):3538-3543.
[25]陈帅,张兴涛,姜茹心,等.微波辅助超声法提取刺梨总皂苷的工艺研究[J].中国酿造,2019,38(10):149-153.