高脂血症是诱发急性胰腺炎(acute pancreatitis,AP)、脂肪肝和增加动脉粥样硬化性心血管等疾病(atherosclerotic cardiovascular disease,ASCVD)发生的主要因素[1],特别是在饮食不健康的人群中,长期摄入高脂饮食可引起外源性脂肪吸收增加,导致血清胆固醇、甘油三酯、游离脂肪酸水平升高[2],从而增加患病的风险。高脂血症又分为高胆固醇血症(hypercholesterolemia,HTC)、高甘油三酯血症(hypertriglyceridemia,HTG)、混合型高脂血症和低高密度脂蛋白血症四种,其中高胆固醇血症和高甘油三酯血症最为普遍[3]。
HTG和HTC是血脂异常的一种常见形式[4],据2012年全国调查结果显示,HTC的患病率为4.9%,HTG的患病率为13.1%[1]。研究表明,甘油三酯和胆固醇的升高与极低密度脂蛋白(very low density lipoprotein,VLDL)颗粒的增加有关,进而导致低密度脂蛋白胆固醇(low density lipoprotein cholesterol,LDL-C)增加和高密度脂蛋白胆固醇(high density lipoprotein cholesterol,HDL-C)降低[5]。迄今为止,治疗高脂血症的药物主要包括他汀类、贝特类药物,但是药物治疗通常存在局限性并对人体健康产生一定副作用[6]。在过去十年,基于体外试验、动物试验和临床试验,摄入活益生菌已经被证实可以治疗高脂血症[7]。乳酸菌作为潜在的益生菌具有多种健康益处,包括缓解糖尿病、肥胖、降低胆固醇以及抗炎等作用[8]。如植物乳杆菌(Lactobacillus plantarum)84-3和发酵乳杆菌(Lactobacillus fermentium)87-1作为干预组,通过调节大鼠结肠粪便菌群可降低糖尿病大鼠空腹血糖水平、血清中总胆固醇含量等作用[9]。但是,同时具有高效缓解胆固醇和甘油三酯升高的乳酸菌鲜见报道[10],特别是分离自发酵肉制品中的乳酸菌。
腊肠、腊肉、咸肉等发酵肉制品作为我国常见的食物同时也是乳酸菌的良好来源[11]。LEE M S等[12]从发酵肉制品中分离出解淀粉芽孢杆菌(Bacillus amyloliquefaciens),并对其优良性能进行了分析论证,证实其是一种优良的益生菌。李权威[13]通过测定脂肪含量、过氧化值和硫代巴比妥酸值的变化情况,发现瑞士乳杆菌(Lactobacillus helveticus)TR13和戊糖片球菌(Pediococcus pentosaceus)RQ3-1-7对于发酵香肠中脂肪的氧化能够起到有效的调控作用。从发酵肉制品中筛选出的乳酸菌具有良好益生潜力,并可能具有更好的调控脂类代谢的功能,这对预防和辅助治疗高脂血症具有重要意义。
本研究采用溶钙圈法从发酵肉制品中分离乳酸菌,通过清除胆固醇、甘油三酯能力及胆盐水解酶(bile salt hydro lase,BSH)活性测定筛选潜在改善高脂血症乳酸菌菌株。在此基础上,结合体外益生特性研究,利用主成分分析(principal component analysis,PCA)确定最终目标菌株,通过形态观察及分子生物学技术对其进行菌种鉴定。最后评价该菌株对HepG2细胞高脂模型中胆固醇和甘油三酯含量的影响能力,为后期体内动物实验和改善高脂血症乳酸菌类产品的开发奠定理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
阿勒泰腊肠、阿勒泰风干牛肉、阿勒泰风干马肉、长春腊肠、南昌腊肠、合肥咸肉等传统自然发酵制品:农家自制发酵食品,保存于吉林农业大学食品科学与工程学院动物产品及功能食品研究实验室。
HepG2细胞:保存于吉林农业大学食品科学与工程学院动物产品及功能食品研究实验室。
1.1.2 试剂
过氧化氢、无水乙醇、冰乙酸、甘油、氯化钠、氢氧化钠、牛胆盐、邻苯二甲醛、甘油三酯、胆固醇、浓硫酸(均为分析纯)、正己烷(色谱纯):长春翊博生物有限公司;总胆固醇(total cholesterol,TC)试剂盒、总甘油三酯(total triglycerides,TG)试剂盒:南京建成生物工程研究所。
模拟人工胃液:1.64 mL稀盐酸加80 mL去离子水,用1 mol/L盐酸调pH值至2.5,加去离子水定容至100 mL,加1 g胃蛋白酶混匀溶解,过0.22 μm滤膜除菌。
模拟人工肠液:0.1 g胰蛋白酶,1.8 g猪胆盐溶于无菌溶剂(1.1 g NaHCO3,0.2 g NaCl及100 mL蒸馏水),用0.1 mol/L NaOH调pH值至8.0,过0.22 μm滤膜除菌。
1.1.3 培养基
MRS液体培养基[14]:葡萄糖20 g/L、牛肉膏10 g/L、蛋白胨10 g/L、酵母浸粉5 g/L、吐温-80 1 g/L、乙酸钠5 g/L、无水硫酸镁0.5 g/L、磷酸氢二钾2 g/L、柠檬酸二铵2 g/L、硫酸锰0.25 g/L,pH=6.0±0.2,121 ℃高压蒸汽灭菌20 min。MRS固体培养基:在MRS液体培养基中添加20 g/L琼脂粉。
选择培养基[14]:MRS固体培养基添加20 g/L碳酸钙。121 ℃高压蒸汽灭菌20 min。
胆固醇-MRS液体培养基[15]:在MRS液体培养基的基础上加入0.5 g/L胆固醇,5 mL/L吐温-80,1.0 g/L牛胆盐,0.5 g/L蔗糖酯,25 mL/L冰乙酸。121 ℃高压蒸汽灭菌20 min。
甘油三酯-MRS液体培养基[16]:在MRS液体培养基的基础上加入0.2 g/L甘油三酯,吐温-80 20 mL/L。121 ℃高压蒸汽灭菌20 min。
胆盐水解酶-MRS固体培养基[17]:在MRS液体培养基的基础上添加牛胆盐3 g/L,巯基乙酸钠2 g/L,氯化钙0.37 g/L,琼脂粉20 g/L。121 ℃高压蒸汽灭菌20 min。
细胞完全培养基:向杜氏改良培养基(dulbecco's modified eagle medium,DMEM)中加入10 mL/100 mL胎牛血清,1 mL/100 mL双抗,4 ℃保存。
1.2 仪器与设备
THZ-300C型恒温培养摇床:上海一恒科学仪器有限公司;PerkinElmer Lambda 365型紫外可见分光光度计:珀金埃尔默仪器(上海)有限公司;LDZM-80KCS型立式压力蒸汽灭菌锅:上海申安医疗器械厂;SI250B型生化培养箱:北京东联哈尔仪器制造有限公司。
1.3 方法
1.3.1 乳酸菌的分离及初步鉴定
参照文献[14]并稍加修改,无菌条件下,将切碎的传统自然发酵肉制品样品(10 g)与无菌生理盐水(100 mL)混合,均质拍打机均质2 min后进行梯度稀释,将稀释液涂布于选择培养基上,37 ℃恒温培养48 h。根据菌落大小、形态的差异及是否存在溶钙圈进行不同单菌落的挑选,并分离纯化菌株。观察纯化菌株的形态并筛选出革兰氏阳性和触酶阴性菌株作为初筛菌株[18],扩大培养到第三代,采用-80 ℃甘油保藏法保藏菌株,备用。
1.3.2 乳酸菌的筛选
具有清除胆固醇能力乳酸菌的筛选:将保存的菌株接种于MRS液体培养基中,37 ℃培养24 h,重复2次,以达到活化的目的。以5%(V/V)的接种量接种到胆固醇-MRS液体培养基中,37 ℃厌氧培养24 h,参照文献[15,19]的方法测定胆固醇含量,并计算胆固醇清除率。
具有清除甘油三酯能力乳酸菌的筛选:将具有降胆固醇作用的菌株以5%(V/V)的接种量接种于甘油三酯-MRS培养基中,37 ℃恒温培养24 h,根据TG试剂盒说明书测定甘油三酯含量,并计算甘油三酯清除率[16,20]。
BSH活性的测定:参考文献[17,21]。
1.3.3 益生特性研究
胃肠液耐受力的测定:参考文献[22],并计算菌株存活率,其计算公式如下:
式中:A0为空白组的吸光度值;At为经过模拟人工胃肠液处理组的吸光度值。
胆盐及酸耐受力的测定:参考文献[17,23-24]。
表面疏水性的测定:参考文献[24-27],并计算疏水性,其计算公式如下:
式中:A0为0 h时的吸光度值;At为加入溶剂后4 h的吸光度值。
自聚集能力的测定:参考文献[17,24],并计算自聚集能力,其计算公式如下:
式中:At表示为各时间的吸光度值,A0表示为菌株初始吸光度值。
1.3.4 菌株的鉴定
形态观察:将筛选得到的优良乳酸菌菌株接种于MRS固体培养基中,37 ℃培养48 h,选择表面光滑的单菌落重复纯化两次,观察菌落形态。用接种环挑取适量生长良好的分离株菌落,涂片、固定于载玻片上,放置待冷后进行革兰氏染色。在显微镜下观察细胞形态[28]。
生理生化鉴定:使用乳酸菌成套生化试剂盒对筛选得到的菌株进行生理生化试验,具体操作按照其说明书进行。参照《常见细菌系统鉴定手册》[29]对菌株进行初步鉴定。
分子生物学鉴定:由上海生工生物工程技术服务公司对筛选菌株的16S rDNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)并测序。将测序结果提交至美国国家生物技术信息中心(national center of biotechnology information,NCBI)的GenBank数据中,进行基本局部比对搜索工具(basic local alignment search tool,Blast)同源性比对分析,选取同源性较高的模式菌株,采用MEGA 5软件中的邻接(neighbor-joining,NJ)法构建系统发育树。
1.3.5 菌株的生长曲线及产酸曲线
筛选菌株活化2代后,以2%(V/V)的接种量接种于MRS液体培养基中,37 ℃厌氧培养,间隔2 h取样,在波长600 nm处测定吸光度值,并测定培养液pH值,绘制生长曲线及产酸曲线[17,30]。
1.3.6 菌株对HepG2细胞高脂模型的影响
筛选菌株的培养:将筛选菌株接种于MRS液体培养基中,37 ℃恒温培养12 h,将其在4 ℃、5 000 r/min条件下离心15 min,取上清为无细胞上清液,菌体沉淀用无菌PBS洗涤2次,并将菌体细胞重悬于PBS溶液中得到菌悬液,菌体浓度为108 CFU/mL。
HepG2细胞的培养:将冻存的HepG2细胞复苏传代,采用1 mL胰酶消化后悬浮计数,调整细胞浓度为2×105个/mL,并接种于含有DMEM培养液的培养皿中,在CO2培养箱中37 ℃恒温培养24~48 h。
高脂模型的建立:当HepG2细胞培养24~48 h后,细胞贴壁达到70%,单层贴满培养皿底部时,吸去培养液,根据周佳敏[31]的方法,分别重新加入10mL含有20μg/mL胆固醇、20 μg/mL甘油三酯溶液的DMEM培养液,37 ℃培养24 h。
试验分组:对照组(未处理的正常细胞)、模型组(处理后的细胞DMEM培养液)、阳性药物组(在处理后的细胞DMEM培养液中加入1 μg/mL辛伐他汀,37 ℃培养24 h)、菌悬液组(在处理后的细胞DMEM培养液中加入100 μL/mL菌悬液,37 ℃培养24 h)、无细胞上清液组(在处理后的细胞DMEM培养液中加入100 μL/mL无细胞上清液,37 ℃培养24 h)[31-32]。
培养结束后的细胞用PBS清洗2遍,弃去上清液,加入0.25%胰酶消化3 min后,加细胞完全培养基终止消化,将各组细胞悬浮液1 500 r/min离心5 min,弃上清,用PBS清洗2次,超声裂解,用TC、TG试剂盒测定细胞内胆固醇和甘油三酯浓度[33]。
1.3.7 数据处理
所有试验重复3次,结果以“平均值±标准差”表示。采用单因素方差分析对数据进行差异显著性分析,并用GraphPad Prism 8软件绘制图。采用SPSS 23.0进行PCA。
2 结果与分析
2.1 乳酸菌的分离
通过选择培养基从腊肠、风干牛肉、风干马肉等传统发酵肉质品中共分离出具有溶钙圈以及典型乳酸菌菌落形态的菌株,通过革兰氏染色镜检以及触酶试验共筛选出125株乳酸菌,编号分别为FN、FH1、FH5~FH6、FH8、FM1~FM8、AC19、ACX1~ACX8、Y4、Y6~Y8、AR1~AR9、AN、HL2~HL10、HX1~HX2、NC1~NC8、FJ9~FJ10、S3~S4、S7~S11、S13、S16、S19~S21、G1~G13、ZD1~ZD12、LC1~LC11、SC1~SC15、XH、SS、XW、SR、WP。以上菌株在选择培养基中均出现溶钙圈、镜检形态多为圆球和长杆状、革兰氏染色为阳性且触酶试验为阴性,初步认定这些分离菌株属于乳酸菌。
2.2 具有潜在改善高脂血症乳酸菌菌株的筛选
2.2.1 具有清除胆固醇能力乳酸菌菌株的筛选
有研究表明,乳酸菌可以通过吸附作用在体外清除胆固醇[34],通过测定125株乳酸菌对胆固醇的清除率发现,125株乳酸菌对胆固醇的清除率为1.08%~78.69%,其中,21株乳酸菌的胆固醇清除率>50%,结果见图1。由图1可知,菌株G12的对胆固醇清除能力最高,清除率达到78.69%,此外,菌株LC4与G13对胆固醇清除率也达到了70%以上。高宇等[35]从四川泡菜中筛选出一株体外清除胆固醇能力为42.7%的植物乳杆菌(Lactiplantibacillus plantarum)LAB4;陈显玲等[36]从来宾酒糟酸菜中筛选出1株具有清除胆固醇能力的乳酸菌,优化发酵条件后胆固醇清除率为61.56%,但其均未测定甘油三酯清除率。为了筛选出同时具有高效清除胆固醇和甘油三酯的菌株,选取清除能力>50%的21株菌进行甘油三酯清除能力的测定。
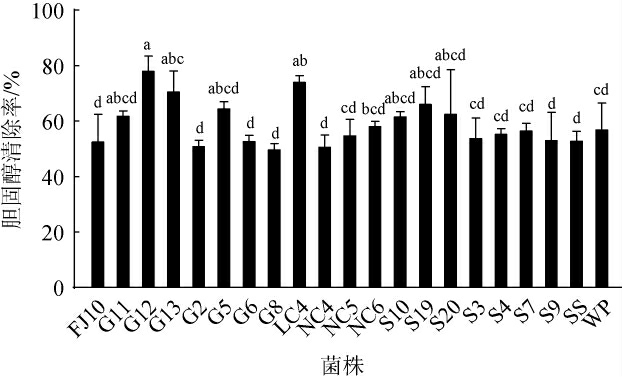
图1 21株乳酸菌菌株对胆固醇的清除能力
Fig.1 Cholesterol scavenging ability of 21 lactic acid bacteria strains
不同小写字母表示差异显著(P<0.05)。下同。
2.2.2 具有清除甘油三酯能力乳酸菌菌株的筛选
相比于乳酸菌清除胆固醇能力的研究,关于乳酸菌清除甘油三酯的研究较少。21株乳酸菌菌株对甘油三酯的清除能力见图2。由图2可知,21株乳酸菌菌株对甘油三酯的清除率为32.51%~91.65%,其中菌株LC4对甘油三酯的清除能力最高,达到91.65%,菌株S20对甘油三酯的清除能力最低,为32.51%。其中,菌株LC4、G5、NC6、G11、NC5、S10、WP、G13对胆固醇和甘油三酯的清除率均>55%。高玉荣等[20]在传统腊肠中分离出一株胆固醇清除率为65.23%、甘油三酯清除率为42.93%的菌株G1-28;王丽等[37]研究发现,菌株X1对甘油三酯的清除率为17.72%,对胆固醇的清除率为18%。以上报道所筛选菌株的甘油三酯及胆固醇清除率的综合能力均低于本研究所筛选的8株乳酸菌,因此,选取这8株乳酸菌菌株进行研究。
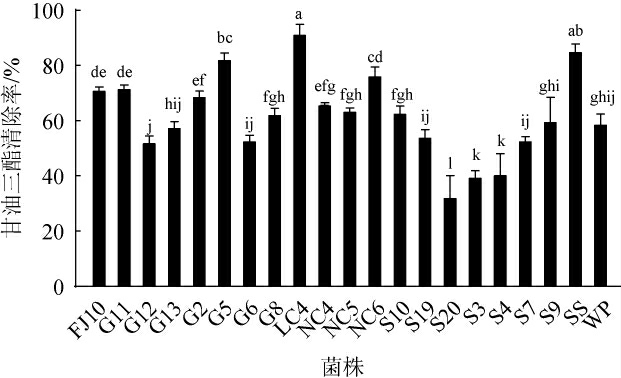
图2 21株乳酸菌菌株对甘油三酯的清除能力
Fig.2 Triglyceride scavenging ability of 21 lactic acid bacteria strains
2.2.3 胆盐水解酶的定性测定
BSH来源于乳酸菌的代谢,BSH可以将结合态的胆盐转变为游离胆酸和氨基酸,胆固醇可以与游离胆酸形成复合物促成共沉淀反应,BSH还能减少宿主在肠道中对脂质的吸收,从而减轻因能量摄入过多导致的体质量增加[22]。8株乳酸菌菌株的BSH定性检测结果见图3。由图3可知,滤纸片周围均产生了不同粗细的白色沉淀圈,表明8株菌均有BSH活性。其中菌株LC4、G13、G5的沉淀圈较大,表明这3株菌的BSH活性较高,且这3株菌株的沉淀圈大小与菌株清除胆固醇能力相对一致,因此推断菌株间的清除胆固醇能力的差异可能受菌株间BSH活性大小的影响。综上,选取BSH活性较高的菌株LC4、G13、G11、S10、G5进行后续试验。
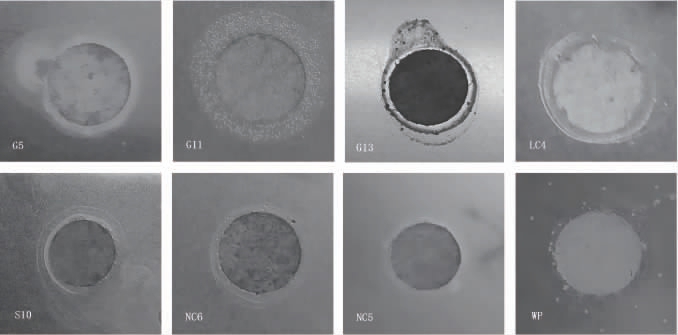
图3 8株乳酸菌菌株胆盐水解酶酶定性检测结果
Fig.3 Qualitative results of bile salt hydrolase activity of 8 lactic acid bacteria strains
2.3 乳酸菌的益生特性研究
2.3.1 模拟胃肠液耐受力的测定
对5株乳酸菌菌株进行模拟胃肠液耐受试验,评价其对胃肠道环境的耐受能力,结果见图4。由图4可知,5株乳酸菌菌株在pH=2.5的模拟胃液环境下存活率均有所降低,但均能存活3 h,其中菌株LC4的耐受力最强,3 h时存活率为87.57%,其次为菌株G5,3 h时存活率为75.07%。将在胃液中存活3 h的菌株接种到模拟人工肠液中观察8 h,发现5株乳酸菌菌株随着处理时间的增长,存活率逐渐降低,但均高于50%,其中,菌株LC4在模拟人工肠液中处理8 h时,存活率最高,为72.7%。
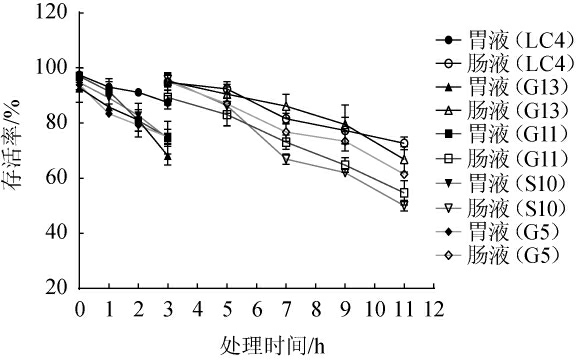
图4 5株乳酸菌菌株对模拟胃肠液的耐受能力
Fig.4 Tolerance of 5 lactic acid bacteria strains to simulated gastroenteric fluid
2.3.2 胆盐耐受力的测定
肠道内胆盐浓度为0.03~0.3%[38],过量的胆汁盐会破坏微生物膜,导致益生菌死亡,从而影响益生菌在肠道中的定植,菌株在高盐环境下生存的能力是益生菌在体内发挥益生特性的重要条件[24]。5株乳酸菌菌株在含有0.3%牛胆盐的MRS液体培养基中37 ℃培养24 h后的生长情况见图5。由图5可知,与空白组相比,5株乳酸菌菌株在含有0.3%牛胆盐的培养基中活菌数明显降低,其中菌株LC4在培养24 h后活菌数相对较高,为9.79 lg(CFU/mL)。
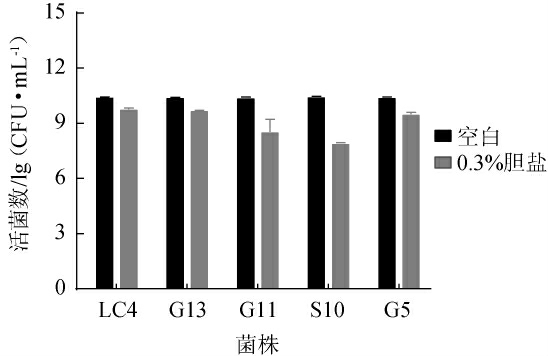
图5 5株乳酸菌菌株对胆盐的耐受能力
Fig.5 Tolerance of 5 lactic acid bacteria strains to bile salt
2.3.3 酸耐受力的测定
菌株在低pH环境下生存的能力是作为益生菌的一个重要条件,5株乳酸菌菌株的酸耐受力结果见图6。由图6可知,除菌株G13外,其他乳酸菌菌株均具有较好的耐酸性。其中,菌株G5耐酸性最好,4h后的活菌数为7.74lg(CFU/mL),其次为菌株LC4,活菌数为7.67 lg(CFU/mL),菌株G11、S10的活菌数均>7.00 lg(CFU/mL)。
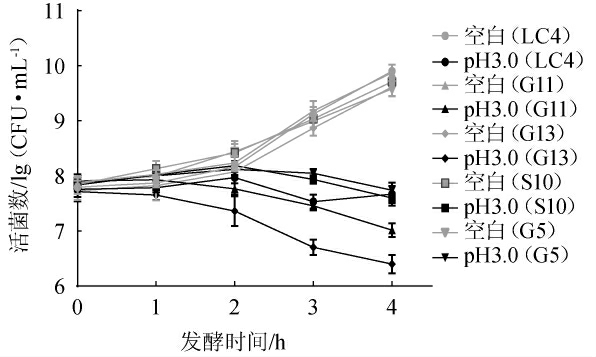
图6 5株乳酸菌菌株对酸的耐受能力
Fig.6 Tolerance of 5 lactic acid bacteria strains to acid
2.3.4 表面疏水性的测定
乳酸菌的表面疏水性越高,表示其具有更高的粘附力,从而具有更好的肠道定植能力[39]。5株乳酸菌菌株的表面疏水性见图7。由图7可知,5株乳酸菌菌株对二甲苯均有较高的亲和力,这与LIN J X等[24]研究结果一致。其中,菌株LC4的疏水性极显著高于其他四株(P<0.05),疏水性达到78.13%。5株乳酸菌菌株在乙酸乙酯中表现的疏水性为26.40%~37.66%,其中菌株G13的疏水性最高,为37.66%。5株乳酸菌菌株对于氯仿的亲和力较低,且菌株G13的疏水性显著低于其他菌株(P<0.05),为4.08%。
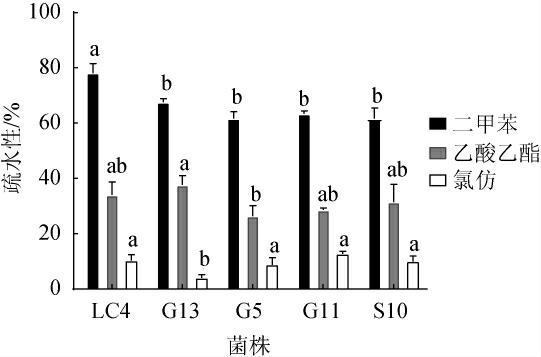
图7 5株乳酸菌菌株的表面疏水性
Fig.7 Surface hydrophobicity of 5 lactic acid bacteria strains
不同小写字母表示不同菌株的疏水性差异显著(P<0.05)。
2.3.5 自聚集能力的测定
益生菌的自聚集对细菌的定植和保护至关重要,是益生菌发挥益生作用的先决条件[24]。5株乳酸菌菌株的自聚集能力见图8。由图8可知,5株乳酸菌菌株的自聚集随着时间的推移而增加,在24 h时,所有菌株的自聚集能力均>30%,其中菌株LC4的自聚集能力最高,为52.77%,这与LIN J X等[24]研究结果一致。
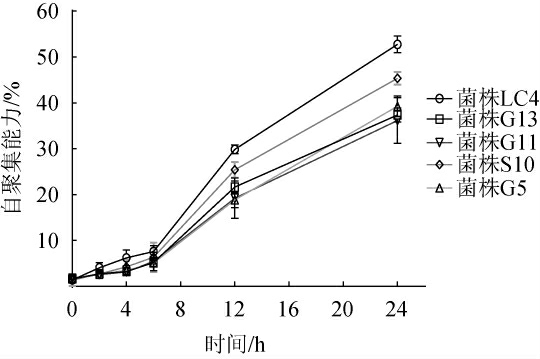
图8 5株乳酸菌菌株的自聚集能力
Fig.8 Auto-aggregation ability of 5 lactic acid bacteria strains
2.4 基于益生特性乳酸菌菌株的主成分分析结果
为评估5株乳酸菌菌株的综合能力,对胆固醇清除能力、甘油三酯清除能力、模拟胃肠液耐受力、酸耐受力、胆盐耐受力、疏水性、自聚集能力8个指标进行PCA,结果见表1及表2。由表1可知,PC1在模型中的贡献率为48.24%,主要代表自聚集能力和降胆固醇能力;PC2在模型中的贡献率为24.63%,主要代表疏水性和模拟人工胃液耐受力;PC3在模型中的贡献率为11.10%。由表2可知,菌株LC4的综合得分最高。综上,通过PCA分析筛选出了一株综合益生特性较好的菌株LC4。
表1 主成分提取结果及成分得分系数
Table 1 Principal component extraction results and component score coefficient
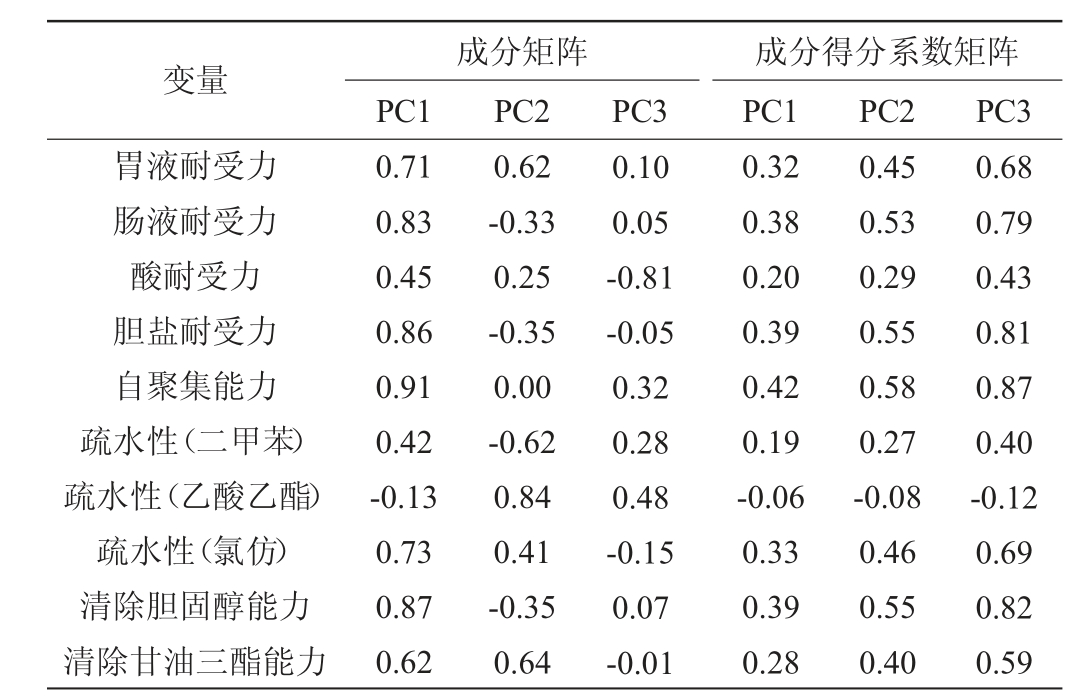
变量胃液耐受力肠液耐受力酸耐受力胆盐耐受力自聚集能力疏水性(二甲苯)疏水性(乙酸乙酯)疏水性(氯仿)清除胆固醇能力清除甘油三酯能力PC2成分得分系数矩阵PC1 PC2 PC3 0.71 0.83 0.45 0.86 0.91 0.42-0.13 0.73 0.87 0.62成分矩阵PC1 PC3 0.10 0.05-0.81-0.05 0.32 0.28 0.48-0.15 0.07-0.01 0.62-0.33 0.25-0.35 0.00-0.62 0.84 0.41-0.35 0.64 0.32 0.38 0.20 0.39 0.42 0.19-0.06 0.33 0.39 0.28 0.45 0.53 0.29 0.55 0.58 0.27-0.08 0.46 0.55 0.40 0.68 0.79 0.43 0.81 0.87 0.40-0.12 0.69 0.82 0.59
表2 主成分分析综合因子得分结果
Table 2 Results of composite factor score by principal component analysis
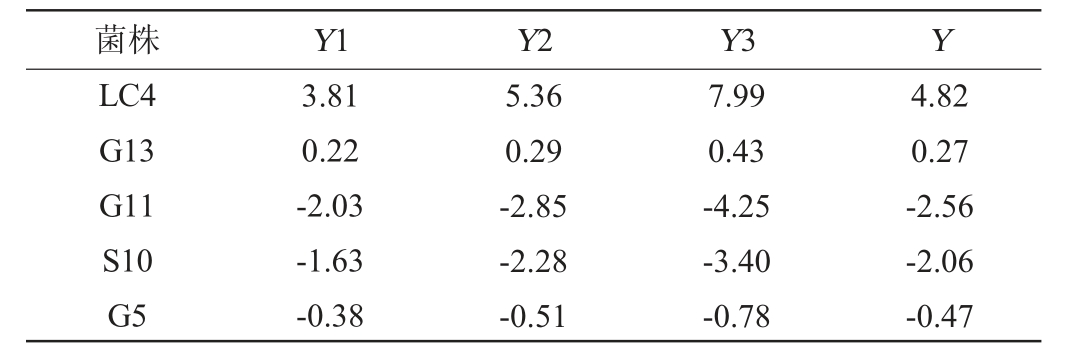
注:Y为PCA综合因子得分。
菌株 Y1 Y2 Y3 Y LC4 G13 G11 S10 G5 3.81 0.22-2.03-1.63-0.38 5.36 0.29-2.85-2.28-0.51 7.99 0.43-4.25-3.40-0.78 4.82 0.27-2.56-2.06-0.47
2.5 菌株LC4的鉴定
2.5.1 形态观察
菌株LC4的菌落及细胞形态见图9。由图9可知,菌株LC4在MRS固体培养基上的菌落表面光滑,中部稍微凸起,边缘整齐,呈白色。菌株LC4的细胞分布不规则,呈圆球状,且革兰氏染色呈阳性。
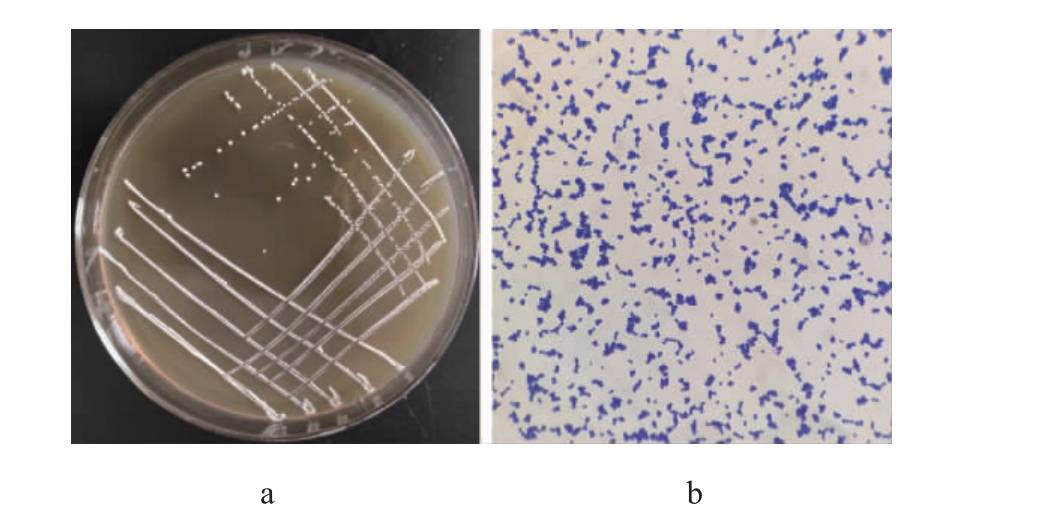
图9 菌株LC4的菌落(a)及细胞(b)形态
Fig.9 Colony (a) and cell (b) morphology of strain LC4
2.5.2 生理生化鉴定
菌株LC4的生理生化鉴定结果见表3。由表3可知,菌株LC4可以代谢麦芽糖、棉子糖、水杨苷和纤维二糖,不能代谢乳糖、蔗糖、甘露醇、山梨醇等。菌株LC4在10 ℃和50 ℃条件下不能生长,在40 ℃条件下可以生长。此外,菌株LC4在pH 9.5环境下不能生长,在pH 4.5及3%和6%NaCl环境中可以生长。根据《常见细菌系统鉴定手册》[29],初步鉴定菌株LC4为戊糖片球菌属(Pediococcus sp.)。
表3 菌株LC4的生理生化鉴定结果
Table 3 Physiological and biochemical identification results of strain LC4
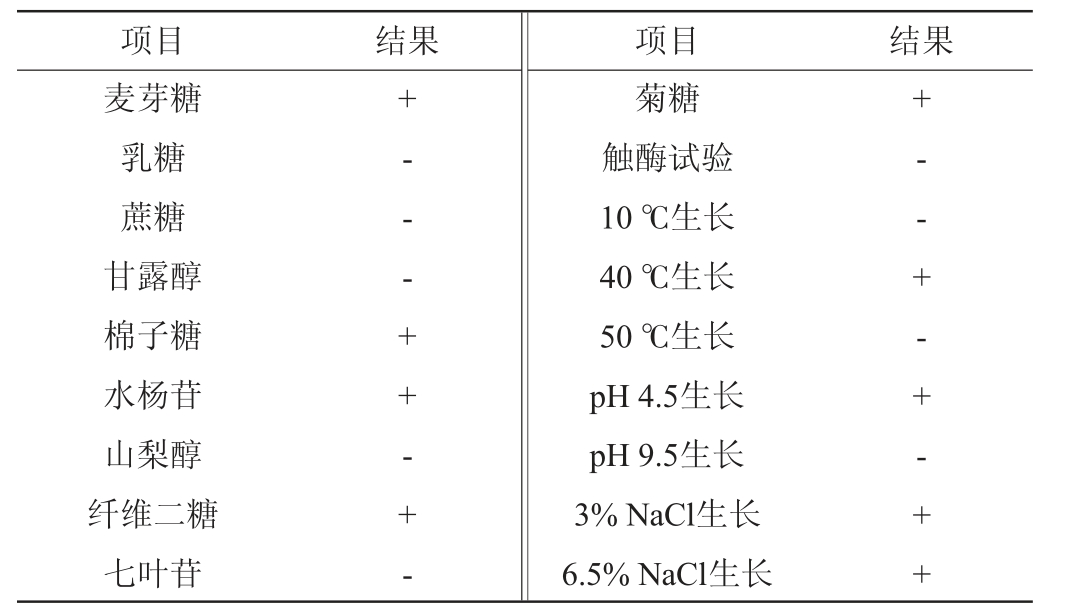
注:“+”表示结果呈阳性,“-”表示结果呈阴性。
项目 结果 项目 结果麦芽糖乳糖蔗糖甘露醇棉子糖水杨苷山梨醇纤维二糖七叶苷+- - - + + - + -菊糖触酶试验10 ℃生长40 ℃生长50 ℃生长pH 4.5生长pH 9.5生长3%NaCl生长6.5%NaCl生长+- - + - + - + +
2.5.3 分子生物学鉴定
基于16S rDNA基因序列,菌株LC4的系统发育树见图10。由图10可知,菌株LC4与戊糖片球菌(Pediococcus pentosus)聚于一支,亲缘关系最近,结合形态特征、生理生化试验鉴定结果,最终鉴定菌株LC4为戊糖片球菌(Pediococcus pentosus)。

图10 基于16S rDNA基因序列菌株LC4的系统发育树
Fig.10 Phylogenetic tree of strain LC4 based on 16S rDNA gene sequences
2.6 戊糖片球菌LC4的生长及产酸曲线
戊糖片球菌LC4的生长曲线见图11。由图11可知,戊糖片球菌LC4在4 h后进入对数期,在12 h后进入稳定期,在22 h后进入衰亡期。戊糖片球菌LC4的pH值变化整体呈下降趋势,pH值从5.92下降至3.90。在0~14 h时pH值下降速度最快,此时戊糖片球菌LC4代谢旺盛,处于对数生长期,产酸速率较快;14~20 h时pH值下降速度减缓,此时部分菌株进入稳定期,营养物质相对减少;20~22 h时pH值下降更慢,推测是因为戊糖片球菌LC4生长消耗大量营养物质且代谢产物大量累积,抑制戊糖片球菌LC4的生长,从而一定程度上抑制了酸的形成。
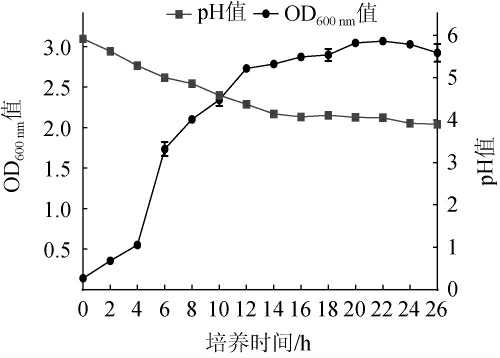
图11 菌株LC4的生长曲线及产酸曲线
Fig.11 Growth and acid production curves of strain LC4
2.7 HepG2细胞内总胆固醇及甘油三酯含量的测定
HepG2细胞保留了较为完整的生物转化代谢酶,是国际公认研究降脂作用的细胞系[33]。因此,采用HepG2细胞进行高胆固醇和高甘油三酯模型的建立。为明确戊糖片球菌LC4菌悬液和无细胞上清液对高脂细胞模型的影响,将其作用于HepG2细胞高胆固醇和高甘油三酯模型,结果见图12。由图12可知,模型组细胞的胆固醇和甘油三酯含量显著高于对照组(P<0.05),分别为3.07 nmol/mL和5.67 nmol/mL。模型组细胞经过干预后,阳性药物、菌悬液及无细胞上清液3组细胞的胆固醇及甘油三酯含量均显著降低(P<0.05),胆固醇含量分别为0.42 nmol/mL、1.79 nmol/mL、1.48 nmol/mL,甘油三酯含量分别为1.01nmol/mL、4.01nmol/mL、2.80nmol/mL,说明菌株LC4的菌体细胞和代谢产物都能在一定程度上降低胆固醇和甘油三酯水平,与体外清除胆固醇及甘油三酯能力结果相符合。熊霜[33]研究表明,高胆固醇模型细胞会促使细胞膜脂质过氧化和细胞损伤,而LEE J Y等[40]研究表明,短乳杆菌(Levilactobacillus brevis)等益生菌可以通过调节细胞色素P-450代谢酶家族中的CYP2E1、脂质合成因子固醇调节元件结合蛋白-1C(sterol regulatory element binding protein,SREBP1C)和脂肪酸合成酶(fatty acid synthetase,FAS)、脂质氧化因子过氧化物酶体增殖物激活受体α(peroxisome proliferator-activated receptor α,PPAR α)来保护HepG2细胞损伤并促进受损细胞的自我修复,这可能也是戊糖片球菌LC4的潜在作用机理。
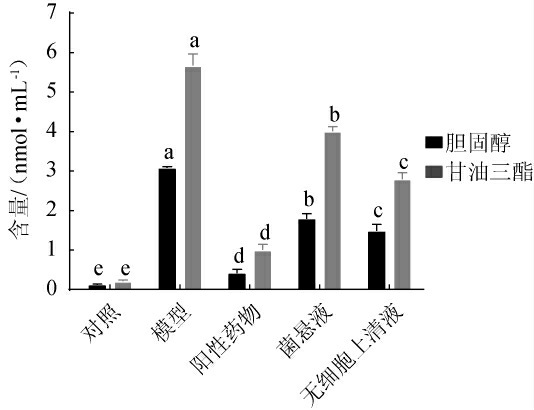
图12 菌株LC4对HepG2细胞高脂模型中胆固醇和甘油三酯含量的影响
Fig.12 Effect of strain LC4 on cholesterol and triglycerides content in high-fat HepG2 cell model
不同小写字母表示不同处理间差异显著(P<0.05)。
3 结论
本研究从腊肠、风干马肉等传统自然发酵制品中共分离出125株乳酸菌,并通过清除胆固醇、甘油三酯能力、胆盐水解酶活性测定及体外益生特性研究从中筛选得到一株具有潜在改善高脂血症且综合益生活性最好的菌株LC4。经形态观察、生理生化试验和16S rDNA序列分析鉴定菌株LC4为戊糖片球菌(Pediococcus pentosus),其体外胆固醇及甘油三酯清除率分别为74.73%和91.65%,具有胆盐水解酶活性;模拟胃液3 h及模拟肠液8 h后的耐受力分别为87.57%和72.70%,在0.3%胆盐条件下处理24 h活菌数为9.79 lg(CFU/mL),在pH 2.5酸性条件下处理4 h,活菌数为7.67 lg(CFU/mL);24 h后的自聚集能力为52.77%;对二甲苯,乙酸乙酯及氯仿的疏水性分别为78.13%、34.07%和10.30%。HepG2细胞高脂模型经菌株LC4处理后,降低了胆固醇和甘油三酯含量。综合来看,LC4具有改善高脂血症的潜力和益生特性,对预防和辅助治疗高脂血症具有一定的应用价值。由于菌株LC4筛选自传统发酵食品,因此食用安全性具有保障,后续将对该菌株体内改善高脂血症的益生作用及体内调节脂代谢作用机理进行进一步研究,为将来开发功能性食品和相关健康食品奠定基础。
[1]关媛媛,郑燕飞,朱玲慧,等.高甘油三酯血症动物模型研究进展[J].中国试验动物学报,2022,30(1):146-152.
[2]郁蓉,彭云鹏,朱小乐,等.游离脂肪酸通过IRE1/XBP1通路调控高甘油三酯血症性急性胰腺炎肾损伤的机制研究[J].南京医科大学学报(自然科学版),2022,42(5):625-631.
[3]王佳楠,刘悦,钱盈莹,等.几种用于评价高脂血症疗效的新型指标[J].中国动脉硬化杂志,2021,29(8):718-721.
[4] KONESHAMOORTHY A, HULSE D, CHONG C Y, et al.Massive hypertriglyceridemia associated with paclitaxel; a case report[J].Gynecol Oncol Rep,2022,42(42):101030-101030.
[5] KONERU S C.Fellow's voice: Hypertriglyceridemia: Understanding the current guideline[J].Am J Prev Cardiol,2022,9(9):100322-100322.
[6] MASOUMEH K, RAUL D S, KAZEMI R O, et al.A novel regulatory facet for hypertriglyceridemia: The role of microRNAs in the regulation of triglyceride-rich lipoprotein biosynthesis[J].Prog Lipid Res,2023,89(89):101197-101197.
[7]田英杰,吴广,王洪桂,等.益生菌干预高脂血症研究的新进展[J].中华高血压杂志,2022,30(5):420-424.
[8]陈忠秀,李嘉文,赵扬,等.益生菌的应用现状和发展前景[J].中国微生态学杂志,2016,28(4):493-497.
[9]梁婷婷.基于多组学联合解析益生乳酸菌降糖降脂功效及作用机制研究[D].西安:陕西科技大学,2021.
[10]ALBANO C,MORANDI S,SILVETTI T,et al.Lactic acid bacteria with cholesterol-lowering properties for dairy applications:In vitro and in situ activity[J].J Dairy Sci,2018,101(12):10807-108018.
[11]陈磊,刘瑞,吴满刚,等.乳酸菌在发酵肉制品中的应用进展[J].美食研究,2022,39(3):93-98.
[12]LEE M S,LEE N K,CHANG K H,et al.Isolation and characterization of a protease-producing bacterium,Bacillus amyloliquefaciens P27 from meju as a probiotic starter for fermented meat products[J].Korean J Food Sci Anim Resour,2010,30(5):804-810.
[13]李权威.乳酸菌对发酵肉制品脂类代谢及品质的影响[D].呼和浩特:内蒙古农业大学,2020.
[14]赵改名,李珊珊,崔文明,等.云南自然发酵火腿中乳酸菌的分离鉴定及发酵特性研究[J].食品与发酵工业,2020,46(1):56-61.
[15]任大勇,曲天铭,杨柳,等.东北传统发酵食品中降胆固醇乳酸菌的筛选及其降解机制[J].食品科学,2019,40(22):199-206.
[16]吴慧昊,牛锋,钟琦,等.高效降胆固醇降甘油三酯乳酸菌的分离鉴定和功能分析[J].食品工业科技,2019,40(14):157-162.
[17]冯利霞.戊糖片球菌的益生性和热应激机制以及对小鼠肠道菌群影响的研究[D].南昌:南昌大学,2017.
[18]AMORIMT R D P D,PEREIRA B J,FURTADO M E M C,et al.Isolation and identification of lactic acid bacteria in fruit processing residues from the Brazilian Cerrado and its probiotic potential[J].Food Biosci,2022,48(48):101739-101739.
[19]李艳,杨晶,姚瑶,等.基于主成分分析法的降血脂乳酸菌筛选[J].中国乳品工业,2018,46(5):18-20,30.
[20]高玉荣,李大鹏,张凤琴,等.传统腊肠中降胆固醇降甘油三酯益生菌的筛选及鉴定[J].食品科技,2020,45(5):14-18.
[21]MARÍA G G A,TOM B.Bile salt hydrolase and lipase inhibitory activity in reconstituted skim milk fermented with lactic acid bacteria[J].J Funct Foods,2021,77(77):104342-104342.
[22]黄耀雄,甘祥武.酸奶中乳酸菌的分离、鉴定及性能研究[J].现代食品,2021(3):222-225.
[23]王浩.戊糖片球菌NCU301体外益生特性的研究及其在豆粕发酵中的应用[D].南昌:南昌大学,2018.
[24]LIN J X,XIONG T,PENG Z,et al.Novel lactic acid bacteria with antihyperuricemia ability:Screening and in vitro probiotic characteristics[J].Food Biosci,2022,49(49):101840-101840.
[25]玛丽娜·库尔曼.降胆固醇益生菌的筛选鉴定及降血脂功能研究[D].哈尔滨:东北林业大学,2020.
[26]WEI B L,PENG Z,XIAO M Y,et al.Three lactic acid bacteria with antiobesity properties:In vitro screening and probiotic assessment[J].Food Biosci,2022,47(47):101724-101724.
[27]DEY D K,KOO B G,SHARMA C,et al.Characterization of Weissella confusa DD_A7 isolated from kimchi[J].LWT-Food Sci Tech,2019,111:663-672.
[28]金鑫燕,闫忠心.自然发酵牦牛酸奶中乳酸菌的分离鉴定[J].青海畜牧兽医杂志,2021,51(5):5-10.
[29]东秀珠,蔡妙英.常见细菌系统鉴定手册[M].北京:科学出版社,2001:349-400.
[30]袁先铃,周莺茹,郑连强,等.酸菜中乳酸菌生长曲线、产酸性能及抑菌性能探究[J].食品研究与开发,2022,43(14):199-203.
[31]周佳敏.鼠李糖乳杆菌胞外多糖的纯化及降脂和调节肠道菌群活性研究[D].杭州:浙江工商大学,2020.
[32]GAN S I,EDWARDS A L,SYMONDS C J,et al.Hypertriglyceridemiainduced pancreatitis:A case-based review[J].World J Gastroenterol,2006,12(44):199-203.
[33]熊霜.海藻膳食纤维复方辅助降血脂试验研究[D].泉州:华侨大学,2014.
[34] WALKER D K, GILLILAND S E.Relationship among bile tolerance,bile salt deconjugation,and assimilation of cholesterol by Lactobacillus acidophilus[J].J Dairy Sci,1993,76(4):966-961.
[35]高宇,廖彩羽,汤科,等.泡菜盐水中降胆固醇乳酸菌的筛选鉴定及性能研究[J/OL].中国测试:1-13[2023-05-31].http://kns.cnki.net/kcms/detail/51.1714.TB.20230313.1048.006.html.
[36]陈显玲,农秀丽,卢丽婷,等.来宾酒糟酸菜中降胆固醇乳酸菌的筛选鉴定及发酵工艺研究[J].中国酿造,2022,41(6):93-98.
[37]王丽,陶志强,马雁,等.降血脂乳酸菌的筛选及发酵工艺的优化[J].安徽农学通报,2019,25(11):23-26,61.
[38]KUMARI V B C,HULIGERE S,RAMU R,et al.Evaluation of probiotic and antidiabetic attributes of Lactobacillus strains isolated from fermented beetroot[J].Front Microbiol,2022,13(13):911243-911243.
[39]龚虹,王海霞,马征途,等.乳酸菌粘附力与生物膜、疏水性和自凝集特性的研究[J].中国微生态学杂志,2016,28(9):1026-1028,1033.
[40] LEE J Y,KIM H,JEONG Y,et al.Lactic acid bacteria exert a hepatoprotective effect against ethanol-induced liver injury in HepG2 cells[J].Microorganisms,2021,9(9):1844-1844.