党参(Codonopsis pilosula)是桔梗科多年生草本植物[1],主要含有生物碱类、炔苷、黄酮及多糖等化学成分[2],具有抗氧化[1]、抗衰老[3]、调节免疫[4]及抗肿瘤[5-6]等广泛的药理作用。作为“药食同源”中药材,除药用成分外,党参中也含有丰富的氨基酸、矿物元素等营养成分,具有较高的食用价值。
黄酒作为世界最古老的酒类之一[7]。是以稻米、黑米、黍米等为主要原料制得的低酒精度的酿制酒[8-9]。黄酒中不仅含有丰富的蛋白质、氨基酸、矿物质、维生素等营养物质[10];还含有功能性低聚糖、活性多糖、γ-氨基丁酸及多肽等功能因子[11],以及谷胱甘肽、酚等生理活性成分[8]。多种成分使黄酒具有抗氧化、调节免疫、抗衰老、保护心血管、调节肠道微生态等多种作用[12-14]。
黄酒的酿造工艺主要涉及浸米、蒸米、落缸、前发酵、后发酵等工艺步骤,因历史演变及地域的不同,现代黄酒的酿造工艺可大致分为北方黄酒和南方黄酒,南方黄酒因酿造原料不同,为保证黄酒良好的色泽,多采用糊化工艺,除此以外,在蒸米及冷却等工序中还有摊饭法、喂饭法等不同工艺保证黄酒的品质;北方黄酒多沿袭传统酿造工艺,坚持手工操作,多用原料,尽量减少水的加入从而保证黄酒的醇厚。在黄酒的酿造过程中,干酵母及糖化发酵剂的添加直接决定了黄酒的品质;酵母菌代谢的乙醇是黄酒酒精度的主要来源,适度的酒精度可以抑制发酵过程中其他杂菌的生长同时使黄酒更具风味;麦曲及糖化酶是黄酒发酵过程中主要的糖化发酵剂,“以麦制曲,以曲酿酒”是黄酒的特色之一[15],麦曲中含有丰富的微生物和酶,如霉菌、酵母、细菌、糖化酶和蛋白酶等[17],是黄酒酿造过程重要的产香剂、糖化剂和液化剂[16],对黄酒的质量和风味起着重要的作用[18],糖化酶加入可代替部分麦曲及干酵母的用量,减少成本,但黄酒发酵是“双边发酵”的过程,平衡失调则会使糖类分解过快,酵母早衰致使杂菌繁殖。在整个酿造过程中,糖化温度与时间决定了酶制剂的利用率;前发酵温度与时间保证了酵母菌的适宜生长环境;其余多种微生物协同产生风味物质;后发酵时间是黄酒增香提味的缓解,也是体系中残糖转化的过程,使酒味变得细腻柔和。一般低温长时间发酵的酒比高温短时间发酵的酒香气足,口味更好。
在黄酒酿造过程中,时间、温度、酵母菌及糖化发酵剂的用量是决定黄酒品质的关键性因素,而党参加入黄酒中时,其加入时机及加入量对黄酒品质的相关系统研究较少。故本研究选择党参加入量、干酵母用量、麦曲用量、糖化时间及温度等因素进行单因素试验,采用GB/T 13662—2018《黄酒》要求对其品质进行评价。在单因素试验基础上,采用响应面试验优化党参黄酒的酿造工艺。通过1,1-二苯基-2-苦肼基(1,1-diphenyl-2-picrylhydrazyl,DPPH)、羟自由基、超氧阴离子自由基清除率试验评价党参黄酒体外抗氧化活性,旨在开发一款风味独特,具有高营养价值及抗氧化活性的党参黄酒,进一步提高黄酒保健功能。
1 材料与方法
1.1 材料与试剂
党参:河北建伟药业有限公司;黍米(大黄米)、麦曲、糖化酶(酶活10万U/g)、酒药:由甘肃省五山池黄酒厂提供;高活性安琪酵母:安琪酵母股份有限公司;3,5-二硝基水杨酸、NaOH、酒石酸钾钠、苯酚、亚硫酸钠、硝酸铝(均为分析纯):国药集团化学试剂有限公司;冬氨酸(Asp)、苏氨酸(Thr)、丝氨酸(Ser)、谷氨酸(Glu)、脯氨酸(Pro)、甘氨酸(Gly)、丙氨酸(Ala)、胱氨酸(Cys)、缬氨酸(Val)、蛋氨酸(Met)、异亮氨酸(Ile)、亮氨酸(Leu)、酪氨酸(Tyr)、苯丙氨酸(Phe)、组氨酸(His)、赖氨酸(Lys)、精氨酸(Arg)等氨基酸标准品(纯度均>98%):美国SIGMA-ALDRICH公司;维生素C(vitamin C,VC)(分析纯)、没食子酸标准品(纯度>98%):天津市科密欧化学试剂有限公司;1,1-二苯基-2-苦肼基(DPPH)(分析纯):上海源叶生物科技有限公司;芦丁标准品(纯度>98%):实验室自制。
1.2 仪器与设备
UV-1700紫外分光光度仪:日本SHIMADUZ公司;OSB-2100型水浴锅:上海爱朗仪器有限公司;H1650高速离心机:湖南湘仪离心机有限公司;CPA225D分析天平:赛多利斯科学仪器(北京)有限公司;KQ-400KDE型超声波清洗仪:宁波新芝生物科技有限公司;S-433D氨基酸全自动分析仪、LCAK06/Na型磺酸基强酸性阳离子交换树脂色谱柱(4.6 mm×150 mm,5 μm):德国SYKAM公司;DHG9075A恒温干燥箱:上海精宏实验设备有限公司;N-WYVAP112型氮吹仪:美国Organomation公司。
1.3 方法
1.3.1 党参黄酒的酿造工艺流程及操作要点
操作要点:
黍米饭的制备:选取颗粒饱满、无霉变虫蚀、色泽金黄的黍米,将黍米去除杂物,清洗干净后浸泡8 h,蒸米30 min,使黍米的吸水率达到300%。按料液比1.00∶0.75(g∶mL)加水。
糖化:待黍米饭的当温度降至60 ℃左右时,按0.2%添加量加入糖化酶搅拌均匀糖化,糖化温度为60 ℃,糖化时间为12 h。
摊凉、前发酵:糖化结束的黍米饭,待温度降至30 ℃左右,按0.1%添加量加入提前用温水活化好的酵母;按1%和15%添加量分别加入酒药及麦曲,充分搅拌均匀,于30 ℃恒温发酵7 d,待发酵醪液中几乎无气泡产生时转入后发酵过程,前发酵主要是酒精产生的过程,发酵体系中的酵母菌在此时大量繁殖,利用糖类、淀粉等物质作为碳源进行生长代谢并产生酒精。
后发酵:前发酵结束后,将其密封,于18 ℃恒温后发酵25 d,使残糖充分转化并促进黄酒的成熟,增加黄酒香味。
压榨、过滤:后发酵结束后选择无纺布精密细沙滤网食用绢布袋,手动压滤,将滤液在6 000 r/min条件下离心10 min,取上清液。
灭菌及装瓶:90 ℃灭菌10 min后装瓶,即得党参黄酒成品。
1.3.2 党参的加入时机选择
党参粗粉的制备:选取一年生的优质党参药材,将药材粉碎,过20目筛即可。
参照1.3.1操作步骤,选择将党参以3%添加量分别在蒸米时及糖化时加入,以酒精度、总酸、总糖、氨基酸态氮和总黄酮为评价指标,确定党参最佳的加入时机。
1.3.3 党参黄酒酿造工艺优化
(1)单因素试验
选择党参添加量(3%、5%、7%、9%、11%),麦曲添加量(5%、10%、15%、20%、25%),酵母添加量(0.09%、0.12%、0.15%、0.18%、0.21%),糖化时间(4 h、8 h、12 h、24 h、48 h)糖化温度(30 ℃、40 ℃、50 ℃、60 ℃、70 ℃)作为考察因素,以酒精度、总糖、总酸、感官评分为考察指标进行单因素试验。
(2)响应面试验
在单因素试验基础上,以党参添加量(A)、麦曲添加量(B)、糖化温度(C)为自变量,以酒精度(Y)为响应值,通过Design-Expert V11.1进行响应面分析得到最优解,再进行验证,确定党参黄酒的最佳酿造工艺参数。
1.3.4 分析检测
总糖、总酸、酒精度的测定:参照国标GB/T 13662—2018《黄酒》;氨基酸的测定:参照GB5009.124—2016《食品中氨基酸的测定》;总多酚测定:采用福林酚法;总黄酮的测定:参考文献[19];DPPH自由基、羟自由基、超氧阴离子自由基清除率测定:参考文献[20-22]。
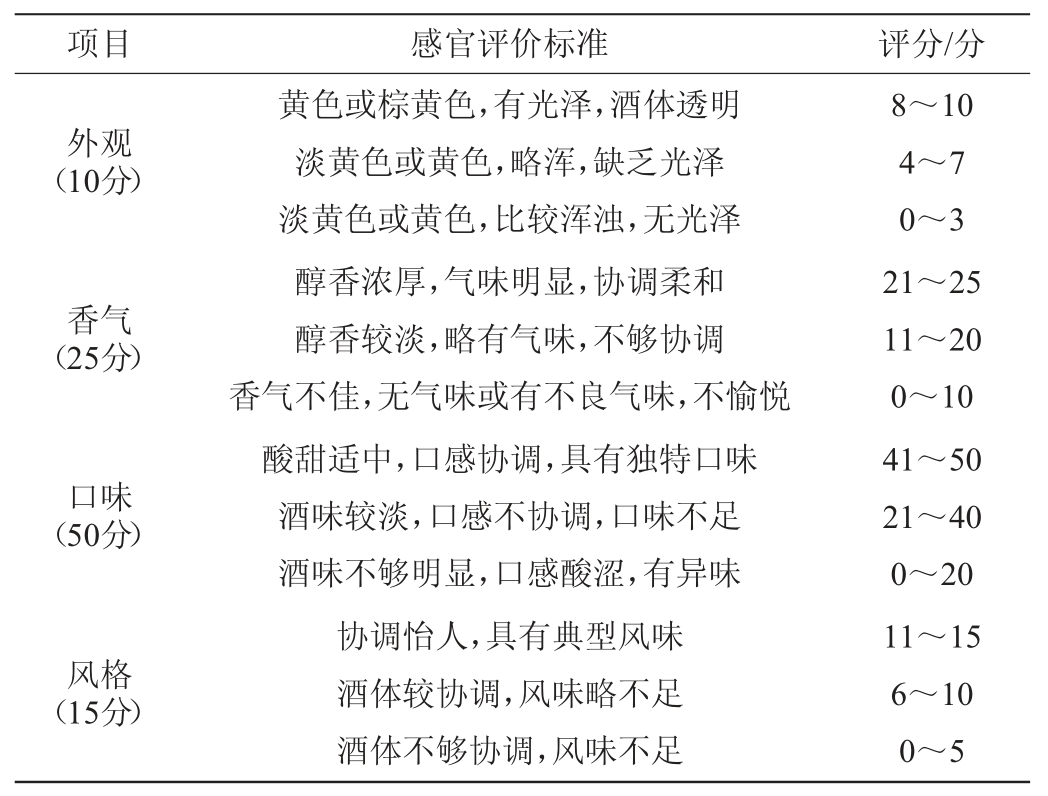
感官评价:选取10人经过培训的人员组成感官评价小组,对黄酒的外观、香气、口味、风格进行评分,满分100分。每个酒样测定3次,结果取平均值。感官评分标准见表1。
表1 党参黄酒的感官评分标准
Table 1 Sensory evaluation standards of Codonopsis pilosula Huangjiu
1.3.5 数据处理
使用SPSS statistics 26.0对数据进行显著性差异分析。每个试验均重复3次,使用OrignPro2023版进行绘图。
2 结果与分析
2.1 党参加入时机的选择
参照GB/T 13662—2018《黄酒》中的要求,对样品中总糖、总酸、酒精度、氨基酸态氮、pH值进行测定,同时对样品中总黄酮的含量进行测定分析,结果见表2。
表2 党参加入时机对党参黄酒品质的影响
Table 2 Effect of adding time of Codonopsis pilosula on the quality of C.pilosula Huangjiu
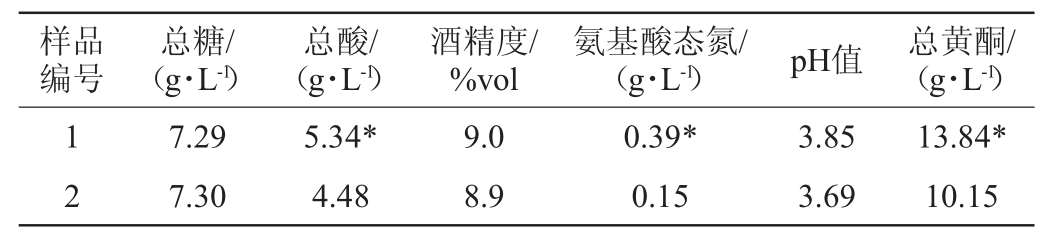
注:样品1表示党参在糖化时加入;样品2表示党参在蒸米时加入;“*”表示样品1与样品2指标有显著性差异(P<0.05)。
由表2可知,党参在糖化时加入,其总黄酮、总酸及氨基酸态氮含量显著高于蒸米时加入(P<0.05),总糖、酒精度及pH值变化不大。原因可能是将党参蒸制后,其中苍术内酯、5-羟甲基糠醛等特征性成分均有所降低[22],党参在蒸制过程中会发生美拉德反应,使还原性糖类及氨基化合物发生聚合等反应生成类黑精类物质[23],不同药材进行蒸制后,会使水溶性氨基酸、黄酮类成分流失[24]、多糖类成分含量有所增加[25],酵母菌可直接利用的糖类成分含量有所降低,导致总酸含量降低。因此,选择在糖化时加入党参为宜。
2.2 党参黄酒的酿造工艺优化单因素试验结果
2.2.1 党参添加量对党参黄酒品质的影响
由图1可知,当党参添加量为3%~9%时,其总酸、总糖含量及感官评分呈逐渐上升的趋势,这可能是因为低聚糖、多糖是党参中主要成分之一[26],党参多糖含量约为25%[27],低聚糖含量约为10%[28],党参加入后增加了发酵醪液中低聚糖含量,同时使黄酒赋予了更多甜味,使感官评分增加;当党参添加量为9%时,其总糖含量及感官评分最高,分别为(52.25±1.44)g/L及68.53分,总酸含量较高,为(10.2±0.04)g/L;当党参添加量继续增加时,由于党参中含有丰富的蛋白质、氨基酸等物质,在发酵过程中产酸,从而使黄酒略微带有酸涩的口感,导致总糖含量及感官评分降低,总酸含量基本平稳。党参添加量为3%~7%时,其酒精度不断增加,这是由于党参中的糖类物质为酵母菌的生长繁殖提供了充足的碳源,使酒精度不断增加;党参添加量为7%时,其酒精度最高,为(12.5±0.01)%vol;当党参添加量继续增加时,其他杂菌利用发酵醪液中多余的糖类物质进行繁殖,使总酸含量不断增加,同时酵母菌的生长繁殖受到抑制,使酒精度略微呈现下降的趋势。综上,党参最适添加量为7%。
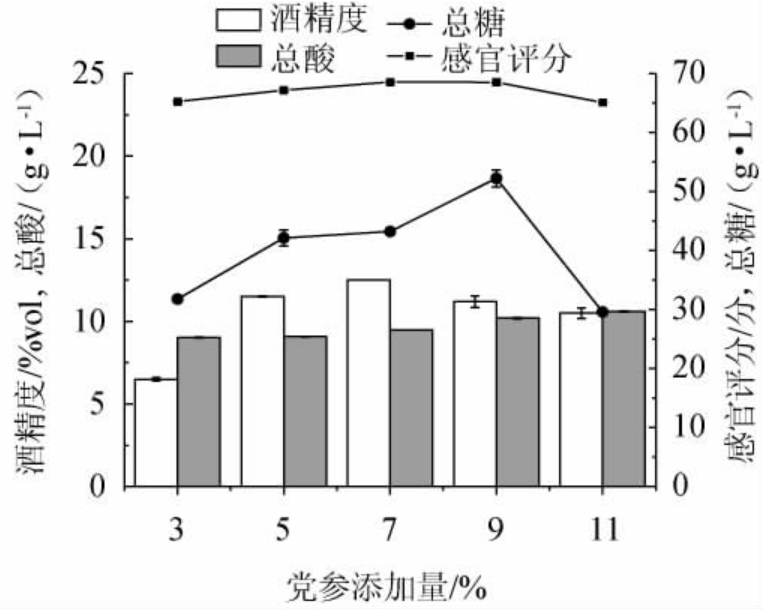
图1 党参添加量对党参黄酒品质的影响
Fig.1 Effect of Codonopsis pilosula addition on the quality of Codonopsis pilosula Huangjiu
2.2.2 麦曲添加量对党参黄酒品质的影响
麦曲是黄酒发酵过程中重要的糖化发酵剂和产香剂,麦曲中有丰富的脂肪酶、淀粉酶等酶类物质,可以分解原料中的淀粉、蛋白质及脂类物质,麦曲的添加量可以显著影响黄酒中有机酸、氨基酸及风味物质含量。由图2可知,当麦曲添加量为5%~15%时,随着麦曲添加量的增加,其总酸、总糖含量、酒精度及感官评分呈逐渐上升的趋势,由于糖化程度较大,为体系中的各种微生物的生长提供充足的碳源,所以总糖、总酸的含量及感官评分都增加[20];当麦曲添加量为15%时,其总酸、总糖含量、酒精度及感官评分最高,分别为(9.48±0.04)g/L、(47.99±3.38)g/L、(11.8±0.12)g/L、75.86分;当麦曲添加量>15%时,其总糖含量、酒精度及感官评分均呈现下降的趋势,总酸含量基本平稳。分析原因可能是由于糖化过程过快,对发酵过程不利,黄酒的“双边发酵”过程被打破,导致其理化指标的降低[29]。综上,麦曲最适添加量为15%。

图2 麦曲添加量对党参黄酒品质的影响
Fig.2 Effect of wheat Qu addition on the quality of Codonopsis pilosula Huangjiu
2.2.3 酵母添加量对党参黄酒品质的影响
酵母在发酵初期会迅速繁殖使酒精不断累积,由图3可知,当酵母添加量为0.09%~0.12%时,随着酵母添加量的增加,其总酸、总糖含量及感官评分呈逐渐上升的趋势;当酵母添加量为0.12%时,其总酸、总糖含量及感官评分最高,分别为(9.3±0.12)g/L、(36.84±1.97)g/L和70.66分;当酵母添加量>0.12%时,其总糖含量及感官评分均呈现下降的趋势,总酸含量基本平稳,在发酵前期,酵母菌迅速繁殖,消耗糖类转化为酒精,发酵后期,其他微生物利用剩余糖类进行自身代谢,产生有机酸,使总酸含量上升,但是随着酵母数量的不断增多,其风味口感会变的不协调。酒精度随着酵母添加量在0.09%~0.21%范围内增加逐渐增加。综上,酵母最适添加量为0.12%。
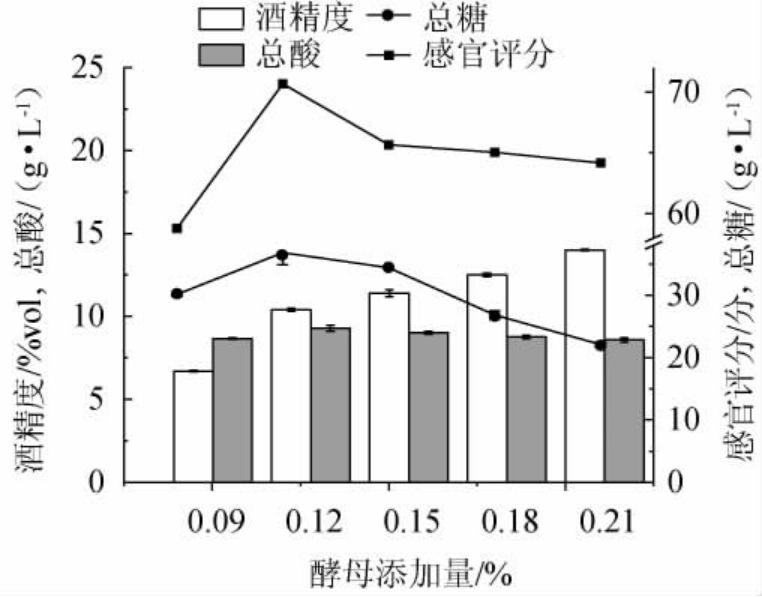
图3 酵母添加量对党参黄酒品质的影响
Fig.3 Effect of yeast addition on the quality of Codonopsis pilosula Huangjiu
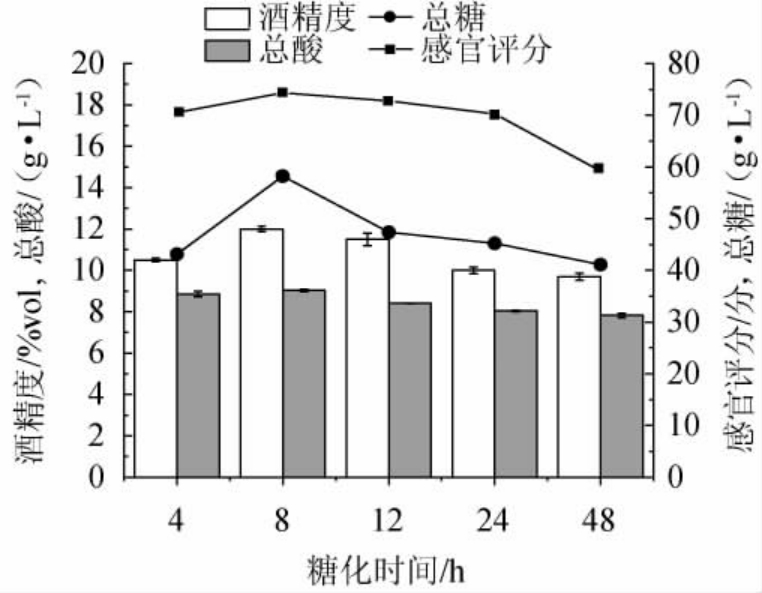
图4 糖化时间对党参黄酒品质的影响
Fig.4 Effect of saccharification time on the quality of Codonopsis pilosula Huangjiu
2.2.4 糖化时间对党参黄酒品质的影响
当糖化时间为4~8 h时,随着糖化时间的增加,其总酸、总糖含量、酒精度及感官评分呈逐渐上升的趋势;当糖化时间在8 h时,其总酸、总糖含量、酒精度及感官评分最高;分别为(9.03±0.07)g/L、(58.22±0.06)g/L、(12±0.13)%vol、74.33分,当糖化时间超过8 h时,其总糖含量、酒精度及感官评分均呈现下降的趋势,总酸含量基本平稳。糖度太高会抑制酵母菌的繁殖,产生较多的副产物,主要的原因是糖度过高会抑制乙醇产生途径中的乙醇脱氢酶的活性,同时,高渗透压和低水分的环境则会抑制乙醇的产生[30],酵母菌的代谢分为有氧呼吸及无氧呼吸,无氧呼吸产生酒精,糖化时间越久,糖化越彻底,酵母菌在前发酵时,有氧呼吸分解利用的糖类物质越多,导致糖类物质越来越少。综上,最适糖化时间为8 h。
2.2.5 糖化温度对党参黄酒品质的影响
温度为影响糖化微生物代谢的主要因素,温度提升能有效提高糖化效率[33]。由图5可知,当糖化温度为30~50 ℃时,随着糖化温度的增加,其总酸、总糖含量、酒精度及感官评分呈逐渐上升的趋势;当糖化温度为50 ℃时,其总酸、总糖含量、酒精度及感官评分最高,分别为(9.30±0.02)g/L、(49.76±2.55)g/L、(15.00±0.09)g/L、69.36分;当糖化温度超过50 ℃时,其总糖含量、酒精度及感官评分均呈现下降的趋势,总酸含量基本平稳。糖化温度对党参黄酒中总酸的含量影响并不显著,其总糖和酒精度呈现先升高后降低的趋势,分析原因可能是因为,当糖化温度较低时,糖化速率较慢,导致体系中某些杂菌竞争性生长,酵母菌可利用的碳源有限,随着糖化温度的升高,糖化速率加快,总糖和酒精度增加,当糖化温度高于50 ℃时,温度较高,导致糖化效果变差。综上,最适糖化温度为50 ℃。
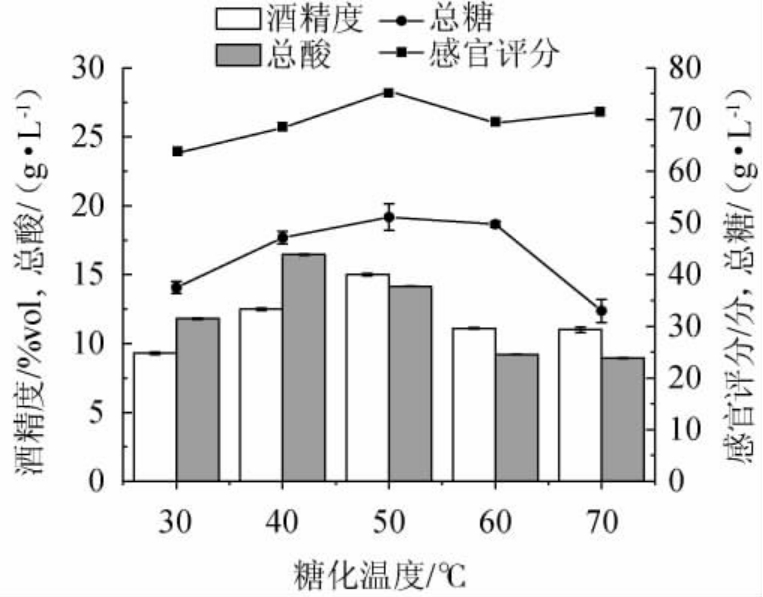
图5 糖化温度对党参黄酒品质的影响
Fig.5 Effect of saccharification temperature on the quality of Codonopsis pilosula Huangjiu
2.3 Box-Behnken响应面试验优化党参酿造工艺
酒精度不仅可以反映发酵的程度,也是评判黄酒质量的重要指标。酵母菌的生长代谢是黄酒中酒精的重要来源,糖是酵母生长所需的重要营养物质,党参中富含糖类;糖化发酵剂可提供各种酶类并在产酶过程中产生麦芽糖、葡萄糖、氨基酸等物质为酵母提供营养源;糖化温度的高低,可显著影响黄酒的酒精度。单因素时确定上述参数的最优范围,但其交互作用并未研究,因此,在单因素试验结果的基础上,以酒精度(Y)为响应值,党参添加量(A)、麦曲添加量(B)及糖化温度(C)为自变量,对党参黄酒的酿造工艺进行响应面法优化,Box-Behnken试验设计及结果见表3,方差分析结果见表4。
表3 Box-Behnken试验设计及结果
Table 3 Design and results of Box-Behnken tests
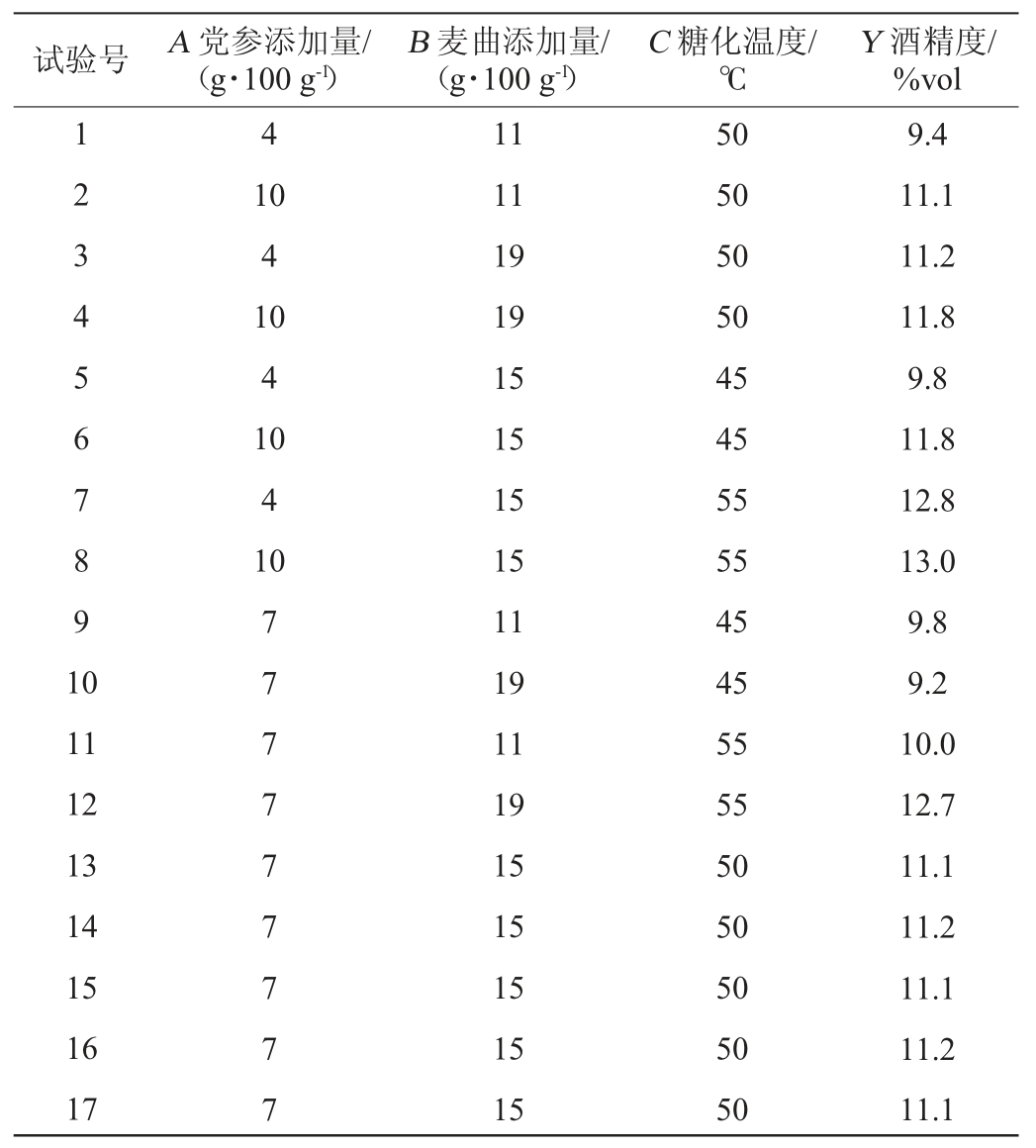
表4 回归模型方差分析
Table 4 Variance analysis of regression model

采用Design-Expert V11.1对表3进行多元回归拟合后得到回归方程:Y=1.4+0.5625A+0.575B+0.9875C-0.275AB-0.45AC+0.825BC+0.58A2-0.845B2+0.13C2。
由表4可知,模型的P值<0.000 1,表明回归模型差异极显著。失拟项P值为0.060 7,不显著,表明试验结果与回归模型之间具有良好的拟合度。决定系数R2为0.997,校正决定系数R2Adj为0.993,变异系数为0.866 6%,表明模型的拟合度较好。由P值可知,二次项C2对结果影响显著(P<0.05),其余各因素对结果影响极显著(P<0.01)。F值越大,说明各因素对酒精度影响越强。由F值可知,3个因素对党参黄酒酒精度的影响次序分别为糖化温度(C)>麦曲添加量(B)>党参添加量(A)。
通过Design-Expert V11.1软件对党参黄酒的酿造工艺条件进行优化分析后,得到最佳酿造工艺条件为:党参添加量9.5%,麦曲添加量16.4%,糖化温度47.1 ℃,在此条件下党参黄酒的酒精度的预测值为11.574%vol。为了便于实际操作,将酿造工艺条件修正为:党参添加量9.5%,麦曲添加量16.0%,糖化温度47 ℃,在此优化条件下进行3次平行验证试验,得到党参黄酒的酒精度实际值为(11.5±0.15)%vol,与预测值的相对误差为0.64%,进一步说明本实验的拟合度较好。
2.4 党参黄酒质量评价
2.4.1 党参黄酒的感官评价
在最佳酿造工艺条件下得到的党参黄酒为淡黄色、略浑,口感醇厚、风味独特,酒味稍淡、口感较协调,酒体较协调,感官评分为76分。
2.4.2 党参黄酒的理化指标检测结果
利用最佳酿造工艺进行党参黄酒酿造,以未加党参的普通黄酒为对照,其理化指标测定结果见表5。
表5 党参黄酒理化指标测定结果
Table 5 Determination results of physiochemical indexes of Codonopsis pilosula Huangjiu

注:“*”表示两组黄酒指标差异显著(P<0.05)。下同。
由表5可知,将党参加入后,其总糖、总酸及氨基酸态氮的含量显著增加(P<0.05),主要是因为党参中含有丰富的多糖、低聚糖等糖类物质,同时多糖还是党参中最主要的活性成分之一,因此与对照组相比,党参黄酒中总糖含量增加显著;总酸表示黄酒中各种有机酸的总含量,适当的酸味可使黄酒的口感更柔和爽口,黄酒中的各种酸性物质主要源于发酵过程中酵母、乳酸菌等菌群的代谢产物,党参中丰富的糖类物质为发酵过程提供了充足的碳源,最终使党参黄酒中总酸的含量显著高于对照组(P<0.05);氨基酸态氮可大致反映黄酒中氨基酸总量水平,党参中富含有丰富的氨基酸,加入后使党参黄酒中的氨基酸态氮与对照组相比有明显增加(P<0.05);与对照组相比,党参黄酒的pH值、酒精度两个指标并无显著性差异(P>0.05)。
研究发现,黄酒中多酚可以降低动脉粥样硬化区域从而减缓心血管病症状,同时,酚类物质可以清除机体内过剩的自由基从而发挥抗氧化等作用[30-32];黄酮作为党参及黄酒中活性成分之一,是发挥清除自由基、抑制肿瘤、调节细胞代谢、抗菌消炎等多种生理功效的重要物质基础,添加党参后的黄酒与不添加党参的黄酒中总多酚及总黄酮含量存在显著性差异(P<0.05),党参黄酒中总酚及总黄酮含量分别比普通黄酒高15.1%和15.52%,进一步说明了党参黄酒的营养成分含量高于对照,具有一定的保健作用。
2.4.3 党参黄酒游离氨基酸含量测定结果
以未加党参的普通黄酒为对照,党参黄酒游离氨基酸测定结果见表6。由表6可知,党参加入后总氨基酸(total amino acid,TAA)、必需氨基酸(essential amino acid,EAA)含量分别增加了19.93%、20.56%。根据1973年世界卫生组织(world health organization,WHO)/联合国粮农组织(Food and Agriculture Organization of the United Nations,FAO)提出的理想蛋白质的标准(EAA/TAA≥0.4;EAA/非必需氨基酸(non-essential amino acid,NEAA)≥0.6)可知[35],党参黄酒及黄酒均有良好的营养价值。
表6 党参黄酒游离氨基酸含量的测定结果
Table 6 Determination results of free amino acids contents in Codonopsis pilosula Huangjiu
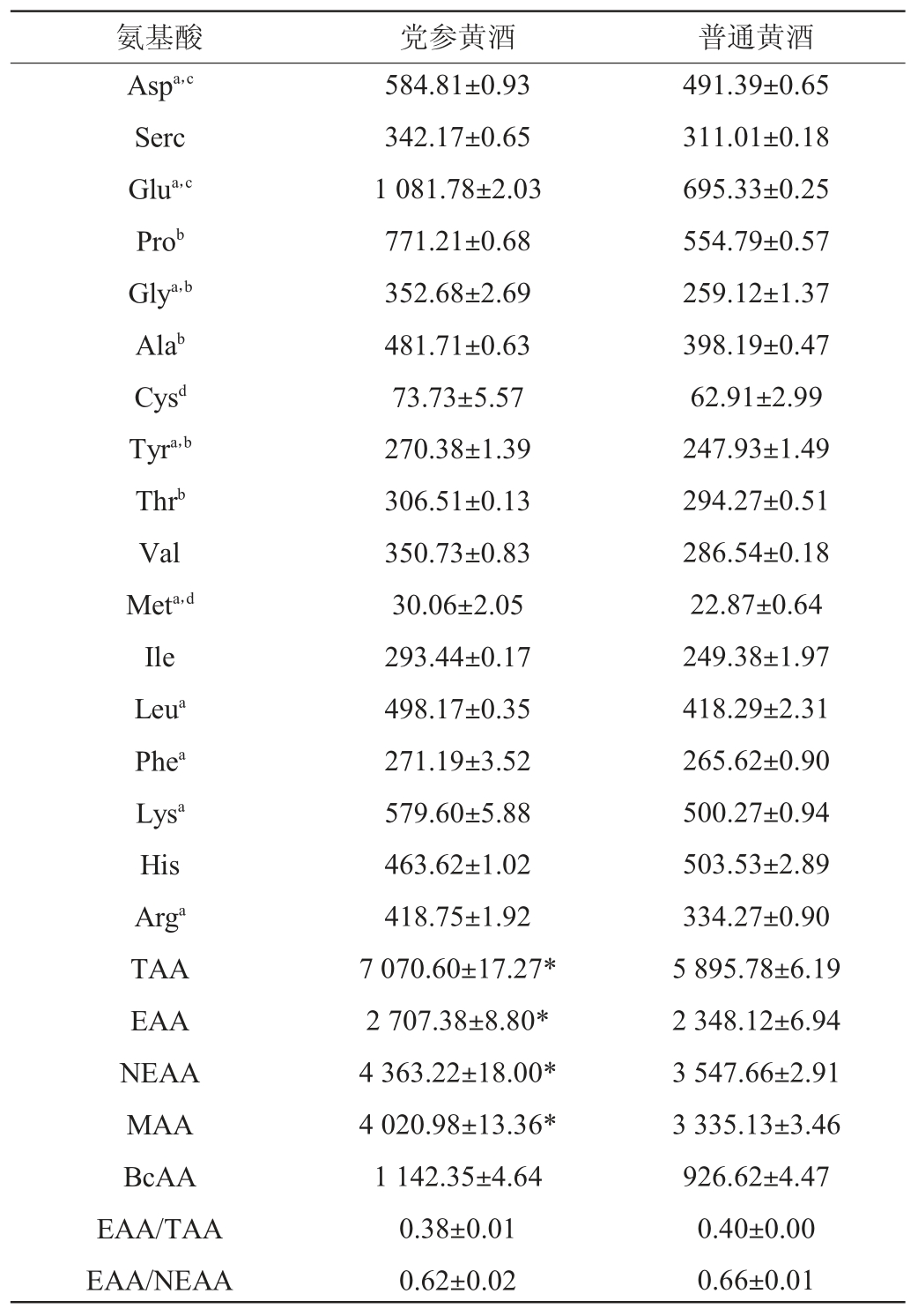
注:a表示药用氨基酸;b表示甜味氨基酸;c表示鲜味氨基酸;d表示咸味氨基酸。
氨基酸侧链不同导致氨基酸味道及功能的差别,根据ZHAO C J等[35]的方法可以将氨基酸的味道划分为甜、鲜、苦、咸四大特征。结果表明,党参添加后其甜味氨基酸含量增加明显,为17.57%,这可能是由于党参中甜味氨基酸比例较大,介于15.85%~23.97%之间。根据高云超等[36]的方法,将甜味及鲜味氨基酸划分为优味氨基酸,苦味及咸味氨基酸划分为劣味氨基酸,党参加入后其优味氨基酸含量增加了23.90%,说明党参加入后可为黄酒带来更多风味,且以甜味及鲜味为主。
根据氨基酸的功能特征,可将氨基酸划分为药用氨基酸及支链氨基酸[35](branched chain amino acid,BcAA)。由表6亦可知,党参黄酒的药用氨基酸占总氨基酸的比例最高,为56.87%,与对照存在显著性差异(P<0.05)。综上,党参黄酒中含有的氨基酸具有丰富的营养价值且呈味氨基酸、药用氨基酸所占比例较高。
2.5 党参黄酒体外抗氧化活性
党参黄酒对DPPH、超氧阴离子及羟基自由基清除率测定结果见图6。
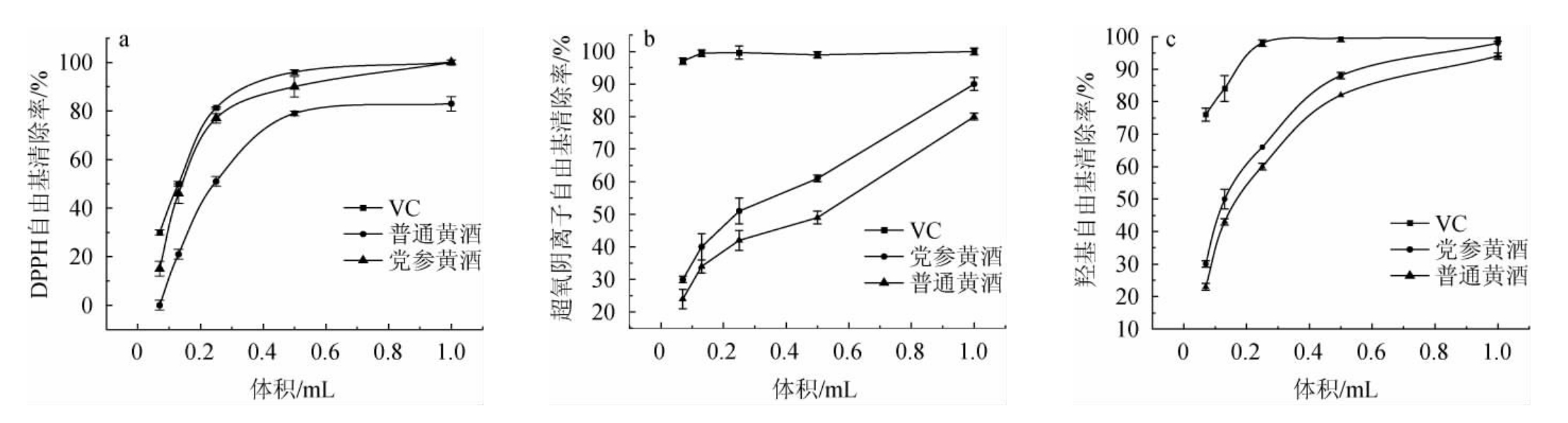
图6 党参黄酒对DPPH(a)、超氧阴离子(b)及羟基(c)自由基清除率
Fig.6 Clearance rates of Codonopsis pilosula Huangjiu on DPPH (a),superoxide anion (b) and hydroxyl (c) free radical
DPPH是一种稳定的自由基,被广泛应用于天然植物或化合物的抗氧化能力评价[32]。由图6a可知,以VC为对照,普通黄酒和党参黄酒的DPPH自由基清除能力随其体积的增加而增加,且DPPH自由基清除能力顺序为VC>党参黄酒>普通黄酒。党参黄酒和普通黄酒清除DPPH自由基的半抑制浓度(half inhibition concentration,IC50)值分别为0.18 mL/mL和0.43 mL/mL,即党参黄酒的DPPH的清除能力是普通黄酒的2.39倍,这可能是由于党参黄酒中含有更多的酚羟基提供活泼的氢从而终止自由基连锁反应,起到抗氧化作用。
超氧阴离子自由基作为生物体内主要自由基之一,可引起生物体内脂质过氧化,导致细胞膜结构和功能发生改变[37]。由图6b可知,以VC为对照,党参黄酒的超氧阴离子的清除率显著高于普通黄酒,且党参黄酒和普通黄酒清除超氧阴离子的IC50值分别为0.31 mL/mL和0.46 mL/mL,即党参黄酒的羟自由基清除能力是普通黄酒的1.48倍。
羟自由基是活性氧中最活泼的自由基,它几乎能与活细胞中任何生物大分子发生反应,且速度极快,是对机体危害最大的自由基[37]。由图6c可知,以VC为对照,党参黄酒及普通黄酒对羟自由基的清除能力顺序为:VC>党参黄酒>普通黄酒,党参黄酒和普通黄酒的羟自由基清除的IC50值分别为0.14 mL/mL和0.24 mL/mL,即党参黄酒的羟自由基清除率是普通黄酒的1.71倍。
3 结论
本研究通过单因素及响应面试验,确定党参黄酒的最佳酿造工艺为:党参添加量为9.5%、麦曲添加量为16.0%、糖化温度47 ℃。党参黄酒的感官评分、总氨基酸、总酚、总黄酮含量分别为76分、(7 070.60±17.27)mg/L、(494.39±11.68)mg/L、(42.40±1.79)mg/L;总氨基酸、必需氨基酸及药用氨基酸含量、体外抗氧化活性均显著高于普通黄酒(P<0.05),极具推广应用价值。
[1]YANG D,CHEN Y,GUO F,et al.Comparative analysis of chemical composition,antioxidant and antimicrobial activities of leaves,leaf tea and root from Codonopsis pilosula[J].Ind Crop Prod,2019,142(5):111844.
[2]HOSSEN M J,KIM M Y,KIM J H,et al.Codonopsis lanceolata:A Review of its therapeutic potentials[J].Phytother Res,2016,30(3):347-356.
[3]ZHOU J,LI X,WANG Y,et al.Interventional effect of Codonopsis pilosula oligosaccharides against D-galactose-induced aging in SD rats via suppression of oxidative stress,inflammation,and apoptosis[J].J Carbohyd Chem,2021,40(1-3):115-134.
[4]GAO Z,ZHANG C,JING L,et al.The structural characterization and immune modulation activitives comparison of Codonopsis pilosula polysaccharide(CPPS)and selenizing CPPS(sCPPS)on mouse in vitro and vivo[J].Int J Biol Macromol,2020,160(5):814-822.
[5]LIU H,AMAKYE W K,REN J.Codonopsis pilosula polysaccharide in synergy with dacarb azine inhibits mouse melanoma by repolarizing M2-like tumor-associated macrophages into M1-like tumor-associated macrophages[J].Biomed Pharmacother,2021,142(10):112016.
[6]XIN T,ZHANG F,JIANG Q,et al.The inhibitory effect of a polysaccharide from Codonopsis pilosula on tumor growth and metastasis in vitro[J].Int J Biol Macromol,2012,51(5):788-793.
[7]韩惠敏,李新生,耿敬章,等.黄酒酿造原料及生产工艺研究现状与展望[J].生物资源,2019,41(1):87-93.
[8]ZHAO W,QIAN M,DONG H,et al.Effect of Hong Qu on the flavor and quality of Hakka yellow rice wine(Huangjiu)produced in Southern China[J].LWT-Food Sci Technol,2022,160(5):113264.
[9]付春艳,吴殿辉,谢广发,等.新型清爽型干黄酒的酿造工艺[J].食品与发酵工业,2021,47(11):165-170.
[10]JIN Z,CAI G,WU C,et al.Profiling the key metabolites produced during the modern brewing process of Chinese rice wine[J].Food Res Int,2021,139(6877):109955.
[11]LIU R,FU Z,ZHANG F,et al.Effect of yellow rice wine on anti-aging ability in aged mice induced by D-galactose[J].Food Science and Human Wellness,2020,9(2):184-191.
[12]刘晓艳,曹甜,傅筱鸥,等.广东客家黄酒体外抗氧化能力的初步评价[J].中国酿造,2019,38(1):154-157.
[13]李国龙,金建明,谢广发.黄酒的营养成分与功能因子分析研究[J].酿酒,2021,48(3):78-80,85.
[14]周建弟,赖敏辉,应维茂,等.黄酒功能性成分与保健功能研究进展[J].酿酒,2021,48(5):24-29.
[15]周志立,刘双平,徐岳正,等.仿草包曲在黄酒发酵中的应用及其对黄酒风味的影响[J].食品科学技术学报,2021,39(5):135-144.
[16]张清文,毛严根,骆思铭.不同原料制备的麦曲及其酿造黄酒的差异性研究[J].酿酒科技,2021(3):40-44.
[17]胡武瑶,杨昳津,窦慧,等.不同麦曲酿造黄酒中挥发性风味物质的代谢差异[J].食品与发酵工业,2020,46(8):226-233.
[18]YANG H,PENG Q,ZHANG H,et al.The volatile profiles and microbiota structures of the wheat Qus used as traditional fermentation starters of Chinese rice wine from Shaoxing region[J].LWT-Food Sci Technol,2022,154(1):112649.
[19]杨小慧,石光波,拜晓彬,等.文冠果落果黄酮成分分析及抑菌性评价[J].食品科学,2018,39(10):53-58.
[20]李杰,许彬,罗建成,等.红小米黄酒酿造工艺研究及体外抗氧化活性评价[J].中国酿造,2021,40(7):123-129.
[21]薛山,肖夏,黄艺婷.双响应面法结合Matlab优化新疆南瓜籽粗油提取工艺研究[J].粮食与油脂,2021,34(10):35-40.
[22]崔晓雯,卢曼菁,汪金玉,等.岭南特色饮片熟党参HPLC指纹图谱及其炮制前后对比研究[J].中国现代应用药学,2021,38(8):953-958.
[23]胡云峰,王晓彬,陈君然,等.基于美拉德反应制备的熟制黑枸杞加工工艺及活性成分变化规律[J].食品与发酵工业,2019,45(7):151-156.
[24]黎珊,高明,陈康,等.蒸制时间对佛手主要成分与抗氧化活性的影响[J].中成药,2015,37(4):821-824.
[25]安琪,丁笑颖,李恒阳,等.基于人参皂苷和多糖含量的蒸制软支和硬支西洋参质量评价研究[J].中国药学杂志,2022,57(13):1068-1075.
[26]谢琦,程雪梅,胡芳弟,等.党参化学成分、药理作用及质量控制研究进展[J].上海中医药杂志,2020,54(8):94-104.
[27]孟衡玲,赵欣,何芳芳,等.党参多糖提取工艺优化及兰州市、定西市党参多糖含量比较[J].时珍国医国药,2020,31(2):318-320.
[28]宋平平,崔方,张亚杰,等.白条党参芦头、主根、参尾功能因子分析[J].食品科学,2022,43(14):242-248.
[29]李少华,李申,李翠翠.山茱萸黄酒发酵工艺的优化研究[J].食品研究与开发,2021,42(22):125-130.
[30]黄根树,张庆华.红枣蜂蜜保健酒的酿造工艺研究[J].中国酿造,2014,33(5):161-164.
[31]朱正军,饶建军,张娟,等.黄酒中健康因子的研究进展[J].中国酿造,2021,40(5):26-31.
[32]梁璋成,何志刚,林晓婕,等.红曲茶黄酒多酚色谱分析及其对小鼠抗氧化酶活力影响[J].中国酿造,2019,38(2):62-65.
[33]李安,刘小雨,张惟广.小米黄酒酿造工艺的研制及优化[J].食品研究与开发,2020,41(5):150-157.
[34]黄永桥,高亮,张群英,等.树莓中氨基酸、矿物元素及维生素含量分析与营养评价[J].食品与发酵工业,2022,48(15):295-302.
[35]ZHAO C J,SCHIEBER A,GANZLE M G.Formation of taste-active amino acids,amino acid derivatives and peptides in food fermentations-A review[J].Food Res Int,2016,89(Pt 1):39-47.
[36]高云超,宫晓波,杨春英,等.广东河源客家黄酒氨基酸分析[J].食品安全质量检测学报,2020,11(24):9503-9515.
[37]杨少辉,宋英今,王洁华,等.雪莲果体外抗氧化和自由基清除能力[J].食品科学,2010,31(17):166-169.