益生菌活跃于人体肠道内,是较为重要的有益微生物,在维持机体的微生态平衡以及改善宿主健康等方面起到正向调节作用[1]。随着现代科技的发展,益生菌的研究与开发取得飞快的发展。当益生菌到达机体肠道后,会处在较为复杂的微生态环境中,进而表现出竞争、吞噬等关系,使得其益生机制难以揭示[2-3]。除此之外,益生菌如何影响机体微生态尚未清晰,使得益生菌的深度利用和研发受到限制[4-6]。
乳酸菌是具有很多益生特性的益生菌,包括乳球菌、乳杆菌和双歧杆菌等,能够调节免疫系统、降低胆固醇、调节肠道菌群、缓解腹泻,抑制病原菌的生长和繁殖[7-8]等。罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)、鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)等均具有乳酸菌的有益功效,且安全性在国内被认可,已被应用于保健食品中[9]。所研究的乳酸菌主要来源于动物和人体的肠道及粪便,不同来源的菌株所具有的性质不同[10],因此探究菌株的特性及安全性尤为重要。
细菌性阴道病(bacterial vaginosis,BV)是女性疾病中较为常见的疾病,主要由致病菌阴道加德纳菌(Gardnerella vaginalis)引起[11]。阴道加德纳菌为革兰氏阴性菌,兼性厌氧菌,是造成阴道炎症疾病的主要致病菌之一,其生物膜的生成能力和阴道黏附能力在其致病过程中发挥重要作用。针对阴道性疾病治疗方式主要为改善患者病症,其次要调节阴道内部微生态平衡,因此恢复阴道内乳杆菌数量来提升阴道安全性显得尤为重要。但是目前我国上市的阴道乳杆菌的活菌制剂较少,有必要继续研发有利于抑制阴道加德纳菌的微生态制剂[12]。本实验从内蒙呼伦贝尔满洲里通达牧场的发酵食品奶豆腐样品中筛选乳酸菌,通过比较不同菌株对阴道加德纳菌的抑制作用,应用双层琼脂扩散法筛选出具有较强抑菌特性的罗伊氏粘液乳杆菌。通过溶血性试验、动物致病性试验评价其安全性评价,测定其耐酸耐胆盐能力,进而为治疗女性阴道疾病提供一种安全性高、抑菌效果显著的微生态制剂,这对改善人们的健康至关重要。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株和实验小鼠
罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)HCS02-001、发酵粘液乳杆菌(Limosilactobacillus fermentum)RR 0601、鼠李糖乳酪杆菌(Lacticaseibacillus rhamnosus)RR 0701、植物乳植杆菌(Lactiplantibacillus plantarum)RR 0801:分离自传统发酵食品奶豆腐样品。罗伊氏粘液乳杆菌(Limosilactobacillus reuteri)HCS02-001、金黄色葡萄球菌(Staphylococcus aureus)CICC 10473、英诺克李斯特氏菌(Listeria innocua)CICC 10417:中国工业微生物菌种保藏管理中心;无特定病原体(specific pathogen free,SPF)级昆明种小鼠(体质量18~22 g):沈阳艾克赛斯生物科技有限公司(许可证号:NO.SCXK(辽)2020-0001)。
1.1.2 试剂
梅里埃E-Test 药敏试条:北京兰伯瑞生物技术有限责任公司;胆盐(色谱纯):西格玛奥德里奇(上海)贸易有限公司;无菌托纤维绵羊血:北京陆桥技术股份有限公司;番茄汁:自制;牛肉粉(生化试剂):上海缘肽生物技术有限公司;酵母蛋白胨、酵母粉(均为生化试剂):安琪酵母股份有限公司;磷酸氢二钾、七水合硫酸镁、硫酸锰、柠檬酸、碳酸钙(均为分析纯):江苏科伦多食品配料有限公司;葡萄糖(分析纯):石药集团圣雪葡萄糖有限责任公司;吐温-80:江苏四新界面剂科技有限公司;碳酸钙(分析纯):天津大茂化学试剂厂;琼脂粉(生化试剂):国药集团化学试剂有限公司。
1.1.3 培养基
胰酪大豆胨肉汤(trypticase soy broth,TSB)培养基:胰蛋白胨1.7%,植物蛋白胨0.3%,氯化钠0.5%,磷酸氢二钾0.25%,葡萄糖0.25%。pH 7.3±0.2,115 ℃灭菌30 min。
改良MRS培养基:酵母蛋白胨1%,牛肉粉0.3%,酵母粉0.4%,磷酸氢二钾0.2%,柠檬酸0.2%,乙酸钠0.5%,葡萄糖2%,七水合硫酸镁0.058%,四水合硫酸锰0.025%,吐温-80 0.06%,碳酸钙1%,中性红0.05 g,番茄汁1%(V/V),琼脂粉2%,调pH至5.5;115 ℃灭菌30 min。
TSB培养基+5%脱纤维羊血:固体TSB培养基添加琼脂粉2%,pH 7.3±0.2,115 ℃灭菌30 min,放凉后加入5%无菌托纤维绵羊血。
可伦比亚琼脂:青岛高科技工业园海博生物技术有限公司。
1.2 仪器与设备
DHP-500电热恒温培养箱、DZKW-S-8电热恒温水浴锅:北京市永光明医疗仪器有限公司;LDZX-50KBS立式压力蒸汽灭菌器:上海申安医疗器械厂;MHY-28473麦氏浊度计:北京美华科技有限公司;PHS-25 pH计:沈阳奥利龙仪器有限公司。
1.3 方法
1.3.1 筛选菌种活化
将试验菌种冻存管置于37 ℃水浴锅中使其迅速溶化,取1 mL冻存管菌液接种至10 mL改良MRS液体培养基中,37 ℃静置培养17 h后,按照5%接种量接种至100 mL改良MRS培基中,于4 ℃放置,备用。
1.3.2 不同菌株对阴道加德纳菌的抑制作用
(1)不同菌株发酵上清液的制备
罗伊氏粘液乳杆菌HCS02-001、发酵粘液乳杆菌RR 0601、鼠李糖乳酪杆菌RR 0701、植物乳植杆菌RR 0801经过解冻、活化、接种、培养、发酵、离心得到筛选菌株的上清液。
(2)阴道加德纳菌试验菌株的活化
将阴道加德纳菌冻存管1 mL菌液接种于100 mL的TSB培养基+5%脱纤维绵羊血,在37 ℃的微厌氧产气包(5%CO2)环境中培养24 h。
(3)制备含指示菌双层平板
将琼脂培养基(13 mL 2%琼脂溶液)置于灭菌平皿中,待琼脂凝固至室温后,均匀放置4个牛津杯,取阴道加德纳菌菌液(100 μL,浓度约为1×108 CFU/mL)和琼脂培养基(10 mL,1.5%琼脂溶液)均匀倒入平皿中,使得致病菌菌液浓度在1×106 CFU/mL,琼脂凝固后取走牛津杯。
(4)添加筛选菌株上清液
在样孔中依次添加罗伊氏粘液乳杆菌HCS02-001、发酵粘液乳杆菌RR 0601、鼠李糖乳酪杆菌RR 0701、植物乳植杆菌RR 0801上清液各100 μL,将平皿置于37 ℃微厌氧产气包(5%CO2)培养48 h。培养后观察抑菌圈,测量抑菌圈直径。抑菌圈出现说明菌株的存在抑制阴道加德纳菌的生长,抑菌圈直径越大,说明抑制作用越强[13]。
1.3.3 罗伊氏粘液乳杆菌HCS02-001浓缩上清液抑菌试验
罗伊氏粘液乳杆菌HCS02-001浓缩上清液的制备:取1.3.1中经活化的筛选菌活化液于10 000 r/min条件下离心10 min,得到的上清液加热浓缩至体积为原来的1/3,得到3倍浓缩上清液,置于4 ℃备用。在加样孔中依次加入3倍浓缩上清液样品、空白对照组(MRS培养基3倍浓缩液)各100 μL,将平皿置于37 ℃微厌氧产气包(5%CO2)培养48 h,培养后观察抑菌圈,测量抑菌圈直径[14]。
1.3.4 溶血性试验
取1.3.1制备的活化菌株接种于哥伦比亚琼脂平皿上,同一平皿中点样英诺克李斯特氏菌CICC 10417菌株作为阴性对照组,点样金黄色葡萄球菌CICC 10473菌株作为阳性对照组,37 ℃环境下培养48 h,观测平皿中溶血圈并拍照记录[15]。若菌落周围出现溶血环,说明益生菌具备溶血能力且是潜在的病原菌。菌落周围未出现溶血环时,表明该菌株无溶血能力[16]。
1.3.5 动物致病性试验
按照《保健食品原料用菌种安全性检验与评价技术指导原则(2020年)》对小鼠进行腹腔注射和经口灌胃试验检验菌株致病性,分别选取40只小鼠,雌、雄小鼠各20只,分为腹腔注射组(10只雄性小鼠和10只雌性小鼠)和经口灌胃组(10只雄性小鼠和雌性小鼠)。具体试验委托《中国工业微生物菌种保藏管理中心》机构进行检测。
1.3.6 耐酸试验
将传代三次的罗伊氏粘液乳杆菌HCS02-001菌液按照10%的接种量分别接种于各个培养基中。37 ℃、静置培养17 h,取出的样品10倍稀释后,制备菌液1 000 μL进行活菌计数操作,每个稀释度做3次重复,37 ℃静置培养48 h后计数[17]。其耐酸存活率计算公式如下:
式中:N'表示不同pH培养基测得的活菌数,CFU/g;N0表示空白对照试验的活菌数,CFU/g。
1.3.7 耐胆盐试验
将经过三次传代的菌液于10%的接种量接种在不同胆盐浓度的液体培养基,37 ℃、17 h静置培养后,测定活菌数[18]。其耐胆盐存活率计算公式如下:
式中:N0表示测得空白对照的活菌数,CFU/g;N″表示其他胆盐浓度条件下测得的活菌数,CFU/g。
1.3.8 数据处理
每组试验重复3次进行平行测定,数据采用SPSS19.0软件和Excel 2016软件进行数据分析,当P<0.05时,差异被认为是显著且有意义的,结果表示为“平均值±标准差”。
2 结果与分析
2.1 筛选菌株抑制阴道加德纳菌试验结果
通过测定不同菌株对阴道加德纳菌的抑制作用,筛选出具有较强特性的菌株,试验结果见图1。由图1可知,罗伊氏粘液乳杆菌HCS02-001的抑菌圈直径为18.23 mm,极显著高于其他菌株的抑菌圈直径(P<0.01)。分析原因可能是罗伊氏粘液乳杆菌HCS02-001可以分泌有机酸等抑菌产物,破坏其菌体细胞结构,抑制致病菌的繁殖[19]。因此,罗伊氏粘液乳杆菌HCS02-001对阴道加德纳菌具有抑制作用。
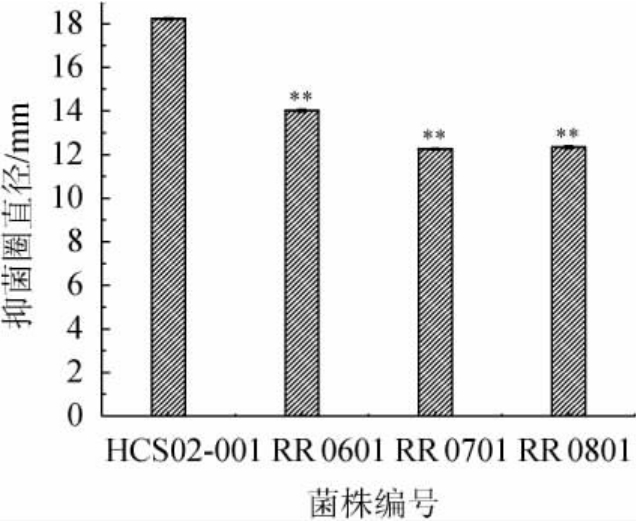
图1 筛选菌株对阴道加德纳菌的抑菌试验结果
Fig.1 Antibacterial results of screened strains against Gardnerella vaginalis
“**”表示与菌株HCS02-001相比差异极显著(P<0.01)。
2.2 罗伊氏粘液乳杆菌HCS02-001抑制阴道加德纳菌试验结果
罗伊氏粘液乳杆菌HCS02-001抑菌效果良好,取其上清液的3倍浓缩液测定对阴道加德纳菌抑制情况,结果见图2。由图2可知,3组罗伊氏粘液乳杆菌HCS02-001实验组均出现抑菌圈,且抑菌圈平均直径达21.32 mm,分析原因可能是菌株HCS02-001代谢产生有机酸、乳酸、小分子肽等物质,有机酸和乳酸会保持培养皿中具有较低的pH,抑制菌群的生长和繁殖,进而抑制多种有害微生物使菌体无法正常发挥致病作用[20]。结果表明,罗伊氏粘液乳杆菌HCS02-001对阴道加德纳菌有抑菌作用。
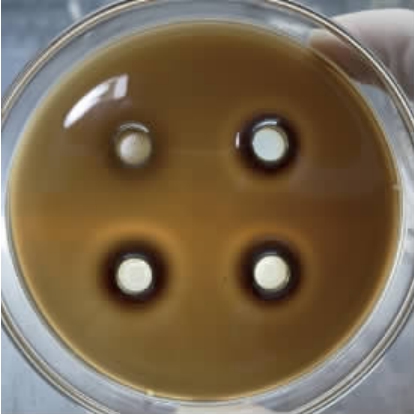
图2 罗伊氏粘液乳杆菌HCS02-001抑制阴道加德纳菌试验结果
Fig.2 Results of Limosilactobacillus reuteri HCS02-001 against Gardnerella vaginalis
左上角为空白对照组,加入3倍浓缩的MRS灭菌培养基,未出现抑菌圈;其余三孔为三组平行,加入3倍浓缩的罗伊氏粘液乳杆菌HCS02-001。
2.3 溶血性试验结果
测定乳酸菌的溶血性是评价乳杆菌安全性的重要指标之一。将已经活化的罗伊氏粘液乳杆菌HCS02-001菌悬液、阴性对照菌英诺克李斯特氏菌CICC 10417和阳性对照菌金黄色葡萄球菌CICC 10473接种在哥伦比亚血琼脂平皿中,于37 ℃环境下培养48 h,溶血性试验结果见图3。由图3可知,阳性对照菌出现溶血圈,表现出溶血性。样品罗伊氏粘液乳杆菌HCS02-001和阴性对照组菌无溶血圈出现,表现为不溶血,说明菌株HCS02-001不具备潜在的致病菌特性,在溶血性方面具有一定的安全性[21]。
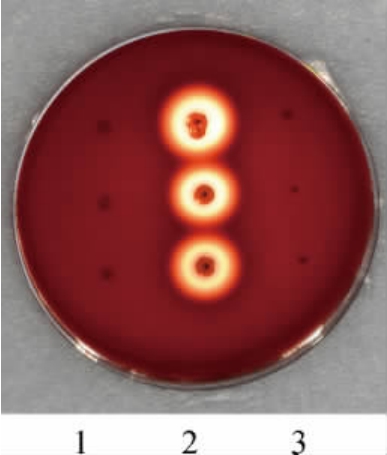
图3 罗伊氏粘液乳杆菌HCS02-001溶血性试验结果
Fig.3 Results of hemolytic tests for Limosilactobacillus reuteri HCS02-001
1.阴性对照菌:英诺克李斯特氏菌CICC 10417;2.阳性对照菌:金黄色葡萄球菌CICC 10473;3.样品:罗伊氏粘液乳杆菌HCS02-001。
2.4 动物致病性试验结果
2.4.1 腹腔注射试验
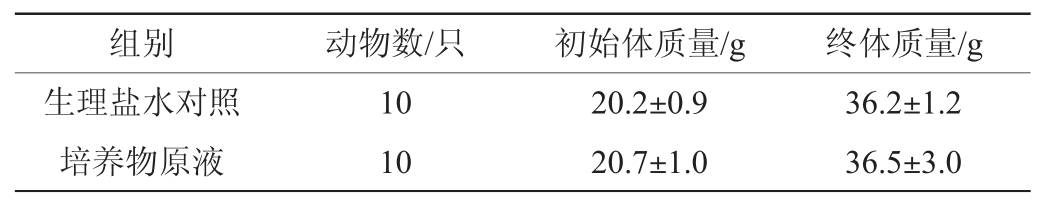
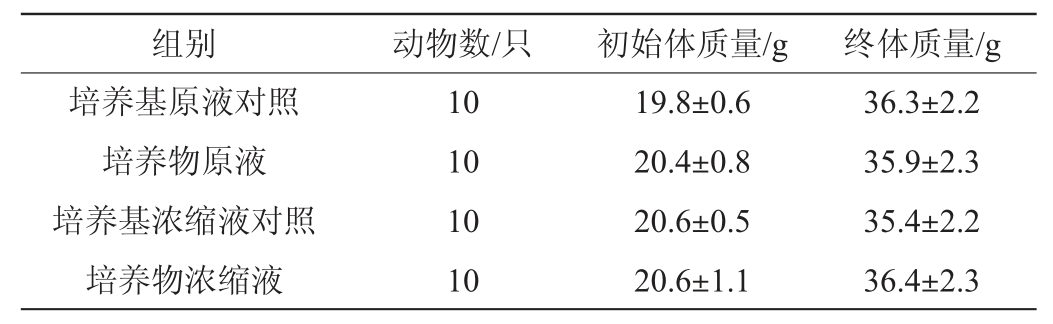
雄性小鼠试验结果见表1。由表1可知,雄性小鼠的初始体质量和终体质量在培养物菌悬液组与其相应对照组之间无显著差异(P>0.05),即在试验期间罗伊氏粘液乳杆菌HCS02-001对于雄性小鼠体质量无影响。因此,注射益生菌粘液对小鼠的基本生理特征无影响。
表1 菌株HCS02-001培养物腹腔注射对雄性小鼠体质量的影响(n=10)
Table 1 Effect of intraperitoneal injection of strain HCS02-001 culture on body mass of male mice (n=10)
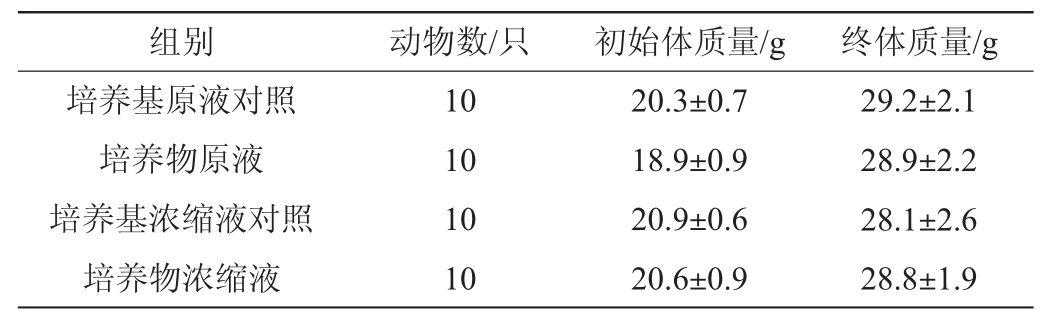
雌性小鼠经腹腔注射后的体质量变化见表2。由表2可知,初始体质量和终体质量在培养物菌悬液组与其相应对照组间比较均无显著性差异(P>0.05)。体质量作为生命体征中重要的指标,说明经腹腔注射菌株HCS02-001培养物对雌性小鼠的体质量无影响,即不影响小鼠正常的生命体征。
表2 菌株HCS02-001培养物腹腔注射对雌性小鼠体质量的影响(n=10)
Table 2 Effect of intraperitoneal injection of strain HCS02-001 culture on body mass of female mice (n=10)

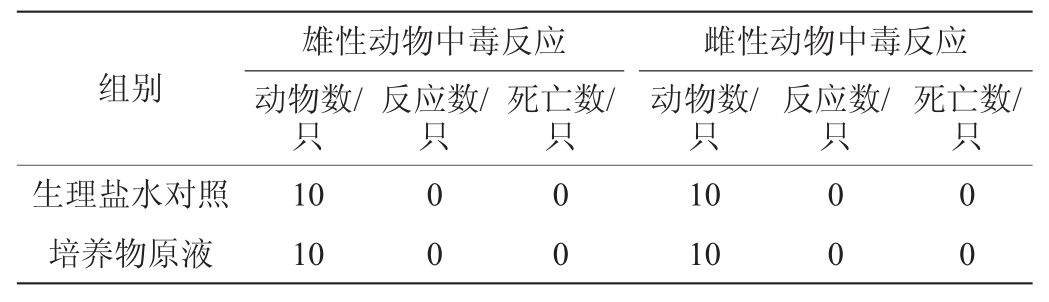
将菌株HCS02-001培养物原液以0.2 mL的剂量腹腔注射小鼠1次,连续观察21 d,结果见表3。由表3可知,小鼠状态良好体态正常,未观察到受试小鼠有毒性反应或死亡。说明罗伊氏粘液乳杆菌HCS02-001对小鼠无毒性作用,未对小鼠健康造成影响。
表3 菌株HCS02-001培养物经口灌胃对小鼠急性毒性作用(n=10)
Table 3 Effect of oral administration of strain HCS02-001 culture on acute toxicity to mice (n=10)
2.4.2 经口灌胃试验结果
参照《保健食品原料用菌种安全性检验与评价技术指导原则(2020年)》,将罗伊氏粘液乳杆菌HCS02-001经口灌胃给小鼠,观测各组雄性小鼠体质量变化,结果见表4。由表4可知,雄性小鼠的初始体质量和终体质量在培养物组与其相应对照组间比较均无显著性差异(P>0.05),即菌株HCS02-001培养物对雄性小鼠的体质量无影响。
表4 菌株HCS02-001培养物经口灌胃对雄性小鼠体质量的影响(n=10)
Table 4 Effect of oral administration of strain HCS02-001 culture on body mass of male mice
雌性小鼠经口灌胃后体质量变化见表5。由表5可知,雌性小鼠的初始体质量和终体质量在培养物组与其相应对照组间比较均无显著性差异(P>0.05),表明菌株HCS02-001培养物对雄性小鼠的体质量无影响。
表5 菌株HCS02-001培养物对雌性小鼠体质量的影响(n=10)
Table 5 Effect of culture of strain HCS02-001 on body mass of female mice (n=10)
将罗伊氏粘液乳杆菌HCS02-001培养物原液和浓缩液,以20.0 mL/kg体质量的剂量经口灌胃小鼠,连续灌胃3 d,观察21 d,结果显示,雄性小鼠和雌性小鼠均无中毒反应。观察到受试小鼠精神状态良好,禁食饮水均正常,无毒性反应或死亡现象,说明罗伊氏粘液乳杆菌HCS02-001经口灌胃对小鼠无毒性作用。
2.5 耐酸试验结果
益生菌进入人体发挥作用场所主要在肠道内,因此益生菌必须具备耐酸的能力,才能通过胃部进入肠道进而发挥作用。人体空腹时胃液pH达到2.0以下,进食后胃液pH可以达到3.0。试验设计测定pH2.0和pH3.0时的菌株存活率,结果见图4。由图4可知,罗伊氏粘液乳杆菌HCS02-001在pH3.0时,活菌数对数值为8.10,存活率为86.91%,在pH 2.0时活菌数对数值为7.97,存活率为85.52%。说明菌株在酸性环境下有较高的存活率,可以耐受胃酸的环境,为菌株在肠道内发挥作用提供基础。其耐酸能力较强可能与强酸环境下菌株的膜蛋白和脱氧核糖核酸(deoxyribonucleic acid,DNA)修复能力等耐酸机制有关[22]。
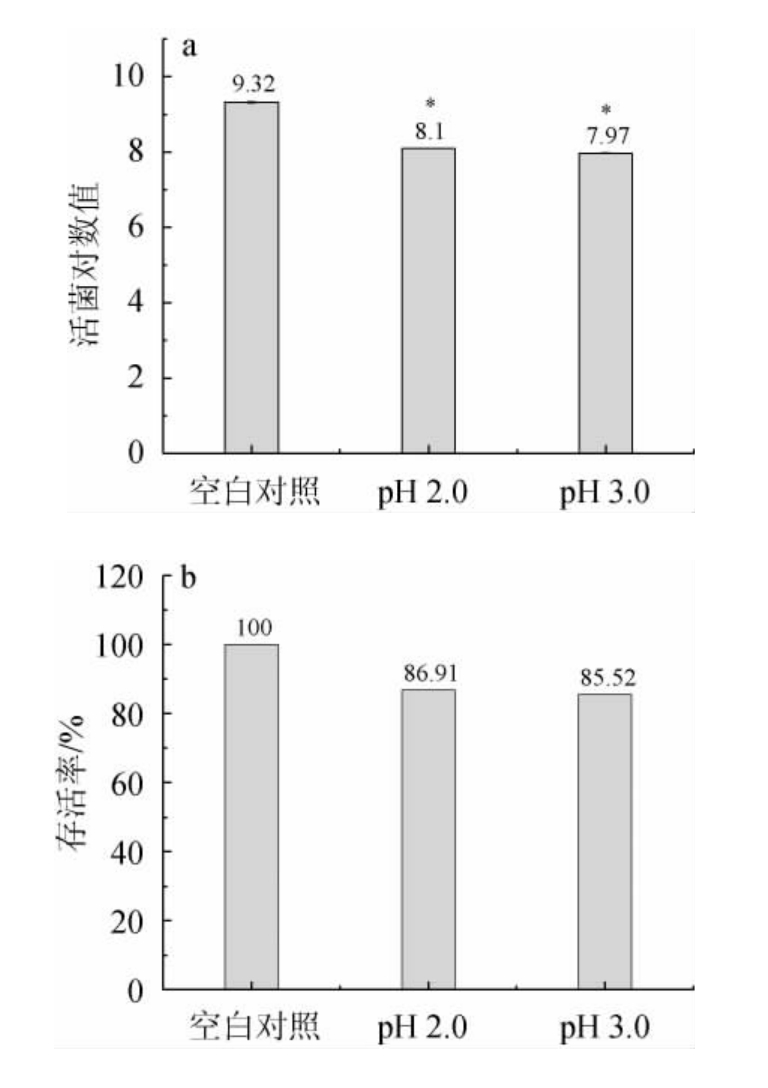
图4 不同pH条件下菌株HCS02-001活菌对数值(a)及存活率(b)(n=3)
Fig.4 Logarithmic values (a) and survival rates (b) of viable bacteria of strain HCS02-001 with different pH (n=3)
“*”表示与空白对照组相比差异显著(P<0.05)。
2.6 耐胆盐试验结果
益生菌进入胃液后,仍需要耐受消化系统的胆盐环境,试验探究不同胆盐浓度下罗伊氏粘液乳杆菌的存活率,结果见图5。由图5可知,在胆盐质量分数为1.5%时,活菌数对数值为8.48,菌株存活率达到90.99%,存活率较高,可以在消化系统中存活。罗伊氏粘液乳杆菌HCS02-001对于胆盐耐受能力较强可能是由于其自身产生胆盐水解酶,进而降低胆盐对于菌体的破坏[23]。
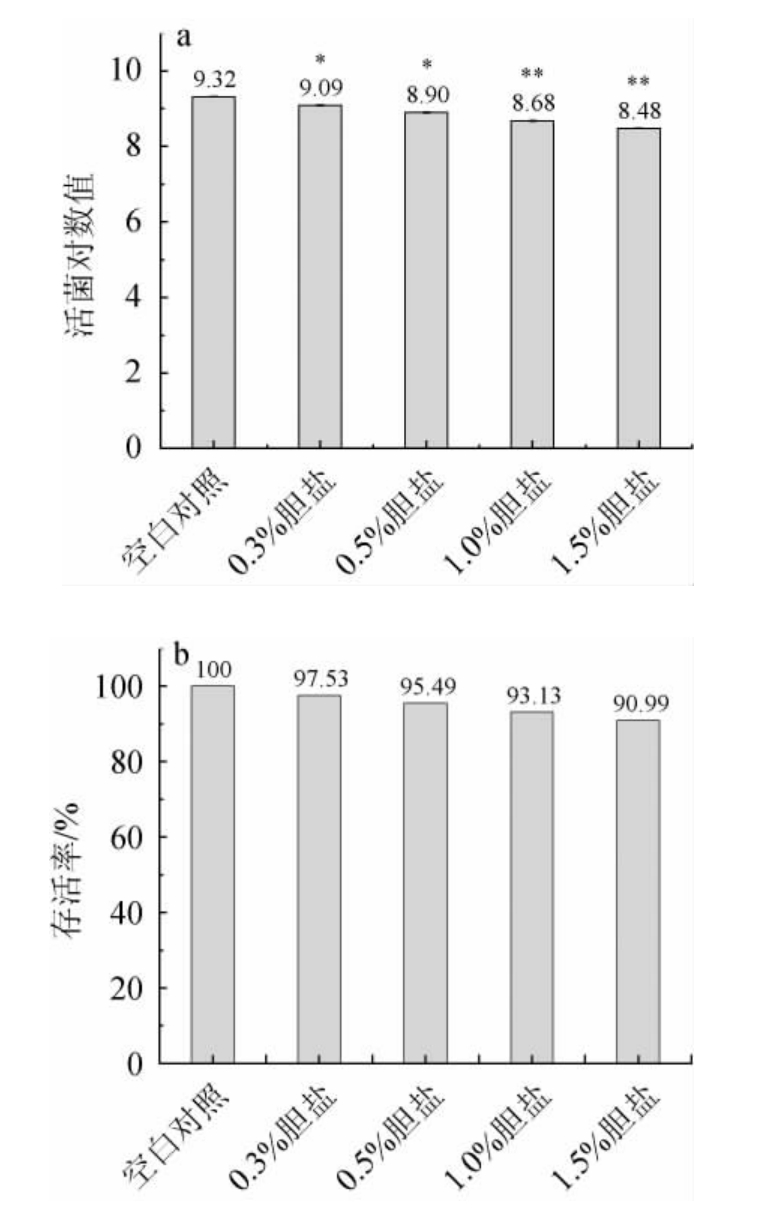
图5 不同胆盐浓度条件下菌株HCS02-001活菌对数值(a)及存活率(b)(n=3)
Fig.5 Logarithmic values (a) and survival rates (b) of viable bacteria of strain HCS02-001 with different bile salt concentrations(n=3)
“*”表示与空白对照组相比差异显著(P<0.05),“**”表示与空白对照组相比差异极显著(P<0.01)。
3 讨论
目前阴道加德纳菌引起的女性疾病困扰着女性疾病患者,针对性的抑制阴道加德纳菌的益生菌的开发和利用显得尤为重要[24]。前期试验中完成罗伊氏粘液乳杆菌HCS02-001的筛选和鉴定,其安全性和益生特性还需进一步评价。抑菌圈的测定是评价抑菌特性的常用方法之一,从奶豆腐样品中筛选出的4株菌株具有抑制阴道加德纳菌特性,其中罗伊氏粘液乳杆菌HCS02-001的抑制阴道加德纳菌能力处于较高水平。其抑菌圈直径可达18.23 mm,这高于鄢梦洁等[25]研究的植物乳植杆菌对阴道加德纳菌抑菌圈直径17.60 mm,经过浓缩处理的罗伊氏粘液乳杆菌HCS02-001的3倍浓缩上清液呈现出较好的抑菌特性。对罗伊氏粘液乳杆菌HCS02-001作出安全性评价,菌株在溶血性试验中表现为不溶血,且无致病性;致病性试验中经腹腔注射和经口灌胃两种方式均未对小鼠造成影响,小鼠状态良好正常进食,无中毒或死亡出现。在益生菌益生特性试验中,菌株HCS02-001对酸及胆盐环境中耐受良好。
4 结论
筛选菌株中罗伊氏粘液乳杆菌HCS02-001抑菌能力较高,发酵上清液的抑菌圈直径为18.23 mm,发酵上清液经过3倍浓缩后抑菌圈直径可达21.58 mm,未显示出致病性和溶血性。经过试验验证其耐酸耐胆盐能力较强,在pH2.0时活菌数对数值为7.97,存活率为85.52%,在胆盐浓度为1.5%时活菌数对数值为8.48,存活率可达90.99%,为菌株定植在体内发挥作用奠定基础。由此可知,罗伊氏粘液乳杆菌HCS02-001被证实不具备潜在致病菌特性,对小鼠无急性毒性作用。初步表明有良好的安全性,具备较强的抑制阴道加德纳菌的能力,适于女性私护类产品的开发和利用。本研究中只探讨了对阴道加德纳菌的抑制作用,在后续的研究中将进一步探究罗伊氏粘液乳杆菌HCS02-001的益生特性和发挥机制。
[1]CHIOCCHETTI G,ALCANTARA B C,MONEDERO G V,et al.Effect of inorganic arsenic on the intestinal epithelium and possible protective role of probiotics[J].Toxicol Lett,2015,238(2):S77-S78.
[2]EHSANNI A,AHARI H,KAKOOLAKI S,et al.Effects of probiotics on Zebrafish model infected with Aeromonas hydrophila: spatial distribution,antimicrobial,and histopathological investigation[J].BMC Microbiol,2022,22(1):167-167.
[3]何小平,张孟,戴承恩,等.益生菌临床应用的研究进展[J].中国新药与临床杂志,2018,37(3):130-135.
[4]VICENTINI F A,AUKEMA R J,HUME C,et al.Intestinal microbiota shapes gut physiology and regulates enteric neurons and glia[J].Microbiome,2021,9(1):210-210.
[5]CHAN C W,MCCULLLEY S J,MACMILLAN R D.Autologous fat transfer-a review of the literature with a focus on breast cancer surgery[J].J Plastic Reconstruct Aesthet Surgery,2008,61(12):1438-1448.
[6]阿热爱·巴合提,武瑞赟,肖梦圆,等.益生菌的生理功能及作用机理研究进展[J].食品与发酵工业,2020,46(22):270-275.
[7]FLOCH M H.The role of prebiotics and probiotics in gastrointestinal disease[J].Gastroenterol Clin North Am,2018,47(1):179-191.
[8]刘桂扬,陈华海,王欣,等.双歧杆菌抗生素耐药性研究进展[J].中国微生态学杂志,2019,31(3):360-364.
[9]张紫薇.罗伊氏乳杆菌J1益生特性初步评价及基因组学研究[D].哈尔滨:东北农业大学,2019.
[10]MASOOD M I,QADIR M I,SHIRAZI J H,et al.Beneficial effects of lactic acid bacteria on human beings[J].Crit Rev Microbiol,2011,37(1):91-98.
[11]BRETELLE F,ROZENBERG P,PASCAL A,et al.High Atopobium vaginae and Gardnerella vaginalis vaginal loads are associated with preterm birth[J].Clin Infect Dis,2015,60(6):860-867.
[12]王则绯,谭宏伟.对阴道加德纳菌、白色假丝酵母菌有抑制作用的人阴道乳酸杆菌的筛选和功能[J].山东医药,2018,58(19):37-41.
[13]SIMOES J A,CITRON D M,AROUTCHEVA A,et al.Two novel vaginal microbicides(polystyrene sulfonate and cellulose sulfate) inhibit Gardnerella vaginalis and anaerobes commonly associated with bacterial vaginosis[J].Antimicrob Agent Chemother,2002,46(8):2692-2695.
[14]矫艳平,余萍,赵迪,等.植物乳杆菌HCS03-001安全性评价及其益生特性分析[J].食品工业科技,2022,43(5):165-171.
[15]KONURAY G,ERGINKAYA Z.Potential use of Bacillus coagulans in the food industry[J].Foods,2018,7(6):92.
[16]张喜昌,费世洲,常亚青,等.刺参肠道微生物组成分析及产酶、溶血性试验[J].海洋科学,2014,38(5):24-30.
[17]FARHANGFAR A,GANDOMI H,AKHONDZADEH B A,et al.Study of growth kinetic and gastrointestinal stability of acid-bile resistant Lactobacillus plantarum strains isolated from Siahmazgi traditional cheese[J].Veter Res Forum,2021,12(2):235-240.
[18]LI M Q,XIA S W,ZHANG Y J,et al.Optimization of ACE inhibitory peptides from black soybean by microwave-assisted enzymatic method and study on its stability[J].LWT-Food Sci Technol,2018,98:358-365.
[19]MCLEAN N W,MCGROATRY J A.Growth inhibition of metronidazole-susceptible and metronidazole-resistant strains of Gardnerella vaginalis by Lactobacilli in vitro[J].Appl Environ Microbiol,1996,62(3):1089-1092.
[20]LIU Z,X U C,TIAN R,et al.Screening beneficial bacteriostatic lactic acid bacteria in the intestine and studies of bacteriostatic substances[J].Journal of Zhejiang University-Sci B,2021,22(7):533-547.
[21]王佳慧.人源益生菌的分离鉴定及体内外抗氧化益生潜能研究[D].兰州:兰州理工大学,2021.
[22]SAIKI A,YAMAGUCHI T,YASUMURA T,et al.A Lactobacillus mutant capable of accumulating long-chain polyphosphates that enhance intestinal barrier function[J].Biosci Biotechnol Biochem,2016,80(5):955-961.
[23]PATEL A K,SINGHANIA R R,PANDEY A,et al.Probiotic bile salt hydrolase:current developments and perspectices[J].Appl Biochen Biotechnol,2010,162(1):166-180.
[24]MOON E C,PARK M S,LIM T.Antibacterial effect of cell-free supernatant fraction from Lactobacillus paracasei CH88 against Gardnerella vaginalis[J].Scientif Rep,2022,12(1):4763-4763.
[25]鄢梦洁,张欢欢,路江浩,等.对阴道炎主要致病菌有抑菌活性乳杆菌的筛选及特性[J].中国微生态学杂志,2021,33(2):161-165.