汾酒是我国的历史文化名酒,也是大曲清香型白酒的典型代表,采用传统的“地缸固态分离发酵、清蒸二次清”酿造工艺,素以入口绵、落口甜、饮后余香、回味悠长的特色而著称,在国内外消费者中享有较高的知名度、美誉度和忠诚度。汾酒酒体的主要成分是乙醇和水,决定汾酒的风格和质量的,则是溶于其中,只占总量1%~2%的酸、酯、醇、醛等种类众多的微量有机化合物。
“曲是酒之骨,好曲出好酒”。大曲是白酒酿造的发酵剂,为酒醅发酵过程提供了丰富的菌系、酶系和各种风味物质[1-2],因此在白酒酿造过程中起到了举足轻重的作用。大曲的品质受到了工艺[3]和环境因素(如温度、湿度、酸度)的影响,并且在整个发酵过程中呈现动态变化[4-5]。大曲的发酵温度和制作工艺不同,造成了高温、中温、低温3种大曲之间糖化力、液化力、酯化力、发酵力等理化指标相差很大[6]。而微生物组成结构和活性的差异是导致其酶系及风味物质差异的根本原因[7-8]。提高大曲发酵温度会导致芽孢杆菌属和曲霉属的相对丰度上升,液化酶和糖化酶活性显著下降,风味物质组成也存在显著差异[9]。三种不同的清香型大曲——清茬曲、红心曲和后火曲中的微生物组成结构存在显著差异,进而导致其酯化力、糖化力、风味物质形成等理化性质的差异[10-11]。进一步研究发现,夏、秋季节和曲房不同位置的大曲微生物群落多样性呈现显著差异[12]。夏季生产的特香型大曲中细菌多样性较高,而秋季生产的大曲中真菌多样性更高[13]。另外,大曲的感官特征、微生物结构、理化性质等品质还具有地域特色[14]。即使在同一区域,而不同场地制成的大曲中淀粉水解酶、酯化酶以及微生物群落结构同样有着显著的差异[15-17]。
汾酒大曲以大麦、豌豆为原料,经过粉碎、压曲块、卧曲、上霉期、晾霉期、潮火期、大火期、后火期、养曲等工序而成。制成的大曲检验合格后,经过3~6个月的贮存期,按照一定比例混合后方可应用于白酒酿造。大曲是在半开放的环境中进行操作的,因此其品质不仅受到工艺的影响,也受到环境微生物的影响。研究发现,酒醅中9.10%~27.39%的细菌群落和61.06%~80.00%的真菌群落来源于大曲[18]。因此,对大曲微生物的研究有助于大曲质量标准的制定及大曲工艺的改进。本研究通过采集伏曲、冬曲等不同区域、不同时期汾酒生产用曲样品,采用高通量测序分析大曲中微生物群落结构的差异,为进一步解析大曲的功能奠定基础。
1 材料与方法
1.1 材料与试剂
不同汾酒生产用曲:某大曲a厂秋季生产的生产用曲(GF)、某大曲b厂秋季生产的生产用曲(ZF)、某大曲c厂秋季生产的生产用曲(BY)、某大曲a厂夏季生产的生产用曲(伏曲,FQ)、某大曲a厂冬季生产的生产用曲(冬曲,DQ)。在相应的大曲厂随机选择6个班组,采集粉碎好的生产用曲,分别编号1~6,即为6个重复。
1.2 仪器与设备
PX224ZH电子天平:奥豪斯仪器(常州)有限公司;Eppendorf 5428R离心机:德国Eppendorf公司;HH-2数显恒温水浴锅:常州国华电器有限公司;PowerSoil脱氧核糖核酸(deoxyribonucleicacid,DNA)IsolationKit核酸提取试剂盒:美国Omega Bio-Tek公司;Nanodrop 2000超微量分光光度计:美国ThermoFisher公司;ABI 9700聚合酶链式反应(polymerase chain reaction,PCR)仪:美国Applied Biosystems公司;Agencourt AMPure XP核酸纯化试剂盒:美国Beckman Coulter公司;Illumina Miseq测序仪:美国Illumina公司。
1.3 方法
1.3.1 DNA提取、扩增和测序
利用PowerSoil DNA Isolation Kit核酸提取试剂盒提取大曲微生物总脱氧核糖核酸(DNA),然后用1%琼脂糖凝胶电泳和Nanodrop2000分别检测DNA质量和浓度。以大曲微生物总DNA为模板,338F(5'-ACTCCTACGGGAGGCAGCAG-3')和806R(5'-GGACTACNNGGGTATCTAAT-3')为引物,通过PCR扩增细菌16S rDNA的V3-V4区基因序列,以内转录间隔区(internal transcribed spacer,ITS)1(5'-CTTGGTCATTTAGAGGAAGTAA-3')和ITS2(5'-TGCGTTCTTCATCGATGC-3')为引物PCR扩增真菌的ITS1区基因序列。利用琼糖凝胶电泳检测PCR产物的条带大小,验证正确后用Agencourt AMPure XP核酸纯化试剂盒纯化PCR产物,然后构建微生物多样性测序文库,在北京奥维森基因科技有限公司使用Illumina Miseq PE300高通量测序平台进行测序。
1.3.2 数据分析
利用Pear(v0.9.6)对数据进行过滤、拼接,利用Vsearch(v2.7.1)软件去除长度<230 bp的细菌16S rDNA V3-V4区序列及<120 bp的真菌ITS1区序列后进行操作分类单元(operational taxonomic units,OTU)聚类。序列相似性>97%可以认为属于同一OTU。将细菌序列在Silva128数据库中进行比对,获得细菌OTU对应的物种分类信息;将真菌序列在Unite数据库中进行比对,获得真菌OTU对应的物种分类信息。利用QIIME1(v1.8.0)软件进行α多样指数分析和β多样性分析。利用t-test进行差异显著性分析,分析结果用P值表示。P>0.05表示无显著性差异,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 样品微生物高通量测序质量
对不同区域、不同时期的汾酒生产用曲提取DNA、扩增后进行测序,去除嵌合体、短序列后得到1 568 742条细菌16S rDNA V3-V4区优质序列和3 175 280条真菌ITS1区优质序列,测序长度主要分布在400~440 bp(99.7%)和260~360 bp(96.2%),与预期相符,因此判断测序结果较好。不同样品微生物菌群稀释性曲线见图1。由图1可知,随着测序深度的增加,所有样品的稀释曲线都趋于平缓,说明所得序列可以基本反映大曲中微生物群落结构的多样性。
图1 不同区域、不同时期汾酒生产用曲细菌(a)和真菌(b)的稀释曲线
Fig.1 Rarefaction curves of bacteria (a) and fungi (b) of Fenjiu Daqu in different regions and periods
2.2 微生物群落的α多样性分析
将测序结果进行α多样性分析,结果见图2。由图2可知,不同区域、不同时期的汾酒生产用曲共识别出850个细菌OTU序列和223个真菌OTU序列。其中FQ细菌OTU数最高,为236±21;DQ次之,为231±21;二者无显著差异(P>0.05);BY最少,为178±13;GF和ZF居中,分别为214±18和195±33。相比之下,大曲中真菌OTU数显著低于细菌OTU数(P<0.05)。ZF大曲中真菌OTU数最高,达到了79±12,而GF大曲、BY大曲和DQ中真菌OTU数相似,分别为65±3、61±3和64±5,显著高于FQ(44±7)(P<0.05)。
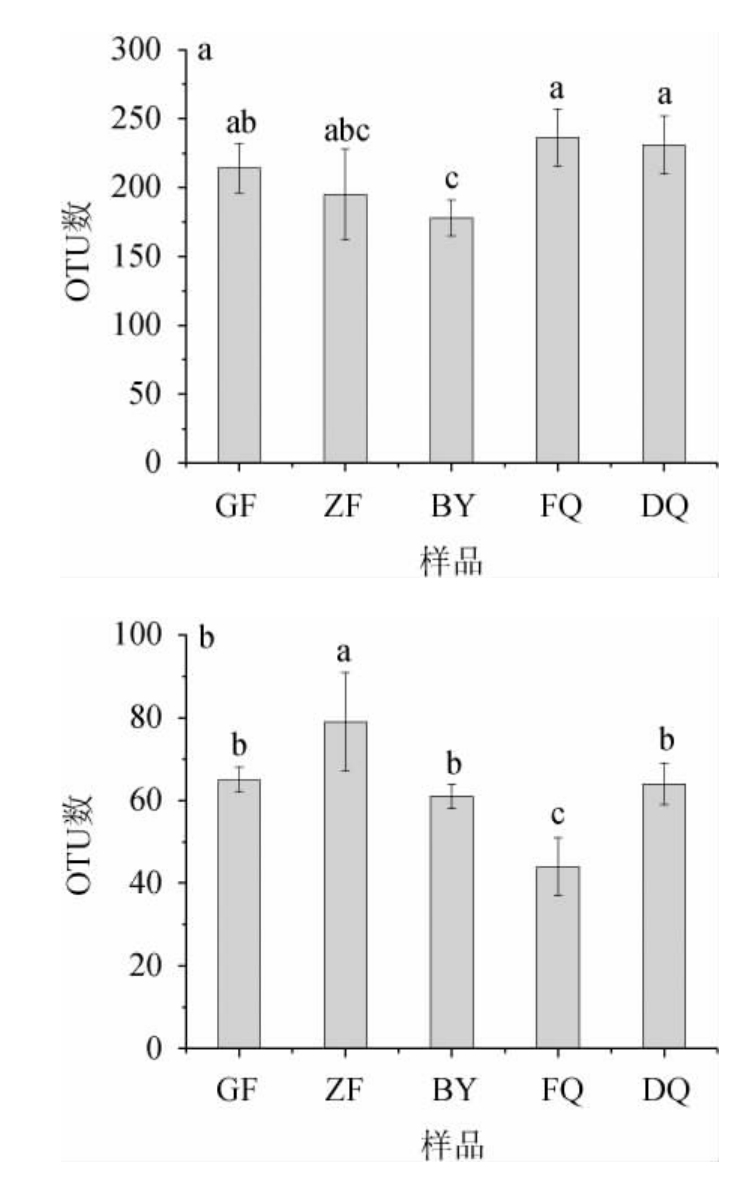
图2 不同区域、不同时期汾酒生产用曲中细菌(a)和真菌(b)OTU数量
Fig.2 OTU number of bacteria (a) and fungi (b) of Fenjiu Daqu in different regions and periods
不同字母表示差异显著(P<0.05)。下同。
将所有样品的核心OTU数进行比较,结果见图3。由图3可知,不同区域、不同时期的汾酒生产用曲中共有54个核心细菌OTU,15个核心真菌OTU,分别占到总数的5.93%和6.64%。在这些核心细菌OTU中,8种属于乳杆菌属(Lactobacillus),魏斯氏菌属(Weissella)、明串珠菌属(Leuconostoc)和芽孢杆菌属(Bacillus)各3种。前三者属于乳酸菌,这些菌株不仅可以发酵产生乳酸,还可能产生乙酸、丙酸、3-羟基-丙酸、甲酸等有机酸,以及双乙酰、乙偶姻、丁二醇、乙醛等风味物质[19]。有机酸也可以进一步反应,合成各种酯类物质。芽孢杆菌不仅可以产生淀粉酶、蛋白酶、酯酶等酶类,以降解大分子物质;还可以产生吡嗪类物质等各种风味物质,降解氨基甲酸乙酯;并且可以抑制链霉菌的生长,以减少白酒中的土味[20-22]。核心真菌OTU中,4种属于毕赤酵母属(Pichia),3种属于覆膜孢酵母属(Saccharomycopsis),2种属于横梗霉属(Lichtheimia)。毕赤酵母与多种香味物质,如苯乙醇[23]、乙酸乙酯[24]的合成有关。覆膜孢酵母可以产生淀粉酶、酸性蛋白酶等水解酶,还具有一定的产香产酯能力[25]。横梗霉也可以产生糖化酶和酸性蛋白酶[26]。因此,这些核心真菌可以将生物大分子降解为小分子,而核心细菌将这些小分子转化为各种风味物质。这些核心真菌和细菌,保证了白酒产品关键风味物质的稳定性。

图3 不同区域、不同时期汾酒生产用曲中细菌(a)和真菌(b)核心OTU数
Fig.3 Core OTU number of bacteria (a) and fungi (b) of Fenjiu Daqu in different regions and periods
进一步对伏曲、冬曲等不同区域、不同时期汾酒生产用曲的微生物多样性进行分析,结果见图4。
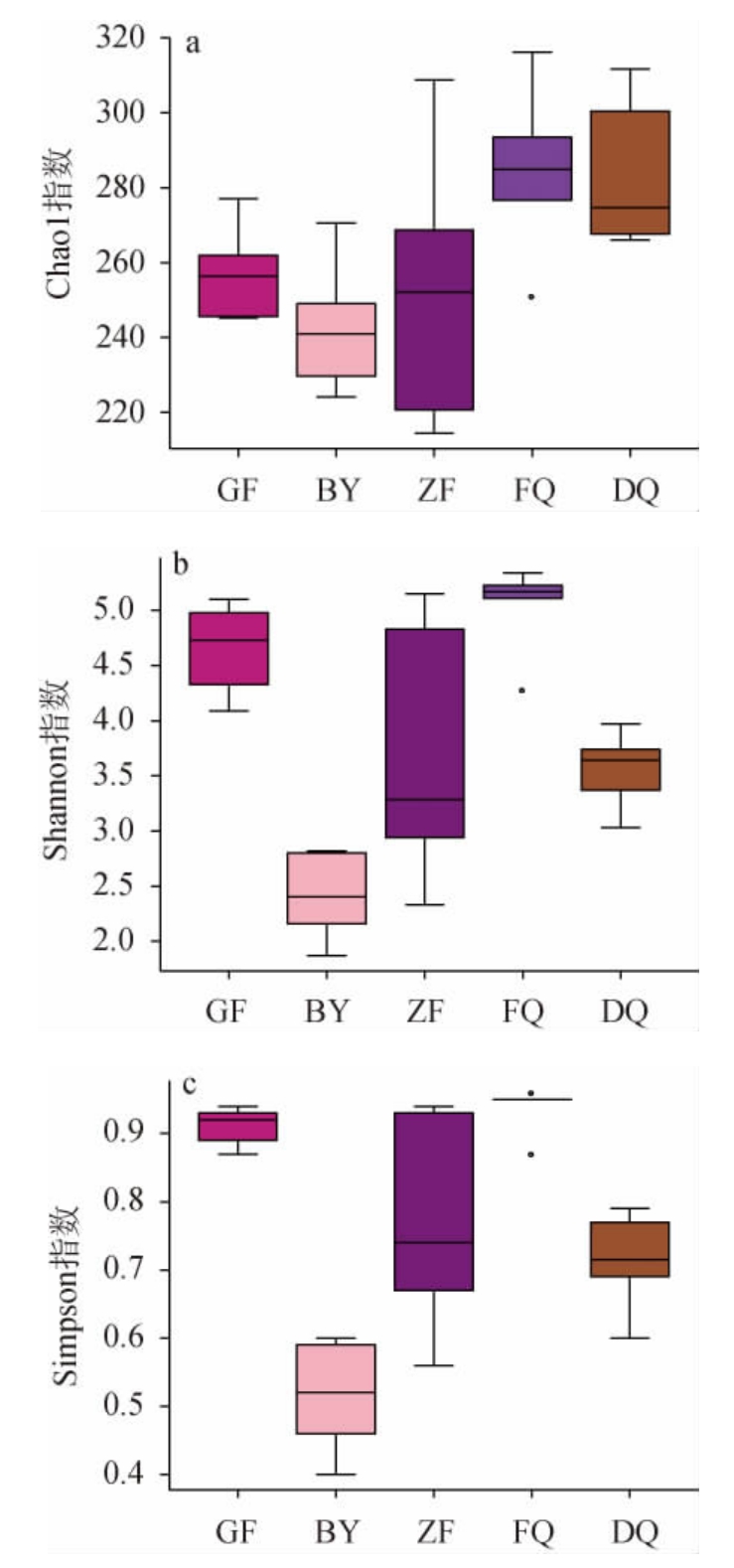
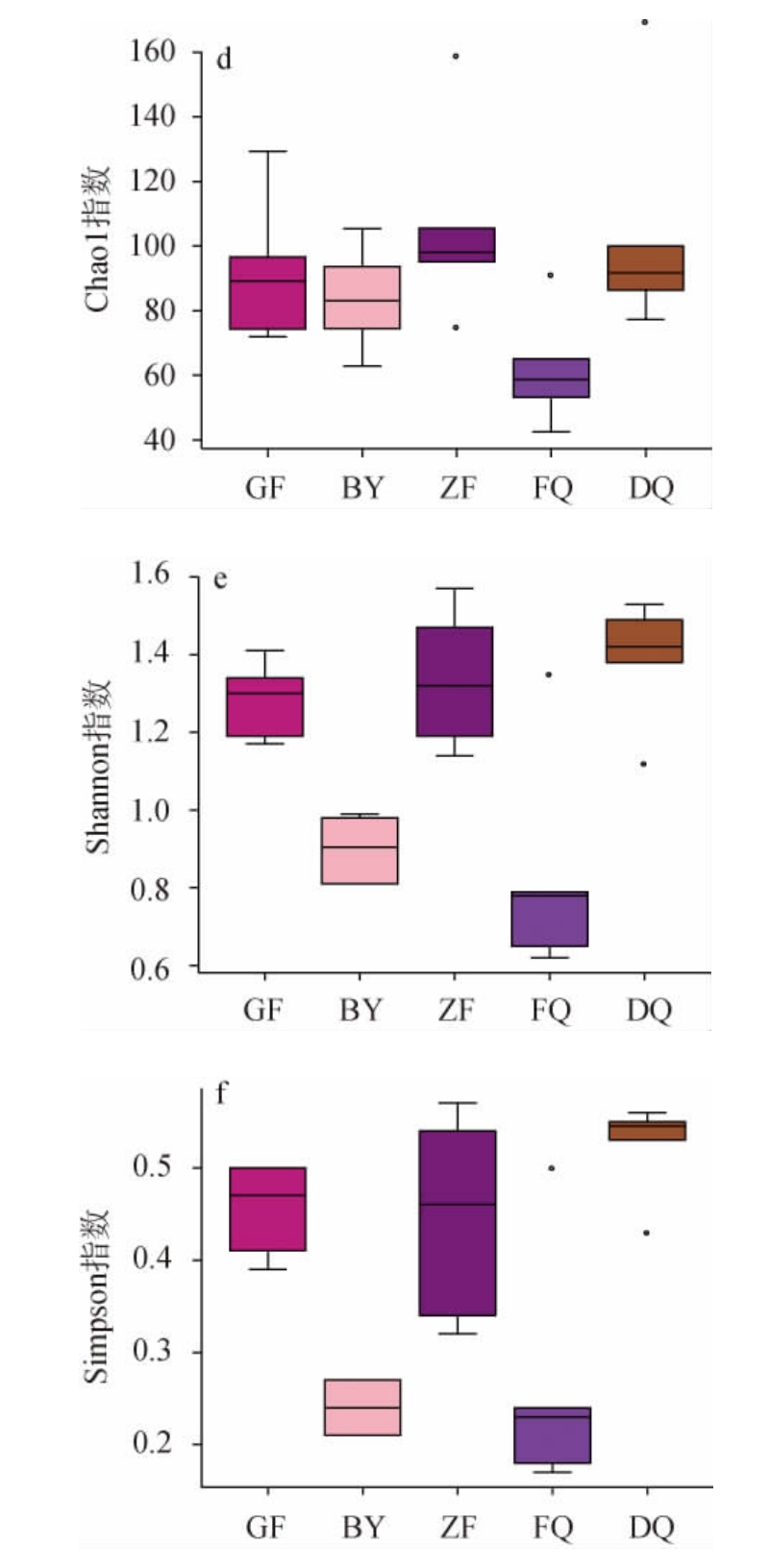
图4 不同区域、不同时期汾酒生产用曲中细菌(a、b、c)和真菌(d、e、f)菌群的α多样性指数
Fig.4 Alpha diversity indexes of bacteria (a,b,c) and fungi (d,e,f)community of Fenjiu Daqu in different regions and periods
由图4可知,细菌菌群的多样性高于真菌的多样性,这与张清玫等[3,27]的研究结果一致。Chao1指数表明,FQ的细菌菌群多样性和DQ相似,比GF、ZF和BY高;而FQ细菌菌群多样性的Shannon指数和Simpson指数均与GF相似,高于其他来源的大曲。FQ真菌菌群多样性的Chao1指数和Shannon指数比其他来源的大曲都低,而Simpson指数与BY相似,低于其他来源大曲。综上所述可知,与其他来源大曲相比,FQ的细菌菌群多样性较高,而真菌菌群多样性较低。
2.3 微生物群落的结构组成
2.3.1 细菌群落结构组成
不同区域、不同时期的汾酒生产用曲中细菌在门和属水平的组成结构见图5。
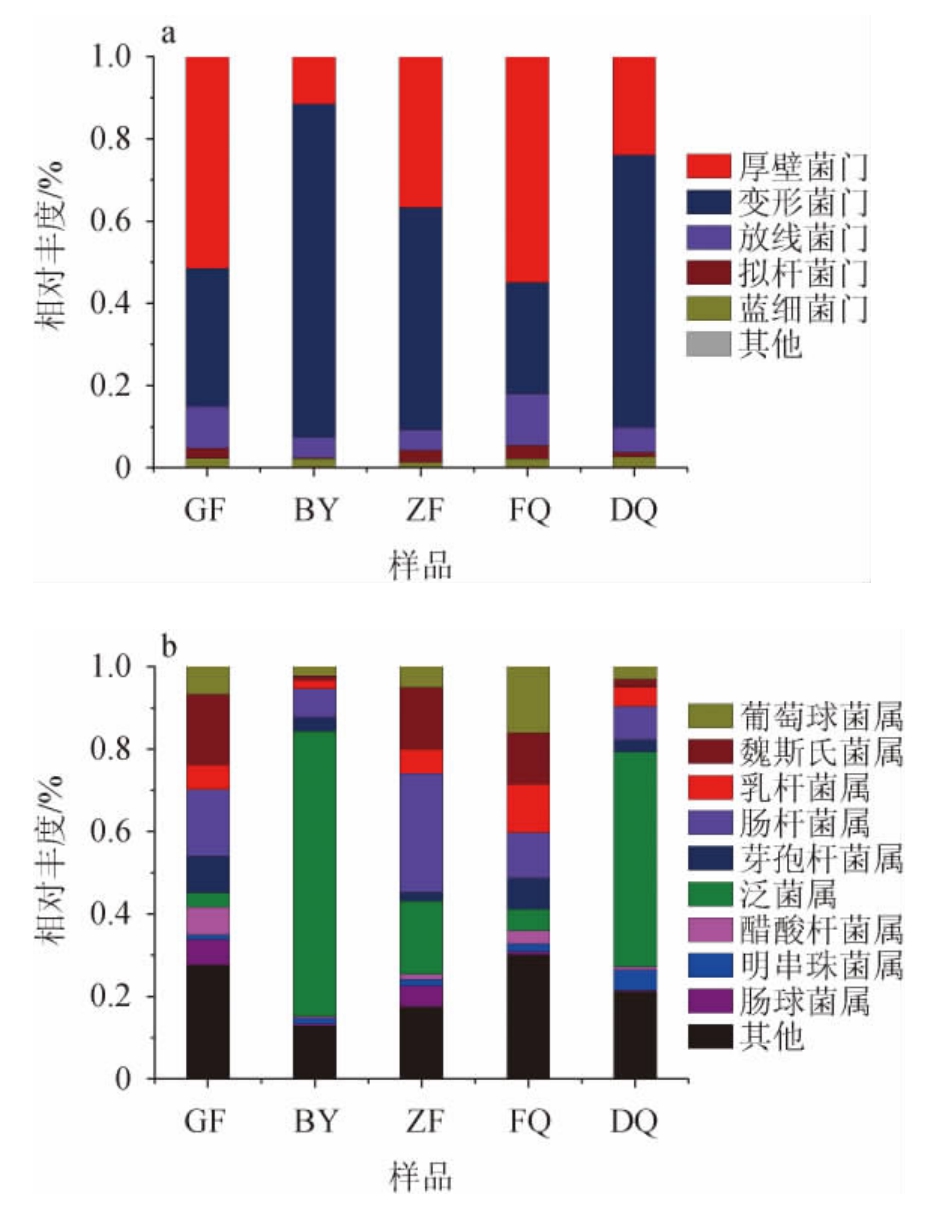
图5 基于门(a)和属(b)水平不同区域、不同时期汾酒生产用曲中细菌菌群结构
Fig.5 Bacteria community structure of Fenjiu Daqu in different regions and periods based on phylum (a) and genus (b)levels
由图5可知,在门水平上,不同区域、不同时期汾酒生产用曲中细菌群落结构已经有了明显差异。厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是大曲中的优势细菌,其相对丰度之和在80%以上。其中变形菌门在BY、ZF和DQ中占绝对优势(81.0%、54.1%、66.1%),而FQ和GF中的优势细菌门为厚壁菌门(55.0%、51.5%)。另外,在FQ和GF中,放线菌门(Actinobacteria)相对丰度均达到了10%以上。
在属水平上,BY和DQ中泛菌属(Pantoea)占据绝对优势,分别占69.2%和52.1%。BY中肠杆菌属(Enterobacter)占7.0%,其他属的相对丰度均<5%。DQ中肠杆菌属和明串珠菌属分别占8.1%和5.0%,其他属的细菌相对丰度均<5%。GF、ZF、FQ中细菌群落组成复杂。ZF中相对丰度>5%的细菌有肠杆菌属(28.8%)、泛菌属(17.8%)、魏斯氏菌属(15.0%)、乳杆菌属(5.8%)、肠球菌属(Enterococcus,5.1%)和葡萄球菌属(Staphylococcus,5.1%);GF大曲中相对丰度>5%的细菌有魏斯氏菌属(17.3%)、肠杆菌属(16.1%)、芽孢杆菌属(8.9%)、醋酸杆菌属(Acetobacter,6.7%)、葡萄球菌属(6.7%)、肠球菌属(6.1%)和乳杆菌属(5.9%);而FQ中相对丰度最高的细菌是葡萄球菌属(16.1%)、魏斯氏菌属(12.3%)、乳杆菌属(11.8%)、肠杆菌属(11.0%)、芽孢杆菌属(7.6%)和泛菌属(5.2%)。这些优势细菌在所有的大曲中都存在,属于核心细菌OTU,但比例差异较大,如泛菌属在BY大曲中是绝对优势细菌,但是在FQ(5.2%)和GF(3.5%)中相对丰度较小;而乳杆菌在FQ中含量最高。乳杆菌不仅与各种风味物质的合成有关,而且还具有较强的环境耐受性[28-29],因此在酒醅发酵后期成为优势细菌。在酒醅发酵过程中,FQ中较高丰度的乳杆菌可以更快地建立起优势地位,保证白酒中风味物质的产量和质量。
2.3.2 真菌群落结构组成
不同区域、不同时期的汾酒生产用曲中真菌在门和属水平的组成结构见图6。
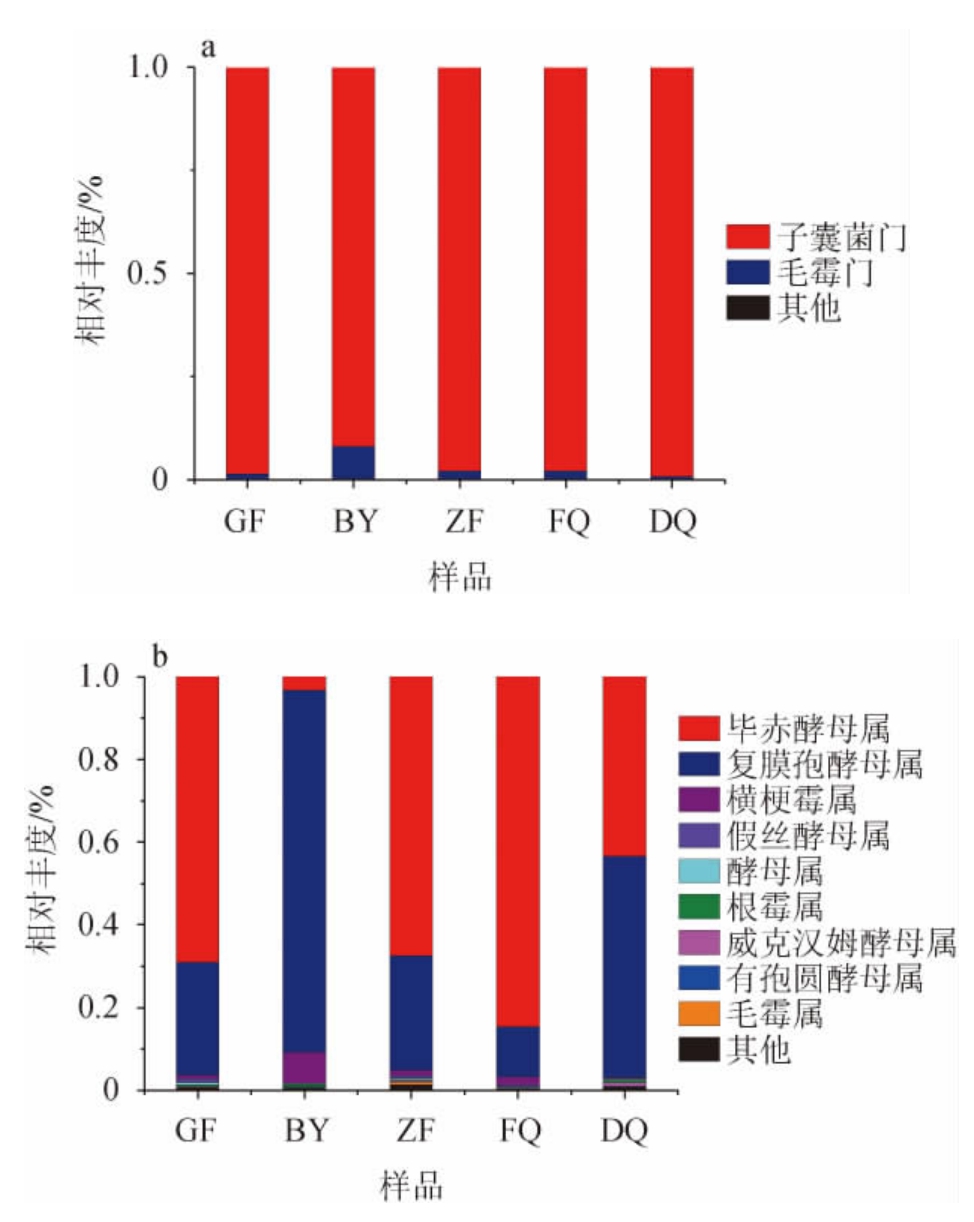
图6 不同区域、不同时期汾酒生产用曲中真菌在门(a)和属(b)水平的组成结构
Fig.6 Fungal community structure at phylum (a) and genus (b) level in Fenjiu Daqu samples from different regions and periods
由图6可知,在门、纲、目水平上,不同区域、不同时期汾酒生产用曲中真菌群落结构没有明显差异,子囊菌门(Ascomycota)占据绝对优势(91.9%~99.2%)。而在属水平上,不同来源的大曲真菌群落组成差异明显。BY中覆膜孢酵母属相对丰度最高,为87.6%;在DQ中,覆膜孢酵母属、毕赤酵母属比例相似,分别为53.6%和43.4%;而在FQ、GF和ZF中,毕赤酵母属成为了绝对优势菌,其相对丰度分别达到了84.6%、69.0%和67.3%。高丰度的毕赤酵母不仅可以产生更多的香味物质[30],还可以有效利用丙酮酸,从而提高发酵效率[31],并且有助于微生物群落的演替[32]。FQ中毕赤酵母是绝对优势真菌,有助于酒醅发酵过程的进行。
2.4 微生物群落的β多样性分析
利用主成分分析法对大曲样品微生物群落结构进行分析,结果见图7。由图7可知,在细菌群落结构方面,主成分1和主成分2在方差贡献率上分别达到47.50%和16.03%,累计方差贡献率为63.53%。GF、ZF和FQ的细菌群落相似性较高,与BY、DQ的差异较大。在真菌群落结构方面,主成分1和主成分2在方差贡献率上分别达到88.08%和7.49%,累计方差贡献率为95.57%。BY与其他大曲的距离较远,说明其差异较大。GF、ZF、FQ、DQ真菌菌落的差异主要是由主成分2导致的;其中,GF和ZF真菌群落结构相似度较高,与FQ、DQ差异性较大。
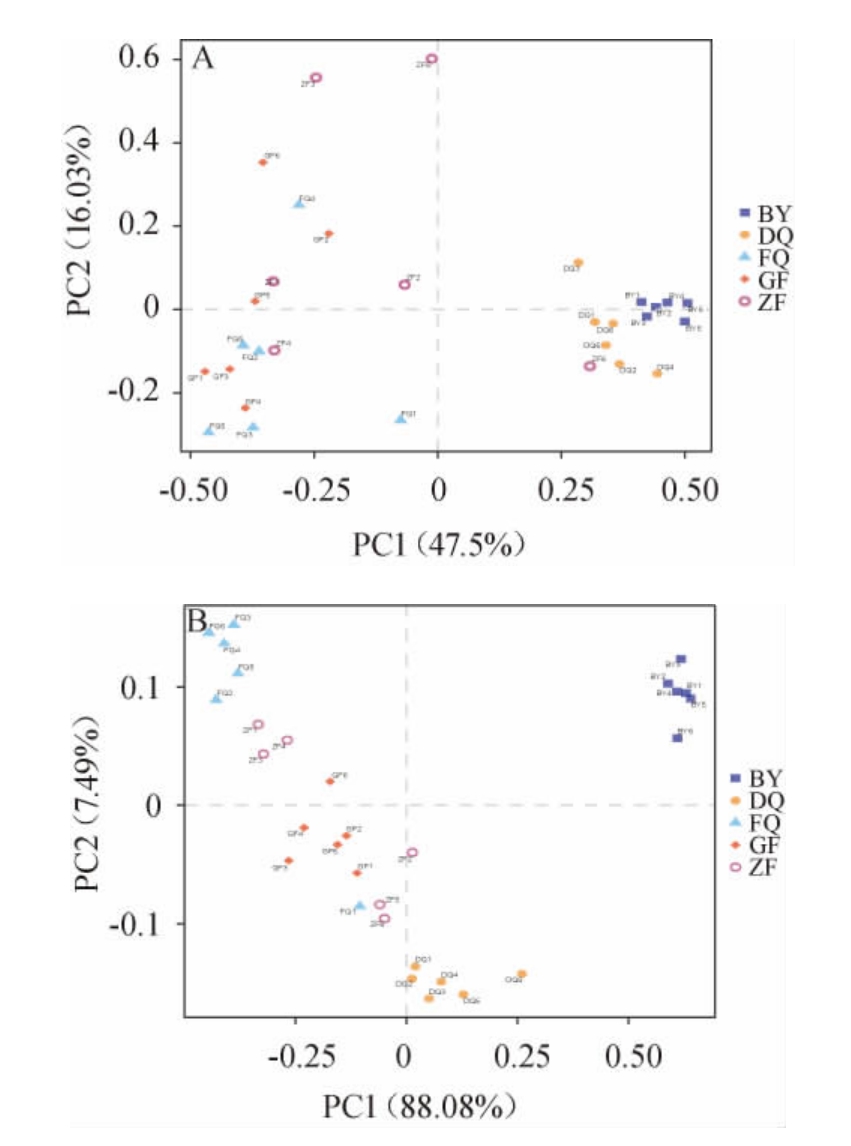
图7 不同区域、不同时期汾酒生产用曲细菌(a)和真菌(b)的PCA结果
Fig.7 PCA results of bacterial (a) and fungal (b) diversity Fenjiu Daqu samples from different regions and periods
3 结论
本研究通过高通量测序分析了伏曲、冬曲等不同时期、不同区域汾酒生产用曲中细菌和真菌的群落结构,结果发现,这些大曲中的优势微生物种类相似,但是其丰度有显著差异。尤其是伏曲,特点明显,拥有较高丰度的乳杆菌属和毕赤酵母属。在白酒发酵中,这两种微生物可以迅速建立优势地位,发挥其应有的功能,从而保证风味物质的产量。
[1]汪凌旭,易卓林,赵海,等.浓香型大曲菌系、酶系的研究进展[J].四川轻化工大学学报(自然科学版),2021,34(5):17-25.
[2]周晨曦,郑福平,李贺贺,等.白酒大曲风味物质研究进展[J].中国酿造,2019,38(5):6-12.
[3]张清玫,赵鑫锐,李江华,等.不同香型白酒大曲微生物群落及其与风味的相关性[J].食品与发酵工业,2022,48(10):1-8.
[4]BAN S B,CHEN L N,FU S X,et al.Modelling and predicting population of core fungi through processing parameters in spontaneous starter(Daqu)fermentation[J].Int J Food Microbiol,2022,363:109493.
[5]MA S Y,LUO H B,ZHAO D,et al.Environmental factors and interactions among microorganisms drive microbial community succession during fermentation of Nongxiangxing Daqu[J].Bioresource Technol,2022,345:126549.
[6]邢钢,敖宗华,王松涛,等.不同温度大曲制曲过程理化指标变化分析研究[J].酿酒科技,2014(6):20-23.
[7]ZENG Y,WANG Y,CHEN Q,et al.Dynamics of microbial community structure and enzyme activities during the solid-state fermentation of Forgood Daqu:a starter of Chinese strong flavour Baijiu[J].Arch Microbiol,2022,204(9):577.
[8]MA S Y,SHANG Z C,CHEN J,et al.Differences in structure,volatile metabolites,and functions of microbial communities in Nongxiangxing daqu from different production areas[J].LWT-Food Sci Technol,2022,166:113784.
[9]冯佳婷,陆震鸣,时伟,等.不同培养温度对大曲微生物群落结构、酶活及挥发性化合物的影响[J].应用与环境生物学报,2021,27(3):760-767.
[10]栾春光,郝建国,江伟,等.不同工艺清香型大曲理化指标差异与微生物菌群结构的相关性研究[J].酿酒,2021,48(2):43-48.
[11]CAI W C,WANG Y R,NI H,et al.Diversity of microbiota,microbial functions,and flavor in different types of low-temperature Daqu[J].Food Res Int,2021,150:110734.
[12]吴秋霞,黄钧,吴重德,等.季节和制曲位置变化对大曲生产影响的研究[J].中国调味品,2017,42(4):42-46.
[13]FU G M,DENG M F,CHEN Y,et al.Analysis of microbial community,physiochemical indices,and volatile compounds of Chinese te-flavor Baijiu daqu produced in different seasons[J].J Sci Food Agr,2021,101(15):6525-6532.
[14]马茹菲,马玉帛,佟世生,等.不同清香型大曲理化生化指标和挥发性成分分析[J].酿酒科技,2019(3):70-75.
[15]徐秋硕,陈亚祥,石凤,等.不同大曲对清香基酒产质量影响的研究[J].酿酒,2021,48(1):116-119.
[16]唐慧芳,黄钧,周荣清,等.场地异质性对中高温大曲微生物群落及品质影响的研究[J].食品与发酵工业,2023,49(8):237-244.
[17]吴树坤,谢军,卫春会,等.四川不同地区浓香型大曲微生物群落结构比较[J].食品科学,2019,40(14):144-152.
[18]WANG X S,DU H,ZHANG Y,et al.Environmental microbiota drivesmicrobial succession and metabolic profiles during Chinese liquor fermentation[J].Appl Environ Microbiol,2018,84(4):e02369-17.
[19]WANG Y Q,WU J T,LV M X,et al.Metabolism characteristics of lactic acid bacteria and the expanding applications in food industry[J].Front Bioeng Biotechnol,2021,9:612285.
[20]TONG W H,HE P,YANG Y,et al.Occurrence,diversity,and character of Bacillaceae in the solid fermentation process of strong aromatic liquors[J].Front Microbiol,2022,12:811788.
[21]WANG S Q,TIAN X Q,TIAN L,et al.Degradation of ethyl carbamate in strong-flavor Baijiu by the microbial combination culture[J].Food control,2023,145:109447.
[22]TANG Q X,CHEN X R,HUANG J,et al.Mechanism of enhancing pyrazines in Daqu via inoculating Bacillus licheniformis with strains specificity[J].Foods,2023,12(2):304.
[23]FAN G S,CHENG L J,FU Z L,et al.Screening of yeasts isolated from Baijiu environments for 2-phenylethanol production and optimization of production conditions[J].3 Biotech,2020,10(6):275.
[24]韩英,李惠源,贾丽艳,等.库德毕赤酵母FJZ固态发酵产乙酸乙酯工艺的优化[J].酿酒科技,2021(9):131-135.
[25]苏畅,马莹莹,杨建刚.扣囊复膜酵母在酿酒中的应用研究进展[J].食品研究与开发,2018,39(1):205-209.
[26]朱丽萍,杨强,江威,等.清香型小曲白酒霉菌菌群解析与酶活特性研究[J].食品与发酵工业,2022,48(7):70-77.
[27]张双燕,廖永红,纪南,等.基于高通量测序技术分析北京清香型大曲微生物多样性[J].中国酿造,2016,35(11):49-53.
[28]赵皓静,冯婧煕,王晓丹,等.一株耐酸乳杆菌Lactobacillus acetotolerans FBKL1.0204的筛选鉴定及耐酸、产酸特性[J].食品与发酵工业,2022,48(19):50-57.
[29]WANG J L,LU C S,XU Q,et al.Bacterial diversity and lactic acid bacteria with high alcohol tolerance in the fermented grains of soy sauce aroma type Baijiu in north China[J].Foods,2022,11(12):1794.
[30]WANG X S,WANG B W,SUN Z G,et al.Effects of modernized fermentation on the microbial community succession and ethyl lactate metabolism in Chinese Baijiu fermentation[J].Food Res Int,2022,159:111566.
[31]ZHANG H X,TAN Y W,WEI J L,et al.Fungal interactions strengthen the diversity-functioning relationship of solid-state fermentation systems[J].mSystems,2022,7(4):e40122.
[32]ZHANG H X,WANG L,TAN Y W,et al.Effect of Pichia on shaping the fermentation microbial community of sauce-flavor Baijiu[J].Int J Food Microbiol,2021,336:108898.