山西老陈醋的发酵过程,是一个多菌混合发酵的过程[1]。在不同的发酵阶段,细菌的数量和种类都处于动态的变化之中,它们之间的相互作用与发酵环境组成一个和谐的整体,对食醋最终的感官性质、营养成分和品质有着至关重要的影响[2-5]。但是,不同的山西老陈醋工厂由于地理位置、制造工艺、原料成分比、发酵温度、发酵气候、水质等环境存在差异,造成了其酿造过程中的微生物组成和风味特异性[6-7]。对山西老陈醋酿造微生物本质的认识主要从可培养微生物到未培养微生物,从微生物学到微生物组学,从群体微生物到山西老陈醋微生态[8-9]。赵馨仪等[10]采用传统分离手段,自山西老陈醋醋醅中分离得到7株产酸菌,并通过筛选获得3株具有高产酸、高醇、酸耐受性的优良菌株。王梦颖等[11]采用高通量测序技术对山西老陈醋酒醅、醋醅样品的细菌菌群结构进行分析,发现二者的主要细菌门为厚壁菌门(Firmicutes)。刘丹彤[12]通过宏基因测序手段对山西老陈醋火醅中的微生物进行检测,结果共注释到48个细菌门和688个细菌属,厚壁菌门和变形菌门(Proteobacteria)是主要的细菌门,主要细菌属是乳杆菌属(Lactobacillus)、醋杆菌属(Acetobacter)和不动杆菌属(Acinetobacter)。
目前,大多数学者仅针对单一醋厂的酿造过程进行研究,缺乏对不同地域、不同生态导致的醋厂间菌群多样性差异的比较。我国的食醋酿造具有鲜明的区域性生态特征,其本质是以不同的自然生态和环境微生态促进微生物多样性,形成微生物生态的结构和功能独特性,导致不同地区食醋风味品质差异。因此,本研究从山西省的6个地区采集了山西老陈醋酒醪、醋醅样品,通过Illumina HiSeq测序技术对山西老陈醋酒精发酵阶段及醋酸发酵阶段样品的菌群多样性进行测定比较,探究山西老陈醋酿造过程中细菌群落多样性,以期揭示不同生态下山西老陈醋酿造的菌群结构差异,为山西老陈醋酿造工艺科学改进提供借鉴。
1 材料与方法
1.1 材料与试剂
样品采集:分别采取山西老陈醋不同地区醋厂(分别编号为A、B、C、D、E、F)的酒精发酵初期、中期、末期的酒醪样品和醋酸发酵初期、中期、末期的醋醅样品置于-80 ℃保存。
QIA quick聚合酶链式反应(polymerase chain reaction,PCR)Purification Kit:德国Qiagen公司;Tris-平衡酚(分析纯):北京索莱宝科技有限公司;乙二胺四乙酸钠(分析纯):天津市恒兴试剂有限公司。其他试剂均为国产分析纯。
1.2 仪器与设备
170-4406型水平电泳系统、Universial Hood Ⅱ型凝胶成像系统、T100型PCR仪:美国Bio-Rad公司;anoDrop2000型微量紫外可见光分光光度计:美国Thermo Scientific公司。
1.3 方法
1.3.1 Illumina MiSeq高通量测序
参考张天震等[13]提取大曲宏基因组的方法提取酒醪、醋醅样品的宏基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),以其为模板,采用特异性引物515F(5'-GTGCCAGCMGCCGCGGTAA-3')和806R(5'-GGACTACHVGGGTWTCTAA-3')对细菌16SrDNAV4区域基因序列进行PCR扩增,扩增产物送至北京百迈客生物科技有限公司进行MiSeq文库构建,通过Illumina MiSeq进行高通量测序[13]。
1.3.2 数据分析
使用FLASH v1.2.7软件,通过overlap关系对各样品的reads进行拼接,即可得到原始Tags数据(Raw Tags),使用Trimmomatic v0.33软件,对拼接得到的Raw Tags进行过滤,得到高质量的Tags数据(Clean Tags),再使用UCHIME v4.2软件,鉴定并去除嵌合体序列,得到最终有效数据(Effective Tags),最终用于划分操作分类单元(operational taxonomic unit,OTU)、计算香农(Shannon)和辛普森(Simpson)指数、超1(Chao1)和ACE指数,以评估样品α多样性。
2 结果与分析
2.1 山西老陈醋酿造过程中细菌菌群α多样性分析
6个醋厂山西老陈醋样品酒精及醋酸发酵阶段细菌菌群α多样性分析结果见表1。
表1 山西老陈醋酿造过程中细菌菌群α多样性分析结果
Table 1 Results of α diversity analysis of bacteria during the production process of Shanxi aged vinegar

注:“J”代表酒精发酵;“C”代表醋酸发酵;“i”为发酵初期;“m”为发酵中期;“e”为发酵末期。下同。
由表1可知,酒精发酵阶段,除F厂外,各醋厂样品细菌菌群丰度皆呈下降趋势,这主要是由于酒精发酵产生大量乙醇,酒醪酒精度升高,各厂细菌生长繁殖均受到不同程度的抑制[11]。各醋厂的细菌菌群多样性存在明显差异,酒精发酵初期,A醋厂和B醋厂的OTU数分别为108个和107个,高于其他醋厂;A醋厂的Chao1指数和ACE指数最高,分别为135.19、139.93;E醋厂的Shannon指数最高,Simpson指数最低,分别为3.05、0.08,说明A醋厂细菌菌群丰度最高,E醋厂细菌菌群多样性最高。酒精发酵中期,B、C和D醋厂的OTU数均为88个,高于其他醋厂;D醋厂的Chao1指数和ACE指数最高,分别为103.09、109.06;E醋厂的Shannon指数最高,Simpson指数最低,分别为2.31和0.14,说明D醋厂细菌菌群丰度最高,E醋厂细菌菌群多样性最高。酒精发酵末期,C和D醋厂的OTU数、Chao1指数和ACE指数均高于其他醋厂;C醋厂的Shannon指数最高,为2.48,说明C和D醋厂的细菌菌群的丰度较高,C醋厂的细菌菌群多样性较高。
由表1亦可知,醋酸发酵阶段,各醋厂细菌菌群多样性整体呈现下降的趋势,主要是由于醋酸菌和乳酸菌等发酵产酸,酸性环境和营养物质的消耗影响了细菌的生长[14]。醋酸发酵初期,各醋厂OTU数差距较大,A醋厂明显高于其他醋厂,为195个,E醋厂最低,为53个;A醋厂的Chao1指数、ACE指数、Shannon指数最高,Simpson指数最低,分别为202.04、204.85、2.62和0.14,说明A醋厂的细菌菌群丰富度及多样性最高。醋酸发酵中期,C醋厂的OTU数为136个,明显高于其他醋厂;A醋厂的Chao1指数和ACE指数最高,分别为193.11、225.64;C醋厂的Shannon指数最高,Simpson指数最低,分别为1.92、0.28,说明A醋厂的细菌菌群丰富度最高,C醋厂的细菌菌群多样性最高。醋酸发酵末期,C醋厂的OTU数为122个,明显高于其他醋厂;A、C和D醋厂的Chao1指数和ACE指数明显高于其他醋厂;C醋厂的Shannon指数最高,Simpson指数最低,分别为1.46、0.36,说明A、C和D醋厂细菌菌群的丰富度较高,C醋厂的细菌菌群多样性最高。综上,各醋厂山西老陈醋酿造过程中细菌菌群多样及丰度存在一定差异,分析原因可能是各厂地理位置、生态环境、发酵工艺、原料等存在差异所致[15]。
2.2 山西老陈醋酿造过程中细菌菌群结构
2.2.1 山西老陈醋酒精发酵过程中细菌菌群结构
6个醋厂山西老陈醋酒精发酵阶段细菌菌群的动态变化见图1。由图1可知,通过高通量测序技术在6个醋厂的山西老陈醋酒精发酵阶段主要注释到9个细菌门和26个细菌属,其中,优势细菌门(平均相对丰度>1%)为厚壁菌门(Firmicutes)(72.56%)、变形杆菌门(Proteobacteria)(24.5%)、蓝细菌门(Cyanobacteria)(1.69%)、放线菌门(Actinobacteria)(1.14%)。优势细菌属(平均相对丰度>1%)为乳杆菌属(Lactobacillus)(42.81%)、片球菌属(Pediococcus)(5.90%)、泛菌属(Pantoea)(2.93%)、链球菌属(Streptococcus)(2.28%)、克雷伯氏菌属(Klebsiella)(1.95%)、魏斯氏菌属(Weissella)(1.89%)、明串珠菌属(Leuconostoc)(1.71%)、芽孢杆菌属(Bacillus)(1.36%)。在细菌属水平上,酒精发酵初期、中期,不同醋厂样品细菌菌群结构差异较大;酒精发酵末期,A醋厂和F醋厂的细菌菌群结构较为相似,B醋厂、C醋厂、D醋厂的细菌菌群结构较为相似,这是由于各醋厂的发酵环境、物料配比、大曲品质、液化方式等不同,导致初期差异性大,随着发酵进行,各厂酒醪环境变得相似,中期之后趋于稳定。
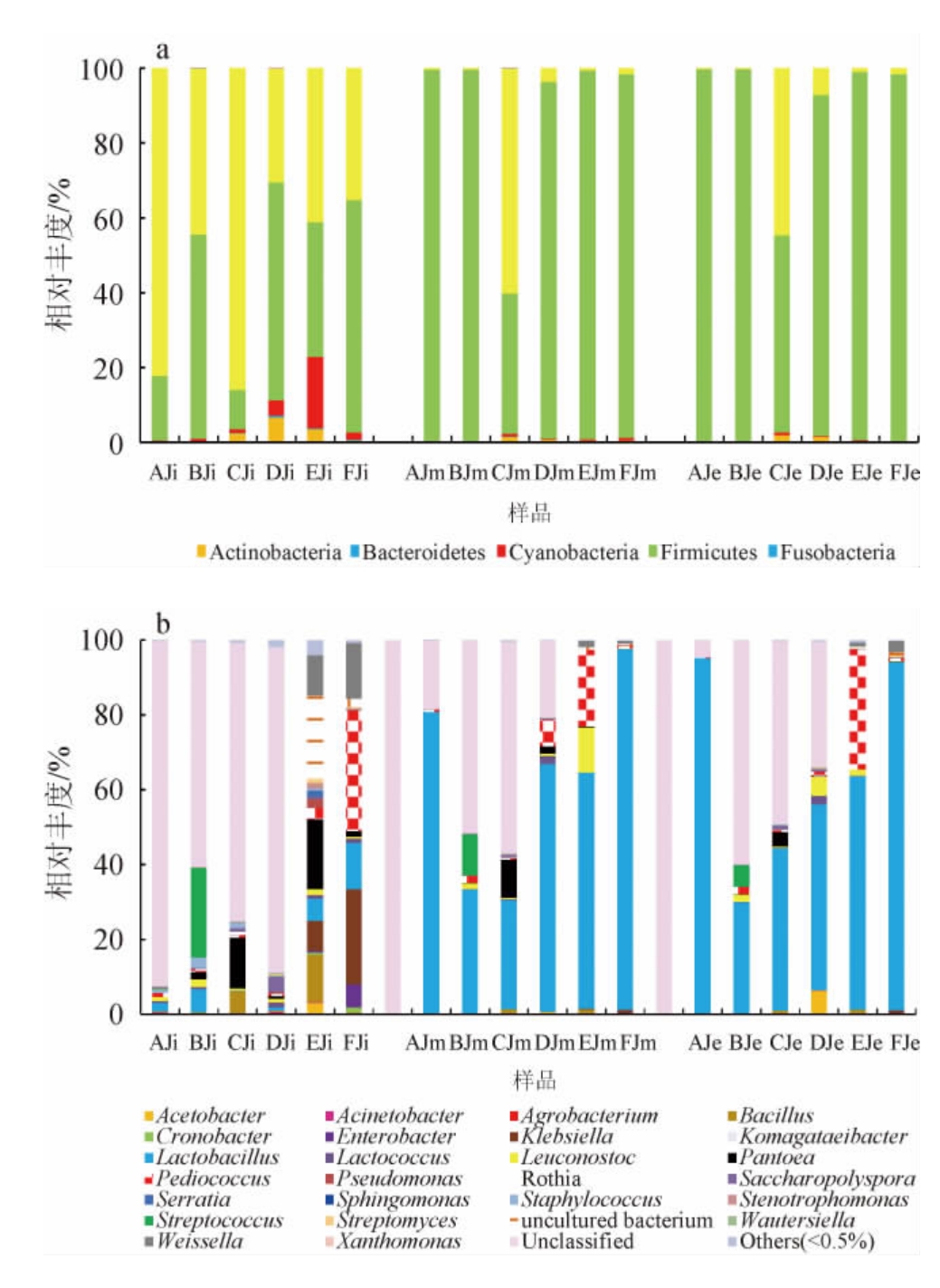
图1 基于门(a)和属(b)水平酒精发酵阶段细菌菌群结构
Fig.1 Bacterial community structure based on phylum (a) and genus (b) level in alcohol fermentation stage
Others:相对丰度<0.5%的细菌属。下同。
在山西老陈醋的酒精发酵阶段,乳酸菌代谢生成乳酸,是乳酸乙酯等香气物质的前体,有助于酒醪醇香的形成[16-17]。由图1可知,酒精发酵中期、后期主要优势细菌属均为乳酸菌菌群,主要包括乳杆菌属、片球菌属、链球菌属、明串珠菌属、魏斯氏菌属。乳杆菌属除了产酸,还会产生细菌素类物质[18],抑制杂菌的生长,保持酿造的生态环境稳定。在6个醋厂山西老陈醋的酒精发酵阶段,乳杆菌属的平均相对丰度(42.81%)最高。片球菌属通过代谢糖类物质,参与乙醇、乳酸等物质的生成[19],与乙偶姻等多种风味物质的生成有关[20],在酒精发酵初期,F醋厂的片球菌属相对丰度明显高于其他醋厂,为32.23%,其在中期下降至0.70%,在酒精发酵中、后期,E醋厂的片球菌属相对丰度明显升高,其平均相对丰度达到了26.29%。链球菌属主要发酵产生乳酸,是乳制品、酒精等发酵过程中的优势菌属[21]。A、B、C、D四个醋厂链球菌属的相对丰度在酒精发酵过程中均呈下降趋势,E、F醋厂未检测到链球菌属,B醋厂的链球菌属相对丰度在酒精发酵初期、中期及后期均高于其他醋厂,分别为23.99%、11.09%和5.73%。明串珠菌属在高糖环境生长旺盛,主要利用葡萄糖产生乳酸、乙醇和醋酸等物质[22],是食品中常见的发酵剂,酒精发酵初期,各醋厂明串珠菌属的平均相对丰度差异不大;酒精发酵中期,E醋厂的相对丰度最高,为12.01%。魏斯氏菌属能够发酵葡萄糖产生乳酸,在发酵过程中,还通过代谢生成葡聚糖、果聚糖等益生元类物质,具有一定的益生作用[23]。在酒精发酵阶段,魏斯氏菌属的相对丰度整体呈下降趋势,酒精发酵初期平均相对丰度最高,为4.47%。其中,E醋厂和F醋厂的魏斯氏菌属相对丰度分别为10.86%和14.98%,明显高于其他醋厂。张天震[24]对山西老陈醋酒醪样品中的微生物进行检测,发现在酒精发酵阶段细菌属水平上,检测到了12个细菌属,魏斯氏菌属和乳杆菌属是主要的细菌属。
泛菌属可以代谢产生抗生素类物质,对酒精阶段的发酵调控有重要意义,有研究发现,某些泛菌属编码次级代谢产物的基因簇中包含某些抗生素类物质的基因簇[25]。在酒精发酵过程中,各醋厂泛菌属的相对丰度整体呈下降趋势,发酵初期,C醋厂和E醋厂的泛菌属相对丰度最高,分别为13.50%和18.63%,在中期和末期,C醋厂的相对丰度分别为10.14%和3.95%,高于其他醋厂。这是由于酒精发酵阶段的泛菌属主要来自大曲中,随着发酵的进行,其相对丰度下降[26]。目前,已有研究证明,芽孢杆菌属是白酒各风味物质形成的重要菌属,芽孢杆菌属代谢产生的淀粉酶、蛋白酶、纤维素酶等对酒精发酵阶段的原料分解,具有促进作用[27];另外,芽孢杆菌属经过代谢产生2-丙基环己酮、2-戊基呋喃等多种挥发性抑菌物质,对多种病原菌有抑制作用[28-30],可以有效抑制酒醪原料中部分病原菌的生长。各醋厂芽孢杆菌属的相对丰度在酒精发酵阶段整体呈下降趋势,其在初期平均相对丰度最高,为3.32%,C醋厂和E醋厂样品中相对丰度分别为6.06%和12.62%,明显高于其他醋厂。聂士昊等[31]研究发现,在酒醅中加入芽孢杆菌,提高了酒醅的蛋白酶活力。
另外,还有一些风味协调菌,这些协调菌群通过协同作用,与优势菌群构成复杂的酿造环境。糖多孢菌属(Saccharopolyspora)可以产生酶、维生素、纤维素降解促进因子,广泛存在于酒曲和酒醪、酒醅中[32]。酒精发酵初期,D醋厂的糖多孢菌属相对丰度较高,为4.16%,其余各醋厂均较低,在发酵中期、末期酒醪营养物质消耗,各醋厂糖多孢菌属相对丰度均较低。葡萄球菌属(Staphylococcus)代谢产生脂肪酶,能促进发酵过程中原料中的脂肪分解利用[33],其在酒精发酵初期的平均相对丰度较高,为0.98%,其中B醋厂和C醋厂的葡萄球菌属相对丰度较高,分别为2.83%和1.43%,发酵中期和末期6个醋厂样品的葡萄球菌属相对丰度均较低。
2.2.2 山西老陈醋醋酸发酵阶段细菌菌群结构
醋酸发酵是食醋酸味、风味形成的重要阶段,是决定醋品质的关键,醋醅中的微生物复杂多样,它们通过代谢,为山西老陈醋带来了不同的风味、营养和功能[34]。6个醋厂山西老陈醋醋酸发酵阶段细菌菌群的动态变化见图2。

图2 基于门(a)和属(b)水平醋酸发酵阶段细菌菌群结构
Fig.2 Bacterial community structure based on phylum (a) and genus (b) level in acetic acid fermentation stage
由图2可知,在醋酸发酵阶段,主要注释到了9个细菌门和26个细菌属(相对丰度>0.5%),其中,优势细菌门(平均相对丰度>1%)为厚壁菌门(Firmicutes)(52.96%)、变形杆菌门(Proteobacteria)(39.56%)和蓝细菌门(Cyanobacteria)(7.21%),优势细菌属(平均相对丰度>1%)为乳杆菌属(Lactobacillus)(34.37%)、醋酸杆菌属(Acetobacter)(27.66%)、片球菌属(Pediococcus)(16.06%)。在细菌属水平上,醋酸发酵初期、中期,细菌菌群结构差异较大,醋酸发酵末期B醋厂、C醋厂和D醋厂的菌群结构较为相似,其优势菌细菌属均为片球菌属、醋酸杆菌属和乳杆菌属,且片球菌属的相对丰度较大;E醋厂、F醋厂和A醋厂的菌群结构较为相似,其优势细菌属均为乳杆菌属和醋杆菌属,E醋厂和F醋厂的乳杆菌属相对丰度较大,而A醋厂的醋酸杆菌属相对丰度较大。
在醋酸发酵阶段,乳酸菌不仅代谢产乳酸,还与苹果酸、琥珀酸、柠檬酸等其他有机酸的生成机制相关[35],对醋的风味和口感的提升具有促进作用。醋酸发酵阶段检测到的主要乳酸菌菌群包括乳杆菌属和片球菌属。由图2可知,6个醋厂的乳杆菌属平均相对丰度(34.37%)最高,其在醋酸发酵初期、中期和末期平均相对丰度分别为29.68%、42.15%和31.27%。在醋酸发酵初期和中期,A醋厂的乳杆菌属相对丰度为57.34%和78.22%,明显高于其他醋厂,到醋酸发酵末期,A醋厂的乳杆菌属相对丰度下降至11.05%,D醋厂和E醋厂的乳杆菌属相对丰度分别上升至72.13%和77.90%。片球菌属在醋酸发酵初期平均相对丰度较低,B醋厂和E醋厂相对丰度分别为2.77%和8.91%,高于其他醋厂,在醋酸发酵中期和末期,片球菌属成为B醋厂、C醋厂和D醋厂的优势菌属,其中,B醋厂相对丰度最高,分别为54.52%和87.22%。李雅茹等[36]自山西老陈醋酒醪、醋醅等发酵食品样品中共分离出了40株乳酸菌,对这些乳酸菌之间产乙偶姻、产酸、降胆固醇等特性进行研究,发现同种且同型别的乳酸菌的特性相似。苏迎会[37]研究发现,在固态发酵食醋生产过程中,醋醅中的乳酸菌数均呈先升后降的变化趋势,乳酸菌最高达到了3.2×107 CFU/g。
醋酸发酵阶段,醋酸杆菌属是重要的产酸细菌,其在还原糖充足的情况下,可以分解还原糖产酸,糖源缺乏的情况下,它可以通过分解醇类、醛类物质产酸,其产生的乙酸是山西老陈醋中的主体酸,在酸味调节中起着很重要的作用[38]。由图2可知,醋酸发酵初期,6个醋厂的醋酸杆菌属平均相对丰度较低,为16.94%,各醋厂差异较大,A醋厂、B醋厂和C醋厂醋酸杆菌属的相对丰度明显低于D醋厂、E醋厂和F醋厂。醋酸发酵中期,各醋厂醋酸杆菌属的相对丰度均有不同程度的增加,其平均相对丰度为35.57%,各醋厂差异较小。与发酵中期相比,醋酸发酵末期,除A醋厂外,各醋厂醋酸杆菌属的相对丰度均有不同程度的下降,分析原因可能是醋醅中营养物质的消耗和酸类物质的大量积累,导致醋醅环境不再适合醋酸杆菌属的生长繁殖。
泛菌属可以代谢D-乳糖、麦芽糖、蔗糖、海藻糖和木糖等多种糖类产酸,但其是免疫力低下患者的机会致病菌,可引起幼儿的多种疾病[39]。由图2可知,醋酸发酵初期泛菌属的平均相对丰度较高,为1.23%,C醋厂的泛菌属相对丰度为5.56%,明显高于其他醋厂,醋酸发酵中期和后期其相对丰度减小,这些泛菌属主要源自酒醪,与酒精发酵末期结果相对应。
醋酸发酵阶段,各醋厂的菌群结构、比例具有一定的差异,发酵初期各醋厂的细菌菌群多样性较高,发酵中期、末期优势菌群较为明显,这是因为发酵初期,各类辅料的添加,带入大量微生物,造成了菌群多样性,随着发酵进行,原料被微生物分解利用,优势菌群开始占据主导地位。
3 结论
本研究利用Illumina MiSeq高通量测序技术,对6个醋厂的山西老陈醋酒精和醋酸发酵阶段的细菌菌群多样性和菌群结构进行研究对比发现,不同醋厂山西老陈醋酒精和醋酸发酵阶段细菌菌群丰度及多样性存在一定的差异。酒精及醋酸发酵阶段均注释到9个细菌门和26个细菌属(相对丰度>0.5%),主要细菌属均为乳杆菌属(Lactobacillus),平均相对丰度分别为42.81%、34.37%。发酵初期和中期,不同醋厂酒醪及醋醅样品的细菌菌群结构差异较大,发酵末期,存在一定的相似性。酒精发酵末期,A厂和F厂的细菌菌群结构较为相似,B厂、C厂和D厂的菌群结构较为相似;醋酸发酵末期,B厂、C厂和D厂的菌群结构较为相似,A、E、F厂的菌群结构较为相似,但E厂和F厂的乳杆菌属相对丰度较大,A厂的醋酸杆菌属(Acetobacter)相对丰度较大。传统与科学技术的结合,对山西老陈醋的品质和特色发展是不断提升的过程,因此,当前需要通过继续发展微生态发酵技术,为山西老陈醋产业实现品质提升。
[1]刘聪.山西老陈醋醋醅中微生物多样性分析及高粱单宁对真菌生长的影响[D].太原:山西大学,2019.
[2]牟俊.山西老陈醋醋酸发酵阶段乳酸菌和醋酸菌相互作用研究[D].天津:天津科技大学,2018.
[3]刘爱平,吴洁,王玉婷,等.基于宏基因组测序的四川麸醋醋醅微生物组和风味形成相关基因分析[J].江苏农业学报,2022,38(3):806-812.
[4]张雅琳,刘廷锐,朱文优.基于Illumina MiSeq高通量测序技术解析四川麸醋发酵过程中微生物菌群结构[J].中国食品学报,2022,22(6):299-307.
[5]甘兴.传统岐山酿造食醋发酵过程中的微生物群落动态演变和风味物质的研究[D].广州:华南理工大学,2018.
[6]秦兴,卢红梅,陈莉.醋酸菌的分子分类学研究和在食醋生产中的应用[J].中国酿造,2017,36(6):1-8.
[7]王宗敏.镇江香醋醋酸发酵阶段菌群结构变化与风味物质组成之间的相关性研究[D].无锡:江南大学,2016.
[8]卢萌萌,任聪,聂尧,等.白酒酿造窖泥未培养微生物菌群的可培养化策略[J].食品与发酵工业,2020,46(19):9-16.
[9]杜如冰,任聪,吴群,等.生态发酵技术原理与应用[J].食品与发酵工业,2021,47(1):266-275.
[10]赵馨仪,范冰倩,郑宇,等.山西老陈醋醋醅中产酸菌的分离、鉴定及醇酸耐受分析[J].中国酿造,2021,40(1):128-132.
[11]王梦颖,赵国忠,赵建新,等.山西老陈醋发酵过程菌群微生态分析及乳酸菌分离[J].中国调味品,2016,41(6):29-38.
[12]刘丹彤.基于宏基因组测序揭示山西老陈醋菌群功能[D].晋中:山西农业大学,2021.
[13]张天震,孙晓琪,刘丹彤,等.山西老陈醋大曲细菌群落结构及多样性研究[J].中国食品学报,2021,21(5):323-330.
[14]李雅茹.山西老陈醋源优良酵母菌和乳酸菌的筛选、互作及应用研究[D].晋中:山西农业大学,2019.
[15]聂志强,韩玥,郑宇,等.宏基因组学技术分析传统食醋发酵过程微生物多样性[J].食品科学,2013,34(15):198-203.
[16]刘凯凤,杨丽,郑胜蓝,等.山西老陈醋中优势产酸菌的分离纯化及功能分析[J].食品工业科技,2020,41(6):124-130.
[17]郑树炀.陈醋酒精发酵菌群研究及工艺优化[D].晋中:山西农业大学,2018.
[18]李荣源,卢红梅,秦兴,等.高通量测序分析赤水晒醋各生产阶段微生物群落结构变化[J].食品科学,2020,41(24):79-85.
[19]LI J,WEI S,YING C M,et al.Major metabolites and microbial community of fermented black glutinous rice wine with different starters[J].Front Microbiol,2020,11:593.
[20]REN Q,SUN L,WU H.et al.The changes of microbial community and flavor compound in the fermentation process of Chinese rice wine using Fagopyrum tataricum grain as feedstock[J].Sci Rep,2019,9(1):1-12.
[21]曾椿淋,朱琳,高凤,等.不同天然奶酪发酵剂和非发酵剂微生物多样性的高通量测序研究[J].现代食品科技,2018,34(10):117-125.
[22]谷新晰,王晨笑,于宏伟,等.壳寡糖对泡菜品质、微生物多样及演替规律的影响[J].中国食品学报,2021,21(10):125-132.
[23]FANELLI F,MONTEMURRO M,CHIEFFI D,et al.Novel insights into the phylogeny and biotechnological potential of weissella species[J].Front in Microbiol,2022,13:914036.
[24]张天震.山西老陈醋微生物酿造机理及四大名醋指纹图谱差异性研究[D].晋中:山西农业大学,2019.
[25]USUDA Y,NISHIO Y,NONAKA G,et al.Microbial production potential of Pantoea ananatis: from amino acids to secondary metabolites[J].Microorganisms,2022,10(6):1133.
[26]陈旭峰,刘丹彤,王佳丽,等.山西老陈醋大曲真菌群落结构及多样性分析[J].中国食品学报,2021,21(10):206-214.
[27]吴文睿,刘飞翔,方颂平,等.皖北地区窖泥类芽孢杆菌发酵风味物质的研究[J].食品工业科技,2019,40(10):274-279.
[28]冯福山,刘君昂,胡廉成,等.枯草芽胞杆菌Y13挥发性物质的分析及抑菌活性[J].中国生物防治学报,2019,35(4):597-604.
[29]黄伟,张丽娟,王宁,等.芽孢杆菌属挥发性物质及其在植物病害防治中的应用研究进展[J].中国植保导刊,2021,41(9):30-36.
[30]王静,曹建敏,陈德鑫,等.短小芽孢杆菌AR03挥发性有机物的抑菌活性及其组分分析[J].中国农业科学,2018,51(10):1908-1919.
[31]聂士昊,张志伟,汪俊卿,等.芽孢杆菌加强菌对酱香型白酒酒醅微生物群落及蛋白酶活力的影响[J].中国酿造,2022,41(8):137-142.
[32]LIU J J,CHEN J Y,FAN Y,et al.Biochemical characterisation and dominance of different hydrolases in different types of Daqu-a Chinese industrial fermentation starter[J].Sci Food Agr,2018,98(1):113-121.
[33]蒋翠翠,尚昊,张素芳,等.产脂肪酶菌株的筛选、酶学特性及其接种对酸肉风味物质的影响[J].食品科学,2023,44(10):106-113.
[34]崔耀明.山西老陈醋醋糟混菌发酵菌种筛选及其发酵条件优化[D].北京:中国农业科学院,2015.
[35]许女,张天震,樊玮鑫,等.山西老陈醋酿造过程中香气成分的动态变化[J].中国食品学报,2018,18(11):198-210.
[36]李雅茹,闫裕峰,陈旭峰,等.传统发酵食品中乳酸菌的分离鉴定、基因分型及优良菌株筛选[J].中国酿造,2019,38(4):89-94.
[37]苏迎会.固态发酵食醋生产过程中主要微生物及风味生成的探讨[J].中国酿造,2015,34(3):137-140.
[38]吴艳芳.山西老陈醋发酵过程微生物相互作用及有机酸代谢调控机制解析[D].天津:天津科技大学,2021.
[39]冯锋.传统食醋大曲固态发酵过程中微生物多样性及其主要优势微生物产酶的研究[D].广州:华南理工大学,2016.