中国传统白酒作为世界三大蒸馏酒之一,以其独特的原料、工艺、香气和悠久的历史以及丰富的文化内涵而闻名[1]。中国传统白酒主要使用谷物为原料,其中高粱占主导地位,其次为大米、小麦、糯米、玉米、大麦、青稞等[2-3]。这些粮食原料主要成分是淀粉,由许多葡萄糖分子单体组成。白酒酿造中影响白酒风味和品质的最关键步骤就是糟醅发酵,在此过程中各种微生物通过代谢产生乙醇和多种风味物质[4-5]。但是参与白酒酿造的许多微生物本身不产淀粉酶,因而对以淀粉等大分子糖类物质的利用效率较低,故采用谷物酿酒时,需要在相关微生物合成的淀粉酶作用下,将谷物原料中的淀粉质分解为低聚、可发酵性糖,然后再转化为酒精和多种风味物质。
淀粉酶又称葡萄糖淀粉酶,其能够依次水解直链淀粉非还原性末端的α-1,4糖苷键,是一种外切型糖苷酶,能把直链淀粉水解成葡萄糖[6-9];也可以水解支链淀粉分支点处的α-1,6糖苷键,进而将支链淀粉水解成葡萄糖。理论上,淀粉酶能够将淀粉完全降解为葡萄糖[10-12]。淀粉酶被广泛应用于食品、医药等领域,可用于生产酒精、味精、有机酸及氨基酸等[13-16]。目前,淀粉酶的生产来源单一,应用于生产的菌株多为丝状真菌,且商用的真菌葡萄糖淀粉酶的应用具有一定的局限性,如中等的热稳定性,无法适应复杂多变的工业生产环境等[17-18]。因此,可以通过广泛地筛选得到具有高产淀粉酶能力的微生物、优化产酶条件,或者以菌株诱变等方式提升已有菌株的产淀粉酶能力,增强酶的热稳定性,提高酶活力,应用于工业生产,以扩大淀粉酶的生产来源[19]。
在白酒酿造过程中,作为原料的粮食除了淀粉层外还含有以纤维素和半纤维素等为主要成分的外壳[20]。为了保持酒醅的水分和含氧量,还需要额外添加适量的稻壳等辅料,以起到疏松酒醅、扩大发酵界面的作用[21]。稻壳中包含了大量纤维素、半纤维素,其中半纤维素含量约占20%,纤维素含量约占36%[22]。若有微生物能够代谢产酶,将纤维素、半纤维素等分解为可发酵性糖,供参与酿造的多种微生物利用并将其转化为酒精、香味物质等代谢产物,将会极大地提高原料的利用效率,减少酒糟处理成本,同时提升白酒品质。
白酒窖泥中微生物种类众多,各类微生物共同作用是白酒生香的关键。本研究通过透明圈法、淀粉酶活力测定、分子生物学鉴定及粗酶液的温度耐受性分析,从浓香型白酒窖泥中分离筛选优良的高产淀粉酶菌株,并对其进行常压室温等离子体(atmospheric room temperature plasma,ARTP)诱变选育,最后研究其对纤维素及半纤维素的分解能力。以期提高白酒生产过程中的原料利用率,并为酒糟处理问题提供新的解决方法。
1 材料与方法
1.1 材料与试剂
1.1.1 材料
窖泥:某大型白酒酒厂。
1.1.2 试剂
可溶性淀粉、玉米淀粉、纤维素、半纤维素、木糖、阿拉伯糖、葡萄糖、硝酸钠、磷酸二氢钾、七水硫酸镁、氯化钾、硫酸亚铁、硫酸钾、二水合氯化钙、牛肉膏、蛋白胨(均为分析纯或生化试剂):北京索莱宝科技有限公司;Taq酶、10×Easy-Taq缓冲液、脱氧核糖核苷三磷酸(deoxy-ribonucleoside triphosphate,dNTPs)、引物、脱氧核糖核酸(deoxyribonucleic acid,DNA)Marker:北京擎科生物科技有限公司。其他试剂均为国产分析纯。
1.1.3 培养基
分离培养基[23]:可溶性淀粉3%,硝酸钠0.2%,磷酸二氢钾0.1%,七水硫酸镁0.05%,硫酸亚铁0.001%,琼脂粉2%。
发酵培养基[23]:可溶性淀粉3%,硝酸钠0.1%,氯化钠0.05%,磷酸二氢钾0.1%,七水硫酸镁0.05%,硫酸亚铁0.001%。
透明圈检测培养基[24]:可溶性淀粉3%,蛋白胨1%,氯化钠0.5%,牛肉膏0.3%,琼脂粉2%。
单一碳源培养基:木糖/阿拉伯糖/葡萄糖3%,硝酸钠0.2%,氯化钾0.05%,磷酸二氢钾0.1%,七水硫酸镁0.05%,硫酸亚铁0.001%。
羧甲基纤维素钠(carboxyl methyl cellulose-Na,CMC-Na)选择培养基[25]:硝酸钾0.1%,磷酸二氢钾0.2%,七水硫酸镁0.015%,CMC-Na 1%。
CMC富集培养基[23]:酵母粉0.5%,胰蛋白胨1%,CMC-Na 0.2%,NaCl 1%,琼脂1.5%。
半纤维素选择培养基[26]:硫酸铵0.05%,磷酸二氢钾0.2%,七水硫酸镁0.05%,二水合氯化钙0.02%,硫酸钾0.01%,氯化钠0.02%,半纤维素1.5%,琼脂粉2%。
以上培养基均在115 ℃条件下高压蒸汽灭菌20 min。
1.2 仪器与设备
THZ-98A恒温振荡培养箱:上海一恒科技有限公司;INESA-721N可见分光光度计、GI54IW高压灭菌器、DW-86L626超低温保存箱:上海力辰邦西仪器科技有限公司;T100基因扩增仪:伯乐生命医学产品有限公司;PS300电泳仪:上海天能科技有限公司;Gel Doc Go凝胶成像系统:伯乐Bio-Rad公司;常压室温等离子体(atmospheric and room temperature plasma,ARTP)诱变仪:昆山超声仪器有限公司;AR223CN电子天平:奥豪斯仪器有限公司。
1.3 方法
1.3.1 产淀粉酶菌株的分离及筛选
分离及初筛:称取10 g窖泥于250 mL的锥形瓶中,加入90 mL无菌蒸馏水,30 ℃、180 r/min条件下振荡培养1 h,取上清液按10倍系列梯度稀释至10-5。取不同稀释度的样液100 μL涂布于透明圈检测培养基,30 ℃倒置培养2~3 d。称取0.4 g碘颗粒磨成粉末,将粉末均匀散布在培养皿盖上,再将培养皿倒扣于其上,静置10 min,具有产淀粉酶能力的菌落周围出现透明圈,选择透明圈直径(D)/菌落直径(d)值较大的菌株,进一步分离纯化得到单菌落[27]。
复筛:挑取初筛得到的单菌落接种至5 mL发酵培养基,30 ℃、180 r/min条件下培养12 h,作为种子液。取种子液按1%(V/V)的接种量接种于100 mL发酵培养基,于30 ℃、180 r/min条件下振荡培养192 h。参照文献[28]的3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)法测定淀粉酶活力。
酶活力定义:1 mL粗酶液1 min分解淀粉产生1 μg的还原糖(以葡萄糖计算)为一个酶活力单位(U/mL)。
1.3.2 产淀粉酶菌株的分子生物学鉴定
以筛选菌株的单菌落为模板,选用细菌通用引物27F(5'-AGAGTTTGATCCTGGCTCAG-3')和1492R(5'-TACGACTTAACCCCAATCGC-3')对菌株的16S rRNA基因序列进行聚合酶链式反应(polymerase chain reaction,PCR)扩增。PCR扩增体系:10×Easy-Taq缓冲液5 μL,Easy-Taq 0.5 μL,dNTPs 5 μL,正、反向引物各2 μL,菌液12.5 μL,双蒸水(ddH2O)23 μL。PCR扩增条件:94 ℃预变性5 min;94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸90 s,共30个循环;72 ℃再延伸5 min。PCR扩增产物送至擎科生物技术服务有限公司完成测序。将测序结果提交至美国国立生物技术信息中心(national center for biotechnology information,NCBI)的GenBank数据库中,采用基本局部比对搜索工具(basic local alignment search tool,BLAST)进行同源性比对搜索,选取同源性较高的模式菌株的16S rRNA基因序列,通过Clustal X进行多重序列比对,利用MEGA X软件中的邻接(neighbor-joining,NJ)法构建系统发育树[29-30]。
1.3.3 温度对淀粉酶酶活的影响
设置温度梯度为30 ℃、40 ℃、50 ℃、60 ℃、70 ℃,将粗酶液在不同温度下处理10 min后,采用DNS法测定淀粉酶活力,考察淀粉酶的温度耐受性[31]。
1.3.4 生长曲线的测定
选择产淀粉酶能力较强且所产淀粉酶对高温处理耐受性较好的菌株接种于发酵培养基,30 ℃、180 r/min条件下培养至OD600nm值为0.6左右。按1%(V/V)的接种量接种于100 mL发酵培养基中,30 ℃、180 r/min条件下培养,每24 h取菌液于波长600 nm处测定OD600nm值。以培养时间(x)为横坐标,OD600nm值(y)为纵坐标绘制菌株生长曲线。
1.3.5 ARTP诱变
菌液预处理:取单菌落接种于发酵培养基,30 ℃、180 r/min条件下培养至OD600nm值为0.8左右。取1 mL菌液于4 ℃、6 000 r/min条件下离心5 min,弃上清液。加入1 mL无菌生理盐水涡旋10 s,离心去除上清液,重复该操作。最后加入1 mL无菌生理盐水涡旋10 s制成菌悬液。
ARTP诱变:取10 μL预处理后的菌液,涂抹在直径为6mm的无菌金属垫片上,设置仪器功率为120 W,距离2mm,工作气体为氦气(He),工作气流量为标准状态下10 L/min,诱变时间分别设置为0 s、30 s、45 s、60 s、90 s、120 s、150 s。诱变结束后将金属垫片放入1 mL 5%甘油生理盐水中,涡旋60 s,得到诱变后的菌液[32-33]。将诱变前后的菌液分别稀释涂布于分离培养基,30 ℃恒温培养2~3 d。采用稀释涂布平板法进行菌落计数,根据菌落数计算诱变致死率,其计算公式如下:
1.3.6 高产淀粉酶突变菌株的筛选
选取致死率为98%的诱变菌液,涂布于透明圈检测培养基,30 ℃倒置培养2~3 d,按1.3.1的方法测定透明圈直径,初步筛选出淀粉酶活力升高的阳性突变菌株。同时,挑取单菌落接种至5 mL发酵培养基,30 ℃、180 r/min条件下培养过夜,取菌液按1%(V/V)的接种量接种于100 mL发酵培养基,于30 ℃、180 r/min条件下振荡培养192 h。采用DNS法测定淀粉酶活力,筛选出高产淀粉酶活力的诱变菌株。
1.3.7 诱变菌株对纤维素及半纤维素的利用能力
诱变菌株对纤维素的分解情况:挑取单菌落接种于发酵培养基中,30 ℃、180 r/min摇瓶过夜培养后进行梯度稀释,选择合适的稀释梯度涂布于CMC选择培养基,30 ℃恒温培养2~3 d。采用刚果红染色法进行染色,用1 mol/L NaCl溶液脱色30 min,观察单菌落周围有无透明圈生成[34]。
诱变菌株对半纤维素的分解情况:挑取单菌落接种于发酵培养基中,30 ℃、180 r/min摇瓶过夜培养后进行梯度稀释,选择合适的稀释梯度涂布于半纤维素选择培养基,30 ℃恒温培养2~3 d,观察菌落周围是否有透明圈产生[35]。
1.3.8 数据处理
每组实验设置三个平行,采用Excel2003处理数据,结果用“平均值±标准差”表示;采用Origin 2022绘图。
2 结果与分析
2.1 产淀粉酶菌株的筛选
从透明圈检测培养基上筛选得到9株D/d值较大的菌株,编号为TS-1~TS-9,具体见表1。由表1可知,菌株TS-1~TS-9的D/d值为1.95~2.11,其中菌株TS-6的D/d值最大,为2.11。
表1 产淀粉酶菌株D/d值
Table 1 D/d value of amylase-producing strains
将初筛得到的9株产淀粉酶菌株进行摇瓶培养,测定其淀粉酶活力,结果见图1。由图1可知,9株初筛菌株的淀粉酶活力为34.40~70.39 U/mL,其中,菌株TS-6的淀粉酶活力最高,为70.39 U/mL,其次为菌株TS-3、TS-5、TS-7,淀粉酶活力分别为54.86 U/mL、55.23 U/mL、55.60 U/mL,菌株TS-4的淀粉酶活力最低,为34.40 U/mL。
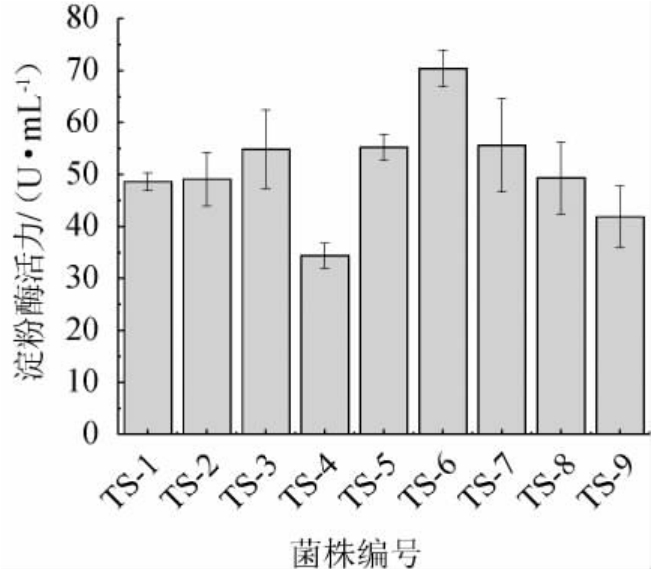
图1 初筛菌株产淀粉酶活力测定结果
Fig.1 Determination results of amylase activity produced by primary screening strains
2.2 产淀粉酶菌株的鉴定
基于16S rRNA基因序列构建9株产淀粉酶菌株的系统发育树,结果见图2。由图2可知,菌株TS-1、TS-2与蜜梳状孢类芽孢杆菌(Paenibacillus favisporus)聚于一支,亲缘关系最近;菌株TS-6与芽孢杆菌属(Bacillus sp.)聚于一支,亲缘关系最近,而其他6株菌株均与厚壁类芽孢杆菌(Paenibacillus cineris)聚于一支,亲缘关系最近。因此,将菌株TS-1、TS-2鉴定为蜜梳状孢类芽孢杆菌(Paenibacillus favisporus),菌株TS-6鉴定为芽孢杆菌(Bacillus sp.),将其他6株菌株鉴定为厚壁类芽孢杆菌(Paenibacillus cineris)。基于菌株TS-1、TS-5、TS-6酶活较高,酶活误差小,重复性高,且在进化树上的位置更分散,最终选择菌株TS-1、TS-5、TS-6为目标菌株。
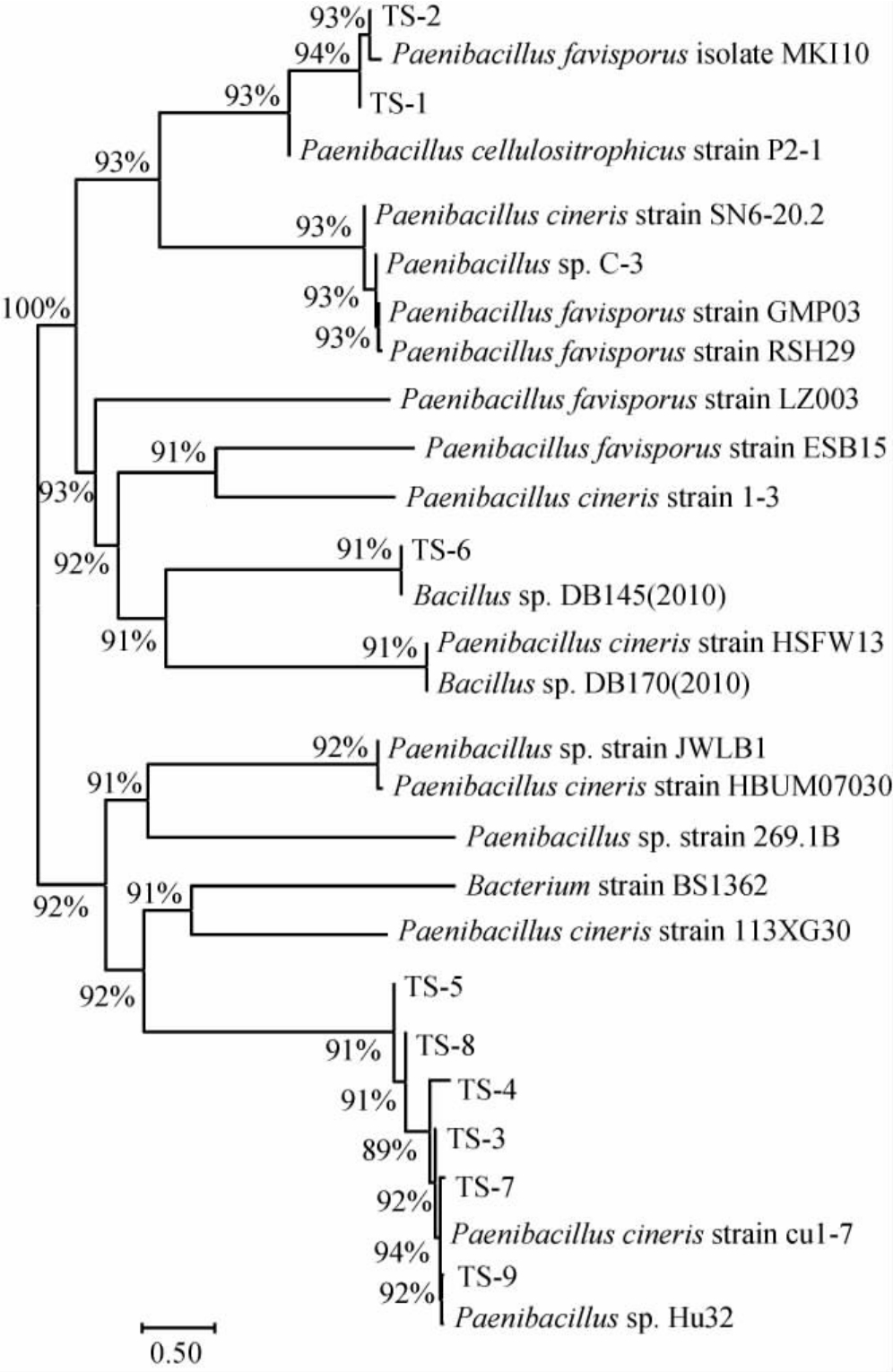
图2 基于16S rRNA基因序列9株产淀粉酶菌株的系统发育树
Fig.2 Phylogenetic tree of 9 amylase-producing strains based on 16S rRNA gene sequences
2.3 粗淀粉酶对高温的耐受能力
不同菌株所产淀粉酶对高温的耐受情况不同,因此具有不同的应用范围。为了更好的指导菌株及其产淀粉酶在工业中的应用,需探究温度对菌株所产淀粉酶酶活的影响。温度对菌株TS-1、TS-5及TS-6产淀粉酶酶活的影响见图3。由图3可知,在30~70 ℃的温度范围内,随着温度的升高,菌株TS-1、TS-6所产淀粉酶活力均呈先升高后下降的趋势,而菌株TS-5所产淀粉酶活力逐渐升高,在70 ℃仍具有较高酶活,相较于大部分研究筛选到的菌株产淀粉酶的温度耐受性范围在30~60 ℃之间[16-17,36-46],菌株TS-5所产淀粉酶有良好的耐热性。综合3株菌所产淀粉酶对温度的耐受特性的研究结果,发现菌株TS-5所产淀粉酶具有较好的耐热性,具有良好的应用潜力。
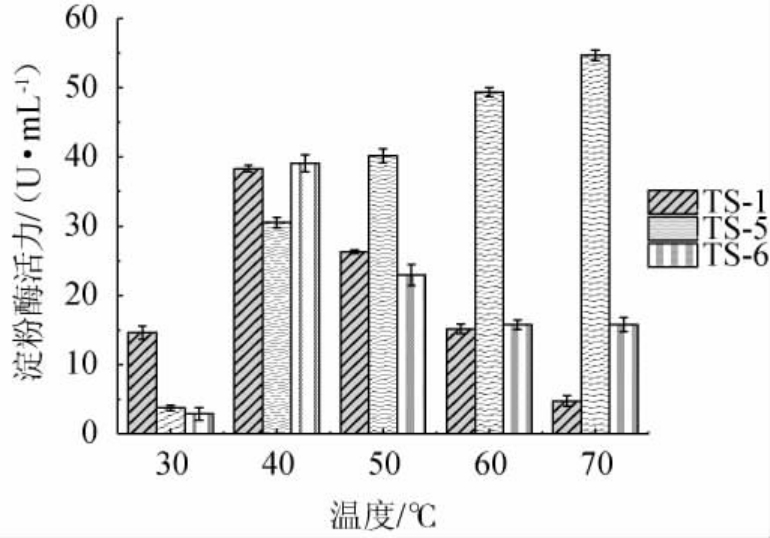
图3 温度对菌株TS-1、TS-5及TS-6所产淀粉酶活力的影响
Fig.3 Effect of temperature on amylase activity produced by strains TS-1,TS-5 and TS-6
2.4 菌株TS-5的生长曲线
菌株TS-5的生长曲线见图4。由图4可知,菌株TS-5培养0~96 h为迟滞期,96~192 h为对数生长期,192 h之后进入稳定期。有研究发现,对数生长期的细菌不但菌体浓度合适、生理状态同步,而且对理化因素敏感,有利于诱变处理[47]。故本选择培养144~168 h的细胞作为诱变用出发菌种。
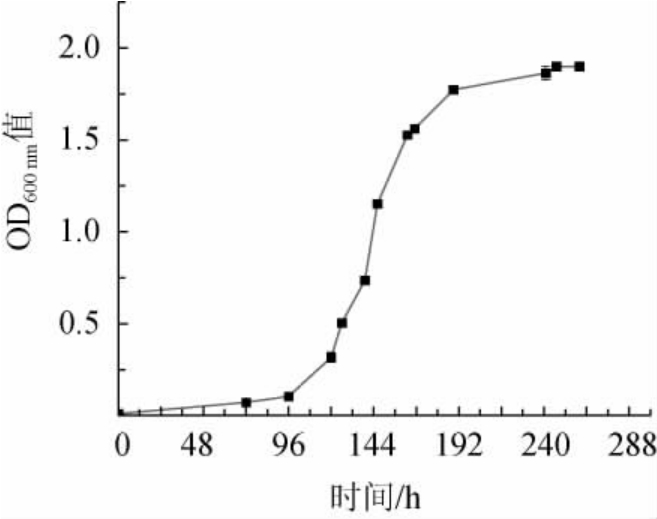
图4 菌株TS-5的生长曲线
Fig.4 Growth curve of strain TS-5
2.5 菌株TS-5的ARTP诱变选育结果
菌株TS-5所产淀粉酶虽然具有较好的耐热特性,但产淀粉酶活力较差,拟通过诱变的方式提高其酶活力,以更好地满足生产要求。菌株TS-5经过ARTP诱变仪分别处理30 s、45 s、60 s、90 s、120 s、150 s后的诱变致死率曲线见图5。
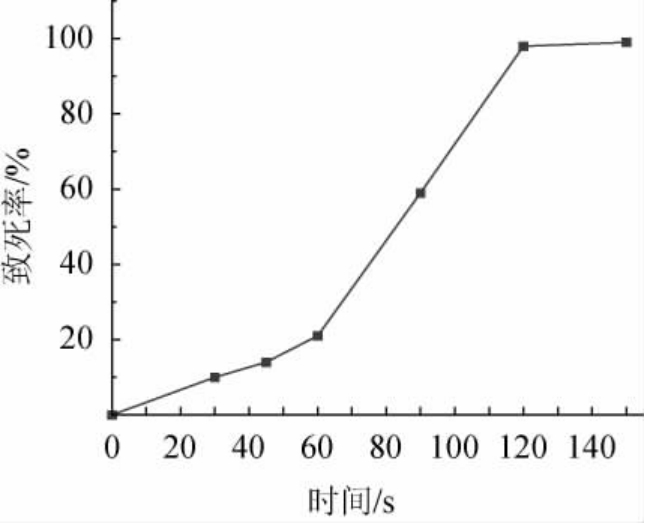
图5 不同ARTP照射时间下菌株TS-5的致死率曲线
Fig.5 Mortality curves of strain TS-5 under different ARTP irradiation times
研究表明,一般认为在菌株致死率达到90%以上,即可筛选出高产突变株[48]。由图5可知,菌株TS-5诱变120 s后,致死率达到98%,故选择诱变时间120 s的菌株测定透明圈,结果筛选出D/d值最大的一株突变菌株,命名为TS-5-ARTP,其D/d值(2.70±0.13)是原始菌株TS-5的1.3倍,表明诱变后得到的突变菌株TS-5-ARTP产淀粉酶能力有较大幅度的提升。在相同条件下,测定突变菌株TS-5-ARTP的淀粉酶活力,结果发现,突变菌株TS-5-ARTP的淀粉酶活力为(95.65±0.91)U/mL,是原始菌株TS-5的1.73倍,表明诱变后的菌株酶活有了明显的提升。
2.6 菌株TS-5-ARTP对纤维素和半纤维素的利用能力
白酒酿造原料的粮食外壳,以及酿造过程中额外添加的稻壳等辅料都含有大量纤维素和半纤维素[21]。可利用微生物代谢产酶分解纤维素、半纤维素以便于进一步将其转化为酒精和香味物质等代谢产物,提高原料的利用效率,减少酒糟处理成本,同时提升白酒品质[49]。菌株TS-5-ARTP对纤维素和半纤维素的利用情况见图6。

图6 菌株TS-5-ARTP对纤维素(a)及半纤维素(b)的利用情况
Fig.6 Utilization of cellulose (a) and hemicelluloses (b) by strain TS-5-ARTP
由图6可知,菌株TS-5-ARTP在以纤维素、半纤维素为唯一碳源的固体培养基培养上均产生较大的透明圈,表明该菌株具有良好的分解纤维素和半纤维素的能力。纤维素是一种相当稳定的大分子多糖,分子间存在许多氢键,因此整个纤维素分子结晶度和聚合度高,难以降解;已经有学者从不同的生物体中鉴定并表征了许多纤维素酶高产菌株,但由于产酶活性低、处理效果不稳定以及菌种易退化等因素的限制,难以得到大规模的应用[50-51]。本实验筛选所得菌株TS-5-ARTP在产淀粉酶的同时也具有利用纤维素和半纤维素的能力,可用于白酒酿造时分解淀粉同时降解植物细胞壁,提高白酒的出酒率。
3 结论
本研究通过透明圈法、淀粉酶活力测定及粗酶液的温度耐受性分析,从浓香型白酒窖泥中分离筛选得到1株产淀粉酶优良菌株,编号为TS-5,经分子生物学鉴定为厚壁类芽孢杆菌(Paenibacillus cineris),其所产淀粉酶活力为55.23 U/mL,可耐受70 ℃的高温处理。以菌株TS-5为出发菌株,通过ARTP诱变得到高产淀粉酶活力的突变菌株TS-5-ARTP,其淀粉酶活力(95.65 U/mL)为出发菌株的1.73倍。进一步对突变菌株TS-5-ARTP分解利用纤维素与半纤维素的能力进行研究发现,该菌株可在纤维素及半纤维素为唯一碳源的培养基上生长产生透明圈,具有分解利用纤维素和半纤维素的能力,有助于分解利用原料中的纤维素、半纤维素等成分,以提高原料的利用效率,对降低白酒生产成本具有重大意义。
[1]JIN G Y,ZHU Y,XU Y,et al.Mystery behind Chinese liquor fermentation[J].Trends Food Sci Technol,2017,63:18-28.
[2]张苗苗.基于光谱的白酒鉴别研究[D].重庆:重庆大学,2010.
[3]郭刚,罗正治,杨国华,等.新疆地区五粮浓香白酒酿造工艺技术探讨与应用[J].酿酒,2016,43(3):59-64.
[4]ZHENG X W,TABRIZI M R,NOUT M J R,et al.Daqu-a traditional Chinese liquor fermentation starter[J].J I Brewing,2012,117(1):82-90.
[5]ZHU S K,LU X,JI K L,et al.Characterization of flavor compounds in Chinese liquor Moutai by comprehensive two-dimensional gas chromatography/time-of-flight mass spectrometry[J].Anal Chim Acta,2007,597(2):340-348.
[6]杨玉婷,吴秋蕾,张俊,等.天漠嗜盐和耐盐细菌产淀粉酶活性及菌株多样性[J].吉首大学学报(自然科学版),2018,39(4):54-59.
[7]刘旭东,徐岩.一种新的中温酸性α-淀粉酶的分离纯化及酶学性质[J].应用与环境生物学报,2008,15(2):235-239.
[8]马歌丽,魏泉增,张志刚.分光光度法测定大曲糖化酶活力探讨[J].中国酿造,2008,27(17):69-71.
[9]王玉川,马俊文,李延啸,等.米黑根毛霉α-淀粉酶的定向进化、高效表达及在面包中的应用[J].中国粮油学报,2022,37(11):78-85.
[10]TSUSAKI K,WATANABE H,YAMAMOTO T,et al.Purification and characterization of highly branched α-glucan-producing enzymes from Paenibacillus sp.PP710[J].J Agr Chem Soc Jpn,2012,76(4):721-731.
[11]李志鹏,黄允升,吕海全,等.不同糖化酶在酒精生产中的应用效果分析[J].轻工科技,2018,34(8):7-8.
[12]张林吉,张海涛,李云龙,等.厨余中产淀粉酶芽孢杆菌的筛选、鉴定及酶学性质研究[J].饲料研究,2021,44(10):69-73.
[13]郑昆,杨红.淀粉酶的研究现状与进展[J].食品安全导刊,2019,13(18):53.
[14]SU Y,LIU C,FANG H,et al.Bacillus subtilis:a universal cell factory for industry,agriculture,biomaterials and medicine[J].Microb Cell Fact,2020,19(1):173-186.
[15]夏昊.酶制剂在动物营养和饲料中的应用[J].畜禽业,2021,32(3):28-29.
[16]王屈祎,钟倩,闫如玉,等.淀粉酶产生菌的筛选、鉴定及其发酵条件优化[J].微生物学通报,2022,49(1):173-188.
[17]王传旭,赵爱华,于慧瑛,等.淀粉酶高产菌株的筛选、紫外诱变及产酶条件优化[J].微生物学通报,2022,49(5):1759-1773.
[18]KUMAR P,SATYANARAYANA T.Microbial glucoamylases:characteristics and applications[J].Crit Rev Biotechnol,2009,29(3):225-255.
[19]LINCOLN L,VEENA S,SUNIL S.Isolation,screening and optimization of extracellular glucoamylase from Paenibacillus amylolyticus strain NEO03[J].Biocatal Agr Biotechnol,2019,6(18):101054.
[20]周文美,胡晓瑜,黄永光.木聚糖酶的性质及其在酿酒方面的应用[J].酿酒科技,2006(11):68-70.
[21]马翠苹.白酒窖泥中纤维素酶产生菌的筛选及在白酒发酵中的应用[D].哈尔滨:黑龙江大学,2014.
[22]刘绪,张华玲,常少健,等.白酒酿造中稻壳功能的探讨[J].酿酒科技,2015(5):21-25.
[23]孙子羽,迟乃玉,王宇,等.低温生淀粉糖化酶菌株RS01分离及其酶学性质[J].微生物学通报,2010,37(6):789-802.
[24]鲁珍,刘家扬,谌馥佳,等.高温大曲中高产糖化酶菌株的筛选鉴定及固态发酵条件优化[J].湖南农业科学,2016(4):1-4.
[25]郑自强,卫春会,邓杰,等.一株产纤维素酶枯草芽孢杆菌的麸曲制作及其产酶特性研究[J].食品与机械,2021,37(10):12-17.
[26]韩晓芳,郑连爽.产木聚糖酶嗜碱细菌的筛选及产酶条件研究[J].环境污染治理技术与设备,2002,23(11):25-27.
[27]赵淑琴,杨孝朴.一株产α-淀粉酶菌株的分离筛选、鉴定及酶学性质研究[J].中国酿造,2018,37(2):60-65.
[28]赵蓉,李多伟,任涛,等.DNS比色法测定白芸豆中α-淀粉酶抑制剂活性的方法研究[J].中成药,2013,35(3):573-576.
[29]杜东晓,赵龙妹,贾少轩,等.产淀粉酶菌株的筛选鉴定及酶学特性研究[J].饲料研究,2021,44(19):80-84.
[30]桑鹏,王肇衿,陈贵元,等.耐热蛋白酶产生菌的筛选鉴定及其酶学性质研究[J].中国饲料,2019,30(23):41-45.
[31]杨倩.米根霉α-淀粉酶pH与温度耐受性相关氨基酸结构研究[D].芜湖:安徽工程大学,2018.
[32]李一鸣,方海田,王红燕,等.ARTP诱变筛选组氨酸营养缺陷型突变菌株及其对胞苷发酵的影响[J].农业科学研究,2022,43(3):16-21.
[33]LIU K Y,FANG H,CUI F J,et al.ARTP mutation and adaptive laboratory evolution improve probiotic performance of Bacillus coagulans[J].Appl Microbiol Biot,2020,104(10):6363.
[34]XU T L,JING P,ZHU Y L,et al.Yield enhancement of recombinant alpha-amylases in Bacillus amyloliquefaciens by ARTP mutagenesis-screening and medium optimization[J].Sains Malays,2019,48(5):965-974.
[35]WANG Z,DUN B Q,LU M.Eukaryotic secrete fusion expression of Rhizopus oryzae glucoamylase and Paenibacillus sp.xylanase[C]//广州:第五届全国微生物资源学术暨国家微生物资源平台运行服务研讨会论文摘要集,2013:143.
[36]杨磊,陈良.浓香型酒醅中一株耐热地衣芽孢杆菌产淀粉酶和蛋白酶培养条件的优化[J].酿酒,2021,48(2):49-53.
[37]曹慧,张腾月,杨佳萌,等.高产淀粉酶菌株Bacillus subtilis XC2的产酶条件及酶学性质[J].饲料研究,2021,44(17):60-64.
[38]梁言,陈中,刘秉杰.3株乳杆菌发酵籼米粉浆及其产酶特性[J].食品科学,2020,41(14):161-168.
[39]方舒,严鹏,周培培.巢湖半汤温泉中菌株CHBT-1721产淀粉酶性质初步研究[J].安阳工学院学报,2019,18(4):37-40,82.
[40]聂晶晶,叶建斌,马科,等.解淀粉芽孢杆菌Y11产淀粉酶的条件优化[J].农产品加工,2019,18(10):34-39.
[41]王勇,王行,贺广生,等.耐高温产淀粉酶芽孢杆菌在烟叶烘烤中降解淀粉的应用研究[J].中国烟草学报,2017,23(4):56-63.
[42]许楚旋,江北,张琪,等.紫色红曲霉M-35菌株产淀粉酶发酵条件和培养基配方的优化[J].湖南农业科学,2017,47(4):5-10.
[43]王传旭,于慧瑛,曹建斌,等.1株产淀粉酶嗜盐细菌X50的分类鉴定及其粗酶活特性研究[J].微生物学杂志,2017,37(1):78-82.
[44]王宝强,吴潇,季秀玲,等.陈化烟叶产淀粉酶菌株的复筛及产酶条件优化[J].甘肃农业科技,2016,54(9):13-18.
[45]郑宸,应长青,洪心,等.嗜热菌Anoxybacillus sp.产淀粉酶培养基优化及产酶条件研究[J].现代生物医学进展,2016,16(19):3619-3624.
[46]冯瑞章,庞建义,王涛,等.浓香型白酒产糖化酶菌株筛选及产酶条件研究[J].中国酿造,2013,32(10):81-84.
[47]赵鑫,赵良启,刘春卉,等.离子注入L-乳酸产生菌诱变选育研究[J].生物技术,2004(6):24-26.
[48]郭昊天.产D-阿拉伯糖醇的鲁氏酵母诱变育种及代谢工程改造[D].镇江:江苏大学,2022.
[49]肖析蒙.一株纤维素降解菌的分离鉴定及其在酿酒上的应用初探[D].成都:西华大学,2020.
[50]EVELEIGH D E,MANDELS M,ANDREOTTI R,et al.Measurement of saccharifying cellulase[J].Biotechnol Biofuels,2009,2(1):1-8.
[51]ZHANG Y,HIMMEL M E,MIELENZ J R.Outlook for cellulase improvement:Screening and selection strategies[J].Biotechnol Adv,2006,24(5):452-481.