酒曲是白酒酿造中重要的糖化发酵剂,为白酒提供丰富的微生物。常见的白酒酒曲有大曲、小曲。其中小曲常以大米、麸皮、高粱等为原材料,人工接种曲母或酵母、根霉培养而成,是一种常用的糖化发酵剂[1]。培菌糖化是将小曲与熟粮混合均匀后,在一定温度下培养,使小曲中的根霉与酵母在熟粮上生长繁殖,将原料中的淀粉分解为糖,以提供适量的糖来进行酒精发酵,同时合成酶系的过程[1-2]。使用小曲培菌糖化工艺的白酒主要有米香型、小曲清香型、董香型和馥郁香型(见表1)[3-4]。培菌糖化是这些白酒酿造的核心工艺,其效果直接影响白酒的出酒率和基酒品质。
表1 使用小曲培菌糖化工艺的主要白酒类型
Table 1 Main styles of Baijiu with the strains culture and saccharification by Xiaoqu

1 培菌糖化中主要糖化微生物及作用
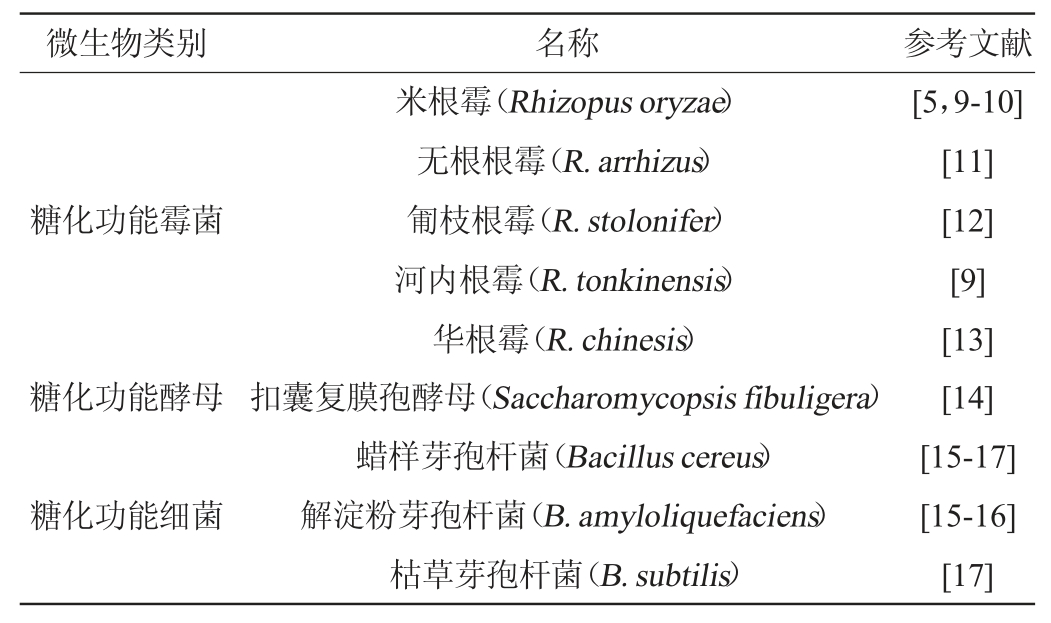
小曲含有丰富的微生物菌系和酶系,其中发挥主要作用的是霉菌、酵母菌,还有一些细菌和放线菌[2]。近年来,随着多组学联用技术、高通量测序技术等的应用,小曲中的糖化功能微生物研究逐步深入。小曲培菌糖化过程中常见的功能微生物见表2。
表2 小曲培菌糖化过程中的常见功能微生物
Table 2 Common functional microbes during the strains culture and saccharification by Xiaoqu
1.1 糖化功能霉菌
霉菌是小曲培菌糖化中的关键功能微生物。霉菌可以分泌多种酶,如淀粉酶、蛋白酶和酯化酶等,可以水解淀粉、蛋白质和脂肪。淀粉酶能将淀粉分解为短链糊精、葡萄糖、果糖和麦芽糖等,为不能直接利用淀粉的微生物的生长提供碳源[18]。蛋白酶可将原料中蛋白质分解为朊、胨和多肽,最后形成氨基酸,为酯类物质的形成提供物质基础[19]。酯化酶通常是可催化合成低级脂肪酸的酶类总称,是形成白酒风味物质的主要途径[20]。在培菌糖化过程中,霉菌分泌的多种酶充分发挥作用,对白酒酿造过程中乙醇和风味物质的产生有重要影响。小曲中的霉菌包括根霉属(Rhizopus)、曲霉属(Aspergillus)、毛霉属(Mucor)等,其中根霉是主要霉菌,常见根霉有米根霉(R.oryzae)、河内根霉(R.tonkinensis)、日本根霉(R.japonicus)、爪哇根霉(R.javanicus)、华根霉(R.chinesis)、德氏根霉(R.decemar)、黑根霉(R.nigricans)和台湾根霉(R.formosaensis)等[13]。
不同香型的白酒小曲中存在不同种类的优势霉菌。王柏文[21]分析了豉香型小曲的糖化酶谱形成机制,利用高通量测序和宏蛋白组学等多组学联用技术揭示根霉属(17.4%)、曲霉属(8.3%)和根毛霉属(0.05%)是该小曲体系中的重要糖化微生物。研究表明,小曲是白酒酿造过程中糖化酶谱的主要贡献者,提高小曲容重有利于调控以多酶为组成特点的糖化酶谱的形成。
米香型白酒小曲中糖化的主要真菌是米根霉(Rhizopus oryzae)。YIN X等[5]研究发现,从米香型白酒小曲中分离的米根霉可以产乳酸。其中35 ℃是最适合米根霉生长、产酶和糖化的温度。米根霉可以合成包括果胶酶、纤维素酶、淀粉酶、蛋白酶、脂肪酶等在内的胞内酶和胞外酶,具有较高的糖化力和蛋白水解力,在培菌糖化中起到重要作用[5]。
清香型白酒小曲中有多种霉菌。唐佳代[22]使用高通量测序分析贵州小曲的微生物结构组成,结果表明,根霉属(Rhizopus)、曲霉属(Aspergillus)、毛霉属(Mucor)是主要的真菌属。WANG C等[11]研究了贵州6种小曲的真菌多样性,15种真菌丰度大于1%,其中无根根霉(R.arrhizus)最多。无根根霉可以分泌糖化酶、脂肪酶[23-24]。WU H等[12]使用传统培养方式及高通量测序研究三种小曲的微生物组成:华西小曲中匍枝根霉(R.stolonifer)相对丰度为94.98%,是主要真菌;四川大竹小曲中真菌主要为酵母;湖北小曲中的霉菌主要为匍枝根霉(R.stolonifer),相对丰度为18.90%。唐洁等[14,25]分析湖北清香型小曲白酒的微生物群落结构和功能微生物,研究发现米根霉(R.oryzae)是主要糖化菌。叶磊[9]从重庆市8种小曲中分离纯化筛选得到2株高产糖化酶和液化酶的根霉,经鉴定分别为米根霉(R.oryzae)和河内根霉(R.tonkinensis)。
霉菌也是青稞酒小曲中的关键糖化微生物[26]。张晓蒙等[27]研究发现,西藏五个地区青稞酒小曲的共有优势霉菌为根霉属(Rhizopus)和毛霉属(Mucor)。耿晓杰等[10]从西藏青稞小曲中筛选得到糖化力为(1 382±77.38)mg/(g·h)的米根霉(R.oryzae)M12,对提升青稞酒的品质有重要意义。
1.2 其他糖化功能微生物
小曲中还存在霉菌之外的其他功能微生物,在糖化过程中发挥不同作用(表2)。小曲中的酵母主要有酒化、代谢合成风味物质的作用[1],但研究发现,部分酵母还具有淀粉酶活性,参与小曲培菌糖化。扣囊复膜孢酵母(Saccharomycopsis fibuligera)是小曲中常见的酵母菌之一[14],不仅可以产生酯香,还可分泌淀粉酶(α-淀粉酶、葡糖淀粉酶、生淀粉糖化酶)、蛋白酶等水解酶类,降解大分子底物[28-29]。HOSTINOVÁ E等[30]深入研究了扣囊复膜孢酵母(Saccha romycopsis fibuligera)的α-淀粉酶编码基因及酶学性质,表明该种酵母具有较强的淀粉酶活力,在发酵生产中表现出很大的应用潜力。
在培菌初期,小曲中的霉菌和酵母存在生长延迟期,细菌在该阶段起着重要作用。小曲中的功能细菌可以产酸,为发酵提供酸性环境[1]。部分功能细菌还可以产生糖化酶、蛋白酶、果胶酶等水解酶类。耿晓杰等[10]从西藏青稞小曲中共分离出278株菌,主要包括6种细菌13种真菌。复筛得到糖化力为(1 382±77.38)mg/(g·h)的米根霉M12,中性蛋白酶活力为(1 035.56±40.09)μg/(g·min)的解淀粉芽孢杆菌Q4。满都拉等[17]从湖北、安徽和四川地区小曲中分别分离得到枯草芽孢杆菌(B.subtilis)和蜡样芽孢杆菌(B.cereus),表现出潜在的糖化能力。
小曲培菌糖化过程中,各种功能微生物之间存在相互作用。如向小曲中添加过多的酵母菌会抑制霉菌的生长[31],芽孢杆菌也会显著抑制甜酒曲中的根霉菌菌丝生长[32],而高产酯酵母和乳酸菌之间也存在互相抑制作用[33]。目前关于小曲糖化功能微生物之间的互作研究还较少,需进一步开展相关实验。
2 小曲培菌糖化过程控制
为了提高小曲培菌糖化的质量,多年来研究者分别从培菌原料、小曲、工艺参数等方面开展相关研究。
2.1 培菌糖化原料
原料是培菌糖化的基础,为微生物的生长糖化提供底物。因此,上世纪就有培菌糖化原料的相关研究。周恒刚[34]研究发现,生料生长的根霉糖化力高于熟料60%以上,这是因为根霉缺乏酸性羧基蛋白酶,不能分解利用加热变性的蛋白质,因此根霉更适合在生料上生长。
高粱是小曲酒生产的主要原料之一。陈帆等[35]以机械化酿造澳洲高粱糖化醅为原料,探究了不同品种澳洲高粱的最佳开箱温度及糖化培菌工艺。研究表明,九江港澳洲高粱、康博红高粱、Buster澳洲高粱和武汉港澳洲高粱的培菌糖化工艺各不相同,并提出不同产地高粱的不同最佳开箱工艺。
馥郁香型白酒采用多粮进行培菌糖化,是唯一采用小曲多粮糖化技术生产的大曲酒。研究表明,多粮糖化的糖化效果优于单粮。多粮糖化显著提高功能微生物的数量,其中酵母和细菌的数量分别是单粮的68倍和470倍。多粮糖化的原料出酒率比单粮高出8%,酒的品质更高,更适合微生物生长发酵[36]。
2.2 培菌糖化小曲
2.2.1 小曲菌种
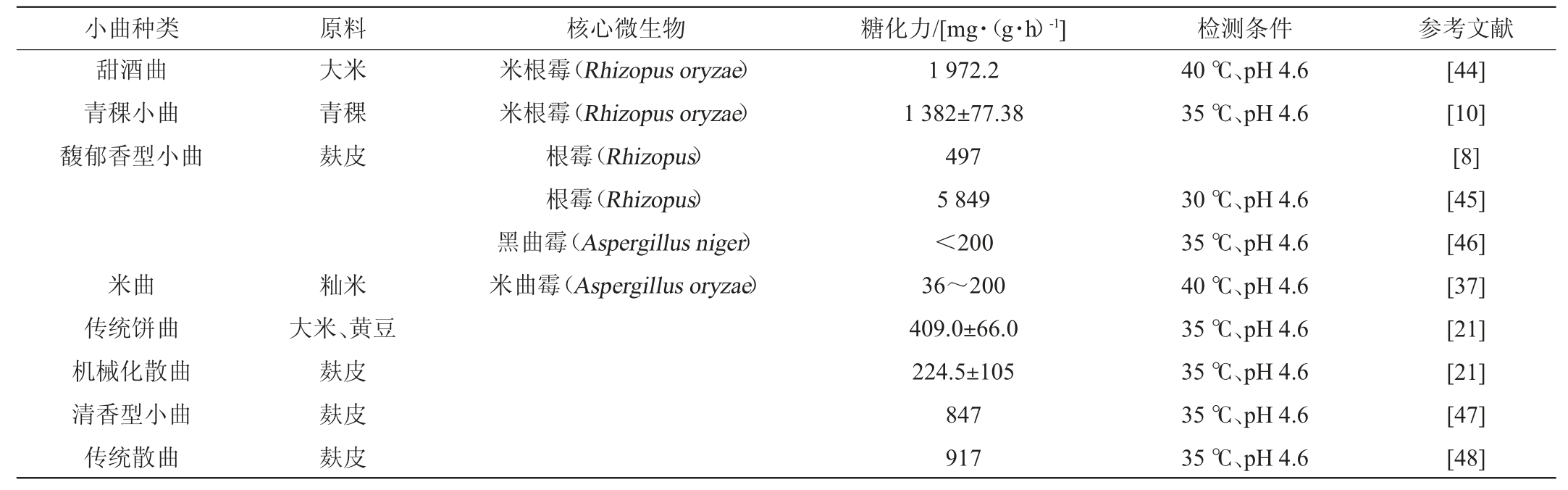
菌种是培菌糖化的灵魂,菌种糖化力的高低直接影响培菌糖化效果,继而决定出酒率。据文献报道,不同小曲的糖化力差别巨大,这与功能微生物有关,也与糖化力的测定方法有关[37]。不同小曲的糖化力测定结果及和小曲培菌糖化过程中常见的核心微生物见表3。小曲中的核心微生物以根霉或曲霉为主,一般在30~40 ℃、pH 4.6条件下测定糖化力,不同小曲的糖化力相差可达数十倍。因此,有学者认为,不能单纯以糖化力作为指标评价微生物的作用,应以原料与功能微生物作用后的整个物系对酒精发酵作用作为评价指标[38]。小曲含有丰富的微生物菌系和酶系,其中发挥主要作用的是霉菌、酵母菌,还有一些细菌和放线菌[4]。近年来,随着多组学联用技术、高通量测序技术等的应用,小曲中的糖化功能微生物研究逐步深入。除了糖化功能,小曲中的霉菌、酵母菌、细菌和放线菌也促进了关键风味物质的合成。添加功能微生物可以定向增加酯类、醇类等物质产量,提升基酒的风味品质[39-43]。
表3 不同小曲的糖化力
Table 3 Saccharifying activities of different Xiaoqu
菌种保藏复壮也是研究者关注较多的方向。关键功能微生物如果保管不当,会发生退化、混杂甚至变异,带来不可估量的损失。研究表明,真空冷冻干燥保藏法比较适合小曲的长期保存,橡胶塞斜面试管保藏法比较适合短期保藏[13]。郭波等[49]研究发现,可以用野生山稔子干为原料对豉香型白酒小曲自然菌种实施复壮,制成的小曲酒饼丸糖化发酵力高,微生物种类丰富,工艺切实可行。
2.2.2 制曲工艺
制曲工艺直接决定了小曲的性能。随着白酒产业升级,机械化、智能化制曲越来越受到关注[4]。王喆等[50]研究了圆盘制曲机在生产上的应用,确定了生产工艺参数,成品曲糖化力显著高于浅盘培养曲。豉香型白酒圆盘制曲所得散曲各项指标达标,用其制作的斋酒与传统豉香型斋酒风味相似[51]。沈晓波等[52]进一步研究了多菌种的圆盘制曲工艺,提出要分阶段制曲,前期(1~20 h)菌丝大量繁殖,培养温度(30~34 ℃)和通风量(10~15 Hz)略低;后期(20~32 h)微生物产酶,培养温度(34~36 ℃)和通风量(20~25 Hz)需要升高。值得注意的是,机械化制曲可能会导致微生物的变化。WANG J等[53]使用高通量测序技术对比了豉香型白酒酿造中机械化圆盘制曲的散曲与传统小曲中的功能微生物。高通量测序表明,乳杆菌属(Lactobacillus)和片球菌属(Pediococcus)是所有小曲中的主要属,魏斯氏菌属(Weissella)、醋酸杆菌属(Acetobacter)和葡糖杆菌属(Gluconobacter)是酒饼中的主要属,魏斯氏菌属(Weissella)是饼丸中的主要属,芽孢杆菌属(Bacillus)、醋酸杆菌属(Acetobacter)、不动杆菌属(Acinetobacter)和克雷白氏杆菌属(Klebsiella)是散曲的主要属。散曲中还检测到一些病原菌,所以在投入生产前机械制曲需要进行改进。
2.2.3 强化小曲
近年来,较多研究关注强化小曲对白酒出酒率和品质的影响。研究发现,在小曲清香原有工艺上添加0.5%根霉曲可以促进培菌糖化,酸类、酯类种类增加;基酒中乙酸乙酯、总酯和总酸含量显著提高,乙酸乙酯:乳酸乙酯由1.42提高至1.92,改善了基酒品质[6]。郭继英等[7]使用大小曲混用的方式糖化发酵,在糖化阶段引入大曲中丰富的微生物,显著提高了基酒中的总酸和总酯。
2.3 培菌工艺参数
工艺参数是糖化培菌的关键。为了优化糖化效果,提高出酒率和优品率,部分酒厂会向小曲中添加糖化酶。研究表明,在云南小曲白酒生产过程中,向小曲中添加0.1%的复合酶制剂(含淀粉酶、纤维素酶、酸性蛋白酶、果胶酶、木聚糖酶、β-葡聚糖酶、β-甘露聚糖酶、植酸酶)可使基酒出酒率提高3.77%~4.48%,总酸、总酯含量也显著提升[54]。值得注意的是,部分学者认为,减曲加糖化酶的方法虽然简单,提高了原料的出酒率,但可能会降低酒质[55]。因此,培菌过程中糖化酶的添加需要根据实际情况决定。
培菌温度控制也是重要的工艺之一。培菌糖化温度一般为30~38 ℃,培菌过程中要防止冷边、冷角、冷面,适宜的温度有利于糖化功能微生物的生长,可以取得较好的糖化效果[56]。小曲培菌时间的长短直接决定了糖化效果的好坏,培菌时间也会根据季节调整。研究发现,在馥郁香型白酒培菌糖化中,培菌时间过长,培菌糖化容易出现“老箱”(霉菌生长偏多,淀粉消耗多),配糟入池会增加淀粉损耗,降低出酒率和酒质。与之相反,“嫩箱”(霉菌生长量少,淀粉消耗少)出箱的淀粉含量适中,对质量和产量均有利[57]。川法小曲清香酒在生产中也会严格控制箱口老嫩,减少培菌中的淀粉损失。
培菌糖化结束时,一般会通过测定糖化料水分、酸度、还原糖,结合感官指标综合评价糖化效果[53]。由于培菌糖化是白酒酿造的过程工艺,多数酒厂还会结合最终基酒的品质(基酒的出酒率、总酯、总酸、乙乳比及感官特征)进行评价[21,53]。
3 展望
近年来,小曲培菌糖化研究取得了一定进展,但仍存在一些不足:①培菌糖化微生物研究主要集中在功能霉菌,对具有潜在糖化功能的酵母、细菌甚至放线菌的研究较少。未来研究需加强对多种糖化功能微生物的挖掘,深入研究开发糖化微生物的功能,并加强相关应用研究。②缺乏糖化过程中不同微生物之间的互作研究。事实上,近年来对白酒微生物的研究表明,白酒酿造过程中功能微生物之间存在协同、拮抗和抑制作用,它们对微生物生长代谢的影响不容忽视。因此,未来研究需重点关注糖化功能微生物之间的互作,以便更好地发挥它们的作用,实现更好的应用。③加强对培菌糖化过程关键变量(如温度、时间)的监测和收集,进一步开展过程微生物菌群与风味品质关联评价研究,加强培菌糖化评价的量化和标准化,促进白酒数字化、机械化、智能化改革。不同酒厂对小曲糖化力的评价各不相同,糖化力的高低并没有统一标准,今后可以开展最佳糖化力范围的研究,结合风味品质评价,建立合理的糖化综合评价体系,促进对糖化力评价的标准化。
[1]王春晓,唐佳代,吴鑫颖,等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.
[2]傅其旭,车经纬,张怀山,等.小曲酿酒的研究进展[J].轻工科技,2018,34(5):1-2,16.
[3]苏金兰,徐柏田,林培.中国白酒香型发展的进展研究[J].酿酒科技,2017(8):102-111.
[4]胡银川,李明元,徐坤,等.菌种混合提高小曲米酒出酒率研究[J].中国酿造,2010,29(3):110-112.
[5]YIN X,YOSHIZAKI Y,IKENAGA M,et al.Manufactural impact of the solid-state saccharification process in rice-flavor Baijiu production Xuan[J].J Biosci Bioeng,2020,129(3):315-321.
[6]潘天全,程伟,张杰,等.安琪根霉曲在小曲清香型白酒酿造生产中的应用分析与探讨[J].酿酒科技,2019(10):116-123.
[7]郭继英,阚永清,朱建敏,等.大小曲混合在云南小曲清香白酒中调味酒生产的应用研究[J].现代食品,2020(11):108-109,112.
[8]王明生,程俊.根霉曲在馥郁香型白酒生产中的应用[J].酿酒科技,2018(8):70-72,88.
[9]叶磊.小曲中优良根霉的分离筛选及产酶条件研究[D].重庆:西南大学,2009.
[10]耿晓杰,张玉红,薛洁,等.西藏青稞小曲中优良微生物的筛选与鉴定[J].食品与发酵工业,2019,45(15):66-73.
[11]WANG C,TANG J,QIU S.Profiling of fungal diversity and fermentative yeasts in traditional Chinese Xiaoqu[J].Front Microbiol,2020,11:2103.
[12]WU H,ZHANG S,MA Y,et al.Comparison of microbial communities in the fermentation starter used to brew Xiaoqu liquor[J].J I Brewing,2016,123(1):113-120.
[13]蔡元宁,余志良,赵春田,等.多粘类芽孢杆菌的保藏及复壮方法研究[J].浙江农业学报,2015,27(1):5-10.
[14]唐洁.清香型小曲酒微生物群落结构及功能的研究[D].无锡:江南大学,2012.
[15]张巧格.解淀粉芽孢杆菌BH072 α-淀粉酶理化性质及基因克隆的研究[D].天津:天津大学,2017.
[16]关晓欢,姜华.解淀粉芽孢杆菌研究进展[J].生物技术世界,2013(1):4-9.
[17]满都拉,刘昊,郑逸飞,等.不同地区小曲中可培养细菌的筛选及鉴定[J].中国酿造,2018,37(10):61-65.
[18]信春晖,许玲,董乔娟,等.酿酒微生物对酒体质量及风格的影响[J].酿酒,2016,43(2):38-47.
[19]李小东.堆积发酵条件对芝麻香型白酒香气品质的影响[D].无锡:江南大学,2018.
[20]张武斌.清香大曲糖化酶的提取及宏蛋白质组学分析[D].太原:山西师范大学,2014.
[21]王柏文.小曲糖化酶谱形成机制及其对白酒发酵过程的影响[D].无锡:江南大学,2020.
[22]唐佳代.贵州传统小曲微生物群落结构及功能酵母的筛选[D].贵阳:贵州大学,2019.
[23]孙宏丹,刘健杰,姚民昌.无根根霉脂肪酶的酶学性质研究及酯合成的应用[J].大连医科大学学报,2001(1):52-55.
[24]HUANG L,JIN B,LANT P,et al.Simultaneous saccharification and fermentation of potato starch wastewater to lactic acid by Rhizopus oryzae and Rhizopus arrhizus[J].Biochem Eng J,2005,23(3):265-276.
[25]王海燕,唐洁,徐岩,等.清香型小曲白酒中微生物组成及功能微生物的分析[J].酿酒科技,2012(12):48-52.
[26]袁亦舟,张伟国,徐建中.青稞酒曲微生物多样性分析及米根霉制曲条件优化[J].食品与发酵工业,2018,44(5):39-45.
[27]张晓蒙,李德美,金玮鋆,等.西藏青稞酒酿造小曲微生物多样性分析[J].中国酿造,2018,37(9):28-33.
[28]臧威,谢广发,孙剑秋,等.绍兴黄酒酒药中酵母菌的物种资源[J].菌物学报,2015,34(6):1078-1084.
[29]应玲云,伍时华,赵东玲,等.烧酒曲中扣囊复膜酵母的分离及鉴定[J].食品与发酵工业,2013,39(1):146-150.
[30]HOSTINOVÁ E,JANECˇEK Š,GAŠPERÁK J.Gene sequence,bioinformatics and enzymatic characterization of alpha-amylase from Saccharomycopsis fibuligera KZ[J].Protein J,2010,29(5):355.
[31]罗高建,倪书干,左可成,等.不同催陈方法对清香型小曲酒品质及微量成分的影响[J].酿酒,2021,48(1):51-54.
[32]康宪.传统桂林甜酒曲微生物协同作用及应用研究[D].广州:华南农业大学,2016.
[33]刘彩霞,郭学武,李玲玲,等.高产酯酿酒酵母与乳酸菌共发酵过程中的相互作用研究[J].现代食品科技,2017,33(7):30,79-84.
[34]周恒刚.试论根霉菌在制曲上的特征[J].酿酒,2001,28(6):23-26.
[35]陈帆,沈永祥,刘怀臣,等.小曲酒新工艺糖化培菌规律研究[J].酿酒科技,2017(8):47-54.
[36]方田华.多粮小曲清香型白酒及其酿造方法:CN105219613A[P].2016-01-06.
[37]林艳,马莹莹,张宿义,等.米曲糖化酶活力测定方法的比较研究[J].酿酒科技,2015(6):23-27,31.
[38]王旭亮,王异静,王德良,等.白酒发酵高糖化性能霉菌的筛选及鉴定[J].酿酒科技,2012(9):22-28.
[39]苏畅.浓香型白酒酒醅中功能酵母的筛选及在川法小曲酿造中的应用[D].自贡:四川轻化工大学,2019.
[40]胡琴,曹新志,张楷正,等.半固态发酵法酿造苦荞小曲酒糖化工艺优化[J].中国酿造,2021,40(4):61-65.
[41]李大和,李国红.固态法小曲白酒调味酒的制作[J].酿酒科技,2022(3):83-88.
[42]潘天全,程伟,张杰,等.安琪小粬对清香型白酒固态发酵挥发性风味物质的影响[J].酿酒科技,2021(10):124-132.
[43]张兆丰,万勇,余有贵,等.浓香型白酒生产中小曲堆积糖化的工艺研究[J].酿酒科技,2022(2):79-86,98.
[44]周金虎,陈茂彬,毛志海,等.甜酒曲中一株高产淀粉酶根霉的筛选与鉴定[J].酿酒科技,2019(1):37-40.
[45]姚万春,唐玉明,任道群,等.酿酒用根霉若干菌株的培养特性研究[J].酿酒,2007(1):24-26.
[46]潘菲,董彪,刘婷,等.黑曲霉Aspergillus niger NCUF413.1对特香型白酒酿造出酒率和风味的影响[J].食品与发酵工业,2020,46(1):23-29.
[47]王晓勇,荆旭,赵恒山,等.应用响应面法对产糖化酶菌株M1制曲工艺的优化研究[J].酿酒,2019,46(5):79-83.
[48]赵恒山.产糖化酶、液化酶菌株的筛选及麸曲的制备[D].晋中:山西农业大学,2017.
[49]郭波,谢敏,陈楚坚.豉香型白酒小曲菌种复壮的工艺研究[J].酿酒科技,2018(9):37-40.
[50]王喆,贺友安,汪陈平,等.圆盘制曲机在根霉曲生产上的应用研究[J].酿酒科技,2016(2):77-79.
[51]郭波,谢敏,谭莹.一种豉香型白酒专用新型糖化发酵剂的工艺技术CN107022452A[P].2017-06-21.
[52]沈晓波,严启梅,胡风光,等.多菌种根霉菌圆盘制曲的生产研究[J].酿酒,2019,46(4):36-38.
[53]WANG J,ZHONG Q,YANG Y,et al.Comparison of bacterial diversity between two traditional starters and the round-koji-maker starter for traditional cantonese chi-flavor liquor brewing[J].Front Microbiol,2018,9:1053.
[54]李俊俊,唐湘华,段永忠,等.复合酶在云南小曲白酒生产中的应用研究[J].食品工业科技,2009,30(1):178-179,182.
[55]江建军,杨官荣,黄志瑜.四川小曲白酒技术的继承与创新(上)[J].酿酒,2011,38(5):7-11.
[56]胡怀玲.小曲的特点以及其中主要微生物间的关系[J].酿酒,2008,35(5):52-53.
[57]张大鑫,黄润娜,韩素娜,等.陶融型调味酒培菌糖化工艺研究[J].酿酒科技,2022(4):38-47.