蓝莓(Vaccinium uliginosum)是杜鹃花科(Ericaceae)越橘属(Vaccinium)蓝果类型植物,蓝莓风味独特、营养丰富,果实中含有多酚、黄酮、花青素和原花青素等多种生物活性物质,具有抗氧化、抗炎、提高免疫力、促进视红素合成、抗癌等多种活性功能[1]。野生蓝莓鲜果口感较酸而不适宜鲜食,保质期短、不易保藏和运输,常被加工成果汁、果酒、果酱、果脯和果粉等产品[2]。蓝莓果酒因具有良好的口感和保健功能成为果酒行业消费的热点之一,蓝莓果酒、果啤、复合果酒等产品的研究与开发是目前蓝莓产品研发的重点[3]。
蓝莓果酒在发酵过程中,其发酵工艺决定了酒体中酚类物质的含量和果酒的品质及功能。果酒通常采用浸渍方式进行发酵,浸渍的关键在于溶出大量酚类化合物和优质单宁,而减少具有苦涩味劣质单宁的溶出。与传统常温发酵工艺相比,发酵前冷浸渍预处理方式有利于增加过果香浓度[4],发酵前热浸渍预处理方式有利于提升果酒的口感和改善果酒风味[5]。目前,对蓝莓果酒的研究主要集中在发酵过程中理化指标、酚类化合物及抗氧化能力的变化等方面,徐雯[6]研究了蓝莓果酒发酵过程中花色苷含量的变化,得到花色苷含量随着发酵的进行呈先增加后下降的趋势。胡品[7]对比3种发酵工艺制备的蓝莓果酒,即发酵蓝莓酒、调配蓝莓酒和浸泡蓝莓酒,发现调配蓝莓酒的抗氧化效果最好。而目前对于蓝莓果酒发酵过程中酚类化合物含量的变化的研究报道较少。
本研究以野生蓝莓为原料,通过低温预浸渍清汁发酵(LT)、热浸渍清汁发酵(HT)以及常温全果发酵(T)3种不同发酵方式制备蓝莓果酒,对发酵期间蓝莓果酒中的理化指标和抗氧化能力的变化进行检测,以期探讨不同发酵方式制备蓝莓果酒的理化指标及抗氧化能力的变化规律,为蓝莓果酒发酵工艺的选择和优化提供参考,深入开发利用蓝莓资源。
1 材料与方法
1.1 材料与试剂
野生蓝莓(Vaccinium uliginosum L.)冻果:大兴安岭超越野生浆果开发有限公司;果胶酶(酶活50 000 U/g)、高活性干葡萄酒酵母:湖北安琪酵母股份有限公司;没食子酸(纯度≥99%)、1,1二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基、芦丁(纯度≥98%):美国Sigma公司;原花青素(纯度≥95%)、2,2-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2,2'-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid,ABTS)自由基:上海源叶生物技术有限公司;交联聚乙烯吡咯烷酮(polyvinylpyrrolidone,PVPP):四川天华股份有限公司。
1.2 仪器与设备
EL20型酸度计:梅特勒-托利多仪器(上海)有限公司;UV-5500PC紫外可见分光光度计:上海元析仪器有限公司;CM-5台式分光测色计:柯尼卡美能达控股公司;JYZ-C500九阳榨汁机:九阳股份有限公司;RE-2000A旋转蒸发器:巩义市予华仪器有限责任公司;HR/T20MM立式高速冷冻离心机:湖南赫西仪器装备有限公司;JQ-300DE数控超声波清洗器:君山超声仪器有限公司。
1.3 方法
1.3.1 不同发酵方式蓝莓果酒的加工工艺流程及操作要点
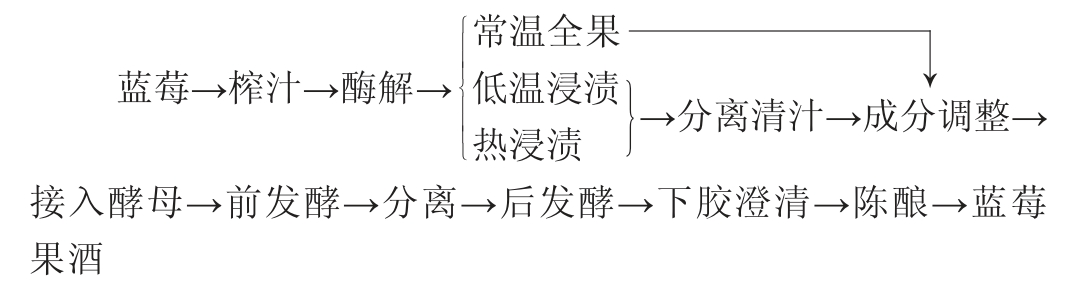
操作要点:
蓝莓预处理:称取500 g蓝莓冻果,采用榨汁机榨汁(不加水),获得蓝莓果浆。
酶解及蓝莓果浆前处理:于蓝莓果浆中加入0.25%果胶酶,于50 ℃的条件下酶解2 h。低温浸渍组(LT)于4 ℃浸渍72 h、热浸渍组(HT)于70 ℃浸渍3 h、常温全果组(T)置于25 ℃条件下备用[8]。低温浸渍和热浸渍处理后的蓝莓果浆采用120目滤布过滤得到澄清的蓝莓果汁。
成分调整、接种:于3组样品中添加0.01 g/L K2S2O5,用白砂糖将样品的糖度调整至20 °Bx,添加CaCO3调整pH值为3.4,接入1.00 g/L高活性干葡萄酒酵母(活化条件:在5%糖水中30 ℃活化24 h,10 ℃以下贮存备用)。
发酵:3组样品在25 ℃条件下进行前发酵12 d,其中,对常温全果发酵组(T)蓝莓果浆发酵液用3层纱布进行过滤,除去沉淀物后将3组样品在20 ℃条件下进行后发酵18 d,下胶澄清(将下胶剂PVPP溶好后与蓝莓原酒充分混合,下胶15 d左右开始分离,利用硅藻土过滤机进行对蓝莓果酒进行过滤),后在20 ℃条件下陈酿30 d,制得蓝莓果酒成品。
1.3.2 基础理化指标的测定
颜色参数(L*值、a*值、b*值)的测定:采用分光测色计;总酸含量的测定:采用NaOH滴定法[8];pH值的测定:采用酸度计;总糖含量的测定:采用3,5-二硝基水杨酸法[9];酒精度的测定:参考GB 5009.225—2016《食品安全国家标准酒中乙醇浓度的测定》[10];花色苷含量的测定:采用pH示差法[11]。
1.3.3 蓝莓果酒中酚类物质含量的测定
总酚含量的测定:采用Folin-Ciocalteu法[12]。在波长760 nm处测定样品的吸光度值,以没食子酸为标准品,以没食子酸含量(x)为横坐标,以吸光度值(y)为纵坐标,绘制没食子酸标准曲线,获得没食子酸标准曲线回归方程为y=0.014 0x+0.010 8,相关系数R2=0.999 2。
总黄酮含量的测定:采用NaNO2-Al(NO3)3法[13]。在波长510 nm处测定样品的吸光度值,以芦丁为标准品,以芦丁含量(x)为横坐标,以吸光度值(y)为纵坐标,绘制芦丁标准曲线,获得芦丁标准曲线回归方程为y=0.012 6x-0.017 9,相关系数R2=0.998 9。
原花青素含量的测定:采用香草醛-盐酸法[14]。在波长500 nm处测定样品的吸光度值,以儿茶素为标准品,以儿茶素含量(x)为横坐标,以吸光度值(y)为纵坐标,绘制儿茶素标准曲线,获得儿茶素标准曲线回归方程为y=1.521 2x-0.010 4,相关系数R2=0.999 2。
1.3.4 蓝莓果酒抗氧化能力的测定
总抗氧化能力的测定:采用铁离子还原能力(ferric ion reducing antioxidant power,FRAP)法[15];DPPH自由基和ABTS自由基清除能力的测定:采用分光光度法[16-17]。
1.3.5 数据处理
采用Origin 8.0、Excel 2010和SPSS 20.0软件处理数据并绘制图表,数据结果以“平均值±标准差”表示。
2 结果与分析
2.1 3种蓝莓果酒发酵过程中基础理化指标的动态变化
2.1.1 颜色参数的变化
3种蓝莓果酒发酵过程中颜色参数的变化见图1。
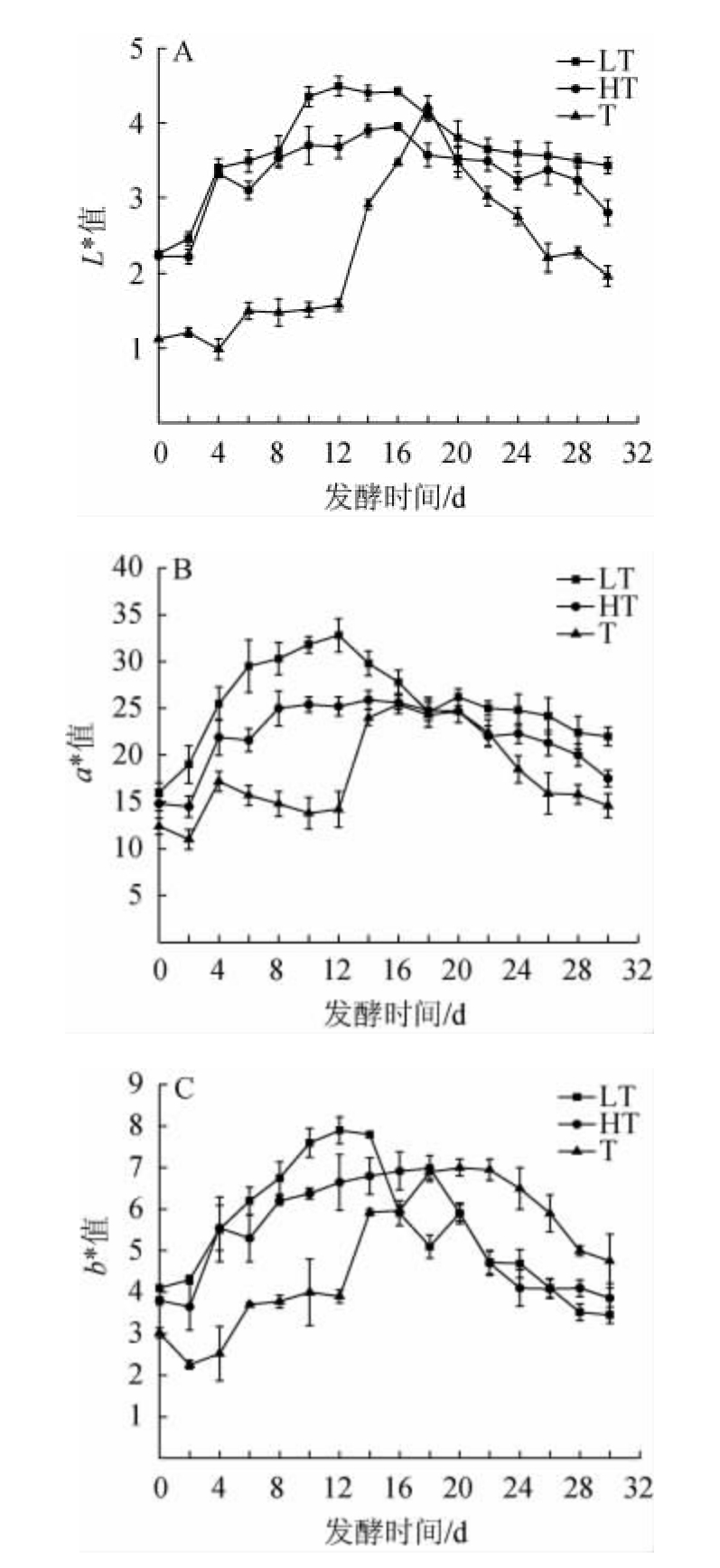
图1 3种蓝莓果酒发酵过程中L*值(A)、a*值(B)及b*值(C)的变化
Fig.1 Changes of L* value (A), a* value (B) and b* value (C) during the fermentation of 3 blueberry fruit wines
由图1A可知,3种蓝莓果酒发酵过程中,L*值均整体呈现先增加后降低的趋势。在前发酵期(0~12 d),3种蓝莓果酒的L*值均随发酵时间的延长而增加,且LT组、HT组的L*值显著高于T组(P<0.05),在后发酵期(13~30 d),LT组、HT组的L*值有所下降,T组的L*值在13~18 d内逐渐增加至最高值,后逐渐下降。由图1B可知,3种蓝莓果酒发酵过程的a*值均为正值,且a*值均呈先上升后下降趋势。在前发酵期(0~12 d),LT组、HT组蓝莓果酒的a*值增加;在后发酵期(13~30 d),LT组、HT组的a*值有所下降,而T组蓝莓果酒的a*值在0~4 d波动上升,4~12 d呈下降趋势,12~16 d之后又增加,在16 d后a*值再次显著下降(P<0.05)。蓝莓中富含大量花色苷,且花色苷在强酸(pH值为3)条件下显现稳定的红色[18],故酒体颜色为红色。由图1C可知,3种蓝莓果酒的b*值均为正值,在发酵过程中,b*值均呈先增加后下降的趋势,LT组、HT组、T组蓝莓果酒的b*值分别在12 d、18 d、20 d时达到最大值。T组由于酒体中酒渣的存在,导致前发酵期(0~12 d)的L*、a*、b*值低于其他两种发酵方式,当第13天进行皮渣分离得到自流酒后,酒液变澄清,色泽鲜亮,L*值极显著增加(P<0.01),此时,果皮果渣内色素也被挤压分离出来,致使a*值、b*值也显著提升。随着后发酵的进行,由于花色苷的损失和酚类物质的氧化损失和聚合[19],a*值和b*值均降低。王行等[20]对蓝莓酒发酵过程中色泽的动态变化研究时发现,蓝莓酒发酵过程中b*值在前发酵期间随发酵时间的延长显著上升(P<0.05),其原因可能是总酚、总黄酮等酚类物质是产生酒液黄色色调的来源;后发酵期间,b*值显著降低(P<0.05),可能是由于酚类物质的聚合。综合考虑,LT清汁发酵方式制得的蓝莓果酒的色泽品质更好。
2.1.2 pH值和总酸含量的变化
3种蓝莓果酒发酵过程中pH值和总酸含量的变化见图2。
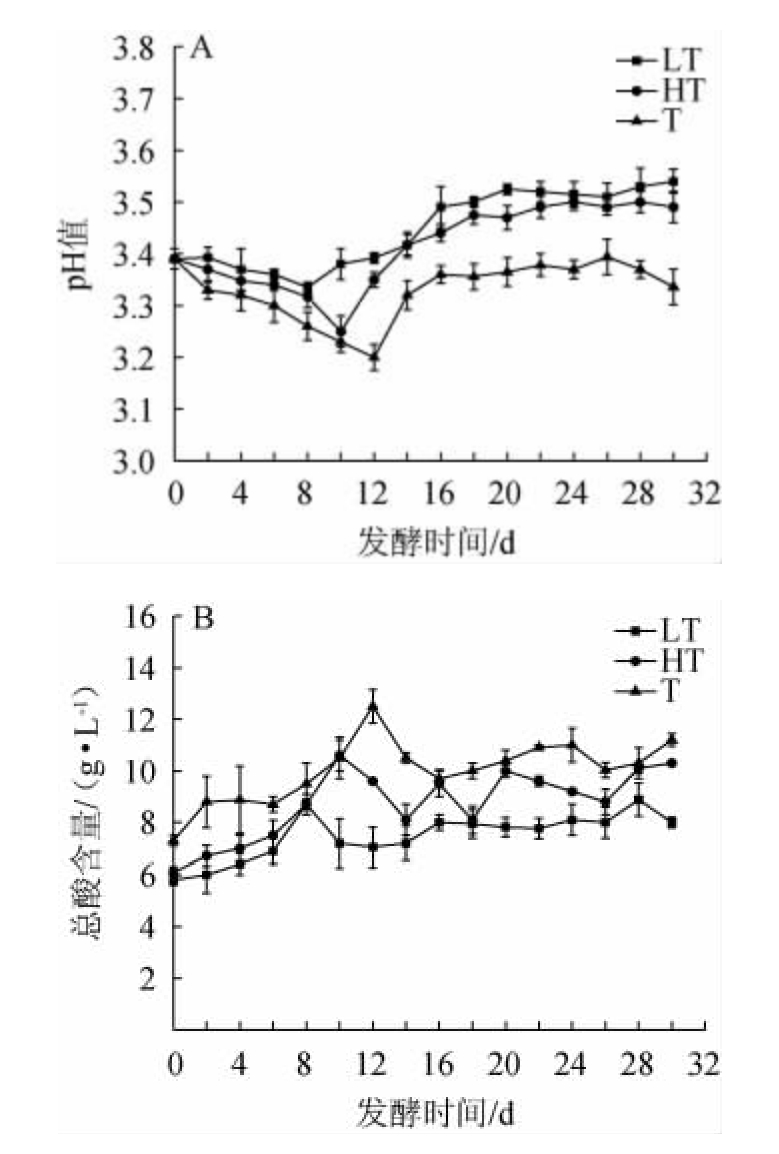
图2 3种蓝莓果酒发酵过程中pH值(A)和总酸含量(B)的变化
Fig.2 Changes of pH (A) and total acid contents (B) during the fermentation of 3 blueberry fruit wines
由图2A可知,LT组、HT组、T组蓝莓果酒的pH值均呈先下降后上升的趋势,LT组、HT组、T组蓝莓果酒的pH值分别于8 d、10 d、12 d到达最低值,此时,pH值分别为3.34±0.01、3.25±0.03、3.20±0.02。当发酵完成时,LT组、HT组、T组蓝莓果酒的pH值分别为3.54±0.02、3.49±0.03、3.33±0.03。由图2B可知,3种蓝莓果酒的总酸含量均整体呈先升高后下降的趋势,LT组、HT组、T组蓝莓果酒的总酸含量分别于8 d、10 d、12 d到达最高值,此时,总酸含量分别为(8.70±0.40)g/L、(10.60±0.60)g/L、(12.50±0.65)g/L。发酵完成时,LT组、HT组、T组蓝莓果酒的总酸含量分别为(8.00±0.20)g/L、(10.30±0.10)g/L、(11.20±0.25)g/L。
3种蓝莓果酒在前发酵期(0~12 d),原料自身含有的有机酸在酒精的作用下溶出,同时发酵液中酵母菌碳源供应充足,产酸菌及酵母菌生长能力旺盛,会产生大量醋酸、乳酸等酸类物质[19],故总酸含量增加。后发酵期间(13~30d)由于发酵液中的有机酸被氧化分解、形成脂类、被菌群作为碳源消耗,使总酸含量有所回落[21]。LT发酵方式的产酸量低于其他两种发酵方式,因此,采用LT发酵方式制作蓝莓果酒不仅可使其口感不粗涩,也可减小果酒降酸工艺操作的压力。
2.1.3 总糖和酒精度的变化
蓝莓果酒发酵过程中总糖含量和酒精度的变化情况不仅反映出酵母菌对糖分的利用和酒精的产生情况,也是体现蓝莓果酒发酵进程的重要标志[22],3种蓝莓果酒发酵过程中总糖含量和酒精度的变化见图3。

图3 3种蓝莓果酒发酵过程中总糖含量(A)和酒精度(B)的变化
Fig.3 Changes of total sugar contents (A) and alcohol content (B)during the fermentation of 3 blueberry fruit wines
由图3A可知,在前发酵期(0~12 d),蓝莓果酒中的总糖含量呈快速下降趋势;随着发酵进入后发酵期(13~30 d),总糖含量的下降趋势趋于平缓,其原因可能是,在前发酵期,酵母菌代谢活力旺盛,糖类物质被大量消耗用于酵母的生长繁殖和酒精发酵[23],在后发酵期,酵母菌进入生长平稳期,糖分利用率减缓,且随着酒精含量上升,酵母菌活力也受到了乙醇胁迫[24]。蓝莓果酒在发酵过程中,葡萄糖、果糖经过糖酵解途径生成丙酮酸,经丙酮酸脱羧酶(pyruvate decarboxylase,PDC)催化下生产乙醛,释放CO2,乙醛在乙醇脱氢酶(alcohol dehydrogenase,ADH)作用下生产乙醇[25]。由图3B可知,随着发酵时间的延长,酒精度呈上升趋势,在前发酵期(0~12 d),糖酵解的反应进程加快,酒精度增幅较大,在后发酵期(13~30 d),酒精度的增速变缓,这是由于酵母菌的活性较低致使耗糖速度降低的缘故[26]。最终3种发酵方式所制备蓝莓果酒的酒精度在10%vol~11%vol范围内,符合农业行业标准NY/T1508—2017《绿色食品果酒》的限量标准[27]。鉴于LT组制得蓝莓果酒的总糖含量最低,酒精度含量最高,所以选择LT发酵方式适合酿造蓝莓果酒。
2.1.4 花色苷含量的变化
3种蓝莓果酒发酵过程中花色苷含量的变化见图4。
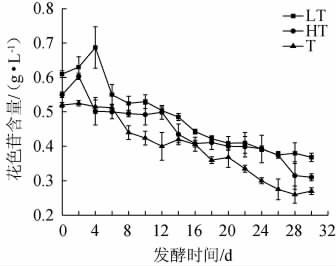
图4 3种蓝莓果酒发酵过程中花色苷含量的变化
Fig.4 Changes of anthocyanin content during the fermentation of 3 blueberry fruit wines
由图4可知,3种蓝莓果酒中的花色苷含量呈先升高后下降的趋势。其中,LT组、HT组、T组蓝莓果酒分别在4 d、2 d、2 d时,花色苷含量达到最高值,分别为(0.68±0.06)g/L、(0.60±0.01)g/L、(0.53±0.01)g/L。3种蓝莓果酒花色苷含量增加的原因可能是,蓝莓果酒酒精度的增加促进蓝莓果浆中酚类物质和花色苷的析出[28];随后蓝莓果酒花色苷含量下降的原因可能是,酿酒酵母在发酵期间的代谢活跃,一些花色苷被耐低温酵母等微生物降解和转化[29]。刘书晶等[30]研究表明,桑葚酒花色苷含量发酵期间呈先升后降的趋势,其认为原因主要在于酵母在发酵初期间产生的β-葡萄糖苷酶水解花色苷的糖苷键,使得在发酵后期花色苷含量大幅度下降。3种发酵方式中,发酵完成时,LT制备的蓝莓果酒中花色苷含量最高,为(0.37±0.01)g/L,故选择LT发酵方式有利于保留蓝莓果酒花色苷。
2.2 3种蓝莓果酒发酵过程中酚类物质的动态变化
2.2.1 总酚和总黄酮类化合物含量的变化
3种蓝莓果酒发酵过程中总酚和总黄酮含量的变化见图5。

图5 3种蓝莓果酒发酵过程中总酚(A)及总黄酮(B)含量的变化
Fig.5 Changes of total phenol (A) and total flavonoids (B) contents during the fermentation of 3 blueberry fruit wines
由图5A可知,LT组、HT组、T组蓝莓果酒的总酚含量在发酵期间均呈先上升后下降的趋势,其总酚含量分别在8 d、8 d、12 d达到最大值,分别为(4.62±0.12)g/L、(4.08±0.13)g/L、(4.63±0.09)g/L。当发酵完成时,LT组、HT组、T组蓝莓果酒的总酚含量分别为(3.66±0.08)g/L、(3.42±0.14)g/L、(2.75±0.22)g/L,T组蓝莓果酒的总酚含量最低,其原因可能是,前发酵后进行皮渣分离带走酒体固相中的部分酚类物质。3种蓝莓果酒发酵初期,一些大分子酚类物质逐渐被微生物分解为小分子酚类物质[31],导致总酚含量增加,而发酵后期,酚类化合物发生非酶促反应,并进一步的聚合,导致总酚含量下降[32]。LT发酵方式蓝莓果酒酚类物质含量在整个发酵过程中保持在3.60~4.70 g/L,变化幅度较小,酒体状态平稳,LT发酵方式有利于保留蓝莓果酒的酚类物质。
由图5B可知,LT组、HT组、T组蓝莓果酒的总黄酮含量在发酵期间均呈先上升后下降的趋势,其总黄酮含量分别在6 d、8 d、12 d达到最大值,分别为(4.03±0.17)g/L、(3.51±0.12)g/L、(3.67±0.15)g/L。在后发酵期总黄酮含量下降,可能是发酵时间过长,总黄酮发生非酶促反应,进一步聚合[33]。发酵完成时,总黄酮含量由高到低排序的发酵方式为LT>HT>T,故选择LT发酵方式有利于保留总黄酮。
2.2.2 原花青素含量的变化
3种蓝莓果酒发酵过程中原花青素含量的变化见图6。
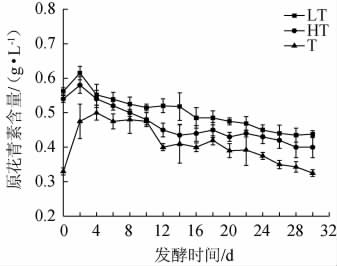
图6 3种蓝莓果酒发酵过程中原花青素含量的变化
Fig.6 Changes of proanthocyanidin contents during the fermentation of 3 blueberry fruit wines
由图6可知,LT组、HT组、T组蓝莓果酒的原花青素含量呈先升高后下降的趋势,其原花青素花青素含量分别在2 d、2 d、4 d时达到最大值,分别为(0.62±0.02)g/L、(0.58±0.02)g/L、(0.50±0.02)g/L。发酵完成时,LT清汁发酵方式蓝莓果酒原花青素含量最高。原花青素含量升高的原因可能是由于蓝莓果酒的浸提作用,可充分溶出原花青素,但随着发酵时间延长,受酒体pH值及温度变化的影响,原花青素发生降解[34],原花青素含量下降。同时T发酵方式在13 d时进行皮渣分离,带走了原花青素含量较高的果皮果肉泥等,致使T发酵蓝莓果酒的原花青素含量低于其他两种发酵方式。LT发酵条件较温和,不仅可以减少酵母对一些原花青素的破坏,同时又有利于原花青素的保存[35],故LT发酵方式制得的蓝莓果酒中原花青素含量要高于其他两种发酵方式。
2.3 3种蓝莓果酒发酵过程中抗氧化能力的动态变化
蓝莓果实中的酚类物质含有多羟基结构,可提供氢原子和电子转移使自由基变为稳定物质,还可螯合金属离子,抑制金属离子发生自由基反应[28],从而起到抗氧化作用。3种蓝莓果酒发酵过程中抗氧化能力的变化见图7。
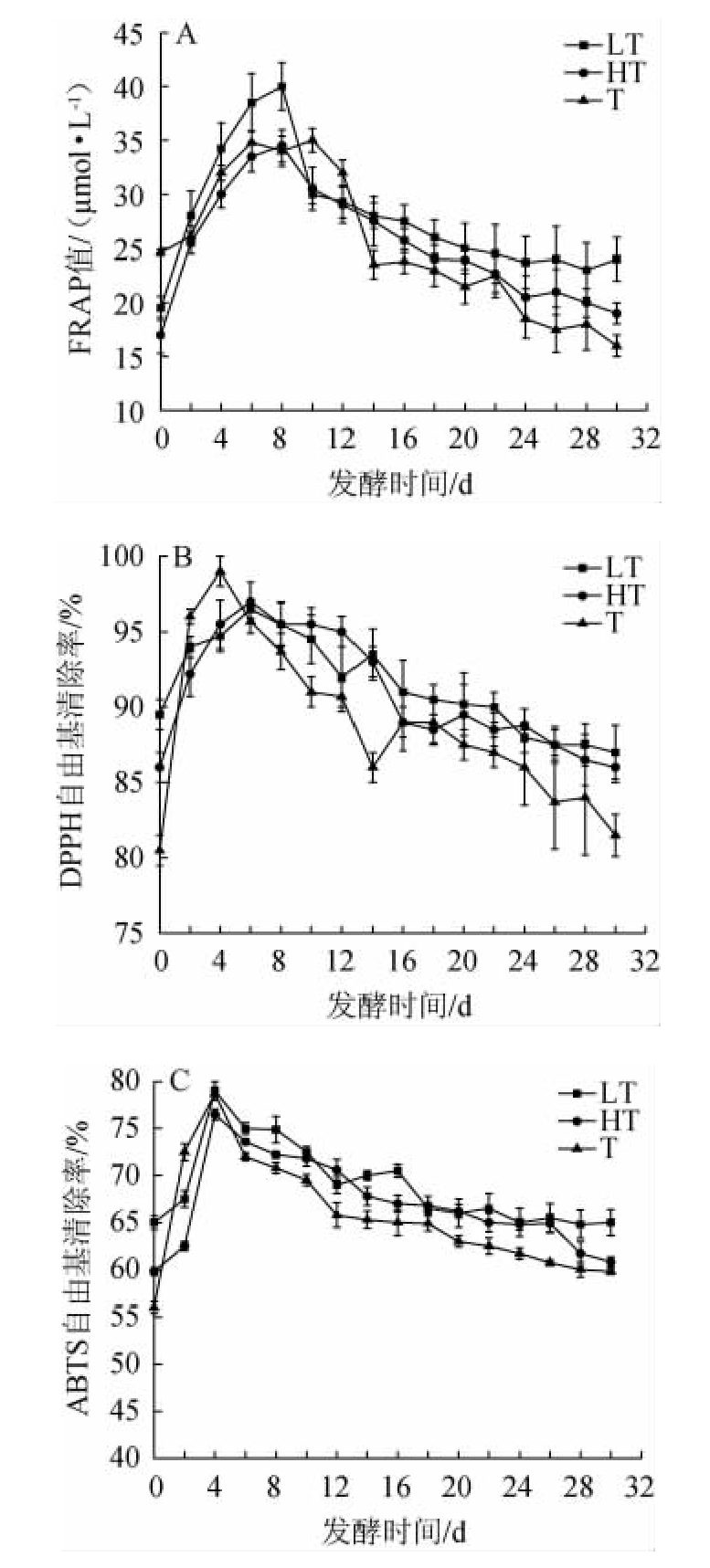
图7 3种蓝莓果酒发酵过程中FRAP值(A)、DPPH(B)及ABTS(C)自由基清除率的变化
Fig.7 Changes of FRAP value (A),scavenging rates of DPPH (B)and ABTS (C) free radical during the fermentation of 3 blueberry fruit wines
由图7A可知,随着发酵时间的延长,3种蓝莓果酒的FRAP值、DPPH自由基清除能力、ABTS自由基的清除能力呈先上升后下降的趋势,LT组、HT组、T组蓝莓果酒FRAP值分别在8 d、8 d、10 d时达到最大值,分别为40.00±2.20、34.50±1.50、35.00±1.10。当发酵结束时,其FRAP值分别为24.00±2.00、19.00±1.00、16.00±1.00。由图7B可知,LT组、HT组、T组蓝莓果酒的DPPH自由基清除率分别在6 d、6 d、4 d时达到最大值,分别为(96.50±0.60)%、(97.00±1.30)%、(99.00±1.00)%。当发酵结束时,其DPPH自由基清除率分别为(87.00±1.80)%、(86.00±1.00)%、(81.50±1.40)%;由图7C可知,LT组、HT组、T组蓝莓果酒ABTS自由基清除能力均在4 d时达到最大值,分别为(79.00±1.00)%、(76.50±0.60)%、(78.70±0.70)%。当发酵结束时,其ABTS自由基清除能力分别为(65.00±1.40)%、(60.80±0.50)%、(59.80±0.30)%。发酵结束时LT发酵方式对ABTS自由基清除能力是T发酵方式的1.08倍(P<0.05),说明LT发酵制备的蓝莓果酒对ABTS自由基清除能力更高。发酵结束时,抗氧化能力由高到低的发酵方式依次为LT>HT>T,综合考虑蓝莓果酒的功能性质,所以选择LT发酵方式酿造蓝莓果酒。
2.4 蓝莓果酒花色苷、酚类物质与抗氧化能力的相关性分析
采用Person法进行3种蓝莓果酒发酵过程中花色苷、酚类物质、原花青素与抗氧化活性的的相关性进行分析,结果见表1。
表1 蓝莓果酒中活性成分与抗氧化能力相关性分析
Table 1 Correlation analysis of active ingredients and antioxidant capacity of blueberry fruit wines

注:“**”表示极显著相关(P<0.01)。
由表1可知,总酚、总黄酮、花色苷和原花青素与总抗氧化能力、DPPH自由基清除能力、ABTS自由基清除能力均呈现极显著相关(P<0.01),这说明总酚、总黄酮、花色苷和原花青素有助于蓝莓果酒的抗氧化性,且总酚与总抗氧化能力的相关性最好,相关系数为0.892。曹玉玺[36]研究结果表明,杨梅酒发酵过程中总酚含量与抗氧化活性之间的相关性较好。因此,可通过酚类化合物含量来预测不同工艺蓝莓果酒的抗氧化能力。
3 结论
本研究比较了3种不同发酵方式制备蓝莓果酒在发酵期间酒体常规理化指标及抗氧化能力的动态变化。结果表明,对比3种发酵方式,LT发酵方式所制蓝莓果酒的品质较好,酚类物质含量和抗氧化能力均高于其他两种。因此,LT清汁发酵方式最有利于蓝莓果酒品质和功能的提升,故在蓝莓果酒的实际生产中可优先选择此发酵工艺技术。本研究为蓝莓果酒的产业化开发提供技术参考。
[1]李广伟,贾淇舒,令狐克琴,等.蓝莓-酸樱桃复合果醋的醋酸发酵工艺优化及抗氧化性研究[J].中国酿造,2022,41(3):180-186.
[2]张星,毕金峰,陈芹芹,等.蓝莓-蓝靛果复合冻干粉贮藏期品质及加工特性[J].食品科学,2022,43(17):240-247.
[3]袁文艳,胡佳星,张璐瑶,等.3种不同酵母产蓝莓酒风味物质的研究[J].中国酿造,2020,39(7):173-177.
[4]成正龙,王千存,彭涛,等.几种浸渍方式对葡萄酒酒质影响探讨[J].中国酿造,2012,31(6):150-152.
[5]杨旭,陈亮,辛秀兰,等.果汁发酵和带渣发酵蓝靛果酒香气成分分析[J].食品科学,2014,35(12):115-119.
[6]徐雯.蓝莓酒发酵过程中关键成分的特性研究[D].常州:常州大学,2021.
[7]胡品.不同制备工艺对蓝莓酒品质及抗氧化能力的影响研究[D].广州:仲恺农业工程学院,2018.
[8]袁晔.蓝莓果酒酿造工艺及其酚类物质变化研究[D].南京:南京农业大学,2012.
[9]刘忠义,欧昌荣,汤海青,等.3,5-二硝基水杨酸法测定葡萄酒中总糖含量的条件优化[J].核农学报,2013,27(11):1717-1723.
[10]中华人民共和国国家卫生和计划生育委员会.GB 5009.225—2016食品安全国家标准酒中乙醇浓度的测定[S].北京:中国标准出版社,2016.
[11]陆卿卿.蓝莓汁中花色苷稳定性及抗氧化活性的研究[D].南京:南京农业大学,2013.
[12]吕俊丽,游新勇,任志龙,等.酶解水溶剂法提取莜麦多酚的工艺研究[J].中国粮油学报,2017,32(11):123-127.
[13]叶松华,王晓燕,杨莹莹,等.黄刺玫果中总黄酮的提取工艺研究[J].山西医科大学学报,2013,44(7):535-538.
[14]高洁.黑苦荞麦壳原花青素分离纯化、降解及其功能性质研究[D].郑州:河南工业大学,2022.
[15]HUR S J,LEE S Y,KIM Y C,et al.Effect of fermentation on the antioxidant activity in plant-based foods[J].Food Chem,2014,160:346-356.
[16]黎英,曾珍清,张薇,等.大孔树脂纯化红腰豆总黄酮的工艺优化及其体外抗氧化活性比较[J].中国粮油学报,2017,32(11):128-136.
[17]张乃珣,尹红力,赵鑫,等.红松多酚与真菌多糖联合清除ABTS自由基活性比较[J].北京林业大学学报,2016,38(10):104-111.
[18]顾魁.蓝靛果酒酿造过程成分和色度变化[D].大连:大连工业大学,2018.
[19]黄晓杰,柴哲,杨钟燕,等.蓝莓酒发酵过程中抗氧化物质变化规律研究[J].食品工业科技,2013,34(17):103-105,109.
[20]王行,张海宁,马永昆,等.蓝莓酒发酵过程中酚类物质动态变化及其抗氧化活性研究[J].现代食品科技,2015,31(1):90-95.
[21]易媛,赵敏惠,左勇,等.桑葚酵素发酵过程中活性物质与抗氧化能力的相关性研究[J].食品与发酵工业,2022,48(9):117-122.
[22]康明丽,潘思轶,范刚,等.柑橘果酒酿造过程中挥发性风味化合物的变化[J].食品科学,2015,36(18):155-161.
[23]李巍巍,郭彪,焦玉晗,等.冷冻桑葚果酒发酵过程中理化性质、抗氧化活性及香气物质形成变化分析[J].食品科技,2022,47(3):77-85.
[24]张文文,白梦洋,吴祖芳,等.果酒酵母菌混合发酵的研究进展[J].食品科学,2018,39(19):252-259.
[25]WATTANAKUL N,MORAKUL S,LORJAROENPHON Y,et al.Integrative metabolomics-flavoromics to monitor dynamic changes of'Nam Dok Mai'mango(Mangifera indica Linn)wine during fermentation and storage[J].Food Biosci,2020,35:100549.
[26]杨艳丽,杨宇航,王璐瑶,等.低度柠檬酒在发酵过程中的品质变化[J].食品与发酵工业,2022,48(17):108-115.
[27]中华人民共和国农业部.NY/T 1508—2017 绿色食品果酒[S].北京:中国标准出版社,2017.
[28]吴梦.发酵型桑椹酒酚类物质、抗氧化能力及澄清效果的研究[D].镇江:江苏大学,2019.
[29]张新蕊.桑葚酒发酵过程中特征风味分析和体外抗氧化活性研究[D].沈阳:沈阳农业大学,2020.
[30]刘书晶,吴彩娥,范龚健,等.桑葚酒发酵期间花色苷及抗氧化活性变化[J].食品与生物技术学报,2018,37(6):624-631.
[31]叶盼,吴慧,王德纯,等.发酵苹果汁的抗氧化性能变化[J].食品与发酵工业,2016,42(4):114-119.
[32]陈亮,杨志勇,辛秀兰,等.蓝莓果酒发酵期间抗氧化成分及活性研究[J].中国酿造,2013,32(12):17-20.
[33]WICZKOWSKI W,SZAWARA-NOWAK D,TOPOLSKA J.Changes in the content and composition of anthocyanins in red cabbage and its antioxidant capacity during fermentation,storage and stewing[J].Food Chem,2015,167:115-123.
[34]王金菊,杜金华,马磊,等.蓝莓酒渣中花色苷提取工艺的优化及其稳定性的研究[J].食品与发酵工业,2009,35(9):151-156.
[35]邓山鸿.低温发酵对脐橙果酒风味物质的影响[D].南昌:南昌大学,2020.
[36]曹玉玺.杨梅发酵酒风味与护色及抗氧化活性的研究[D].宁波:宁波大学,2020.