2001年,联合国粮农组织(food and agriculture organization,FAO)和世界卫生组织(world health organization,WHO)将益生菌定义为“活的微生物,足量摄入后对宿主健康有益”[1]。在我国卫生管理部门颁发的《可用于食品的菌种名单》和《可用于婴幼儿食品的菌种名单》中符合益生菌定义的菌株主要来自于双歧杆菌属(Bifidobacterium)和乳杆菌属(Lactobacillus)[2-3]。
双歧杆菌最初由法国儿科医生TISSIER在1899年从婴儿粪便中分离得到[4]。目前经研究报道的双歧杆菌已有100多种,其中有5种符合《可用于食品的菌种名单》,可作为食品应用,包括青春双歧杆菌(Bifidobacterium adolescentis)、动物双歧杆菌(Bifidobacterium animalis)(含动物亚种和乳亚种)、两歧双歧杆菌(Bifidobacterium bifidum)、短双歧杆菌(Bifidobacterium breve)和长双歧杆菌(Bifido-bacterium longum)(含长亚种和婴儿亚种)[2-3]。近几十年来科学家对于肠道菌群的研究愈发深入,发现双歧杆菌在人类肠道普遍存在,其能够利用人类饮食中特定种类的多糖成分,且能够与肠道菌群和宿主互作[5]。双歧杆菌作为一种人类内源性菌种对健康有重要意义,其能够缓解便秘腹泻等消化道不适症状,且对炎症性肠病和肠易激综合症等疾病有一定的缓解作用,并在调节免疫、抗衰老、改善肥胖和高血脂等代谢性疾病、调节脑肠轴抗焦虑等方面发挥着重要作用[6-13]。作为婴儿肠道的开拓性定居菌,双歧杆菌对婴儿早期生命阶段的新陈代谢和免疫系统的建立是不可或缺的[14]。肠道中缺少双歧杆菌和能够利用母乳低聚糖的基因,可能会导致生命早期的系统性炎症和免疫失衡,婴幼儿源的双歧杆菌补充对早产儿肠道菌群的成熟起到促进作用[15]。而婴幼儿源的双歧杆菌对婴幼儿具有更好的亲和力,更适合用于婴幼儿益生菌产品开发[16]。
目前,我国可用于婴幼儿益生菌产品的菌株多为国外公司垄断,为开发具有中国自有知识知产权的本土菌株,本研究采用含莫匹罗星锂盐、半胱氨酸盐酸盐的MRS琼脂培养基从婴儿粪便中筛选双歧杆菌,采用形态观察、生化试验、基质辅助激光解吸电离飞行时间质谱(matrix-assisted laser desorption ionization time-of-flight mass spectrometry,MALDI-TOF MS)及全基因组测序对其进行菌种鉴定,并对其耐酸、耐胆盐能力、抗生素敏感性和安全性进行分析,以期为开发适用于婴幼儿的肠道调节益生菌产品提供了理论基础。
1 材料与方法
1.1 材料与试剂
1.1.1 材料婴儿粪便:河北一然生物科技股份有限公司收集的健康婴儿新鲜粪便样品。
1.1.2 菌株
肠道致病性大肠埃希氏菌(Escherichia coli)、产肠毒素大肠埃希氏菌、肠道出血性大肠埃希氏菌、肠道集聚性大肠埃希氏菌、肠道侵袭性大肠埃希氏菌、产志贺毒素大肠埃希氏菌、福氏志贺菌(Shigella flexneri)、鲍氏志贺菌(Shigella boydii)、宋内志贺菌(Shigella sonnei)、痢疾志贺菌(Shigella dysenteriae)、金黄色葡萄球菌(Staphylococcus aureus)、肠炎沙门氏菌(Salmonella enteritidis)、铜绿假单胞菌(Pseudomonas aeruginosa)、脱硫弧菌脱硫亚种(Desulfovibrio desulfuricans subsp.desulfuricans):北京北纳创联生物技术研究院。
1.1.3 培养基
MRS肉汤(琼脂)培养基、营养肉汁培养基、哥伦比亚肉汤培养基、莫匹罗星锂盐(分析纯):北京陆桥技术有限公司。
1.1.4 试剂
阿莫西林/克拉维酸、氨苄西林、美罗培南、四环素、氯霉素、头孢噻肟、克林霉素、莫西沙星和甲硝唑(均为分析纯):杭州微生物试剂有限公司;细菌基因组提取试剂盒、X-Gal、2×Taqmaster mix:天根生化科技有限公司;通用引物27F、1492R:上海生工生物工程股份有限公司;厌氧袋:美国Thermo公司;厌氧菌及棒状杆菌鉴定(anaerobic and Corynebacteria identification card,ANC)卡片:法国生物梅里埃公司;α-氰基-4-羟基肉桂酸(α-cyano-4-hydroxycinnamic acid,HCCA):德国布鲁克公司;甲酸(分析纯):北京百灵威科技有限公司;Dneasy Blood&Tissue Kit、Qubilt dsBR Assay kit:美国invitrogen公司;Lysozyme酶(酶活力>20 kU/mg):上海翊圣生物科技有限公司;Triton X-100、硫代硫酸钠、L-半胱氨酸硫酸盐(均为分析纯):美国sigma公司;其他试剂均为国产分析纯。
1.1.5 实验动物
无特定病原体(specific pathogen free,SPF)级KM小鼠,雌雄各60只,饲养于中国食品药品检定研究院实验动物房(许可证号为SYXK(京)2016-0004)。
1.2 仪器与设备
SW-CJ-2FD生物安全柜:苏州安泰空气技术有限公司;RapifleX基质辅助激光解吸电离飞行时间质谱仪:美国布鲁克科技有限公司;Biolog MicroStation全自动微生物分析系统:美国Biolog公司;FRESCO 21低温高速离心机:美国赛默飞世尔科技公司;LRH-250F生化培养箱:昆山一恒仪器有限公司。
1.3 方法
1.3.1 双歧杆菌菌株的分离及筛选
使用生理盐水将婴儿粪便样品进行10倍梯度稀释,取1 mL合适梯度的菌悬液,采用倾注法接种于含0.05 g/L半胱氨酸盐酸盐和0.05 g/L莫匹罗星锂盐的MRS琼脂培养基,于37 ℃生化培养箱中厌氧培养24~48 h。采用接种针挑取符合双歧杆菌菌落形态的单菌落,划线接种于含0.01 g/L溴甲酚紫的MRS琼脂培养基,于37 ℃厌氧培养48 h后,将长出的单菌落进行革兰氏染色,通过显微镜观察选出符合双歧杆菌典型形态的菌株。
1.3.2 双歧杆菌菌株的鉴定
生理生化鉴定:将筛选菌株接种于含0.05 g/L半胱氨酸盐酸盐的MRS琼脂培养基平板,37 ℃条件下厌氧培养48 h。挑取单菌落接种于MRS琼脂培养基,在37 ℃条件下厌氧培养48 h。无菌棉签刮取部分菌落,制成9×108 CFU/mL的菌悬液,使用VITEK 2厌氧菌及棒状杆菌鉴定卡ANC及全自动微生物分析系统对其进行鉴定。
基质辅助激光解吸电离飞行时间质谱鉴定[17-18]:将筛选菌株接种于含0.05 g/L半胱氨酸盐酸盐的MRS琼脂培养基平板,37 ℃条件下厌氧培养48 h。挑取单菌落在相同条件下进行二次培养。挑取单菌落,在质谱仪靶板上涂布,使用1μL体积分数70%甲酸-水溶液覆盖,在室温条件下自然晾干后覆盖1 μL HCCA溶液,再次晾干后放入质谱仪进行鉴定。
全基因测序鉴定[19]:将筛选菌株接种于含0.05 g/L半胱氨酸盐酸盐的MRS琼脂培养基平板,37 ℃条件下厌氧培养48 h。挑取单菌落接种于含0.05 g/L半胱氨酸盐酸盐的MRS肉汤培养基,在(36±1)℃培养48 h,离心,收集菌体。使用Dneasy Blood&Tissue Kit提取基因组脱氧核糖核酸(deoxyribonucleic acid,DNA),并使用Qubilt dsBR Assay kit测定DNA浓度,当提取的DNA总量≥2 μg时,使用Illumina NovaSeq6000平台进行全基因组测序鉴定。采用Readfq软件对测序结果的原始数据进行过滤处理,采用Fqcheck软件统计有效数据的Q20、Q30值,采用基于K-mer统计的分析方法估计基因组大小,使用SOAPdenovo(v2.04)软件进行组装,然后使用CISA软件进行整合,采用Gapclose软件对初步组装结果进行优化和补洞得到最终组装结果。使用Center for Genomic Epidemiology网站(网址:http://www.genomicepidemiology.org/)中的KmerFinder 3.1将组装后的contig文件进行分析鉴定。
1.3.3 抑菌能力的测定
选取大肠埃希氏菌、志贺氏菌和沙门氏菌等14种致病菌作为指示菌,使用牛津杯法测定菌株对致病菌的抑制效果[20]。筛选菌株采用改良MRS肉汤培养基培养24 h,大肠埃希氏菌、志贺氏菌、肠炎沙门氏菌和铜绿假单胞菌采用营养肉汁培养基培养24 h,脱硫弧菌脱硫亚种采用哥伦比亚肉汤培养基(添加5%脱纤维羊血)培养24 h。在无菌培养皿中加入10 mL 20 g/L的琼脂,凝固后放入牛津杯,取1 mL指示菌菌液(菌体浓度约为1℃CFU/mL)与相应的培养基混匀倒入培养皿中,凝固后取出牛津杯,将100 μL筛选菌株菌悬液(1×108 CFU/mL)加至孔中,37 ℃培养18 h,采用游标卡尺测量抑菌圈直径,当抑菌圈直径>8 mm表示有抑菌作用[21]。
1.3.4 模拟胃液和肠液实验
人工胃肠液配制:参考范颖等[22]的方法并略有改进。人工胃液由0.5%的NaCl和0.3%的胃蛋白酶配制,用1 mol/L HCl溶液调节pH至2.5,使用1 L容量瓶定容,并使用0.22 μm滤膜过滤后冷藏备用。人工肠液由胰腺液和胆汁液以2∶1混合得到,其中胰腺液由碳酸氢钠(1.1 g/100 mL)、NaCl(0.2 g/100 mL)和胰蛋白酶(0.1 g/100 mL)组成;胆汁液由0.9 g/100 mL的胆盐组成。胰腺液和胆汁液均须调节pH值为8.0,并使用0.22 μm滤膜过滤后4 ℃保存。
将筛选菌株按3%(V/V)的接种量接种于含0.05 g/L半胱氨酸盐酸盐的MRS肉汤培养基中,37 ℃厌氧培养24 h,将菌液进行离心(9 000 r/min,5 min)后收集菌体,将菌体用10 mL无菌磷酸缓冲液(phosphate buffered solution,PBS)洗涤2次后重悬(5×108 CFU/mL),分别取1.0 mL的菌悬液接种至9.0 mL pH 2.5的人工胃液和9.0 mL pH 8.0的人工肠液(含0.3%胆盐),37 ℃培养2 h,采用平板计数法测定0 h和2 h的活菌数,每个试验重复3次,并计算存活率,其计算公式如下:
1.3.5 抗生素敏感性检测
参照美国临床实验室标准化协会(Clinical and Laboratory Standards Institute,CLSI)M100—2022《抗菌药物敏感性测试性能标准》测定筛选菌株对9种抗生素的敏感性。根据CLSI标准将测试结果分为耐药、中介以及敏感[23]。
1.3.6 急性毒性试验
口服急性毒性试验:取雄性和雌性小鼠各30只,平均分为菌悬液灭活组(对照组)和菌悬液组(实验组),每组各有雌性和雄性小鼠15只。以2.0 mL/100 g体质量剂量经口灌胃1次后,连续监测21 d,并对小鼠的体质量、中毒现象及死亡率进行记录[24-25]。
腹腔注射急性毒性试验:取雄性和雌性小鼠各30只,平均分为菌悬液灭活组(对照组)和菌悬液组(实验组),每组各有雌性和雄性小鼠15只。以每只小鼠注射0.2 mL的剂量注射1次后,连续监测21 d,并对小鼠的体质量、中毒现象及死亡率进行记录[24-25]。
1.3.7 数据处理
采用Excel 2019软件对试验数据进行统计整理,SPSS 24.0软件进行数据分析,使用Origin软件作图,结果以“平均值±标准差”表示,P<0.05表示差异有统计学意义。
2 结果与分析
2.1 双歧杆菌菌株的分离及筛选
从婴幼儿粪便样本中分离得到一株能够在含0.05 g/L半胱氨酸盐酸盐和0.05 g/L莫匹罗星锂盐的MRS固体培养基生长且产酸最强的双歧杆菌菌株,编号为BAL531。
2.2 菌株BAL531的鉴定
2.2.1 形态观察
菌株BAL531在含0.05 g/L半胱氨酸盐酸盐MRS固体培养基上37 ℃厌氧培养48 h后的菌落及细胞形态见图1。由图1可知,菌落呈乳白色,圆形,表面湿润,不透明且边缘整齐。显微镜观察发现菌体呈不规则杆状,顶端稍膨大,菌体大小为(0.6~0.8 μm)×(1.1~2.5 μm),单个或成对排列,革兰氏阳性。

图1 菌株BAL531的菌落(A)及细胞(B)形态
Fig.1 Colony (A) and cell (B) morphology of strain BAL531
2.2.2 生理生化试验
菌株BAL531的生理生化试验结果见表1。由表1可知,菌株BAL531能够利用L-脯氨酸芳胺、丙氨酸-苯丙氨酸-脯氨酸芳胺、蔗糖、5-溴-4-氯-3-吲哚-α-D-半乳糖苷、麦芽三糖、D-核糖、亮氨酸芳胺、D-葡萄糖、七叶苷、β-半乳糖吡喃糖苷吲哚酚、β-D-岩藻糖苷、苯丙氨酸芳胺、酪氨酸芳胺、D-麦芽糖、5-溴-4-氯-3-吲哚-β-D-葡萄糖苷酸、α-阿拉伯糖苷,但不能利用D-半乳糖、尿素、5-溴-4-氯-3-吲哚-α-D-甘露糖苷、L-吡咯烷酮芳胺、熊果苷、5-溴-4-氯-3-吲哚-α-D-葡萄糖苷酸、β-甘露糖苷、α-L-岩藻糖苷、苯基磷酸盐、Ellman试剂、D-纤维二糖、D-甘露糖、N-乙酰-D-氨基葡萄糖、精氨酸、磷酸、α-L-阿拉伯糖苷、丙酮酸、5-溴-4-氯-3-羟基吲哚-β-N-乙酰-葡糖胺、L-阿拉伯糖、D-木糖。通过VITEK 2厌氧菌及棒状杆菌鉴定卡ANC和全自动微生物分析系统得到该菌株与乳双歧杆菌(Bifidobacterium lactis)的相似度达92.0%,初步鉴定为乳双歧杆菌(Bifidobacterium lactis)。
表1 菌株BAL531的生理生化试验结果
Table 1 Physiological and biochemical tests results of stain BAL531

注:“+”表示结果呈阳性;“-”表示结果呈阴性。
2.2.3 基质辅助激光解吸电离飞行时间质谱鉴定结果
基质辅助激光解吸电离飞行时间质谱鉴定比对值满分为3.0,比对值≥2.0为鉴定到种水平且具有高可信度[17]。通过基质辅助激光解吸电离飞行时间质谱分析,菌株BAL531与乳双歧杆菌(Bifidobacterium lactis)DSM 10140的比对值为2.275,因此,将该菌株鉴定为乳双歧杆菌(Bifidobacterium lactis)。
2.2.4 全基因组测序分析结果
采用KmerFinder 3.1对菌株BAL531的全基因组序列进行分析,结果见表2。由表2可知,菌株BAL531与乳双歧杆菌B420的全基因组信息(NC-017866.1)相似度达99.97%,结合形态观察、生理生化试验、基质辅助激光解吸电离飞行时间质谱鉴定结果,最终将菌株BAL531鉴定为乳双歧杆菌(Bifidobacterium lactis)。
表2 全基因组序列分析结果
Table 2 Result of whole genome sequence analysis

2.3 乳双歧杆菌BAL531的抑菌能力
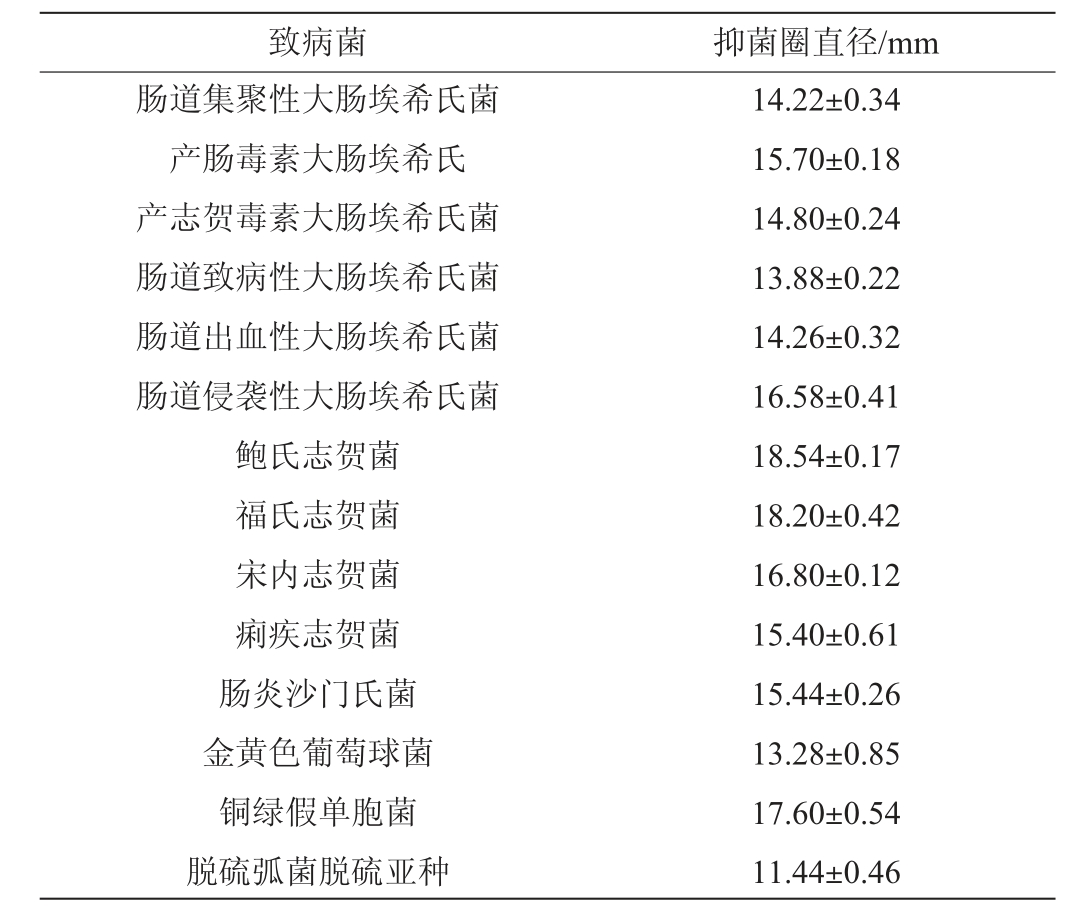
乳双歧杆菌BAL531对14种肠道致病菌的抑菌能力见表3。由表3可知,乳双歧杆菌BAL531对6种致泻性大肠埃希氏菌的抑菌圈直径为(13.88±0.22)~(16.58±0.41)mm,对4种志贺氏菌的抑菌圈直径为(15.4±0.61)~(18.54±0.17)mm,略高于致泻性大肠埃希氏菌,对金黄色葡萄球菌、肠炎沙门氏菌、铜绿假单胞菌和脱硫弧菌脱硫亚种的抑菌圈直径分别为(13.28±0.85)mm、(15.44±0.26)mm、(17.60±0.54)mm和(11.44±0.46)mm。说明该菌株对常见肠道致病菌均有一定抑制能力,具有较广泛的抑菌谱。
表3 乳双歧杆菌BAL531对肠道致病菌的抑菌能力测定结果
Table 3 Determination results of antimicrobial capability of Bifidobacterium lactis BAL531 against intestinal pathogenic bacteria
2.4 乳双歧杆菌BAL531的胃肠道耐受能力
乳双歧杆菌BAL531在经模拟胃肠液处理后的存活率见图2。由图2可知,乳双歧杆菌BAL531在pH 2.5的人工胃液培养2 h后,活菌数略有上升,存活率为(130.30±5.38)%;在人工肠液中培养2h,活菌数降低,存活率为(55.50±1.81)%。说明乳双歧杆菌BAL531能够耐受胃酸和胆盐损伤,具有在胃肠道定植的潜力。
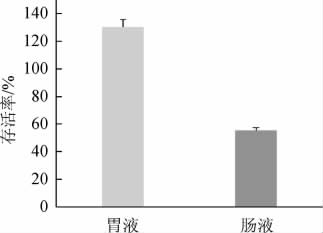
图2 乳双歧杆菌BAL531经模拟胃肠液处理后的存活率
Fig.2 Survival rates of Bifidobacterium lactis BAL531 after simulated gastrointestinal fluid treatment
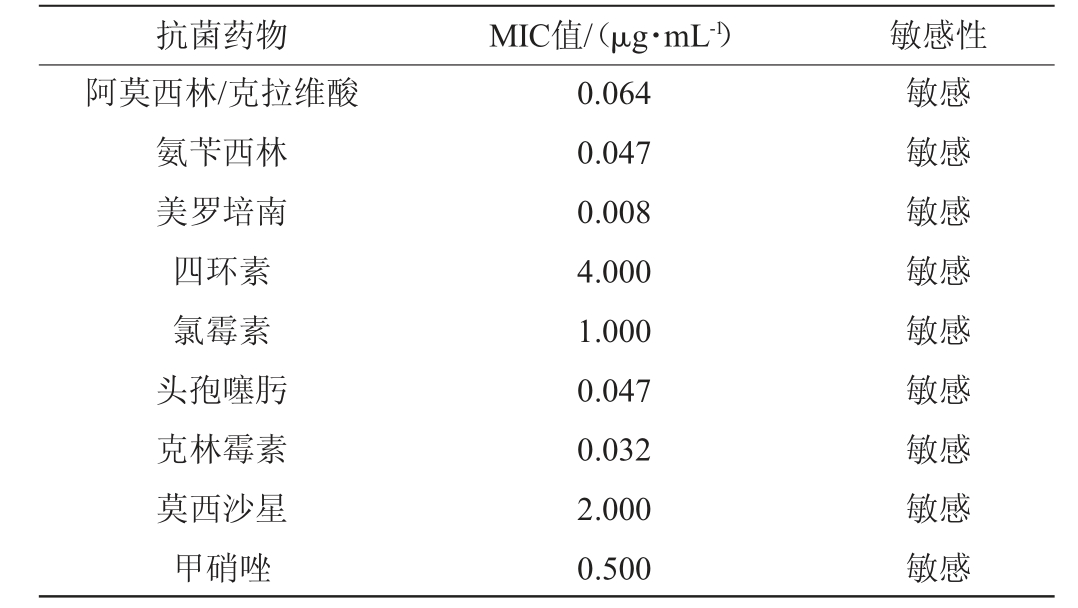
2.5 乳双歧杆菌BAL531对抗生素的耐药性
如果菌株携带抗生素耐药性基因,在食用后可能会出现转移到致病菌的现象[26]。乳双歧杆菌BAL531对抗生素的耐药性见表4。由表4可知,乳双歧杆菌BAL531对常见的9种抗生素均敏感,最低抑菌浓度(minimum inhibitory concentration,MIC)值为0.008~4.000 μg/mL,不具备耐药性,说明该菌株存在常见抗生素耐药基因的概率较低。
表4 乳双歧杆菌BAL531对抗生素的耐药性结果
Table 4 Results of antibiotic resistance of Bifidobacterium lactis BAL531
2.6 乳双歧杆菌BAL531的急性毒性实验
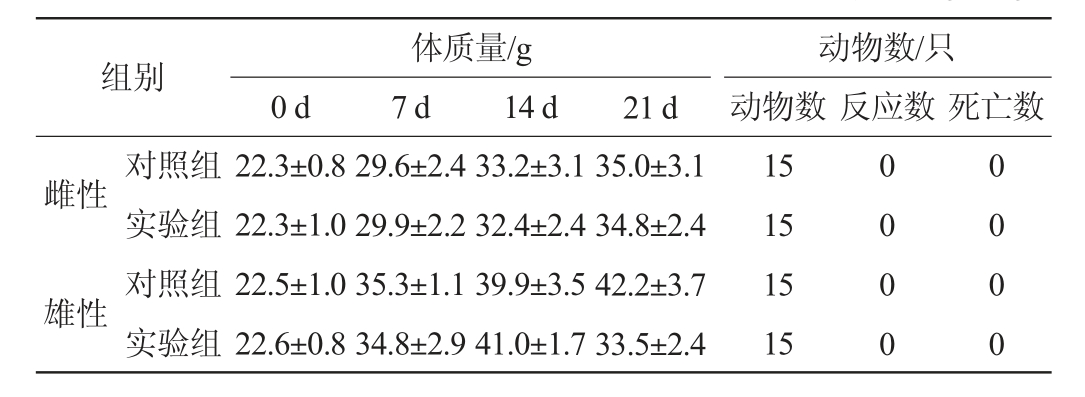
2.6.1 口服乳双歧杆菌BAL531急性毒性实验结果
乳双歧杆菌BAL531经口灌胃对小鼠的影响见表5。由表5可知,实验组和对照组间相比较,小鼠体质量和死亡率均未见显著性差异(P>0.05),说明口服乳双歧杆菌BAL531菌悬液无急性毒性。
表5 乳双歧杆菌BAL531经口灌胃对小鼠的影响
Table 5 Effect of Bifidobacterium lactis BAL531 on mice by oral gavage
2.6.2 腹腔注射乳双歧杆菌BAL531急性毒性实验结果
乳双歧杆菌BAL531经腹腔注射对小鼠的影响见表6。由表6可知,实验组与对照组相比较,小鼠体质量和死亡率均未见显著性差异(P>0.05),说明腹腔注射乳双歧杆菌BAL531菌悬液无急性毒性。
表6 乳双歧杆菌BAL531经腹腔注射对小鼠的影响
Table 6 Effect of Bifidobacterium lactis BAL531 on mice by intraperitoneal injection
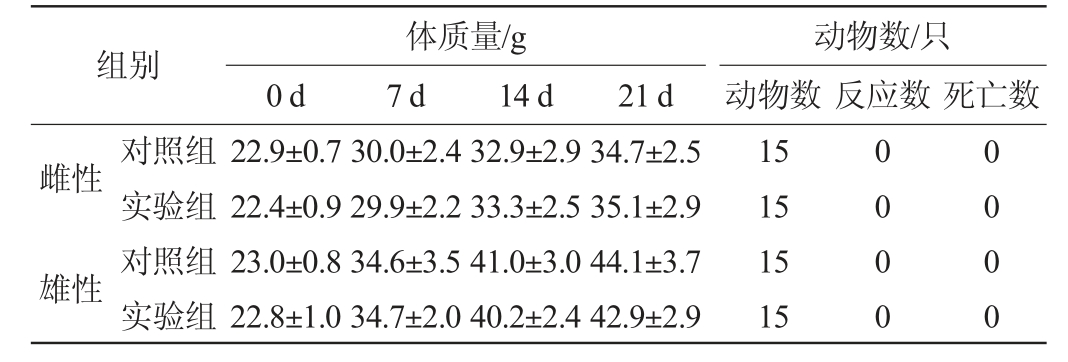
综上,小鼠无论经口灌胃还是腹腔注射乳双歧杆菌BAL531菌悬液后,受试小鼠均未见毒性反应或者出现死亡现象,由此可见,乳双歧杆菌BAL531具备一定的安全性。
3 讨论
DELCARU C等[27]研究发现,儿童细菌感染性腹泻以致泻性大肠埃希氏菌和志贺氏菌为主,且通过研究分离的12株双歧杆菌的抑菌活性发现,仅有部分双歧杆菌对肠道侵袭性大肠埃希氏菌和致病大肠埃希氏菌有抑菌活性。本研究筛选得到的乳双歧杆菌BAL531,其不仅对致泻性大肠埃希氏菌和志贺氏菌有较好的抑菌效果,对其他肠道致病菌如肠炎沙门氏菌、金黄色葡萄球菌、铜绿假单胞菌和脱硫弧菌都有较好的抑菌效果,说明该菌株对常见肠道致病菌有广泛的抑菌谱,这为将其开发为肠道调节益生菌产品提供了良好的基础。
对胃酸及胆盐的良好耐受能力是益生菌发挥作用的关键指标。但通常来说双歧杆菌对胃酸及胆盐的耐受能力较差,如赵志霞等[28]在母乳样品中分离出来的15株双歧杆菌经模拟胃液处理后,存活率为0.027%~20.37%,经模拟肠液处理后,存活率最高为0.302%。余萍等[29]从婴幼儿粪便中分离的乳双歧杆菌HCS04-002分别经酸、胆盐及人工胃肠液处理后存活率均在60%以上。本研究中筛选出的乳双歧杆菌BAL531在模拟胃酸中的存活率为(130.30±5.38)%;在模拟肠液中的存活率为(55.50±1.81)%,与赵志霞等[28]的研究结果存在较大差异,但与余萍等[29]的研究结果相似,这可能与菌株的来源有关,需要进一步试验验证。
2019年《中国营养学会益生菌与健康专家共识》指出,益生菌需要经过分离鉴定和安全性评价,并通过试验证明其益生功能[30]。如果菌株携带有耐药基因,则可能在服用过程中转移到肠道致病菌中并提升致病菌的耐药性[26]。有研究指出,有严重消化道损伤的病人在服用益生菌过程中可能会有菌血症发生[31-33]。本研究对乳双歧杆菌BAL531的抗生素耐受性进行研究,发现该菌株对常见抗生素敏感,这虽然不利于其在服用抗生素的患者肠道中生存,但便于控制其在体内的数量,防止菌血症等不良风险。且小鼠实验表明,该菌株经口灌胃和腹腔注射后,小鼠均未发生急性毒性,说明该菌株在体内具有良好的安全性,虽然该菌株分离自健康婴幼儿肠道,但将其应用于婴幼儿健康食品需要更严格的临床试验证明。
4 结论
本研究从健康婴儿粪便中分离筛选得到一株双歧杆菌BAL531,经鉴定,该菌株为乳双歧杆菌(Bifidobacterium lactis),其对14种常见肠道致病菌有较好的抑制效果,对9种常用抗生素敏感,经人工胃肠液处理后存活率均在55%以上,无口服及腹腔注射毒性反应。综上,乳双歧杆菌BAL531具有较好的胃肠液耐受性,并能够抑制肠道致病菌,且具有一定的安全性,可以作为一株潜在的益生菌菌株用于开发肠道调节益生菌产品。
[1]Food and Agriculture Organization of the United Nations/World Health Organization.Health and nutritional properties of probiotics in food including powder milk with live lactic acid bacteria[R].Córdoba: FAO/WHO,2001.
[2]国家卫生健康委.可用于食品的菌种名单(2022年第4号)[EB/OL].https://www.susong.gov.cn/public/2000004111/2023459261.html.
[3]国家卫生健康委.可用于婴幼儿食品的菌种名单(2022年第4号)[EB/OL].https://www.susong.gov.cn/public/2000004111/2023459261.html.
[4]CHICHLOWSKI M,SHAH N,WAMPLER J L,et al. Bifidobacterium longum Subspecies infantis(B.infantis)in pediatric nutrition:current state of knowledge[J].Nutrients,2020,12(6):1581.
[5]DERRIEN M,TURRONI F,VENTURA M,et al.Insights into endogenous Bifidobacterium species in the human gut microbiota during adulthood[J].Trends Microbiol,2022,30(10):940-947.
[6]陈昱馨,张军.双歧杆菌三联活菌联合马来酸曲美布汀治疗腹泻型肠易激综合征的临床疗效及安全性[J].临床合理用药杂志,2022,15(15):89-91.
[7]王倩,曹莹.双歧杆菌三联活菌肠溶胶囊联合蒙脱石散治疗小儿腹泻的临床效果[J].临床医学研究与实践,2022,7(17):118-121.
[8]蔡霞.双歧杆菌活菌与蒙脱石散联合治疗小儿腹泻的近期疗效观察[J].中国实用医药,2022,17(18):130-133.
[9]SABATÉ J M,IGLICKI F.Effect of Bifidobacterium longum 35624 on disease severity and quality of life in patients with irritable bowel syndrome[J].World J Gastroenterol,2022,28(7):732-744.
[10]AL-SHERAJI S H,AMIN I,AZLAN A,et al.Effects of Bifidobacterium longum BB536 on lipid profile and histopathological changes in hypercholesterolaemic rats[J].Benef Microbes,2015,6(5):661-668.
[11]ZHANG M,ZHOU L X,ZHANG S,et al. Bifidobacterium longum affects the methylation level of forkhead box P3 promoter in 2,4,6-trinitrobenzenesulphonic acid induced colitis in rats[J].Microb Pathog,2017,110:426-430.
[12]司倩,焦婷,杨树荣,等.两歧双歧杆菌缓解Ⅱ型糖尿病的效果差异及机制分析[J].食品与发酵工业,2019,45(22):12-19.
[13]JANG H M,JANG S E,HAN M J,et al.Anxiolytic-like effect of Bifidobacterium adolescentis IM38 in mice with or without immobilisation stress[J].Benef Microbes,2018,9(1):123-132.
[14]TURRONI F,MILANI C,DURANTI S,et al.Glycan utilization and cross-feeding activities by bifidobacteria[J].Trends Microbiol,2018,26(4):339-350.
[15]HENRICK B M,RODRIGUEZ L,LAKSHMIKANTH T,et al.Bifidobacteria-mediated immune system imprinting early in life[J].Cell,2021,184(15):3884-3898.
[16]HARATA G,YODA K,WANG R,et al.Species-and age/generationdependent adherence of Bifidobacterium bifidum to human intestinal mucus in vitro[J].Microorganisms,2021,9(3):542.
[17]张秋艳,唐静,祝素珍,等.基质辅助激光解吸电离飞行时间质谱分析技术在微生物鉴定与分型中的应用[J].食品安全质量检测学报,2021,12(19):7549-7555.
[18]熊强,王延斌,韩浩.双歧杆菌的分子生物学鉴定方法的比较[J].食品与发酵工业,2016,42(12):45-48.
[19]LARSEN M V,COSENTINO S,LUKJANCENKO O,et al.Benchmarking of methods for genomic taxonomy[J].J Clin Microbiol,2014,52(5):1529-1539.
[20]郭兴华,凌代文.乳酸细菌现代研究实验技术[M].北京:科学出版社,2013:161-331.
[21]张秀红,刘婷婷.具广谱抑菌活性乳酸菌的筛选[J].乳业科学与技术,2010,33(2):56-59.
[22]范颖,陈思涵,党芳芳,等.一株降胆固醇乳酸菌的筛选及其在模拟消化环境活性的研究[J].中国乳品工业,2018,46(9):4-7.
[23]WORETA A N,KEBEDE H B,TILAHUN Y,et al.Antibiotic susceptibility pattern and bacterial spectrum among patients with external eye infections at Menelik II Referral Hospital in Addis Ababa,Ethiopia[J].Infect Drug Resist,2022,15:765-779.
[24]中华人民共和国国家卫生和计划生育委员会.GB 15193.24—2014 食品安全国家标准食品安全性毒理学评价中病理学检查技术要求[S].北京:中国标准出版社,2014.
[25]戴寅,陈君石,李悠慧,等.食品安全性毒理学评价程序和方法[J].医学研究通讯,1997(12):9-10.
[26]骆慧晓,张晓婷,汪庆,等.人体肠道菌群中抗生素耐药基因的水平转移研究[J/OL].中国抗生素杂志:1-8[2022-12-20].DOI:10.13461/j.cnki.cja.007372.
[27]DELCARU C,ALEXANDRU I,PODGOREANU P,et al.Antagonistic activities of some Bifidobacterium sp.strains isolated from resident infant gastrointestinal microbiota on Gram-negative enteric pathogens[J].Anaerobe,2016,39:39-44.
[28]赵志霞,许翠,安美玲,等.宁新疆喀什地区维吾尔族母乳源双歧杆菌分离筛选及其益生特性分析[J].食品科学,2019,40(22):185-192.
[29]余萍,赵迪,张春宇,等.动物双歧杆菌乳亚种菌株HCS04-002益生特性的研究[J].中国酿造,2021,40(5):86-90.
[30]益生菌益生元与健康分会.中国营养学会益生菌与健康专家共识[EB/OL].(2019-06-25).https://www.cnsoc.org/policystand/5619202027.html.
[31]FARINA C,AROSIO M,MANGIA M,et al.Lactobacillus casei subsp.rhamnosus sepsis in a patient with ulcerative colitis[J].J Clin Gastroenterol,2001,33(3):251-252.
[32]ARPI M,VANCANNEYT M,SWINGS J,et al.Six cases of Lactobacillus bacteraemia:identification of organisms and antibiotic susceptibility and therapy[J].Scand J Infect Dis,2003,35(6-7):404-408.
[33]MEINI S,LAUREANO R,FANI L,et al.Breakthrough Lactobacillus rhamnosus GG bacteremia associated with probiotic use in an adult patient with severe active ulcerative colitis: case report and review of the literature[J].Infection,2015,43:777-781.