酸、甜、苦、咸、鲜是人的五种基础味觉,其中苦味阈值仅有0.001 6%,当苦味分子与味觉受体蛋白产生的兴奋信号抵达味觉中枢而产生苦味感知,使人产生不愉悦的感受且持续时间长[1-2]。很多苦味物质是具有良好药理功能的活性物质,但苦味不容易被消费者接受是苦味物质令人排斥的重要原因。因此,在保护苦味物质生物活性的基础上,使苦味变得适口,是食品行业有待解决的问题。呈味核苷酸对苦味、腥味等不良风味具有消杀作用,对甜味、肉味和醇厚感有增效作用[3]。呈味核苷酸中研究较多的是鸟嘌呤核苷酸(guanosine-5'-monophosphate,GMP)、次黄嘌呤核苷酸(inosine-5'-monophosphate,IMP)和腺嘌呤核苷酸(adenosine monophosphate,AMP)[4],其中核苷酸二钠(G+I)已作为新一代核苷酸类食品增鲜剂投入商业化生产并食用。此外,AMP是一种通过竞争苦味受体或截断苦味信号传递的苦味阻滞剂[5],已经作为一种新型的掩苦方法被开发,美国食品药品监督管理局(Food and Drug Administration,FDA)已批准其为合法的食品添加剂[2]。添加0~5 mmol/L腺嘌呤核苷酸(AMP)即可掩盖苦味,且不影响其他味感[6]。现有研究表明,AMP能降低咖啡因溶液的苦味[7];掩盖茶汤的苦味,且对茶汤滋味的协调性没有明显影响[8]。但AMP生产成本较高,应用受到一定限制。
目前,核苷酸的合成方法主要有化学合成法、酶解法、生物催化法和微生物发酵法[9]。化学合成法加入有机试剂会危害人体健康且副产物多;酶解法生产周期长、工艺繁琐;生物催化法生产成本高。微生物发酵法利用微生物的生物合成途径来生产核苷酸,过程易控制,副产物少,效率高且生产成本低。目前研究多采用细菌,如枯草芽孢杆菌(Bacillus subtilis)和产氨短杆菌(Brevibacterium ammoniagenes)发酵生产GMP、IMP[10-11]。关于大型真菌(是指能够形成子实体的一类高等真菌,广义上指蘑菇或蕈菌)发酵产核苷酸的研究尚有空缺。深层液体发酵具有易控制、周期短,效率高,成本低等优点,适合工业化生产[12]。大型真菌可以通过深层液体发酵获取菌丝体和高附加值的初级、次级代谢产物,如多糖、蛋白质、核酸、酶、生物碱、萜类化合物、糖醇及维生素等功能成分,具有抗瘤、抗衰老、消炎、提高免疫力等生物活性[13]。液体深层发酵的培养基组分和发酵条件可为微生物提供营养需求以及稳定的环境,对微生物的生长和代谢产物的合成有着重要的影响[14-15]。因此,本研究中筛选高产腺嘌呤核苷酸菌株,采用分子生物学技术对筛选菌株进行鉴定,并通过单因素试验及响应面试验,优化筛选菌株发酵工艺。旨在通过大型真菌得到AMP发酵液,开发一种安全、高效、稳定、廉价的掩苦发酵液,提高大型真菌代谢产物的附加值,为食品中不良风味的改善提供理论支撑。
1 材料与方法
1.1 材料与试剂
1.1.1 菌株7株大型真菌(编号为A1~A7):华南农业大学食品学院应用微生物实验室。
1.1.2 化学试剂
葡萄糖(分析纯):山东祥瑞药业有限公司;胰蛋白胨(生化试剂):北京兰杰柯科技有限公司;酵母提取物、麦芽提取物、琼脂粉(均为生化试剂):广东环凯微生物科技有限公司;玉米浆干粉(生化试剂):山东新普生物科技有限公司;硫酸镁(MgSO4)、磷酸二氢钾(KH2PO4)(均为分析纯)、可溶性淀粉(生化试剂):天津大茂化学试剂有限公司;四水硫酸锰(MnSO4·4H2O)、硫酸铵、3,5-二硝基水杨酸(dinitrosalicylic acid,DNS)(均为分析纯):成都化夏化学试剂有限公司;AMP、GMP、IMP标准品(纯度均>98%)、蔗糖(分析纯):上海源叶生物科技有限公司;丙酮酸钠(C3H3NaO3)、六偏磷酸钠(NaPO3)6(均为分析纯):北京索莱宝科技有限公司;玉米粉、黄豆粉:市售。
1.1.3 培养基
马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基:土豆去皮,切块,取200 g放锅中,加蒸馏水,煮沸20 min,四层纱布过滤,加入葡萄糖20 g,琼脂粉20 g,定容至1 000 mL。121 ℃灭菌30 min。
基础发酵培养基(用于真菌培养)采用马铃薯葡萄糖肉汤(potato dextrose broth,PDB)改良培养基:土豆去皮,切块,取200 g放锅中,加蒸馏水,煮沸20 min,四层纱布过滤,加入葡萄糖20 g,胰蛋白胨4 g,定容至1 000 mL。121 ℃灭菌30 min。
1.2 仪器与设备
DSX-24L-I手提式高压灭菌锅:上海申安医疗器械厂;CT-C热风循环烘箱:常州奇琪干燥制粒设备有限公司;SPX-250B-Z生化培养箱:上海博讯实业有限公司医疗设备厂;H1850离心机:湖南湘仪实验室仪器开发有限公司;FE28 pH计:梅特勒托利多仪器(上海)有限公司;SPH-2102立式双层大容量恒温培养摇床:上海世平实验设备有限公司;SPD-20A1高效液相色谱(high performance liquid chromatography,HPLC)仪:日本岛津公司;KQ-300DB数控超声波清洗器:昆山市超声波仪器有限公司。
1.3 方法
1.3.1 菌株活化
将母种菌株接种于PDA培养基,在28 ℃条件下避光培养3 d,菌丝形态均一,表明菌株较纯,可进行下一步实验。待菌丝长满4/5平板时,作为种子菌,在4 ℃条件下避光保存备用。
1.3.2 产AMP菌株的筛选
使用基础发酵培养基,分别接种大型真菌A1~A7的菌块(0.5 cm2),于28 ℃、150 r/min条件下摇瓶发酵5 d,测定各菌株发酵液中AMP含量,筛选最佳产AMP菌株。
1.3.3 产AMP菌株分子生物学鉴定
按照脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒说明书提取菌株基因组DNA,以真菌通用引物内部转录间隔区(internal transcribed spacer,ITS)1(5'-TCCGTAGGTGAACCTGCGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')为引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,将PCR产物进行琼脂糖凝胶电泳检测,引物合成与PCR扩增产物测序由擎科生物有限公司完成。测得的ITS序列利用美国国家生物技术信息中心(national center of biotechnology information,NCBI)进行在线基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,采用MEGA-X软件中邻接(neighbor joining,NJ)法构建系统发育树。
1.3.4 筛选菌株发酵过程中生物量、还原糖及pH的变化
使用基础发酵培养基,采用打孔法进行接种,即用一次性的打孔器获得相同大小(0.5 cm2)的菌块,接种于培养基中,于28 ℃、150 r/min条件下培养12 d,考察筛选菌株发酵过程中生物量、还原糖及pH的变化。
1.3.5 分析检测
还原糖含量的测定:采用DNS法[16]测定还原糖。
生物量的测定:将菌丝体倒在60目筛网中,蒸馏水洗涤3次,80 ℃烘干至恒质量,即为菌丝体的生物量。
AMP、GMP和IMP含量的测定:采用HPLC法。将发酵液样品在120 ℃条件下处理30 min[17],用0.45 μm滤膜过滤发酵液。HPLC色谱条件为[18]:流动相(磷酸盐缓冲液∶甲醇=1 000∶40,V/V);C18-T反向色谱柱(250 mm×4.6 mm,5 μm);流速1 mL/min;波长254 nm;柱温30 ℃;进样体积10 μL。称取AMP标准品10 mg,GMP和IMP标准品5 mg,用超纯水定容至100 mL容量瓶中,此时AMP标准溶液的质量浓度为100 μg/mL,GMP和IMP标准溶液的质量浓度为50 μg/mL。分别吸取AMP、GMP和IMP标准溶液2mL、4mL、6mL、8mL、10 mL,加超纯水定容至50 mL,将过滤后的AMP、GMP和IMP标准溶液分别进行测定,得到相应的峰面积。通过标准品的出峰时间进行定性,以峰面积与其质量浓度进行线性回归定量分析。
1.3.6 菌株产腺嘌呤核苷酸发酵工艺优化
(1)单因素试验
以基础发酵培养基为初始水平,探究添加20 g/L不同碳源(葡萄糖、蔗糖、玉米粉、可溶性淀粉、麦芽提取物),4 g/L不同氮源(胰蛋白胨、硫酸铵、黄豆粉、玉米浆干粉、酵母提取粉),1.5 g/L不同无机盐(硫酸锰(MnSO4·4H2O)、磷酸二氢钾(KH2PO4)、丙酮酸钠(C3H3NaO3)、硫酸锰(MgSO4)、六聚偏磷酸钠((NaPO3)6),初始pH值(4、5、6、7、8),装液量(60mL/250mL、80mL/250mL、100mL/250mL、120mL/250mL、140 mL/250 mL),发酵时间(4 d、5 d、6 d、7 d、8 d)等对筛选菌株发酵过程中AMP含量和生物量的影响。发酵初始条件为初始pH自然,装液量为100 mL/250 mL,在28 ℃、150 r/min条件下振荡培养5 d。
(2)Plackett-Burman(PB)试验
基于单因素试验结果,以AMP含量为考察指标,选取黄豆粉添加量(A)、酵母提取粉添加量(B)、玉米粉添加量(C)、可溶性淀粉添加量(D)、麦芽提取物添加量(E)、(NaPO3)6添加量(F)、KH2PO4添加量(G)、初始pH值(H)、装液量(J)9个因素进行PB试验,以确定出对AMP含量影响显著的因素,使用Design-Expert12.0.3进行N=12(10个因素,1个虚拟项)的PB试验设计,PB试验设计因素与水平见表1。
表1 PB试验设计因素与水平
Table 1 Factors and levels of PB experiments design
(3)最陡爬坡试验
根据PB试验筛选对AMP含量影响显著的因子,参考PB试验显著因子的正负效应和单因素试验效应来设计最陡爬坡试验步长,设计出最陡爬坡试验最佳路径。
(4)Box-Behnken试验
基于PB试验结果,确定了3个对AMP含量影响显著的因素,即玉米粉添加量(A)、KH2PO4添加量(B)、装液量(C),以AMP含量(Y)为响应值,使用Design-Expert 12.0.3软件进行3因素3水平Box-Behnken试验,Box-Behnken试验因素与水平见表2。
表2 Box-Behnken试验设计因素与水平
Table 2 Factors and levels of Box-Behnken experiments design

1.3.7 数据处理
每次试验均进行3次重复,数据处理、统计分析使用Excel 2020、SPSS 25.0和Design-Expert12.0.3软件,作图使用Origin 2021。
2 结果与分析
2.1 高产AMP菌株的筛选
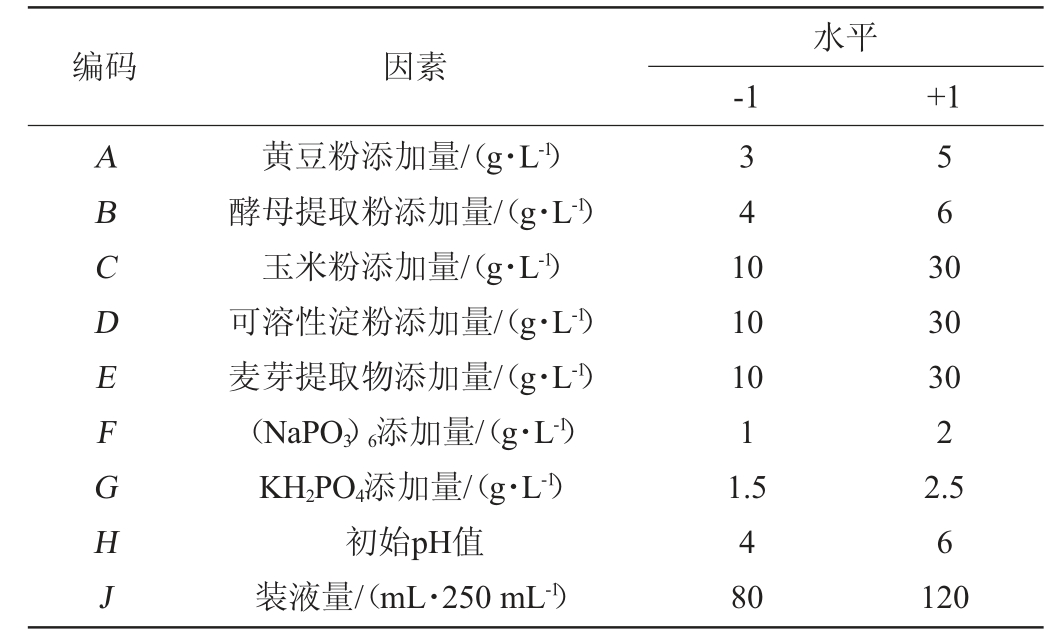
将不同菌株产AMP能力进行筛选,比较AMP产量,结果见图1。由图1可知,菌株A2 AMP产量显著高于其他菌株(P<0.05),为3.26 μg/mL。因此,选择菌株A2进行后续试验。
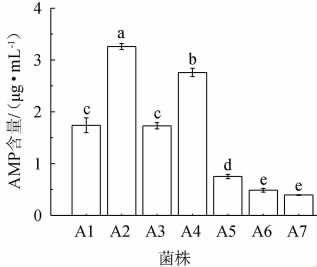
图1 不同菌株产腺嘌呤核苷酸比较
Fig.1 Comparison of adenosine monophosphate production by different strains
不同字母代表组间差异显著(P<0.05)。下同。
2.2 菌株A2分子生物学鉴定
由图2可知,菌株A2与赭紫硬孔菌(Rigidoporus vinctus)同处于最小的分支,亲缘关系最近。因此,菌株A2被鉴定为赭紫硬孔菌(Rigidoporus vinctus)。

图2 基于ITS基因序列菌株A2的系统发育树
Fig.2 Phylogenetic tree of strain A2 based on ITS gene sequences
2.3 赭紫硬孔菌A2发酵过程中生物量、还原糖及pH的变化
赭紫硬孔菌A2发酵过程中生物量、还原糖及pH的变化见图3。由图3可知,第1~2天时,赭紫硬孔菌刚接种到培养基中,代谢系统需要适应新的环境,还原糖的消耗和pH变化不明显;第3~9天时,赭紫硬孔菌处于对数生长期,此时生长速率最快,还原糖快速消耗,pH下降明显,代谢旺盛;第9~12天时,赭紫硬孔菌进入稳定期和衰亡期,体系中还原糖消耗殆尽,生物量基本不变,pH呈现上升趋势,推测,此时菌丝体出现自溶,菌丝球内碱性内容物外泄,发酵液中积累了部分碱性代谢产物。因此,为了得到赭紫硬孔菌最佳的代谢活力,选择最适发酵时间为5 d。
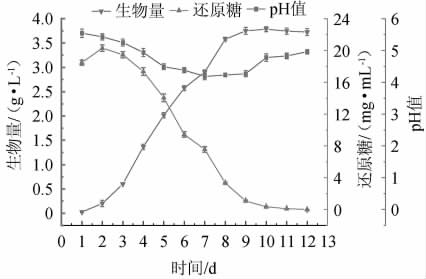
图3 赭紫硬孔菌A2发酵过程中生物量、还原糖及pH的变化
Fig.3 Changes of biomass,reducing sugar and pH during fermentation process of Rigidoporus vinctus A2
2.4 赭紫硬孔菌A2产腺嘌呤核苷酸发酵工艺优化单因素试验
2.4.1 碳源的选择
碳源是为微生物生长提供碳元素的物质,其经过一系列反应组成细胞结构的碳架,同时提供维持生命活动所需的能量。以不加碳源为对照,探究添加量为20 g/L不同碳源种类对赭紫硬孔菌A2生物量及AMP产量的影响结果见图4。由图4可知,不同碳源处理组的AMP含量和生物量均大于对照组;相比于纯糖原料(葡萄糖、蔗糖),淀粉质原料(可溶性淀粉、玉米粉、麦芽提取物)作为碳源更利于赭紫硬孔菌A2产AMP,其中玉米粉组的效果最佳,AMP含量和生物量都显著高于其他组(P<0.05),这与胡宝等[19]的研究结果相一致。推测可能的原因如下:一方面,对照组不额外添加碳源时,体系中碳元素不足够形成自身正常的细胞结构,故赭紫硬孔菌A2的生长受到阻碍,产生的代谢产物减少;另一方面,赭紫硬孔菌A2对碳源物质的利用具有选择性,玉米粉是天然原料的淀粉质类物质,含有一定天然的营养成分,有利于赭紫硬孔菌A2的生长及发酵。因此选择最适碳源为玉米粉、可溶性淀粉、麦芽提取物。
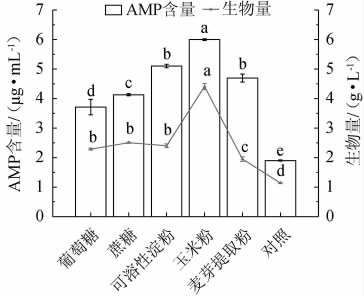
图4 不同碳源种类对赭紫硬孔菌A2生物量及腺嘌呤核苷酸产量的影响
Fig.4 Effect of different carbon source types on biomass and adenosine monophosphate production of Rigidoporus vinctus A2
2.4.2 氮源的选择
氮源是为微生物生长提供氮元素的物质,用来合成细胞中的含氮化合物。以不加氮源为对照,探究添加4 g/L不同氮源种类对赭紫硬孔菌A2生物量及AMP产量的影响,结果见图5。
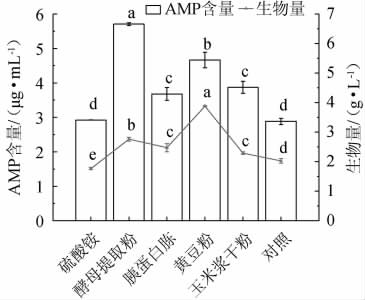
图5 不同氮源种类对赭紫硬孔菌A2生物量及腺嘌呤核苷酸产量的影响
Fig.5 Effect of different nitrogen source types on biomass and adenosine monophosphate production of Rigidoporus vinctus A2
由图5可知,赭紫硬孔菌A2利用不同氮源产AMP的能力有差别,其中无机氮源(硫酸铵)效果最差,但与对照组无显著差异(P>0.05);有机氮源-酵母提取粉组所产AMP含量最高,与各组均具有显著性差异(P<0.05),这与BEHERA S等[20]的研究相一致,其次为黄豆粉。可能是因为无机氮源营养不高,赭紫硬孔菌A2无法利用合成自身的必需氨基酸[21]。相比之下,有机氮源更利于菌株A2的生长和AMP物质积累。因此,选择最适氮源为酵母提取粉和黄豆粉。
2.4.3 无机盐的选择
无机盐是微生物生长和代谢不可或缺的营养物质,具有构成菌体细胞的组织成分、酶的组成成分、维持酶的活性、调节细胞渗透压、氢离子浓度和氧化还原电位等作用。以不加无机盐为对照,探究添加1.5 g/L不同无机盐种类对赭紫硬孔菌A2生物量及AMP产量的影响,结果见图6。由图6可知,与对照组相比,赭紫硬孔菌A2利用MnSO4·4H2O所产AMP和生物量最低,其显著抑制菌株的生长、代谢(P<0.05);MgSO4组生物量和AMP与对照组无显著差异(P>0.05),C3H3NaO3组生物量显著低于对照组(P<0.05),AMP含量与对照组无显著差异(P>0.05),表明C3H3NaO3、MgSO4对菌株A2的生长、代谢没有起到促进作用。KH2PO4和(NaPO3)6组的发酵体系中生物量和AMP含量均显著高于其他组(P<0.05),表明其对赭紫硬孔菌A2的生长、代谢有促进作用。这可能是因为大型真菌发酵需要少量的无机盐,其中P、K最为重要[22]。P是构成大型真菌细胞中核酸、磷脂或辅酶等的组成元素,因此,KH2PO4很大程度上影响着菌株生物量和AMP含量,其次是(NaPO3)6。因此,选择最适无机盐为KH2PO4和(NaPO3)6。
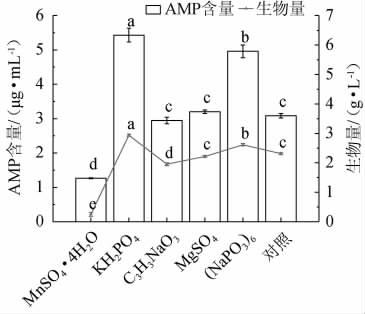
图6 不同无机盐种类对赭紫硬孔菌A2生物量及腺嘌呤核苷酸产量的影响
Fig.6 Effect of different inorganic salts types on biomass and adenosine monophosphate production of Rigidoporus vinctus A2
2.4.4 初始pH值的选择
pH与微生物的生长代谢有着密切的联系,从多方面影响菌株的发酵,如影响代谢途径中各种酶的活力、菌株细胞形态和结构[23],以及菌株对营养物质的吸收和代谢产物的合成等[24],因此选择合适的pH来控制发酵过程是非常有必要的。不同初始pH值对赭紫硬孔菌A2生物量及AMP产量的影响结果见图7。由图7可知,当体系中初始pH值为5时,AMP含量最高,为3.74 g/L,与各组均具有显著性差异(P<0.05),而其他各pH组之间AMP含量无显著差异(P>0.05)。生物量随着初始pH增加呈先增加后下降的趋势,初始pH值为6时最有利于菌丝的生长,此时其生物量最高,为2.68 g/L。由此可见,在发酵过程中,菌株A2的生物量最高时,AMP产量不是最高,但二者都需要偏酸性的环境。因此,选择最适初始pH值为5。
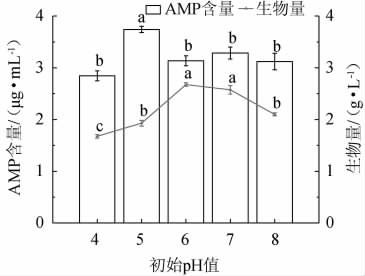
图7 不同初始pH值对赭紫硬孔菌A2生物量及腺嘌呤核苷酸产量的影响
Fig.7 Effect of different initial pH value on biomass and adenosine monophosphate production of Rigidoporus vinctus A2
2.4.5 装液量的选择
大型真菌发酵是一个耗氧过程,氧气在发酵过程中非常重要。不同装液量对赭紫硬孔菌A2生物量及AMP产量的影响结果见图8。由图8可知,随着装液量在60~120 mL/250 mL范围内增加,AMP含量和生物量均随之增加;当装液量为120 mL/250 mL时,AMP含量和菌体A2生物量均最高;当装液量>120 mL/250 mL之后,溶解氧虽增加,但发酵空间减少,基质中的营养物质减少,阻碍了菌丝体的生长。因此,最适装液量为120 mL/250 mL。
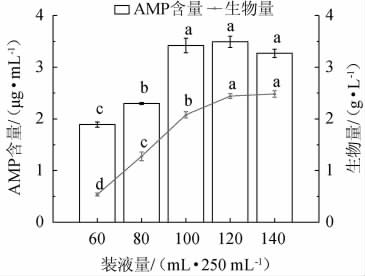
图8 不同装液量对赭紫硬孔菌A2生物量及腺嘌呤核苷酸产量的影响
Fig.8 Effect of liquid volume on biomass and adenosine monophosphate production of Rigidoporus vinctus A2
2.4.6 发酵时间的选择
不同发酵时间对赭紫硬孔菌A2生物量及AMP产量的影响结果见图9。由图9可知,AMP含量随着发酵时间的增加呈现先增加后下降的趋势,在发酵第5 天时,AMP含量达到最高值。生物量随着发酵时间的增加不断增加,说明生物量与AMP含量不存在严格的正相关关系,但AMP含量的积累可能与菌丝的旺盛程度有关。本试验结果与李艳婷等[25-26]研究结果相一致。因此,选择最适发酵时间为5 d。
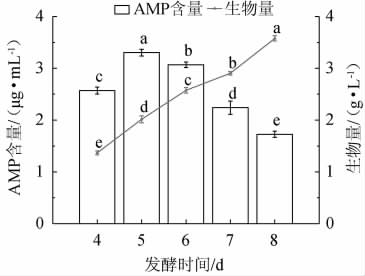
图9 不同发酵时间对赭紫硬孔菌A2生物量及腺嘌呤核苷酸产量的影响
Fig.9 Effect of different fermentation time on biomass and adenosine monophosphate production of Rigidoporus vinctus A2
2.5 响应面试验
2.5.1 Plackett-Burman试验
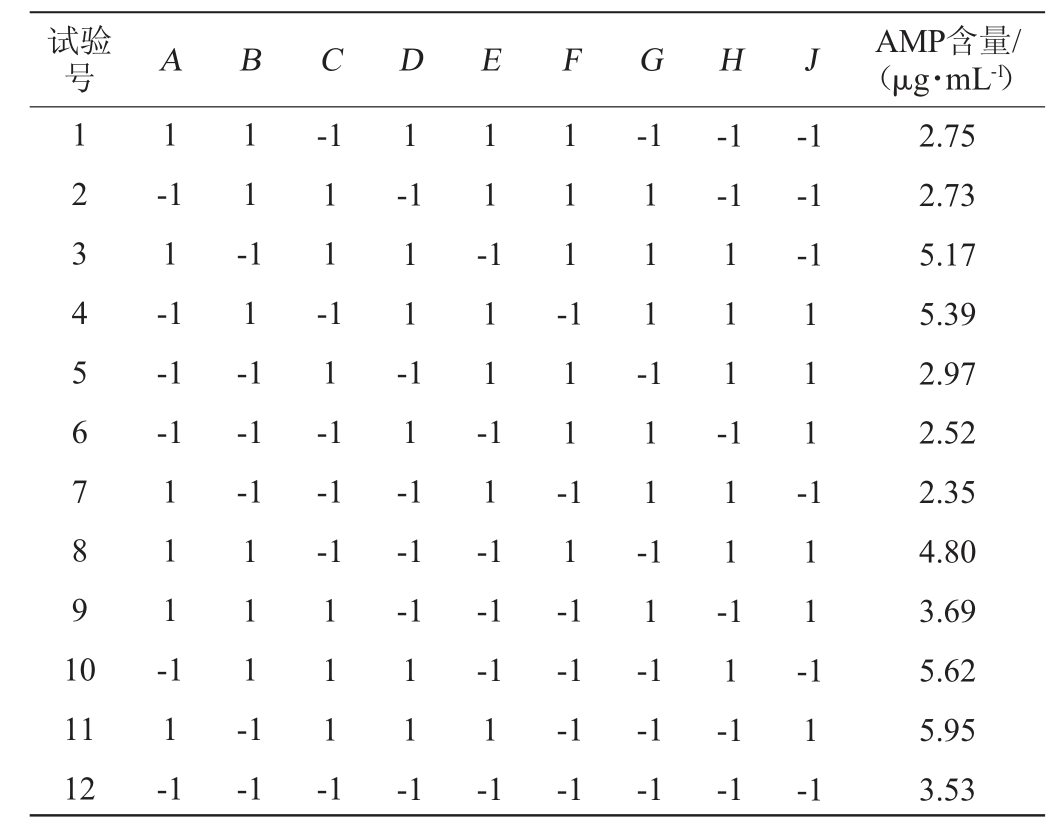
基于单因素试验结果,以AMP含量为考察指标,选取黄豆粉添加量(A)、酵母提取粉添加量(B)、玉米粉添加量(C)、可溶性淀粉添加量(D)、麦芽提取物添加量(E)、(NaPO3)6添加量(F)、KH2PO4添加量(G)、初始pH值(H)、装液量(J)9个因素进行PB试验,结果见表3。
表3 PB试验设计及结果
Table 3 Design and results of PB experiments
由表4可知,模型P值为0.023 9<0.05,有显著性差异,具有统计学意义。从各因素P值可知,影响菌株产AMP含量的主次因素为装液量>玉米粉添加量>KH2PO4添加量>初始pH值>黄豆粉添加量>(NaPO3)6添加量>麦芽提取粉添加量>酵母提取粉添加量>可溶性淀粉添加量,其中玉米粉添加量、KH2PO4添加量对AMP含量影响显著(P<0.05),装液量对AMP含量影响极显著(P<0.01),其他因素则影响不显著(P>0.05)。因此,选择玉米粉添加量、KH2PO4添加量、装液量进行最陡爬坡试验。
表4 PB试验结果显著性分析
Table 4 Significance analysis of PB experiment results
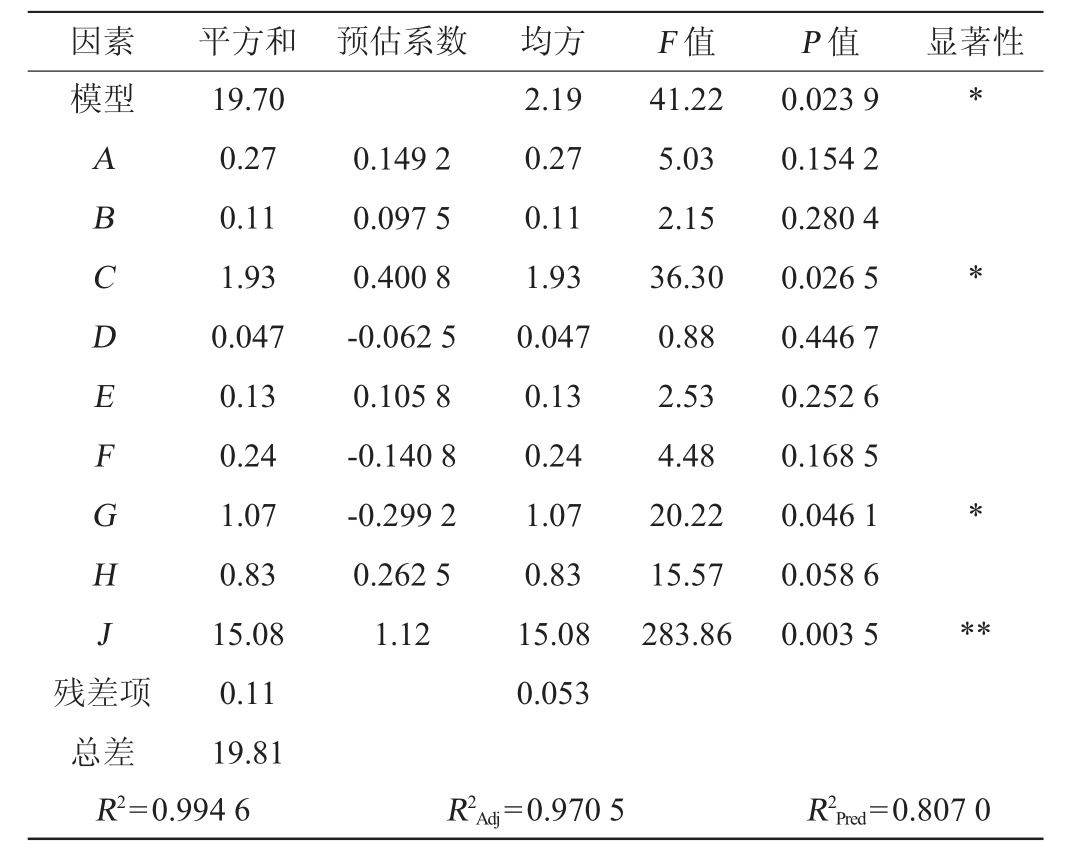
注:“**”表示对结果影响极显著(P<0.01);“*”表示对结果影响显著(P<0.05)。下同。
2.5.2 最陡爬坡试验
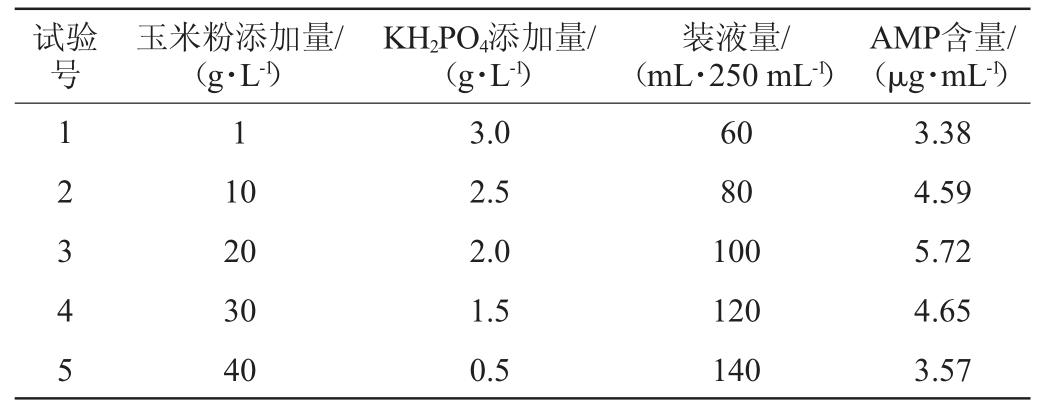
根据PB试验结果筛选得出玉米粉添加量、KH2PO4添加量、装液量3个对AMP含量影响显著的因子,根据因素的效应值和实际情况确定爬坡试验中的爬坡方向和步长,其余6个影响不显著的因素根据单因素试验结果进行设置,最陡爬坡试验设计及结果见表5。由表5可知,第3试验组AMP含量最高,即玉米粉添加量为20 g/L,KH2PO4添加量为2 g/L,装液量为100 mL/250 mL。因此,选择第3试验组作为Box-Behnken试验的中心点进行Box-Behnken试验设计。
表5 最陡爬坡试验设计及结果
Table 5 Design and results of the steepest ascent experiments
2.5.3 Box-Behnken试验
以玉米粉添加量(A)、KH2PO4添加量(B)、装液量(C)为自变量,以AMP含量(Y)为响应值,使用Design-Expert 12.0.3软件进行3因素3水平Box-Behnken试验,结果见表6,方差分析结果见表7。
表6 Box-Behnken试验设计结果
Table 6 Design and results of Box-Behnken experiments
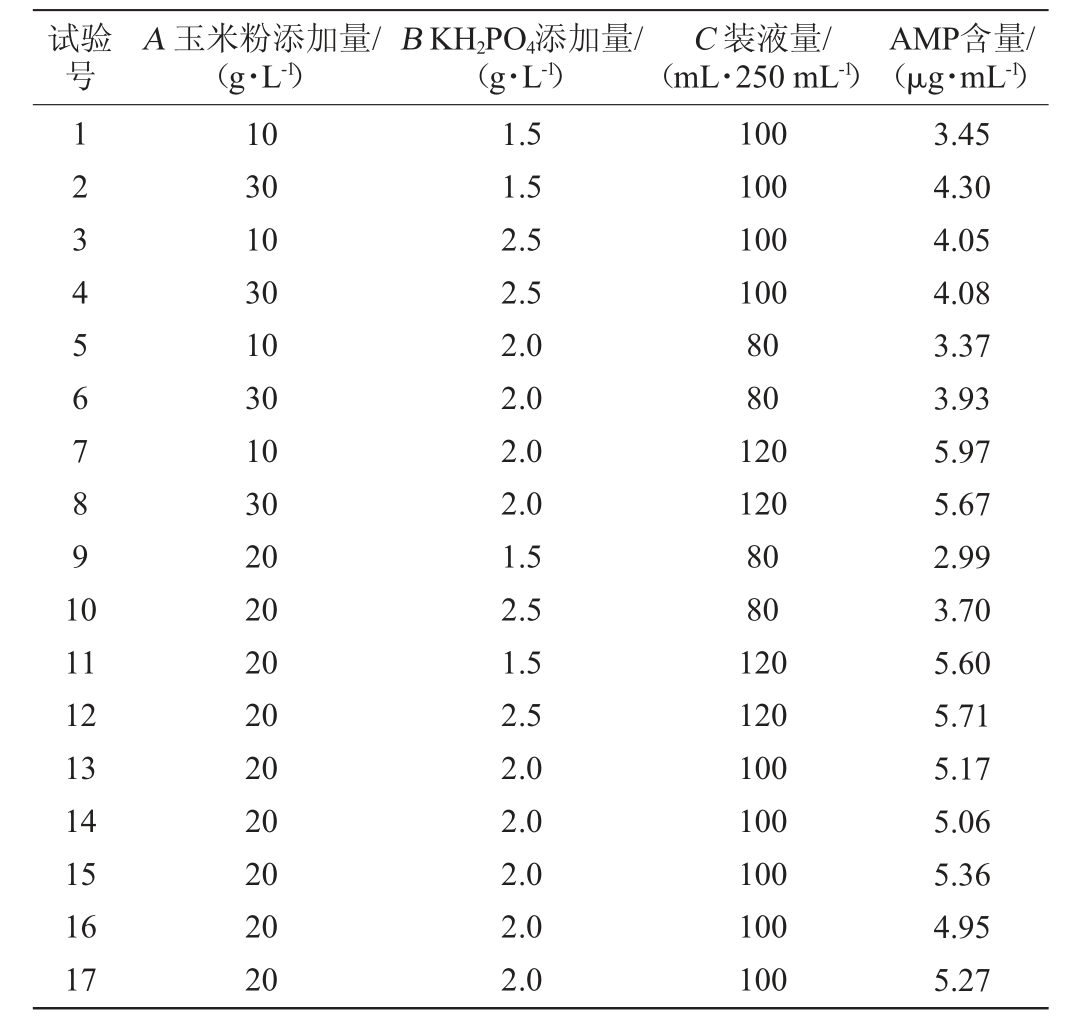
表7 回归模型方差分析
Table 7 Variance analysis of regression model
利用Design-Expert12.0.3软件对表6结果进行方差分析和二次多元回归拟合,获得AMP含量与玉米粉添加量、KH2PO4添加量、装液量的二次多项式回归方程:
Y=5.16+0.14A+0.15B+1.12C-0.20AB-0.22AC-0.15BC-0.48A2-0.71B2+0.051C2
由表7可知,模型P值<0.000 1,说明该模型极显著,模型的失拟项不显著(0.469 0>0.05),决定系数R2=0.986 8,说明试验结果与该模型拟合度较高,能较好的预测AMP含量;校正决定系数=0.969 9,说明AMP含量有96.99%受试验因素影响。由P值可知,一次项C、二次项A2、B2对结果影响极显著(P<0.01),一次项A、B、交互项AB、AC对结果影响显著(P<0.05),其他项对结果影响均不显著(P>0.05)。由F值可知,影响AMP含量的顺序为装液量>KH2PO4添加量>玉米粉添加量。
2.5.4 响应面分析
各因素间交互作用对AMP含量影响的响应面及等高线见图10。
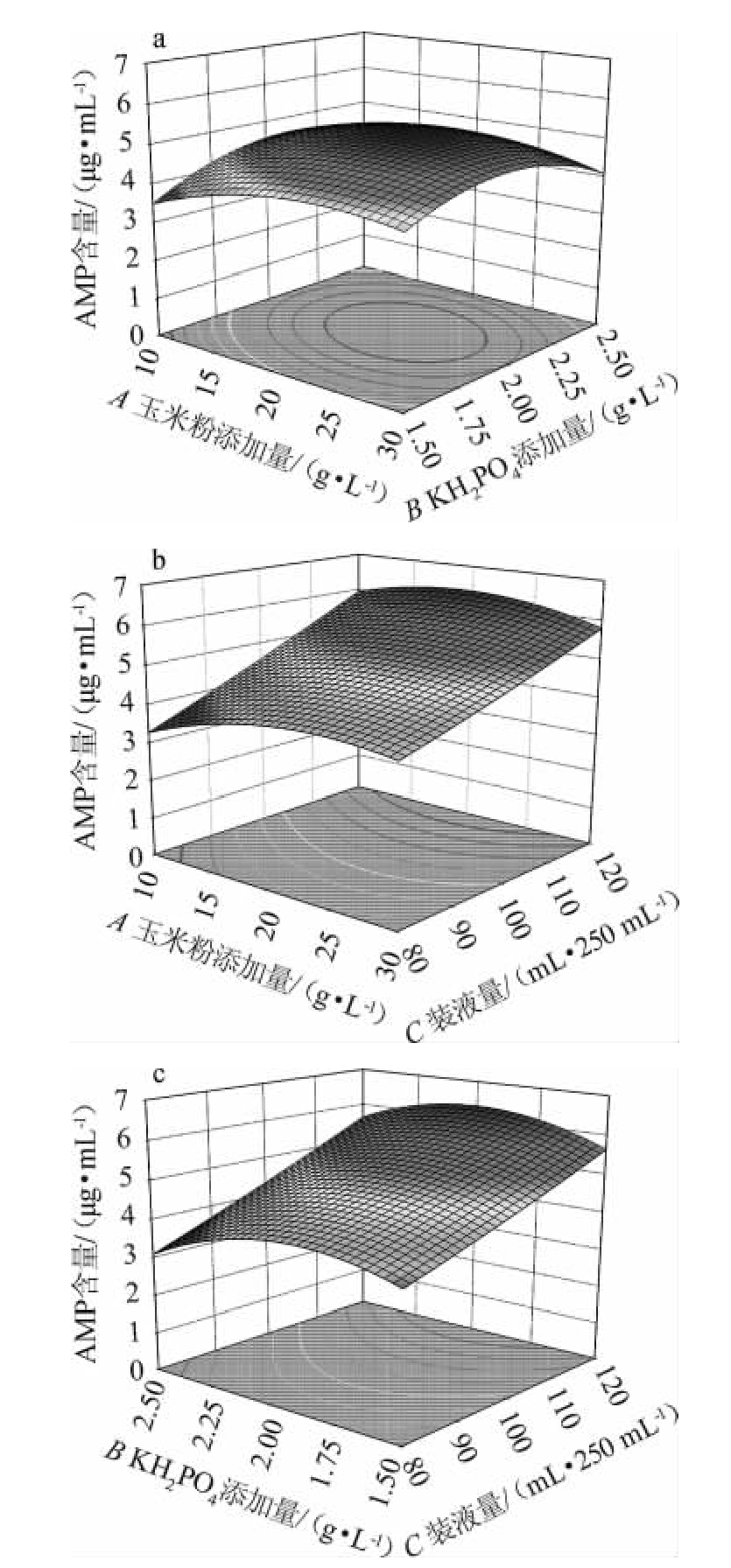
图10 各因素间交互作用对腺嘌呤核苷酸含量影响的响应面及等高线
Fig.10 Response surface plots and contour lines of effects of interaction between each factor on adenosine monophosphate production
响应面和等高线的颜色从蓝色到红色的变化表示AMP含量值从低到高的变化,变化的越快表示坡度越大,即对结果影响更为显著,等高线可以直观反映因素对AMP的影响,等高线中的最小椭圆的中心点即为AMP含量的最高点[27]。由图10a可知,AMP含量随着玉米粉添加量和KH2PO4添加量增大而增大,到达中心点后开始下降;等高线呈椭圆,说明两者交互作用对AMP含量影响显著(P<0.05)。由图10b可知,二者曲面均有弧度,但装液量曲面大于玉米粉添加量曲面,表明装液量对AMP含量的影响大于玉米粉添加量;等高线形状也类似于椭圆,说明两者交互作用对AMP含量影响显著(P<0.05)。由图10c可知,响应曲面较为陡斜,AMP含量随装液量的增加而增加,随着KH2PO4添加量增加呈现先增加后减小的变化;从等高线形状看,形状类似于圆形,表明两者交互作用对AMP含量影响不显著(P>0.05)。
2.6 验证试验
根据Design-Expert 12.0.3软件预测出最优发酵工艺条件为玉米粉添加量19.2 g/L,KH2PO4添加量2 g/L,装液量120 mL/250 mL。此条件下AMP含量理论值为6.34 μg/mL。为了便于实际操作,将最优发酵工艺条件修改为玉米粉添加量19 g/L,KH2PO4添加量2 g/L,装液量120 mL/250 mL,采用最优条件重复3次试验,得到AMP含量实际值为(6.47±0.32)μg/mL,与预测值误差为2.1%,说明此模型能够较好预测AMP含量,证明了其优化发酵条件的可靠性。
2.7 赭紫硬孔菌A2发酵工艺优化前后呈味核苷酸含量测定
赭紫硬孔菌A2发酵工艺优化后,对赭紫硬孔菌A2发酵液中呈味核苷酸有显著的影响,发酵优化后AMP、GMP和IMP含量分别为6.47 μg/mL、28.03 μg/mL和14.68 μg/mL,较未优化组分别显著提高98.5%、36.3%和22.6%(P<0.05)。赭紫硬孔菌发酵液中呈味核苷酸含量的增加,使得发酵液滋味更佳。试验结果为后续验证发酵液的抑苦效果奠定了理论基础。
3 结论
本研究筛选出一株高产腺嘌呤核苷酸的菌株A2,经鉴定菌株A2为赭紫硬孔菌(Rigidoporus vinctus)。采用单因素及响应面试验得到菌株A2的最佳发酵工艺条件为:玉米粉19 g/L,酵母提取粉5 g/L,KH2PO4 2 g/L,初始pH值为5,装液量120 mL/250 mL,发酵5 d。在此优化发酵工艺下,发酵液中AMP、鸟嘌呤核苷酸(GMP)和次黄嘌呤核苷酸(IMP)含量分别为6.47 μg/mL、28.03 μg/mL、14.68 μg/mL,较未优化组均显著提高98.5%、36.3%和22.6%(P<0.05)。本研究结果可为大型真菌发酵生产的代谢产物在食品行业进一步开发风味掩盖剂提供技术支持,具有一定的实际应用价值。
[1]杨挡,姜梦华,封亮,等.基于中药口服液体制剂不良口感综合分析的蒲地蓝消炎口服液顺应性改善研究[J].中国中药杂志,2020,45(18):4316-4323.
[2]吴陈晖,杨艳君,朱毛毛,等.创新儿童中药制剂的造粒掩味关键技术研究概况[J].中国中药杂志,2022,47(21):5708-5716.
[3]林礼钊,刘向军,李库.酵母抽提物对原酿黄豆酱呈味物质的影响研究[J].中国酿造,2021,40(12):120-124.
[4]高文超,田俊,姜雪峰.味觉化学之鲜味化学[J].化学教育(中英文),2020,41(18):1-7.
[5]康俊丽,韩德恩,黄海英,等.关于中药掩味新思路的探讨[J].中药材,2017,40(8):1987-1990.
[6]李悦.口感改良剂5'-腺嘌呤核苷酸的制备与应用研究[D].广州:华南理工大学,2011.
[7]GRAVINA S A,MCGREGOR R A,NOSSOUGHI R,et al.Biomimetic in vitro assay for the characterization of bitter tastants and identification of bitter taste blockers[J].ACS Publ,2003,867(6):91-101.
[8]徐文平,李大祥,宛晓春.茶叶中AMP的苦味掩盖效果评价及其含量的测定方法[J].安徽农业大学学报,2010,37(4):682-687.
[9]董长勇,于伟厚,苟亚夫,等.核苷酸类食品添加剂的生产与应用研究进展[J].食品与发酵工业,2022,48(22):345-352.
[10]刘晨.鸟苷酸发酵工艺优化及肝保护功效研究[D].郑州:河南工业大学,2018.
[11]李丽.核苷酸发酵生产工艺的研究[D].石家庄:河北科技大学,2014.
[12]李华祥,陆震鸣,耿燕,等.樟芝深层发酵工艺研究进展[J].菌物学报,2017,36(10):1332-1345.
[13]许莹莹,廖烨,李德海,等.食用菌发酵液中功能性成分研究及应用[J].包装与食品机械,2018,36(1):57-62.
[14]陈璋.双孢菇液体菌种培养条件及熟料栽培的研究[D].沈阳:沈阳农业大学,2017.
[15]杜凯.食用菌液体发酵合成有机硒的研究[D].济南:山东大学,2018.
[16]余志坚,陈传,赵晋宇.DNS法检测食用菌多糖含量条件优化研究[J].江苏农业科学,2012,40(1):259-260.
[17]LI B,LIU C,FANG D,et al.Effect of boiling time on the contents of flavor and taste in Lentinus edodes[J].Flavour and Frag J,2019,34(6):506-513.
[18]KHAN M S,PARVEEN R,MISHRA K,et al.Determination of nucleosides in Cordyceps sinensis and Ganoderma lucidum by high performance liquid chromatography method[J].J Pharm Bioall Sci,2015,7(4):264-266.
[19]胡宝,徐子昕,周金看,等.响应面法优化香菇液体菌种发酵培养基配方[J].北方园艺,2022(22):97-103.
[20]BEHERA S,GUPTA N.Optimized culture conditions for enhanced recovery of exopolysaccharide from Pseudolagarobasidium acaciicola[J].Curr Sci,2019,116(8):1397-1406.
[21]FANG Q H,ZHONG J J.Submerged fermentation of higher fungus Ganoderma lucidum for production of valuable bioactive metabolitesganoderic acid and polysaccharide[J].Biochem Eng J,2002,10(1):61-65.
[22]杨庆尧.食用菌生物学基础[M].上海:上海科学技术出版社,1981:283.
[23]唐晨旻,张劲松,刘艳芳,等.pH对灵芝液态发酵代谢物及抗氧化活性的影响[J].菌物学报,2023,42(2):570-583.
[24]DUDEKULA U T,DORIYA K,DEVARAI S K.A critical review on submerged production of mushroom and their bioactive metabolites[J].3 Biotech,2020,10(8):1-12.
[25]李艳婷,郭尚,王海珍,等.大白桩菇多酚的定向液态发酵条件优化[J].中国食用菌,2022,41(7):41-48.
[26]林群英,龙良鲲,吴亮亮,等.营养条件对桑黄菌丝体生长及活性成分的影响[J].贵州农业科学,2018,46(11):112-116.
[27]李光月,李雪玲,祁姣姣,等.响应面法优化枯草芽孢杆菌表面活性素的发酵工艺[J].食品工业科技,2022,43(12):146-154.